Использование бактерий и вирусов
Для борьбы с вредителями и болезнями растений используют грибы, бактерии, вирусы, гельминтов и простейших.
1. Патогенность, способность вызывать болезненные явления.
2. Вирулентность – быстро размножаться в тканях насекомого и вызывать смерть.
3. Способность проникать в организм насекомого пассивно (с пищей) и активно (через покровы тела).
4. Сохранность в природе.
Использование грибов.Наиболее патогенны для насекомых фикомицеты – облигатные паразиты. Известно около 400 видов энтомопатогенных грибов. Многие лесные насекомые поражаются плесенью гриба белая мюскардина (препарат боверин). Кроме того, различают розовую и зеленую мюскардину (в зависимости от цвета мицелия). Эти грибы вызывают мускардиноз насекомых (погибшие насекомые уменьшаются в размерах, сморщиваются и покрываются белым мучнистым налетом, состоящим из грибницы и конидий). Для массового выращивания грибов применяют твердые среды растительного происхождения (картофель, кукурузу, мельничные отходы), которые стерилизуют под давлением и затем засевают соответствующей грибной культурой. Грибы выращивают при определенной температуре, высушивают, размалывают и используют в виде препаратов. Микозы (грибные заболевания) не являются острозаразными, в естественных условиях не вызывают эпизоотий и поражают, в основном, ослабленных насекомых.
Использование бактерий получило широкое распространение. Они применяются в виде бактериальных препаратов. Технология их приготовления заключается в массовом накоплении спор путем стерильного выращивания бактерий в жидких средах. Затем споры отделяют от жидкости сепарированием, смешивают с нейтральным наполнителем и высушивают. Бактериальные препараты не имеют специфического запаха, не отпугивают насекомых, не повреждают растений, практически неопасны для людей и животных. Они готовятся на основе спорообразующих кристаллоносных энтомопатогенных бацилл группы бациллюс турингиензис (Bacillus thuringiensis Berliner). Характерным для этой группы бацилл является образование в спорангиях рядом со спорой протеиновых кристаллов белкового токсина очень токсичных для насекомых, в основном для чешуекрылых.
Наряду с эндотоксином бактерии в процессе жизнедеятельности вырабатывают экзотоксин, по химической природе близкий к нуклеотидам. Он накапливается в культуральной жидкости после отделения от нее спор и кристаллов бактерии и вызывает специфические задержки линьки у личинок насекомых и уродства у имаго, токсичен для многих групп насекомых.
Поражение гусениц вредителей происходит при попадании спор и кристаллов в кишечник вместе с пищей. Проглотив первые порции корма, гусеницы прекращают питание вследствие действия эндотоксина. Затем начинается размножение попавших внутрь тела гусениц бацилл, сопровождающееся образованием токсичных для насекомых веществ (главным образом экзотоксинов).
У погибших гусениц наблюдается разложение внутреннего содержимого: сквозь легко разрывающиеся покровы вытекает бурая жидкость, содержащая споры бацилл и кристаллы эндотоксина.
Бактериальные препараты выпускаются промышленностью в виде смачивающихся порошков и паст. В 1 г порошка содержится не менее 30 млрд. спор и столько же кристаллов, в 1 г пасты – не менее 20 млрд. спор. Гарантийный срок хранения 1 год. Инертным наполнителем обычно служит каолин. Бактериальные препараты применяют методом мелкокапельного авиационного или наземного опрыскивания насаждений.
В зависимости от температурных условий (при температуре ниже 18°С развитие бацилл сильно замедляется, отмирание гусениц затягивается и многие из них выздоравливают), активности препаратов и физиологического состояния вредителя гибель гусениц начинается по истечении 2-3 суток после обработки, а массовая смертность обычно бывает в интервале от 3-5 до 7-10 дней.
Эффективность препаратов во многом зависит от дисперсности дробления рабочей жидкости, определяющей густоту покрытия обрабатываемой поверхности растений.
Широкое применение имеют: лепидоцид (против соснового шелкопряда, непарного шелкопряда, златогузки, шелкопряда-монашенки), лепидобактоцид (хвоелистогрызущих гусениц младших возрастов), битоксибациллин против листоверток, шелкопряда, пядениц, златогузки). Лепидоцид, препарат, вырабатываемый на основе бактерии Bacillus thuringiensis, var. kurstaki (спорово-кристаллический комплекс). Битоксибациллин - экзотоксин Bacillus thuringiensis, var. thuringiensis(спорово-кристаллический комплекс).
Эффективность бактериальных препаратов при различных способах использования в борьбе с вредителями колеблется в пределах 70—90%.
Использование вирусов. Вирусы вызывают заболевания (вирозы) на стадии личинки у многих видов чешуекрылых и пилильщиков. Возникающие очаги инфекции обычно действуют несколько лет, обеспечивая вторичное инфекцирование и гибель гусениц в течение нескольких последующих поколений.
Основная вирусная болезнь насекомых – полиэдроз (известно около 170 видов). Он сопровождается появлением в клетках различных тканей многочисленных внутриядерных белковых включений, имеющих форму многогранников (полиэдров). Полиэдры устойчивы к действию неблагоприятных факторов (химикатов, солнечного света, ферментов и др.) и сохраняют жизнеспособность находящихся в них вирусов многие годы. Размеры полиэдров колеблются в пределах 0,3-15 мкм. В белковом матриксе полиэдров расположены вирионы в форме палочек длиной 200-400 и шириной 20-50 мкм. Вирус передается через яйца (трансовариально) и специфичен для каждого вида насекомого. Больные насекомые становятся малоподвижными, прекращают питание, их покровы приобретают светлую окраску, утончаются, и через их разрывы вытекает мутная, непахнущая, беловатая жидкость.
Для приготовления вирусных препаратов зараженных полиэдрозом гусениц высушивают, затем их содержимое соответствующим образом обрабатывают. Вирусные препараты используют для борьбы с сибирским шелкопрядом (вирин-ГСШ), сосновыми пилильщиками (вирин-Диприон), шелкопрядом монашенкой (вирин-ПШМ).
Вирин-Диприон представляет собой суспензию, состоящую из полиэдров. Ее разбавляют водой и используют для опрыскивания очагов сосновых пилильщиков.
Первыми организмами, появившимися на Земле несколько миллиардов лет назад и создавшими предпосылки для дальнейшего развития жизни, были бактерии. Сейчас они составляют отдельное царство живых организмов. Вирусы — самые мелкие из известных живых существ. Но если бактерии, без всякого сомнения, считаются самостоятельными живыми организмами, то вирусы, не имеющие собственного обмена веществ, заимствуют свою жизнь у клеток растений, животных и бактерий. Вирусы являются внутриклеточными паразитами живых организмов.
Бактерии
Это одноклеточные организмы, которые не имеют ядра, окруженного собственной мембраной, то есть являются прокариотами. Они обладают всего лишь одной хромосомой, которая располагается в так называемой ядерной зоне. Клетки бактерий имеют микроскопические размеры (0,0005— 0,005 мм), в них отсутствуют многие органеллы, характерные для эукариот.
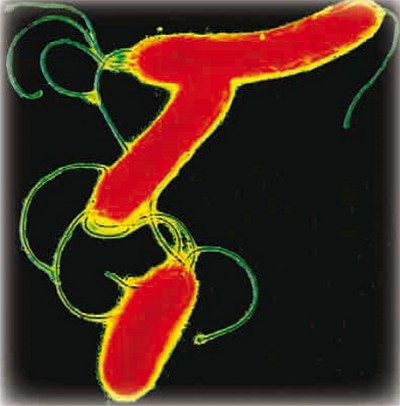
Форма бактерий довольно разнообразна, они бывают палочковидными (бациллы), шарообразными (кокки), извитыми (вибрионы), спиралеобразными (спирохеты). Некоторые бактериальные клетки объединяются в колонии, а некоторые из них способны к движению с помощью жгутика.
Бактерии обладают способностью к стремительному размножению. В среднем бактерия делится надвое через каждые 20—30 минут, и уже через 6 часов от одной бактерии может образоваться 250 тыс. дочерних. Миллиарды бактерий присутствуют в воздухе, воде, почве, внутри растительных и животных организмов, бактерии живут даже в горячих источниках. Ветер и вода могут переносить бактерии на большие расстояния. В неблагоприятных условиях внутренняя часть клетки бактерии превращается в спору с толстой оболочкой, устойчивую к высоким температурам, отсутствию кислорода и высушиванию. В таком состоянии споры сохраняются в течение многих лет.
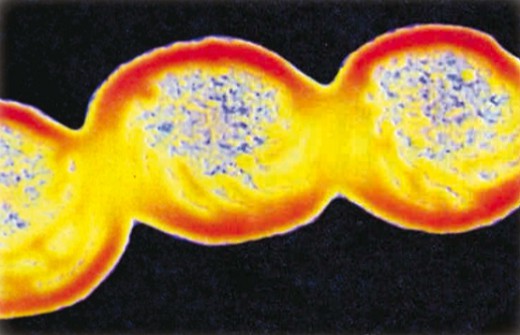
Бактерии играют важнейшую роль в круговороте веществ в природе, в процессах почвообразования, некоторые виды бактерий живут в пищеварительной системе животных и человека, принимая активнейшее участие в процессах пищеварения. Однако среди бактерий немало очень вредных и опасных для человека микроорганизмов, являющихся возбудителями инфекционных заболеваний, среди которых дизентерия, брюшной тиф, холера, чума, сибирская язва.
Вирусы
Вирусы представляют собой неклеточную форму жизни. Они намного мельче бактерий, поэтому их удалось обнаружить лишь в конце XIX в. Вирусы состоят из нуклеиновой кислоты (РНК или ДНК), покрытой оболочкой, у них нет собственного обмена веществ, вне клеток других организмов они безжизненны. Однако, встретившись с восприимчивой к вирусу клеткой, вирус проникает через ее оболочку и подчиняет себе ее обмен веществ, заставляя продуцировать новые вирусные частицы. Очень скоро зараженная клетка погибает, а размножившиеся вирусы разносятся по всему организму, поражая всё новые клетки.
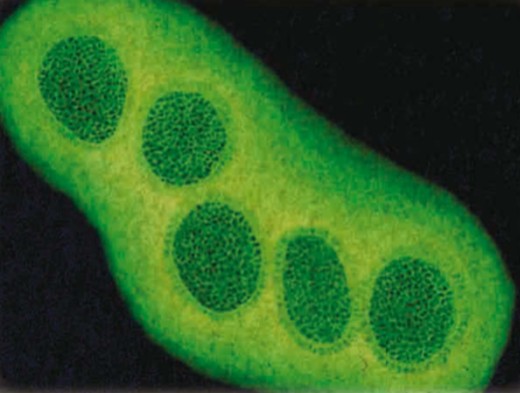
Известно более 400 вирусов, вызывающих заболевания растений, животных и человека, среди которых ветряная оспа, краснуха, бешенство, полиомиелит. Вирусы определенной разновидности поражают определенные организмы и органы. Не все вирусы одинаково опасны, некоторые из них заражают только животных, но безвредны для человека, и наоборот. Как все организмы, вирусы могут претерпевать мутации, в результате которых образуются новые формы, устойчивые к реакциям организма. Ярким примером является вирус гриппа: известно несколько десятков его разновидностей, появляющихся каждый год и вызывающих эпидемии.
Клетки иммунной системы человека вырабатывают антитела против вирусов и интерферон — белок, подавляющий их размножение. Некоторые вирусные заболевания можно предотвратить с помощью вакцинации: в здоровый организм вводится вакцина (препарат, содержащий небольшую дозу вирусов, безопасную для организма) и иммунная система начинает вырабатывать антитела. Оставаясь в крови, антитела препятствуют повторному заболеванию. Однако в мире распространены и такие вирусы, против которых до сих пор не найдены эффективные лекарства. Среди них — ВИЧ (вирус иммунодефицита человека), вирусы атипичной пневмонии, птичьего гриппа и т. д.
Паразиты, бактерии и вирусы были бичом человечества на протяжении всей его истории, но также изменили ее и повлияли на нашу эволюцию. Паразиты помогли нашей иммунной системе обрести необходимый стимул и заработать, а смиренные бактерии целиком и полностью определили правила жизни на этой планете. Иногда кажется, что мы, люди, просто игрушки в их руках. Есть мнение, что пришельцы из далеких миров могут не понять, кто на этой планете настоящий хозяин. В любом случае микроорганизмы делают невероятные вещи, чтобы помочь человечеству.

Африканские вирусы помогли нам выжить

Кроме того, они, возможно, сыграли роль в том, что среди конкурирующих видов гоминид именно Homo sapiens вышли на первое место. В то время как наш вид развивался, разного рода заболевания и паразиты нападали на генетическое разнообразие и отсеивали непригодные модели. Как только первый Homo sapiens покинул континент, он привез с собой свои инфекционные колонии и паразитов.
Вирусные паразиты распространились на других гоминид типа Homo neanderthalensis (неандертальцев), у которых не было заранее выработанной системы защиты от новых заболеваний и структура носа, которая была менее эффективной при фильтрации воздуха и удерживании новых вирусов. Другие виды гоминид вымерли, поскольку не были приспособлены к выживанию в условиях, в которых могли выживать вредные микроорганизмы. Моделирование показало, что если у неандертальцев уровень смертности был хотя бы на 2% выше, чем у людей, этого было бы достаточно, чтобы они вымерли спустя 1000 лет конкуренции. Хотя заболевания, конечно, не были единственным фактором, они сыграли большую роль.
Большинство моделей эволюции человеческих заболеваний утверждают, что их основная часть развивалась в течение эпохи неолита, после того как человек перебрался из Африки и население увеличилось. Таким образом, есть некоторые доказательства этого избирательного вирусного давления. Многие из этих ранних вирусов были так успешны, что их гены буквально стали частью нашей ДНК. К примеру, человеческий геном содержит борнавирус, который стал его частью около 40 миллионов лет назад. В общей сложности ученые выделили около 100 000 элементов человеческой ДНК, которые могли быть частью вирусов, так называемая мусорная ДНК. Вирусы, которые составляют большую часть нашей мусорной ДНК, называются эндогенными ретровирусами.
Современное использование пиявок и личинок

Тем не менее в 70-80-х годах пиявки вернулись. Косметические и реконструктивные хирурги выяснили, что их можно эффективно использовать для кровопускания из опухших лиц, черных глаз, конечностей и прочего. Они также полезны при повторном присоединении небольших частей тела вроде ушей и лоскутов кожи, поскольку отсасывают кровь, которая может свернуться и прервать процесс заживления. Пиявки спасают людей от ампутации и даже могут облегчить боль при остеоартрите. Даже ветеринары иногда используют их.
Личинки, с другой стороны, являются природными очистителями. Они прекрасно подходят для разъедания мертвой или зараженной плоти, открывая здоровые ткани в процессе так называемой хирургической обработки раны. Также они оказались эффективным средством для лечения язв, гангрен, рака кожи и ожогов.
Паразиты и иммунная система совместно защищают нас от аллергии

Самая интересная часть в том, что как только паразиты и безвредные микроорганизмы, присутствующие в воде и почве, были в значительной степени удалены из своей естественной среды внутри нас в процессе развития цивилизации и медицины, наша иммунная система фактически сверхкомпенсировала эту утрату, что привело к аллергии и увеличению шансов возникновения астмы и экземы.
Первым гипотезу старых друзей предложил Грэм Рук из Университетского колледжа в Лондоне в 2003 году.
Некоторые люди доводят гипотезу старых друзей к ее логическому заключению: если удаление паразитов из общества приводит к проблемам со здоровьем, нужно вернуть их назад. В 2008 году профессор неврологии Университета Висконсина Джон Флеминг провел клиническое исследование, в ходе которого заражал некоторых пациентов с рассеянным склерозом паразитирующими червями и проверял эффективность этого метода. В течение трех месяцев у пациентов, которые в среднем имели 6,6 активных очагов среди нервных клеток мозга, уровень заболевания упал примерно в два раза. Когда испытание закончилось, количество очагов вернулось к 5,8 за два месяца.
Паразитарная терапия все еще находится в фазе эксперимента, и, скорее всего, на данный момент имеет негативные последствия, которые перевешивают позитивные. В настоящее время врачебные комиссии классифицируют червей как биологические продукты, которых нельзя продавать, пока не будет доказана их безопасность. Только один вид, Trichuris suis, был одобрен для тестирования нового препарата.
Виротерапия
Методика аналогична той, которая используется для выведения генно-модифицированных растений, только в качестве носителя гена используется вирус. Он уже давно признан в качестве наиболее эффективного средства переноса генов. Эта система используется для производства полезных белков в генной терапии и имеет большой потенциал для лечения иммунологических заболеваний, таких как гепатит и ВИЧ.
Еще в 1950-х годах стало известно, что у вирусов есть потенциал для лечения рака, но появление химиотерапии замедлило прогресс в этом направлении. Сегодня виротерапия на поверку оказывается весьма эффективным средством борьбы против опухолей, поскольку не повреждает здоровые клетки вокруг нее. Клинические испытания онколитической виротерапии показали низкую токсичность и перспективные признаки эффективности. В 2013 году препарат под названием TVEC стал первым лекарством на основе вируса для борьбы с опухолями на поздней стадии.
Использование вирусов для лечения бактериальных инфекций

Поскольку фаги нарушают метаболизм бактерий и уничтожают их, уже давно признано, что они могут играть определенную роль в лечении широкого спектра бактериальных заболеваний. Но из-за инноваций в сфере антибиотиков, фаготерапию снова положили на полку, пока рост резистентных к антибиотикам бактерий не вызвал повышенный интерес в этой области.
Отдельные виды фагов, как правило, эффективны только против небольшого диапазона бактерий или даже одного конкретного вида (основного хозяина), что изначально рассматривалось как недостаток. Но поскольку мы узнали больше о полезных аспектах нашей природной флоры, недостаток превратился в преимущество. В отличие от антибиотиков, которые, как правило, убивают бактерии без разбора, бактериофаги могут атаковать вызывающие заболевание организмы, не нанося вред нашей естественной флоре.
В то время как бактерии могут вырабатывать устойчивость как к антибиотикам, так и к фагам, разработка новых штаммов фагов займет всего несколько недель, а не лет. Фаги также могут проникать в тело, находить цель, а когда бактерии будут уничтожены, прекращать воспроизводство и вскоре вымирать.
Вакцины
Когда вакцина вводится, возбудитель начинает работать, что недостаточно, чтобы размножиться в таком размере, чтобы вызвать заболевание. Тело производит иммунный ответ, убивает возбудителя или разрушая токсин, ответственный за болезнь. Иммунная система организма теперь знает, как бороться с болезнью и будет помнить, если возбудитель снова проникнет в тело. Другими словами, ученые выяснили, как заставить возбудитель помочь своей цели защититься от него. Они даже сделали несколько шагов к разработке вакцин для нескольких форм рака и вируса гепатита B (который вызывает рак печени), вируса папилломы человека типа 16 и 18 (который вызывает рак шейки матки) и метастатический рак предстательной железы у некоторых мужчин.
Благодаря вакцинам, несколько заболеваний были вынуждены виртуально исчезнуть. Оспа остается наиболее известным примером, но полиомиелит, который хоть и не полностью уничтожен, стоит на втором месте. Несколько других заболеваний могут уйти хоть сейчас, если бы вакцины не было так трудно доставить в слаборазвитые страны.
Бактериальная утилизация отходов
Мертвые останки животных и растений, наряду с экскрементами всех организмов, содержат жизненно важные питательные вещества и запасенную энергию. Без возможности вернуть эти питательные вещества, имеющиеся источники были бы быстро исчерпаны. К счастью, многие виды бактерий выбирают именно эти источники энергии, разбивая их на свои маленькие молекулы и возвращая их в почву, откуда они затем повторно входят в пищевую цепочку.
В дополнение к этому процессу люди нашли массу способов использования его аналогов. Бактерии используются в очистке сточных вод, управлении промышленными отходами и очистке нефтяных разливов, утекших фармацевтических препаратов и сточных вод. Они также полезны в развитии аквахозяйств, борьбе с водорослями и биотуалетах. Исследователи и инженеры постоянно ищут способы применения бактерий. Возможно, их даже приспособят для расщепления пластиковых отходов.
Мы бы погибли без кишечных бактерий
Чем больше мы узнаем о полезных штаммах бактерий кишечника, тем больше мы можем включить эти знания в здоровый образ жизни. После того как было установлено, что некоторые кишечные бактерии могут играть определенную роль в ожирении, особую популярность приобрели пробиотики. Пробиотики — это бактерии, которые заменяют ферментированные пищевых продукты и в настоящее время продаются в виде добавок. Бактерии типа некоторых видов бифидобактерий могут создавать высококислотную среду, в которой менее полезные микроорганизмы выжить не могут. Жирная пища и стресс также могут играть роль в здоровье нашей желудочной флоры, убивая полезные бактерии и давая развернуться вредным бактериям, которые вызывают газы, вздутие живота и синдром повышенной кишечной проницаемости.
Бактерии кожи могут быть на передовой иммунитета
Одной из наиболее распространенных бактерий кожи является Staphlococcus epidermis. Известно, что она играет важную роль в борьбе с Leishmania major, причиной опасной болезни под названием лейшманиоз, которая рождает незаживающие язвы. Хорошая бактерия вызывает иммунный ответ под названием IL-1, который тело не может производить самостоятельно. Эти стафилококки стали обязательной частью нашего существования.
Прокариоты, которые населяют пищеварительный тракт, также охватывают и всю наружную поверхность на коже. Наряду с остальной частью нашей полезной микрофлоры кожи, они стали частью нас, когда конкурировали с менее доброжелательными микроорганизмами за право жить. Наряду с иммунными клетками нашей кожи, они защищают нас от болезнетворных бактерий и патогенных грибов, которые хотят в нас жить. Это позволяет нашим органам тратить меньше энергии, защищая наш экстерьер, и больше сосредоточиваться на вещах типа борьбы с вирусами и предраковыми клетками.
Хотя нам еще многому нужно поучиться у них и больше узнать об этих полезных бактериях, в будущем бактерии кожи будут использоваться целенаправленно.
Жизни не было бы без цианобактерий

Цианобактерии были первыми фотосинтезаторами в мире. Они использовали энергию солнца вместе с химическими веществами в первых океанах и инертный азот в атмосфере для пропитания. В качестве продукта отходов они производили кислород, который был ядом практически для любой другой формы жизни в то время. В течение примерно 300 миллионов лет все эти кислородные отходы образовали атмосферу, какой мы ее знаем, в течение архейских и протерозойских эр.
Иногда, в течение протерозоя или в начале кембрийского периода, эти бактерии формировали симбиотические отношения с некоторыми клетками эукаритот, давая клеткам пищу в обмен на стабильные условия, которые можно было назвать домом. Это были первые растения. Невероятное событие эндосимбиоза до сих пор считается одним из важнейших в становлении первой жизни.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
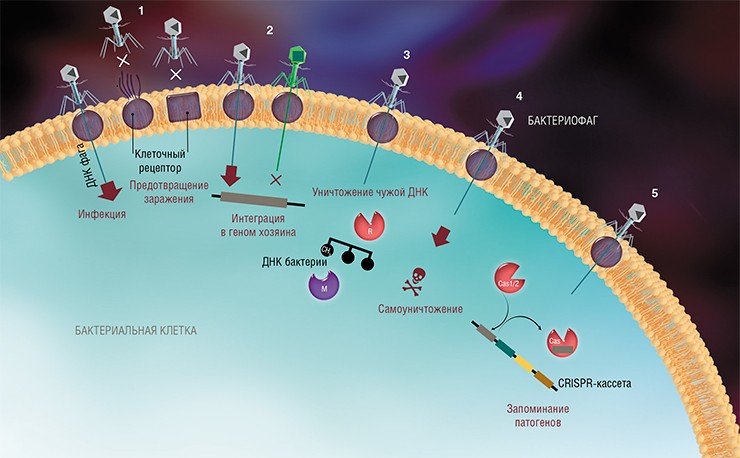
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Читайте также:


