Как лечить тромбоцитопению при гепатитах
ТРОМБОЦИТОПЕНИИ ПРИ ВИРУСНОМ ГЕПАТИТЕ С И ВОЗМОЖНОСТИ ЕЁ КОРРЕКЦИИ МНФК “ГРИНИЗАЦИЯ”
Контакт с автором: ppsss@i.ua
Национальный медицинский институт им. А.А. Богомольца
МОЗ Украины, г. Киев
В статье приведены данные о возможных механизмах развития тромбоцитопении у больных вирусным гепатитом С и связанные с этим трудности лечения таких пациентов. Сделан акцент на отсутствие в настоящее время препаратов для повышения уровня тромбоцитов, что делает невозможной специфическую противовирусную терапию, или очень снижает её эффективность. Приведены данные наблюдения стабилизации уровня тромбоцитов у некоторых больных вирусным гепатитом С с помощью МНФК “Гринизация”.
Ключевые слова: метаболический синдром, вирусный гепатит, тромбоцитопения, Гринизация.
Тромбоцитопении при вирусном гепатите С имеют несколько механизмов развития, являются одним из внепеченочных проявлений заболевания и являютися серьезным препятствием к назначению специфической противовирусной терапии, либо причиной прерывания начатого лечения. Последнее крайне нежелательно, особенно у больных с 1 генотипом вируса, т.к. несвоевремено прерванное лечение не только снижает эффективность ПВТ, но и способствует формированию новых, еще более устойчивых к терапии квазивидов вируса (1,2). На сегодняшний день в нашей стране отсутствуют зарегистрированные тромбопоэтины, а за рубежем имеющиеся препараты этой группы только начинают линические исследования, связанные с гепатитом С.
Причина развития тромбоцитопении при ХВГС до конца не изучена. В организме человека тромбоциты выполняют ряд функций. Прежде всего это участие в немедленном гемостазе, местное выделение вазоконстрикторов, катализ реакций гуморальной системы свертывания крови, инициирование репарации тканей, регуляция местной воспалительной реакции и иммунитета, клиренс иммунных комплексов (3).
Схематично тромбоцитопоэз можно представить в следующем виде:
Таким образом, “гиганты красного костного мозга (промегакариоцит и мегакариоцит) дают карликов крови” - тромбоциты представляют собой маленькие безъядерные элементы крови.
Основные причины возникновения тромбоцитопении у больных с вирусным гепатитом С можно разделить на следующие группы (2,3,4):
- Гиперспленизм - повышение функции селезенки, чаще на фоне ее увеличения. Селезенка в организме выполняет две основные функции – тормозящее действие на костный мозг и ускорение гибели старых кровяных клеток путем их фагоцитоза. Основными клиническими проявлениями гиперспленизма являются различные цитопении (лейкопения с нейтропенией, эритропения, тромбоцитопения, реже – негемолитическая анемия, панцитопения). Явления гиперспленизма могут возникать как следствие всех форм спленомегалии, однако отсутствие увеличения селезенки не является исключением гиперспленизма. Диагноз устанавливается на основании характерной клинической картины, а также обнаружением в пунктате костного мозга нормального либо чуть повышенного количества мегакариоцитов (5).
- Уменьшение продукции тромбопоэтинов. . При тяжелых диффузных поражениях печени возможно угнетение продукции стимуляторов тромбоцитопоэза, в частности, тромбопоэтина (4,5)
- Иммуноопосредованный клиренс тромбоцитов. Хорошо известна связь тромбоцитопении с воздействием различных вирусов. Известна ассоциация тромбоцитопении с ВИЧ, у детей до 70% тромбоцитопений связано с предшествующими инфекциями – ветряная оспа, корь и т.д. Предполагается, что вирусы изменяют антигенную структуру тромбоцитов как в результате взаимодействия с мембранными белками (гликопротеинами), так и вследствие ненепосредственной фиксации на поверхности тромбоцитов. В результате происходит выработка антител против измененных тромбоцитарных гликопротеинов, либо перекрестное взаимодействие собственно противовирусных антител с фиксированными на тромбоцитах вирусными частицами. Впервые связь ВГС-инфекции с тромбоцитопенией была обнаружена, когда удалось в отмытых эритроцитах обнаружить РНК ВГС. При этом связывание вируса с тромбоцитами может индуцировать либо формирование новых антигенов на поверхности тромбоцита, либо изменять конформацию тромбоцитарных гликопротеинов. И то и другое приводит к образованию антитромбоцитарных антител (2,,5,6).
- Действие вируса на клетки-предшественники тромбоцитопоэза, в частности, мегакариоциты. Доказана репликация вируса в клетках-предшественниках тромбоцитопоэза, в частности, мегакариоцитах (5).
- Тромбоцитопения, связанная с лечением альфа-интерферонами. Лекарственная тромбоцитопения может быть вызвана самыми разными препаратами, в т.ч. интерферонами. Основной механизм развития — разрушение тромбоцитов комплементом, который активируется реакцией препарата с антителами против него. Препарат, вызвавший тромбоцитопению, отменяют, после чего уровень тромбоцитов нормализуется за несколько суток (5,6)
Для коррекции тромбоцитопении у больных ХВГС в Украине предложены препараты мультинутриентного функционально-пептидного комплекса (МНФК), относящиеся к группе биологически активных добавок. Получают препараты путем переработки природного сырья (перепелиное мясо, спирулина, кумыс, зародыши пшеницы и др.) с помощью специальной технологии “ Grinization ”. Это оригинальный принцип низкотемпературной многоступенчатой переработки, который позволяет разделять и концентрировать пептидные фракции, витамины, ферменты в природной конфигурации. Они представлены двумя формами – жидкой (Грин Микс) и сухой (Грин Про).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В клинике кафедры инфекционных болезней Национального медицинского университета в 2007-2008 году находилось под наблюдением 31 больной с ХВГС, имеющих тромбоцитопению до начала проведения ПВТ, причем 12 из них – с рецидивом заболевания после ПВТ. Уровень тромбоцитов колебался от 28х10 6 /л до 141х10 6 /л (среднее значение тромбоцитов составило 99,4 6±8,5).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Распределение больных в зависимости от генотипа вируса представлено на следующей диаграмме.
Рис.1. Удельный вес больных ХВГС и тромбоцитопенией с различными генотипами вируса, %.
1-генотип наблюдался у 19 больных (61,3%), 3 генотип – у 10 (32,2%) больных и у 2 (6,5%) – 2 генотип вируса. У 7(22,6%) больных наблюдались клинические признаки компенсированного цирроза печени. Все пациенты до проведения ПВТ получали препарат Грин-Микс и Грин-Про в стандартных дозировках с целью стабилизации уровня тромбоцитов. Курс лечения препаратом в среднем составил 12 недель.
Повышение уровня тромбоцитов наблюдалось у всех больных без признаков цирроза печени и у 4(57,2%) больных с признаками цирроза печени. Максимальный клинический эффект наблюдался в течение первых 2-х недель от начала приема препарата. После проведения курса терапии уровень тромбоцитов оставался в пределах нормальных величин в течение 24 недель наблюдения.
У больных с признаками компенсированного цирроза печени эффект был достигнут более чем в половине случаев, однако после прекращения применения препарата отмечалась вновь склонность к тромбоцитопении.
При применении препаратов отмечены следующие закономерности:
- чем ниже изначальное количество тромбоцитов, тем более выраженное было их повышение при приеме препаратов группы “Гринизация” (например, 27 х10 6 /л → 280 х10 6 /л);
- у больных с клиническими признаками цирроза печени наблюдался менее выраженный клинический эффект;
- полученный эффект не зависел от генотипа вируса гепатита С.
● Тромбоцитопения является важным фактором, препяствующим начать ПВТ у больныхс ХВГС.
● Для стабилизации уровня тромбоцитов до начала ПВТ хорошо зарекомендовали препараты группы “Гринизация.
● Действие препарата не зависит от генотипа вируса гепатита С, но зависит от наличия цирроза печени.
● Действие препарата на фоне ПВТ требует дальнейшего изучения.
- Т.М. Игнатова, З.Г. Апросина, В.В. Серов, и др . Внепеченочные проявления хронической HCV-инфекции // РМЖ. — 2001. — № 2: — С. 13—18.
- М.В. Маевская – Тромбоцитопения на старте противовирусной терапии хронического гепатита С. – Материалы конференции “Гепатология сегодня”, Москва, 19-22 апреля 2007 года.
- Ш. Шерлок, Дж. Дули . Заболевания печени и желчных путей. М., Гэотар Медицина, 1999
- Freeman AJ, Marinos G, Ffrench RA, Lloyd AR . Immunopathogenesis of hepatitis C virus infection. Immunol Cell Biol 2001;79:515-536
Дополнение к статье
Выдержка из Методических рекомендаций МОЗ Украины, “Мультинутриентный функционально- пептидный комплекс “Гринизация” в клинической практике”, с. 23, 2010г.
Алгоритм применения МНФК “Гринизация” ( Грин Микс и Грин Про ) у больных ХВГС при проведении противовирусной терапии
Вариант 1. Больным при отсутствии изменений количества тромбоцитов во время проведения противовирусной терапии рекомендуют профилактические дозы Гринизации. При умеренном уменьшении количества тромбоцитов дозу Гринизации увеличивают.
Вариант 2. Больным при незначительном уменьшении количества тромбоцитов в крови (не меньше 100х109 в 1 в л) во время проведения противовирусной терапии рекомендуют средние дозы Гринизации. При отсутствии тенденции к уменьшению количества тромбоцитов дозу уменьшают до профилактической.
Вариант 3. Больным при значительном уменьшении количества тромбоцитов в крови (70 - 90х109 в 1 в л) перед проведением противовирусной терапии в течение 14 суток рекомендуют применение высоких доз Гринизации до увеличения количества тромбоцитов к 100х109 в 1 в л и больше. На весь период проведения противовирусной терапии рекомендуют назначать Гринизацию в средней дозе. При условии стабилизации количества тромбоцитов можно перейти на профилактические дозы.
Вариант 4. Больным, у которых количество тромбоцитов уменьшилось до 80х109 в 1 в л и меньше, не отменяя противовирусную терапию, назначают Гринизацию в высокой дозе. При увеличении количества тромбоцитов продолжают лечение на фоне применения Гринизации в высоких дозах. При стабильно допустимом количестве тромбоцитов (в пределах 100-150х109 в 1 в л) дозу Гринизации уменьшают до средней. При появлении тенденции к уменьшению количеству тромбоцитов - дозу увеличивают.
Положительное влияние Гринизации на количество тромбоцитов предопределено, иммуномодулирующим, цитопротекторным, антиоксидантным и апоптозмодулирующим действием биологически активных компонентов мультинутриентного комплекса.
ДОЗЫ И РЕЖИМ УПОТРЕБЛЕНИЯ МУЛЬТИНУТРИЕНТНОГО ФУНКЦИОНАЛЬНО-ПЕПТИДНОГО КОМПЛЕКСА ГРИНИЗАЦИЯ
Дозы и длительность применения “Гринизация Микс” и “Гринизация Про” зависит от цели назначения, нозологии, массы тела, пола и возраста.
Грин Микс - от 5 до 10 мл в сутки
Грин Про - от 3-4 до 7 или от 2,5 до 5 г порошка в сутки.
Грин Микс - 15 мл в сутки
Грин Про - 10 капсул или 7 г порошка в сутки.
(Как правило, используется порошковая форма Грин Про)
Как лечебное питание при тяжелых инфекциях, истощени и , ожог ах , травм ах и других тяжелых состояни ях , а также при проведении лучевой терапии, химиотерапии: Грин Микс - от 25 до 33 мл, Грин Про - от 12 до 16 г в сутки.
При тяжел ых состояниях дозу можно увеличивать Грин Микс - до 50 мл на сутки, Грин Про - до 25 г в сутки. Длительность применения 1-2 месяца с дальнейшим уменьшением дозы на 1-2 мес.
При значительном истощении, высоких показателях активности воспалительного процесса в печени, тяжелой интоксикации во время проведения химиотерапии дозу Грин Микс можно увеличить до 100 мл в сутки, Грин Про - до 50 г в сутки (т. е., практически до суточной потребности организма в белках).
Одно из ведущих мест в структуре этиологических причин поражения печени занимает хронический гепатит С. Часто именно у пациентов с хроническим гепатитом С наблюдается тромбоцитопения.
Клиническое значение тромбоцитопении при хроническом гепатите С определяется повышенным риском развития кровотечений при проведении инвазивных диагностических и лечебных манипуляций (пункционная биопсия печени, эндоскопия, трансплантация печени). Даже при тромбоцитопении менее 50х103/мкл спонтанные кровотечения и кровоточивость встречаются крайне редко. Однако у пациентов со сформированным циррозом печени в исходе гепатита С риск кровотечений при тяжелой тромбоцитопении выше, чем у пациентов с небольшим уровнем фиброза. Уровень тромбоцитов оценивается врачом для решения вопроса о назначении интерферонотерапии.
Тромбоцитопения у пациентов с хроническим гепатитом С возникает вследствие нарушенной продукции и повышенного разрушения тромбоцитов. При гиперспленизме происходит избыточный распад тромбоцитов в гипертрофированной селезенке. Аутоиммунный процесс поломки тромбоцитов связан с образованием антитромбоцитарных антител, которые связывают поверхностные антигены тромбоцитов и образованные иммунные комплексы разрушаются в печени и селезенке. Нарушение выработки тромбоцитов вызвано подавлением костномозгового кроветворения вследствие прямого цитотоксического действия. Кроме того, печень является основным органом, в котором происходит синтез тромбопоэтина, который регулирует созревание и дифференцировку мегакариоцитов в тромбоциты в костном мозге. С развитием фиброза в печени снижается выработка тромбопоэтина. Также нарушается синтез тромбоцитов вследствие действия на процесс кроветворения интерферона-α - основного препарата, который в комбинации с рибавирином используется для лечения вирусного гепатита С. Снижение уровня тромбоцитов происходит у 20-30% пациентов, получающих комбинированную противовирусную терапию. Обычно тромбоциты снижаются на 10-50% от исходного уровня.
Пороговым безопасным исходным значением уровня тромбоцитов для комбинированной противовирусной терапии пегилированными интерферонами и рибавирином является уровень тромбоцитов более 90х103/мкл для Пег-интерферонов более 100х103/мкл. На практике такая выраженная исходная тромбоцитопения встречается преимущественно у пациентов с декомпенсированным циррозом печени (класс С по системе Чайлда-Таркотта-Пью), при котором нельзя проводить противовирусную терапию в связи с риском осложнений.
Инфузии тромбомассы не приводят к желаемому уровню тромбоцитов, имеют высокую стоимость, в связи с чем их введение не используется для подготовки пациентов к противовирусной терапии.
Около 3-6% пациентов требуется модификация терапии пегилированным интерфероном. В соответствии с инструкциями к лекарственным препаратам (Пег-интерферон-α 2а и Пег-интерферон-α 2b) рекомендуется снижение дозы интерферона до половины терапевтической, если число тромбоцитов менее 50х103/мкл и прекращение приема интерферона, если число тромбоцитов менее 25х10з/мкл. Есть данные о том, что такое снижение дозы сопровождается снижением вероятности излечения гепатита С.
Для коррекции начальной и интерферон-индуцированной тромбоцитопении у пациентов с гепатитом С для проведения противовирусной терапии Федеральным агентством по контролю качества пищевых продуктов и лекарственных препаратов США одобрено применение фактора роста тромбоцитов - элтромбопага, который стимулирует пролиферацию и дифференцировку мегакариоцитов. Начальная дозировка элтромбопага - 25 мг перорально ежедневно, максимальная дозировка - 100 мг/сут. Рекомендуемый уровень тромбоцитов на фоне терапии элтромбопагом - (50-150)х10з/мкл. Прием препарата прекращается при прекращении противовирусной терапии.
ТРОМБОЗЫ СОСУДОВ ПЕЧЕНИ
Анатомия сосудов печени
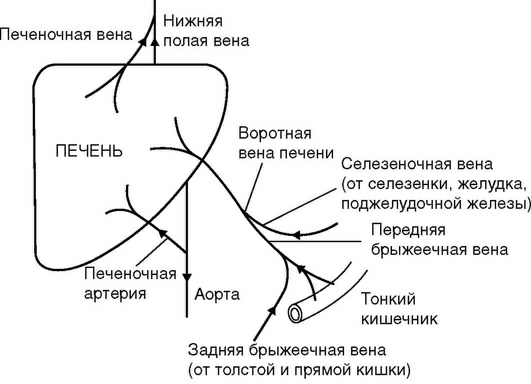
Печень снабжается кровью из двух сосудов: венозного - воротной вены и артериального - печеночной артерии. Воротная (или портальная) вена несет кровь от селезенки, желудка, поджелудочной железы, кишечника. Печеночная артерия ответвляется от чревного ствола, который является одной из основных ветвей аорты. Эти сосуды входят в печень в области ее ворот, где оба сосуда дают ветви к левой и правой долям печени. Венозная кровь от печени оттекает по печеночным венам от левой и правой долей печени, печеночные вены впадают в нижнюю полую вену (рис. 11).
Тромбозы при декомпенсированных заболеваниях печени
У пациентов с декомпенсированным циррозом печени и гепатоцеллюлярной карциномой склонность к венозным тромбозам повышена по сравнению со здоровыми пациентами. Однако в структуре венозных тромбозов непосредственно сосудов печени (воротной вены и печеночных вен) цирроз печени занимает всего 5%, тогда как при гепатоцеллюлярной карциноме тромбоз вен печени происходит в 30% случаев.
Артериальные тромбозы для пациентов с циррозом печени не характерны. Исключение составляют пациенты с неалкогольной жировой болезнью печени, у которых высок риск артериальных тромбозов в рамках метаболического синдрома (инфаркт миокарда, острое нарушение мозгового кровообращения). Тромбоз печеночной артерии может являться осложнением оперативных вмешательств на печени.
При декомпенсированных заболеваниях печени микроскопически часто выявляют тромбозы мелких сосудов печени. Микротромбозы паренхимы печени являются фактором, усугубляющим процесс фиброзирования путем местной ишемии.
Не разработаны эффективные рекомендации по ведению пациентов с тромбозами при декомпенсированных заболеваниях печени.
Тромбоз воротной вены
Тромбоз воротной вены возникает вследствие:
• спленэктомии и других хирургических вмешательств;
• гепатоцеллюлярной карциномы, реже - цирроза печени;
• беременности, длительного приема оральных контрацептивов.
Диагностику тромбоза воротной вены проводят с помощью ультразвукового исследования, которое выявляет в просвете воротной вены тромб, ультразвуковое исследование с допплером оценивает нарушение кровотока. Визуализацию тромба можно проводить с помощью компьютерной и магнитно-резонансной томографии печени с контрастированием, также в воротах печени выявляется сеть расширенных мелких вен. Ангиография выявляет дефект наполнения воротной вены.
В результате гиперспленизма развиваются лейкопения и тромбоцитопения, анемия не развивается (если не происходит кровотечения из варикозно-расширенных вен пищевода). Функциональные печеночные пробы (аланинаминотрансфераза, аспартатаминотрансфераза, γ-глютамилтранспептидаза, щелочная фосфатаза, билирубин, протромбиновый индекс, альбумин) обычно долго остаются в пределах нормы (кроме случаев тромбоза воротной вены на фоне заболевания печени). При выполнении коагулограммы повышены фибриноген и протромбиновый индекс.
При остром тромбозе портальной вены возможно проведение тромболизиса урокиназой, стрептокиназой в воротную вену или верхнюю брыжеечную артерию.
Всем пациентам должна проводиться антикоагулянтная терапия с целью предотвращения распространения тромбоза и, по возможности, восстановления кровотока в воротной вене. Раннее применение антикоагулянтов способствует реканализации воротной вены.
Антикоагулянтную терапию начинают с внутривенного введения нефракционированного гепарина в течение 2-3 нед под контролем АЧТВ.
Можно назначать НМГ (далтепарин, эноксапарин, надропарин), которые так же эффективны и более удобны в применении.
При стабилизации состояния пациента назначается непрямой антикоагулянт - антагонист витамина K - варфарин, доза которого подбирается индивидуально под строгим контролем и поддержанием МНО в пределах 2-3.
Нельзя начинать антикоагулянтную терапию у пациентов с хроническим тромбозом воротной вены, не проведя профилактику кровотечения из варикозно-расширенных вен пищевода.
При циррозах печени с тромбозом портальной вены гепарин или варфарин могут оказать непредсказуемое действие. Ввиду высокого риска кровотечения эти препараты не назначаются у этой группы пациентов. Кроме того, контролировать их дозировку невозможно: АЧТВ у пациентов с циррозом печени зачастую удлиняется, МНО при развитии печеночной недостаточности повышено вследствие низкого синтеза протромбина.
При оперативном лечении имеется большой риск осложнений, в связи с этим хирургическое шунтирование воротной вены выполняется только при продолжающихся кровотечениях из вен пищевода и неэффективности консервативной терапии.
Прогноз определяется основным заболеванием.
Тромбоз печеночной артерии
Тромбоз печеночной артерии встречается крайне редко. Возможные причины тромбоза печеночной артерии:
• осложнение хирургических вмешательств на печени.
Диагноз редко ставится при жизни больного. Работ с описанием клинической картины тромбоза печеночной артерии очень мало. Боль в эпигастрии сопровождается шоковым состоянием, лихорадкой. В результате инфаркта печени быстро нарастает желтуха, повышаются трансаминазы, наблюдается лейкоцитоз. Резко снижается протромбиновый индекс, появляется кровоточивость. При тромбозе крупных ветвей печеночной артерии пациент погибает в течение нескольких суток. Легкое течение тромбоза печеночной артерии, сопровождающееся несильной болью в правом подреберье, может остаться недиагностированным и случайно выявляется при патологоанатомическом вскрытии.
Рутинные исследования показывают гипокоагуляцию. Изменения системы гемостаза, связанные с активацией свертывающих механизмов, можно выявить только с помощью специальных методик, например откалиброванной автоматической тромбинографии.
При ультразвуковом исследовании можно визуализировать гипоэхогенные инфарктные очаги. Также инфаркт печени можно выявить при компьютерной томографии, магнитно-резонансной томографии. Необходимо проведение печеночной артериографии.
Есть скудные данные о применении аспирина для профилактики тромбоза печеночной артерии.
Основной целью является терапия печеночной недостаточности.
Синдром Бадда-Киари - это заболевание, характеризующееся нарушением оттока венозной крови от печени. Основная причина синдрома Бадда-Киари - тромбоз печеночных вен, а также печеночного отдела нижней полой вены.
Причинами синдрома Бадда-Киари могут служить:
• гематологические заболевания (истинная полицитемия, миело-пролиферативные заболевания, АФС);
• использование больших доз эстрогенов;
• гепатоцеллюлярная карцинома, редко - цирроз печени;
• метастатические поражения печени;
• инфекционные болезни печени (туберкулез, амебиаз, аспергиллез);
Клинически синдром Бадда-Киари проявляется надпеченочной портальной гипертензией: гепатомегалией, диуретико-резистентным асцитом, позже присоединяются спленомегалия и варикозное расширение вен пищевода. Поэтому кровотечения из вен пищевода - редкое осложнение синдрома Бадда-Киари. Как правило, гепатомегалия и асцит появляются быстро. Характерен полицитоз, высокий уровень гемоглобина из-за перемещения жидкой части крови в брюшную полость. Быстро прогрессирует печеночная недостаточность, и вследствие этого пациенты погибают. При появлении отеков на ногах следует искать тромбоз нижней полой вены.
Обычно дифференциальная диагностика проводится с печеночной формой портальной гипертензии.
Специфических гематологических тестов не существует. Для диагностики используются допплеровское ультразвуковое исследование, магнитно-резонансная томография и компьютерная томография с контрастированием, золотым стандартом диагностики является печеночная венография. Биопсия печени, использующаяся для дифференциальной диагностики и оценки стадии фиброза печени в случае длительного тромбоза, показывает венозный застой, атрофию печеночных клеток, редко - микротромбозы печеночных венул.
Медикаментозная терапия, направленная на лечение портальной гипертензии и отечно-асцитического синдрома, малоэффективна. Незначительный эффект показали антикоагулянтная (НМГ с переводом на варфарин) и тромболитическая терапия.
Основным методом лечения является хирургическое лечение - проводится портосистемное шунтирование. Некоторым пациентам выполняют трансъюгулярное внутрипеченочное портосистемное шунтирование. Также проводится трансплантация печени.
Дата добавления: 2018-05-02 ; просмотров: 1266 ;

Нормальное число тромбоцитов составляет 150-350 х 10 9 л -1 .
Тромбоцитопения, при которой это число составляет менее 150 х 10 9 л -1 может быть легкой, умеренной и тяжелой. При числе тромбоцитов выше 50 х 10 9 л -1 кровотечения редки и носят легкий характер, пока оно превышает 10 х 10 9 л -1 . Спонтанные кровотечения и кровотечения, требующие медицинской помощи, обычно говорят о снижении числа тромбоцитов менее чем до 10 х 10 9 л -1 . Однако четкая связь между риском кровотечений и числом тромбоцитов часто отсутствует, поскольку гемостаз зависит и от других факторов, включая целостность эндотелия и сохранность функций тромбоцитов.
Оценка степени тяжести тромбоцитопении
| Степень | Число тромбоцитов (х 10 9 л -1 ) |
|---|---|
| Легкая | 50-150 |
| Умеренная | 20-50 |
| Тяжелая | 9 л -1 у беременной женщины, скорее всего, служит проявлением тромбоцитопении беременных, характеризующейся доброкачественным течением. Резкое снижение числа тромбоцитов на фоне лечения сердечно-сосудистых, ревматических или инфекционных заболеваний может быть обусловлено используемыми препаратами. Тромбоцитопения на фоне острых заболеваний и состояний, например сепсиса или респираторного дистресс-синдрома взрослых, обычно бывает связана с усиленным потреблением тромбоцитов и может сопровождаться признаками ДВС-синдрома. Тромбоцитопения у больных с микроангиопатической гемолитической анемией (в мазках крови — фрагментированные эритроциты) и тромбозами указывает на гемолитико-уремический синдром или тромботичп кую тромбоцитопеническую пурпуру. Панцитопения у прежде здоровых людей может быть проявлением апластической анемии или лейкоза, увеличение селезенки может говорить о печеночной недостаточности, миелофиброзе или болезни накопления, например болезни Гоше.
Первичная иммунная тромбоцитопенияПервичная иммунная тромбоцитопения раньше встречалась преимущественно у молодых женщин, однако по мере старения населения она все чаще обнаруживается у пожилых, причем с одинаковой частотой у женщин и мужчин. Распространенность первичной иммунной тромбоцитопении среди всего населения составляет 2,5:100 000, тогда как у лиц старше 60 заболевание встречается с частотой 4,5:100 000. У многих больных тромбоцитопения обнаруживается при проведении общего анализа крови в рамках очередного профилактического осмотра, однако в остальных случаях больные сами обращаются к врачу по поводу возникшей у них петехиальной сыпи или кровоточивости слизистой рта. Обследование начинают со сбора анамнеза, обращая особое внимание на такие симптомы, как лихорадка, боль и похудание, недавно перенесенные инфекции дыхательных путей, факторы риска ВИЧ-инфекции, употребление алкоголя или применение хинина в качестве препарата для лечения мышечных спазмов или в составе напитков. Необходимо собрать сведения обо всех недавно применявшихся больным лекарственных средствах и фитопрепаратах. Во время физикального исследования больного осматривают на предмет признаков нарушений гемостаза, например петехий, субконъюнктивальных кровоизлияний, экхимозов и пузырей с геморрагическим содержимым на слизистой рта. Отмечают также признаки системных заболеваний, включая похудание, гипотиреоз, увеличение лимфоузлов и спленомегалию. При проведении общего анализа крови оценивают тяжесть тромбоцитопении. При хроническом кровотечении общий анализ крови выявляет гипохромную микроцитарную анемию, однако число лейкоцитов обычно бывает нормальным. Как уже упоминалось, для подтверждения тромбоцитопении и исключения других гематологических заболеваний проводят микроскопию мазка крови. Согласно опубликованному в 2011 г. руководству Американского гематологического общества, больным с впервые выявленной первичной иммунной тромбоцитопенией проводить исследование костного мозга не рекомендуется, если анамнез и физикальное исследование у них неинформативны, а общий анализ крови выявляет только тромбоцитопению и железодефицитную анемию. Однако все больные должны быть обследованы на гепатит С и ВИЧ-инфекцию. Если число тромбоцитов превышает 50х10 9 л -1 , лечение не требуется, однако больные должны проходить регулярное обследование. У детей первичная иммунная тромбоцитопения обычно носит острый характер и проходит самостоятельно, не вызывая выраженного или длительного кровотечения, поэтому медикаментозное лечение у них необязательно. Однако у взрослых она может иметь более длительное течение, требующее специфической терапии. Глюкокортикоиды. Больным, у которых число тромбоцитов составляет менее 30х10 9 л -1 или имеются кровотечения, назначают преднизон или преднизолон. Больным с числом тромбоцитов ниже 20х10 9 л -1 обычно показана госпитализация, при сильных кровотечениях им назначают метилпреднизолон в/в. При повышении числа тромбоцитов более чем до 30 х 10 9 л -1 дозу тлюкокортикоидов снижают (во избежание рецидива дозу снижают медленно). Чтобы не допустить повторных кровотечений, число тромбоцитов поддерживают на уровне не ниже 20 х 10 9 л -1 . Однако если это потребует использования тлюкокортикоидов в дозах, превышающих 10-20 мг/сут, придется назначить другое лечение. Хотя при лечении глюкокортикоидами для приема внутрь число тромбоцитов может начать увеличиваться лишь через 5-7 дней, кровоточивость часто снижается в течение 1-2 дней. Иммуноглобулин для в/в введения. В США детям с тяжелыми клиническими проявлениями часто назначают иммуноглобулин для в/в введения, 0,8-1 г/кг однократно, а в Великобритании лечение обычно начинают с тлюкокортикоидов. Во избежание анафилактических реакций препарат вводят медленно, в течение 4-6 ч. В связи с сообщениями о случаях острой почечной недостаточности, вызванной препаратом, во время его введения следят за функцией почек. Причиной этого осложнения могло быть высокое содержание сахарозы в препаратах иммуноглобулина. В настоящее время препараты иммуноглобулинов производятся без добавления сахарозы, с чем может быть связано снижение частоты этого осложнения. Эффект лечения иммуноглобулинами для в/в введения наступает в течение 24-48 ч, однако длится недолго, поэтому у многих больных после лечения отмечаются рецидивы. Спленэктомия. При неэффективности тлюкокортикоидов и иммуноглобулинов для в/в введения проводят спленэктомию или используют препараты второго ряда: агонисты рецепторов тромбопоэтина и ритуксимаб. Следует подчеркнуть, что оптимальным методом признана спленэктомия. Рекомендациям по ее применению присвоена степень 1В (по уровню качества доказательств), означающая высокую степень достоверности того, что данное лечение приведет к желаемому исходу. Перед проведением операции больных как можно раньше вакцинируют против пневмококковой инфекции и Haemophilus influenza, в некоторых центрах проводится также вакцинация против менингококковой инфекции. Кроме того, перед операцией для повышения числа тромбоцитов назначают глюкокортикоиды в высоких дозах. Благодаря такому лечению число тромбоцитов в течение 48 ч часто повышается более чем до 50 х 109 л. Для повышения числа тромбоцитов до уровня, необходимо для обеспечения гемостаза во время операции, вместо тлюкокортикоидов можно использовать агонисты рецептора тромбопоэтина. Агонисты рецептора тромбопоэтина, например ромиплостим и элтром-бопаг, рекомендуется назначать больным с высоким риском кровотечений при развитии у них рецидивов после спленэктомии, наличии противопоказании к ее проведению и неэффективности хотя бы одного из других методов лечения. Ромиплостим вводят п/к 1 раз в неделю, дозу рассчитывают в зависимости от массы тела; элтромбопаг принимают внутрь 1 раз в сут. До тех пор, пока доза препарата не достигнет уровня, обеспечивающего желаемое число тромбоцитов, оно может колебаться в достаточно широких пределах. Если на фоне лечения число тромбоцитов стабильно превышает норму, могут возникнуть ишемические осложнения, однако резкая отмена лечения может привести к быстрому снижению числа тромбоцитов. Ритуксимаб. Это химерные моноклональные антитела к CD20, вызывающие разрушение В-лимфоцитов. Препарат вызывает ремиссию у 40-70% больных, при этом почти у 40% больных она носит стойкий характер. Использование ритуксимаба в сочетании с дексаметазоном, у ранее нелеченных больных позволяет увеличить частоту стойкой ремиссии до 60%. Тромботические микроангиопатииКлинические проявления включают ишемическое поражение органов и тканей: головного мозга, сердца и почек при гемолитико-уре мическом синдроме, печени при HELLP-синдроме, гангрене конечностей или стенки толстой кишки при гепариновой тромбоцитопении. Тромбоцитопения беременныхУ 6-10% беременных развивается легкая тромбоцитопения. Обычно она носит доброкачественный характер и выявляется случайно. В ряде случаев она сопутствует артериальной гипертонии беременных и первичной иммунной тромбоцитопении. Иногда диагноз тромбоцитопении ставят по ошибке из-за неправильного подсчета тромбоцитов в связи с их слипанием in vitro. Во избежание этой ошибки рекомендуется проводить микроскопию мазка крови для выявления агрегатов тромбоцитов. Кроме того, для правильного определения числа тромбоцитов рекомендуется проводить его сразу после забора крови, поскольку ее хранение при комнатной температуре может приводить к их агглютинации. Иногда подсчет тромбоцитов бывает более точным, если в кровь добавляют не ЭДТА, а цитрат натрия. После проверки правильности результатов подсчета тромбоцитов проводят дифференциальный диагноз между тромбоцитопенией беременных, составляющей 75% всех случаев тромбоцитопении, выявляемой во время беременности, и первичной иммунной тромбоцитопенией, составляющей всего 4% этих случаев. Тромбоцитопения беременных не требует лечения, в этих случаях достаточно наблюдения. Однако первичная иммунная тромбоцитопении ( течением беременности может принимать все более тяжелый характер. Для профилактики кровотечений могут потребоваться ежемесячные инфузйи иммуноглобулина для в/в введения отдельно или в сочетании с глюкокортикоидами. В тех случаях, когда во время родов планируется использовать эпидуральную анестезию, число тромбоцитов следует повысить не менее чем 75 000 мкл -1 , чтобы обеспечить безопасную установку катетера. Тромбоцитопения при гепатите С и ВИЧ-инфекцииТромбоцитопения служит частым осложнением гепатита С и ВИЧ-инфекции, однако она редко приводит к спонтанным кровотечениям, даже при крайне выраженном снижении тромбоцитов. Описано несколько механизмов, отвечающих за ее развитие, включая захват тромбоцитов селезенкой, образование иммунных комплексов и заражение мегакариоцитов вирусами. На поздних стадиях ВИЧ-инфекции возможна атрофия костного мозга с развитием панцитопении. Успешная антиретровирусная терапия часто приводит к небольшому повышению числа тромбоцитов. У некоторых больных с гепатитом С число тромбоцитов увеличивается в результате применения элтромбопага, что позволяет им пройти полный курс лечения интерфероном. Ятрогенная тромбоцитопенияЛекарственные тромбоцитопении встречаются относительно редко, их частота оценивается в 1-2 случая на 100 000 человек в год. Лекарственные средства, вызывающие тромбоцитопению, угнетают образование тромбоцитов или индуцируют выработку направленных против тромбоцитов антител. Пожалуй, самой частой причиной лекарственной иммунной тромбоцитопении служит гепарин, однако в данном случае он вызывает не кровотечения, а тромбозы. Наконец, к развитию острой тромбоцитопении могут приводить такие средства, как алемтузумаб, молотое кунжутное семя и китайские фитопрепараты. В развитии лекарственной тромбоцитопении участвуют разные механизмы. Один из них включает связывание препарата с гликопротеидами мембраны тромбоцитов с последующей стимуляцией синтеза антител к данному препарату и их взаимодействие с комплексами препарата с гликопротеидами тромбоцитов. Гепарин вызывает конформационные изменения тромбоцитарного фактора 4, превращая его в чужеродный для данного организма антиген, стимулирующий выработку направленных против него антител. Другие препараты, например хинидин и сульфаниламиды, индуцируют синтез антител, распознающих мембранные гликопротеиды тромбоцитов в присутствии самих препаратов или их метаболитов. Эти антитела могут связываться с мегакариоцитами, подавляя образование тромбоцитов. Тромбоцитопении, вызванные другими причинами. Посттрансфузионная пурпура развивается у лиц, тромбоциты которых лишены антигена PLAI (присутствует на тромбоцитах у 97% людей), после переливания им компонентов крови, содержащих этот антиген. Антитела к PLAI, вырабатываемые реципиентом и направленные против тромбоцитов донора, перекрестно реагируют с его собственными тромбоцитами, вызывая тяжелую тромбоцитопению. После трансплантации органов от РLАI-отрицательных доноров а РLАI-положительным реципиентам, у последних также развивается тромбоцитопения. По-видимому, в данном случае антитела к PLAI вырабатываются донорским лимфоцитами, перенесенными в организм реципиента вместе с трансплантатом. Лечение тромбоцитопенииБольному сообщают, что он должен прекратить применение используемых им с недавнего времени препаратов и отказаться от употребления напитков, содержащих хинин, и проводят повторные определения числа тромбоцитов. В отсутствие кровотечений за больным внимательно наблюдают. При развитии массивных и угрожающих жизни кровотечении переливают тромбоцитарную массу. Исключение составляют гепариновая тромбоцитопения и тромботическая тромбоцитопеническая пурпура, при которых инфузия тромбоцитов противопоказана, поскольку она усиливает тромбоз. Показания к переливанию тромбоцитарной массы
Тромбоцитарную массу получают путем тромбафереза (от одного донора) или выделения из цельной крови (от случайных доноров). По числу тромбоцитов одна доза тромбоцитарной массы, полученной с помощью тромбафереза, эквивалентна 6 дозам, полученным из цельной крови от случайных доноров. Повышение числа тромбоцитов должно быть подтверждено их подсчетом через 1 и 24 ч после переливания. Это исследование позволяет также оценить сохранность и жизнеспособность донорских тромбоцитов. Переливание тромбоцитарной массы может вызывать трансфузионные реакции, риск которых можно свести к минимуму путем удаления из нее лейкоцитов. Во время переливания возможна передача инфекции реципиенту. Для снижения риска этого осложнения необходимо тщательно обследовать донорскую кровь на вирусы. Тромбоцитарную массу необходимо также проверять на бактериальное загрязнение. Иммунизация реципиента донорски ми тромбоцитами встречается редко, даже при переливании тромбоцитарнои массы от случайных доноров. В случае развития аллоиммунизации используют тромбоцитарную массу от доноров, совместимых по группам крови АВО и антигенам системы HLA. Читайте также:
|


