Какие гены составляют геном ретровируса
Геном всех ретровирусов включает две одинаковые одноцепочечные молекулы РНК (8000-10000 н.о.) позитивной полярности , имеющие кэп на 5'-конце и ро1у(A)-последовательность на З'-конце. Две молекулы РНК ассоциированы друг с другом 7-11-нуклеотидными участками на 5'-концах. Помимо геномной РНК в составе вирионов в небольшом количестве обнаруживается тРНК (как правило, триптофановая , пролиновая или лизиновая) , необходимая на этапе репликации вирусов.
Уникальной особенностью ретровирусов среди РНК-содержащих вирусов является то, что их позитивно-полярный геном не принимает участия в транскрипции , а становится основой для формирования интегрированного в хромосому провируса, последовательность которого служит матрицей для синтеза мРНК.
Геном ретровирусов ( рис. 192.2 ) содержит как кодирующие, так и некодирующие нуклеотидные последовательности. Многие некодирующие последовательности представляют собой специфические участки связывания регуляторных факторов.
В зависимости от уровня организации их геномов ретровирусы разделяют на две группы - простые и сложные.
Геном простых ретровирусов (к ним относится большинство онкогенных вирусов ) включает три кодирующих участка: gag , направляющий синтез матриксного белка, капсида и нуклеокапсида; pol , ответственный за образование ферментов обратной транскриптазы, протеазы (у некоторых ретровирусов этот белок кодируется С-концевой частью гена gag или смежной с нею последовательностью pro ) и интегразы ; env , кодирующий белки, формирующие вирусную оболочку. У большинства ретровирусов гены pol и env перекрываются и имеют разные рамки считывания. Порядок взаимного расположения генов одинаков для всех ретровирусов: 5'-gag-pol-env-3'.
Геномы сложных ретровирусов ( лентивирусы и спумавирусы ) в дополнение к генам gag, pol и env имеют последовательности, которые служат матрицей для синтеза регуляторных ( Tat и Rex HTLV ) и вспомогательных ( Vpr и Vif ВИЧ-1 ) белков.
Концевые участки ДНК-генома ретровирусов отличаются от концевых участков РНК-генома. На обоих концах ДНК-генома имеются идентичные последовательности, названные длинными концевыми повторами (LTR - long terminal repeats), которые выполняют регуляторные функции: содержат промоторы, участвуют в интеграции провируса в клеточный геном, в регуляции размножения вирусов ( рис. 2.13 ) и полиаденилировании вирусной РНК. Участок связывания праймера , необходимого для инициации обратной транскрипции, и последовательности, ответственные за сборку вирусов, находятся вне длинных концевых повторов.
Основные области LTR носят наименования U3 , R и U5 ; размеры их существенно различаются среди ретровирусов. Область U3 (75-250 н.о.) включает большинство элементов контроля транскрипции , последовательности энхансера и промотора . Точка инициации транскрипции отделяет U3 от области R (18-250 н.о.), обеспечивающей гомологию последовательностей, которая необходима для переноса цепи в ходе обратной транскрипции . Область U5 (75-250 н.о.) содержит сигнал полиаденилирования и совместно с областью R отвечает за посттранскрипционное присоединение poly(A)-последовательности. Кроме того, в этой области содержатся AТТ-сайты, необходимые на этапе интеграции. В составе вирусной РНК на 5'-конце находятся области R и U5, а на З'-конце - области U3 и R.
Кодирующие участки генома содержат структурные гены gag , pol и env . В результате транскрипции генов gag и pol образуется единая молекула мРНК, которая в большинстве случаев транслируется в полипротеин Gag . Однако часть молекул мРНК в результате сдвига рамки считывания дает большой полипротеин Gag-Pol .
При расщеплении полипротеина Gag образуются от трех до пяти капсидных белков.
Полипротеин Pol состоит из трех белков: обратной транскриптазы, интегразы и протеазы. Обратная транскриптаза обеспечивает образование на матрице вирусной РНК двухцепочечной ДНК, которая затем встраивается в клеточный геном при участии интегразы. Протеаза расщепляет полипротеин Gag-Pol на отдельные белки.
Ген env кодирует гликопротеиды внешней оболочки: один из белков обеспечивает адсорбцию вируса на мембранных рецепторах клетки и определяет тропность вируса; другой небольшой трансмембранный белок удерживает комплекс гликопротеидов во внешней оболочке.
Среди других важных для жизнедеятельности последовательностей ретровирусов выделяют: участок связывания праймера ( PBS - primer binding site ) размером 18 и.о., расположенный правее 5'-U5-области и комплементарный З'-концу тРНК, используемой в ходе обратной транскрипции; нетранслируемую лидерную последовательность (leader) длиной 90-500 н.о., участвующую в димеризации и упаковке РНК; полипуриновый тракт (PPT - poly-purine tract) - короткую последовательность из пуриновых (A и G) нуклеотидов, ответственную за инициацию синтеза позитивно-полярной цепи ДНК в ходе обратной транскрипции.
Строение ретровирусов показано на рис. 192.3 .
В геноме Т-лимфотропных вирусов человека между геном env и З'-длинным концевым повтором расположена нуклеотидная последовательность, кодирующая по меньшей мере два разных белка. Белок Tax с молекулярной массой 40000 сам не взаимодействует с ДНК, но запускает синтез клеточных факторов, стимулирующих транскрипцию клеточных генов. Белок Rex с молекулярной массой 27000 регулирует транскрипцию вирусных генов. Образование обоих белков обеспечивается альтернативным сплайсингом, в результате которого из одного транскрипта образуются две зрелые мРНК на основе различных, хотя и перекрывающихся экзонов .
Геномы всех лентивирусов , и особенно ВИЧ-1 и ВИЧ-2 , превосходят по размеру геномы других патогенных ретровирусов, поскольку между генами pol и env у них имеется дополнительный участок. Этот участок кодирует несколько белков, синтезируемых путем трансляции одной мРНК с различными рамками считывания. Белок Tat с молекулярной массой 14000 стимулирует экспрессию вирусных генов, связываясь с трансактивируемым регуляторным элементом (TAR) , расположенным в области длинных концевых повторов. Белок Rev регулирует у ВИЧ-1 сплайсинг транскриптов, а также транспорт РНК из ядра в цитоплазму. Он функционирует аналогично белку Rex у Т-лимфотропных вирусов человека . Белок Nef подавляет образование антигенов CD4 (на которых адсорбируется ВИЧ ), нарушает процесс активации Т-лимфоцитов и способствует распространению вирусной инфекции. Белок Vif необходим для правильной сборки нуклеокапсидов ВИЧ ; без этого белка нарушается образование ДНК провируса в некоторых типах зараженных клеток. Белки Vpr и Vpu / Vpx (соответственно у ВИЧ-1 и ВИЧ-2 ) синтезируются путем трансляции одной мРНК с различными рамками считывания.
Как уже было сказано, лентивирусы в отличие от онкогенных ретровирусов способны заражать непролиферирующие клетки. Эта способность в значительной степени зависит от белка Vpr , который облегчает перенос провируса в клеточное ядро, вызывает задержку пролиферации клетки в периоде G2 или дифференцировку некоторых клеток- мишеней. Белок Vpx структурно сходен с белком Vpr , но функция белка Vpx окончательно не установлена. Белок Vpu стимулирует разрушение CD4 в эндоплазматическом ретикулуме, а также выход вирусов из клетки.
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-зависимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы выделены от множества видов животных и проявляют разнообразный спектр патогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гамма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам лимфОретикулярной и гемопоэтической системы. Ретровирусы у специфических для них видов животных встречаются повсеместно. В борьбе с ретровирусными инфекциями основной мерой является предотвращение передачи вируса.
Вирионы ретровирусов представляют собой округлые оболочечные частицы диаметром 80—100 нм, обладающие уникальной трехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта структура окружена икосаэдрическим капсидом диаметром около 60 нм, покрытым оболочкой, происходящей из мембраны клетки, от которой отходят гликопротеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72 шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уплотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный димер из двух молекул линейной позитивной полярности, оцРНК; каждая молекула содержит 7-11 тн и имеет полиА последовательность на З'-конце и КЭП-структуру на 5'-конце. Детальная организация геномов разных ретровирусов широко варьирует.
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после инфекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интеграза и РНКаза, каждая в меру своей определенной функции, представляют различную часть белковой молекулы. Геном недефектных ретровирусов содержит три разных гена, каждый из которых кодирует два и более белка. Gag ген кодирует вирионные коровью белки, pol ген кодирует обратную транскриптазу, a env ген кодирует вирионные пепломерные белки. Геном кодирует также несколько определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген — вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в другом месте генома, обычно в env гене, так что большинство v-onc содержащих вирусов не способны синтезировать полностью оболочку и поэтому являются дефектными по репликации. Они всегда находят связь с недефектными вирусами, которые реплицируются полностью и функционируют в качестве помощников. Вирус саркомы Рауса является исключением. Его геном содержит вирусный онкоген v-src и также полные gag, pol и env гены, и поэтому является репликативнокомпетентным.
Vpu, vpr и vpx найдены в лентивирусах приматов. Vpu способствует созреванию вирусных гликопротеинов и освобождению вирионов почкованием; Vpr -слабый активатор транскрипции; Vpx, по-видимому, способствует репликации в Т-лимфоцитах и макрофагах.
При продуктивной инфекции вирионы формируются и освобождаются почкованием через плазматическую мембрану. Некоторые ретровирусы вызывают образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях. Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они представляют проблему, когда контаминируют клеточные культуры, но их связь с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе стоят к ДНК гепаднавирусам.
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород свиней. Известны три субгруппы этого вируса: А, В и С. Все свиньи содержат множественные провирусы (около 50) в своем геноме. PERVлатентно инфицирует многие культуры клеток свиньи и, реже, человека. Патогенность этого вируса не установлена.
Онковирусы, в отличие от лентивирусов, реплицируются в делящихся клетках. В составе ретровирусов обнаружено 11-13 белков. Часть из них локализована в сердцевине, а главный внутренний белок Р27 - Р30 - в мембране, окружающей РНК. В составе липопротеиновой оболочки 2-5 гликопротеинов, из которых более крупный образует головку шипика и является главным компонентом оболочки, а более мелкие белки образуют отросток, погруженный в билипидный слой. Различные белки ответственны за групповую и типовую специфичность. Подгрупповые и типоспецифические антигены связаны с наружными гликопротеинами и выявляются в РН, РСК, ИФ и РИД. Группоспецифические антигены связаны с белками сердцевины. Их обнаруживают в РСК, ИФ и РИД. Главный внутренний белок Р27 - РЗО - основной группоспецифический антиген, общий для всех ретровирусов птиц или млекопитающих, относящихся к одной группе.
Согласно предложенной ранее номенклатуре структурные белки ретровирусов обозначали следующим образом: МА - матриксный, СА - капсидный, NC -белок нуклеокапсида, SU - поверхностный, ТМ - трансмембранный, PR- протеаза, RT - ревертаза, IN - белок интеграции.
Одна интересная черта ретровирусов заключается в том, что мы можем понять их эволюцию и эволюцию нашей клеточной защиты. Вирус иммунодефицита человека пришел к нам от приматов. Самый распространенный тип ВИЧ называется ВИЧ-1. Он составляет примерно 60 миллионов человеческих заражений ВИЧ. Это практически единичный случай, когда вирус шимпанзе поразил человека и стал распространяться среди человеческого населения. Мы знаем, что направление заражения именно такое — от шимпанзе к человеку, — потому что у шимпанзе существует больше типов этого вируса, чем у людей.
Существует еще один тип ВИЧ, названный ВИЧ-2, который пришел к нам от африканских обезьян, а именно дымчатого мангобея. И снова разновидностей этого вируса у мангобеев намного больше, чем у человека. Это говорит нам о том, что перенос вируса происходит от обезьяны к человеку. ВИЧ-2 вызывает похожую болезнь, что и ВИЧ-1, у примерно 20–30% людей. Однако у большинства людей не наблюдаются никакие значимые симптомы после заражения ВИЧ-2. Поэтому один из важных вопросов ВИЧ-биологии заключается в поиске отличий между тем вирусом, который заразил 60 миллионов человек, и тем, что не инфицировал даже приблизительно такое число.
У приматов есть похожие вирусы. Более того, большинство африканских приматов имеют вирус, который родственен нашему ВИЧ-1. Обычно мы называем эти вирусы в соответствии с видом, в котором мы их нашли. Вирус шимпанзе называется ВИО (SIV) — вирус иммунодефицита обезьян (simian immunodefiency virus). В таком случае, бывает ли у шимпанзе СПИД? Это не до конца понятно. Не все шимпанзе заражены. Существуют определенные территории, где проживают зараженные шимпанзе. Но так как они не живут жизнью людей, не ведут утонченный образ жизни, а, наоборот, проживают более трудную жизнь, то умирают намного раньше, за ними становится очень сложно следить и выяснять, есть ли у них это заболевание.
Из-за этого долгое время мы думали, что они не страдают никакими болезнями, потому что у них нет такого сильного иммунодефицита, как у людей. Но в последнее время мы стали думать, что они тоже имеют эту болезнь, возможно, в менее суровой форме. Так как они не живут долго, им не приходится страдать от тех симптомов, которые переживает человек.
Таким образом, до конца не известно, что происходит с ретровирусной инфекцией в организме обезьян. У африканских обезьян вирус практически не вызывает никаких заболеваний, поэтому кажется, что имеет место адаптация как носителя, так и самого вируса по такому принципу, что обезьяна может быть инфицирована, но не страдать от болезней. Они могут заразиться в достаточно раннем возрасте, поэтому могут иметь вирус в своем теле, но при этом не ощущать значимых последствий для своей жизни.
Среди других видов ретровирусы тщательно изучались у мышей. Это делалось в основном потому, что ретровирусная инфекция у мышей способна вызывать рак. Мышь заражается ретровирусом, который обычно называют гамма-ретровирус. Оказывается, что эта ретровирусная инфекция вызывает у мышей рак. Люди, изучавшие рак в 1950–1960-х годах, то есть в самом начале подобных исследований, выращивали мышь до тех пор, пока она не становилась очень уязвимой к этой болезни, а потом пытались выяснить, почему у этих мышей развивается рак. Оказалось, что они получали рак, потому что были инфицированы ретровирусом. Эти ретровирусы переносили гены (онкогены), которые вызывали рак. Таким образом, все первичные исследования ретровирусов были направлены на понимание того, как работает рак и что его вызывает.
Когда появился ВИЧ и стал вызывать иммунодефицит, это стало первым случаем, когда такой тип вируса вызвал такую болезнь. До этого мы знали о ретровирусах только из исследований гамма-ретровирусов, вызывающих рак. Ретровирусы — это такие типы вирусов, которые можно рассматривать как вирусы, путешествующие налегке. Так, например, ВИЧ имеет всего девять генов, а другие ретровирусы вообще три. Так что они действительно путешествуют налегке по сравнению с вирусом герпеса, например, который имеет около двухсот генов. Я считаю, что эти вирусы — МО (modus operandi), их стратегия — путешествовать налегке и быть тихими. Их цель при поражении клетки — не активировать ее и не причинить много ущерба. Я думаю, что изначально они не вызывают сильных болезней, но в длительной перспективе эта инфекция может вызвать болезни вроде рака у мышей. Хотя, возможно, они не вызовут рак у диких мышей. Это происходит только тогда, когда мы пробиваем защиту мыши.
Итак, ретровирусы — это относительно милосердные вирусы, я считаю, потому что они не управляют вашим телом, как делают другие вирусы. Главное их отличие в том, что они превращают РНК в ДНК и интегрируют ДНК в хроматин. Это и есть уникальная черта ретровирусов. Некоторые другие вирусы поступают так же, но только в качестве дополнения. Ретровирусы целиком зависят от этого процесса интеграции. Если клетка не может от них избавиться, она должна умереть для избавления себя от вирусной инфекции.
Ретровирусы внедряют свой геном в хроматин хозяина. Стоит этим генам попасть внутрь хроматина — они останутся там навсегда. Клетка в целом относится к ним как к клеточным генам, так что они считываются, производят РНК, а позже эта РНК направляется в цитоплазму. Вирус производит протеин, клетка производит вирусный протеин, новые вирусы формируются, и они готовы двигаться дальше, заражать новые клетки. Так ретровирусы стали отличным инструментом для изучения клеточной биологии, и это потому, что они простые. Некоторые из них имеют всего три гена. Даже сложный ретровирус вроде ВИЧ имеет всего девять генов. Поэтому очень легко взять их, разделить на части и изучать, какая часть за что отвечает.
В поле генной терапии существует трюк, когда берут ретровирус, вынимают из него ретровирусные гены и вставляют те гены, которые нужны. Потом можно сформировать ретровирусные частицы. Этот трюк можно использовать для развития ретровирусного вектора. Работает это так: можно взять ретровирусный геном, который обычно шифрует все ретровирусные гены, избавиться от них и поставить на их место предпочтительный ген, например терапевтический ген или ген, который можно просто измерять, — мы обычно используем ЗФБ (GFP), который заставляет клетки зеленеть. Если вы это сделаете, вы сможете производить ретровирусные частицы, которые будут только заражать клетку и производить белок. В ретровирусе не окажется ретровирусных генов, так что он сможет производить только терапевтические гены или ЗФБ. И это прекрасный инструмент для изучения клеточной биологии.
Например, можно изменить клетку и посмотреть, продолжает ли вирус оказывать на нее свое влияние, или можно, наоборот, изменить вирус и проверить, может ли он теперь инфицировать клетку. Это будет называться генетическим подходом. Можно выяснить роль различных частей вируса в попадании в клеточное ядро, в попадании в клетку, в пересечении цитоплазмы.
Аннотация научной статьи по биологическим наукам, автор научной работы — Киселёв О. И.
Похожие темы научных работ по биологическим наукам , автор научной работы — Киселёв О. И.
Endogenous retroviruses: structure and function in the human genome
In 1990 there was posthumously published monograph “Evolution of viruses” written by famous academician AMS USSR V.M. Zhdanov. In fact, the monograph was an unique attempt to analyze and systematize the representatives of the kingdom of Viruses (Virae) according to their origin and evolution. The end of 1980s was a turning point in the development of virology and preceded the start of the program “Human Genome ”. For understanding a role of endogenous retroviruses in a genome of animals and humans remained not a lot of time. But V.M. Zhdanov had made a significant contribution even in this section fundamental virology. So, this article dedicated to the memory V.M. Zhdanov is an attempt to tie the amazing atmosphere of national molecular biology and virology in 1970-1980s with unique discoveries in the field of fate and evolution of intragenome functionalization of viral genomes and their elements of animals and humans. Active development of researches of endogenous retroviruses (ERV) refers to 1960-1970. In that years three ERV types had been identified: avian leukemia virus, murine leukemia virus, and the mouse mammary tumor virus. ERV of primates and humans are represented by a complete integrated copies of viral genomes, pseudogenes and mobile genetic elements of different families: LTR/ERV, LINE, SINE/Alu, SINE/MIR, LTR/ERV. Transcripts of ERV sequences were identified as a miRNAs and non-coding RNAs in total genome transcriptome . Understanding the functions of endogenous retroviruses allowed to explain the central paradox of the human genome : the discrepancy between the information in the genome and the volume of genetic information in the transcriptome . Mobile genetic elements of viral origin have been actively involved in “editing” (remodeling) of the so-called non-coding transcriptome . National studies in this area were far ahead of the time. However, during that period of molecular virology and eukaryotic genome researches have not yet led to the unification of ideas about the origin of viruses and their role in the evolution and structure of the human genome . It is therefore valuable contribution of such scientists as V.M. Zhdanov in the development of this unique field.
Эндогенные ретровирусы: структура и функции в геноме человека
Ключевые слова: эндогенныйретровирус, Retroviridae, провирус, геном, транскриптом,
мобильный генетический элемент, ретропозон, синцитин.
Endogenous retroviruses: structure and function in the human genome
In 1990 there was posthumously published monograph "Evolution of viruses" written by famous academician AMS USSR V.M. Zhdanov. In fact, the monograph was an unique attempt to analyze and systematize the representatives of the kingdom of Viruses (Virae) according to their origin and evolution. The end of 1980s was a turning point in the development of virology and preceded the start of the program "Human Genome". For understanding a role of endogenous retroviruses in a genome of animals and humans remained not a lot of time. But V.M. Zhdanov had made a significant contribution even in this section fundamental virology. So, this article dedicated to the memory V.M. Zhdanov is an attempt to tie the amazing atmosphere of national molecular biology and virology in 1970-1980s with unique discoveries in the field of fate and evolution of intragenome functionalization of viral genomes and their elements of animals and humans. Active development of researches of endogenous retroviruses (ERV) refers to 1960-1970. In that years three ERV types had been identified: avian leukemia virus, murine leukemia virus, and the mouse mammary tumor virus. ERV of primates and humans are represented by a complete integrated copies of viral genomes, pseudogenes and mobile genetic elements of different families: LTR/ERV, LINE, SINE/Alu, SINE/MIR, LTR/ERV. Transcripts of ERV sequences were identified as a miRNAs and non-coding RNAs in total genome transcriptome. Understanding the functions of endogenous retroviruses allowed to explain the central paradox of the human genome: the discrepancy between the information in the genome and the volume of genetic information in the transcriptome. Mobile genetic elements of viral origin have been actively involved in "editing" (remodeling) of the so-called non-coding transcriptome. National studies in this area were far ahead of the time. However, during that period of molecular virology and eukaryotic genome researches have not yet led to the unification of ideas about the origin of viruses and their role in the evolution and structure of the human genome. It is therefore valuable contribution of such scientists as V.M. Zhdanov in the development of this unique field.
Key words: endogenous retrovirus, Retroviridae, provirus, genome, transcriptome, mobile genetic element, retroposon, syncytin.
Исследования генома человека показали, что инфицирование и эндогенизация геномов ЭРВ и других мобильных генетических элементов ретровирусного происхождения, сыграли критическую роль в эволюции человека 6. С точки зрения современной молекулярной вирусологии, данная проблема имеет непосредственное отношение к роли вирусов в контроле физиологических процессов и в развитии основных заболеваний человека. С экспрессией ЭРВ связывается развитие онкологических заболеваний, аутоиммунных процессов, патологии беременности и даже таких психических заболеваний, как шизофрения [6, 7, 14]. Поэтому прогресс в этой области непосредственно связан с предстоящей революцией в понимании основ патологии человека и создании новых подходов к терапии наиболее значимых для общества заболеваний.
Необходимо отметить, что в 1970-ые гг. между АМН СССР и профильными научными учреждениями США работала постоянная Комиссия по сотрудничеству в области вирусологии. В работе этой Комиссии принимали участие ведущие специалисты США и СССР. Совещания Комиссии проходили в Институте вирусологии им. Д.И. Ивановского. В составе Комиссии были крупнейшие американские вирусологи, и среди них преобладали специалисты в области исследования ретровирусов (РВ). В.М. Жданов был руководителем Комиссии с советской стороны. Комиссия была независимой от ВОЗ и работала самостоятельно. Это был очень влиятельный межгосударственный орган, ориентированный, главным образом, на научные исследования и развитие представлений в области потенциальной опасности вирусов для человечества. Аналогов такого международного взаимодействия в настоящее время нет. Исследования ЭРВ человека и приматов относятся к концу 1960-х - началу 1970-х гг.. В СССР исследования ЭРВ проводились под руководством академиков АМН СССР В.М. Жданова и Б.А. Лапина. Значительный вклад в эти исследования внесли известные вирусологи проф. А.Ф. Быковский и проф. А.Д. Альтштейн 3.
Открытие ЭРВ и их избирательной экспрессии в плаценте обратило на себя внимание возможностью реализации на этом уровне специфических механизмов иммуносупрессии, свойственных РВ [16, 17]. Однако, каким образом реализуется этот механизм, долгое время оставалось неизвестным.
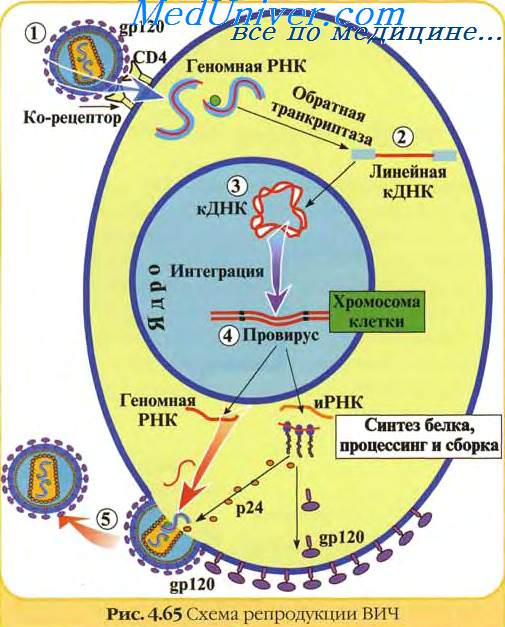
РВ представляют собой сем. Retroviridae, геном которых представлен РНК, репликативный цикл которых основан на использовании обратной транскрипции и интеграции вирусной геномной провирусной ДНК в геном клетки-хозяина 4.
Эпсилон-ретровирусы (простейшие) SnRV
WDSV HTLV-H Пйнтириоупы
Рисунок 1. Филогенетическое происхождение ретровирусов [4]. Сокращенные названия вирусов даны в соответствии с международной номенклатурой [4].
На рис. 1 красными кружками выделены гамма- и бетаретровирусы, к которым относятся HERV-W (HERV-FRD) и HERV-K, играющие важную функциональную роль в морфогенезе плаценты и онкопатологии человека 7.
ЭРВ в геноме представлены разнообразными полидисперсными последовательностями, среди которых идентифицированы полноценные открытые рамки считывания, кодирующие вирусные белки, или их гомологи, и регуляторные элементы, известные, как LTR - long terminal repeats - длинные концевые повторы, мобильные генетические элементы LINE и SINE 13.
В отношении функциональной активности ЭРВ в плаценте представляют интерес два рода РВ - гамма и бета и НЕ^-РЯЛ) (см. рис. 1) [4, 18].
Отдельные элементы ЭРВ относятся к мобильным генетическим элементам -ретротранспозонам, участвующим в регуляции активности генов [4-7, 8, 15], которые в процессе дивергенции разделились на отдельные семейства и подсемейства с чётко дифференцированными функциями [5, 18]. В табл. 2 представлены основные, наиболее
Роль ЭРВ в репродуктивных функциях животных и человека.
распространённые мобильные генетические элементы (МГБ) и их представительство в геноме человека.
Таблица 1. Эндогенные ретровирусы человека (HERV), играющие роль в репродуктивных функциях и, в частности, в плаценте .
HERV Роль в репродукции
ERVWE1 (HERV-W) Дифференцировка синцитиобластов и слияние клеток с образованием синцития (env = синцитин-1).
HERV-FRD Образование синцитиобластов путём слияния (трофобластов). Также играют роль в плацентарной защите от отторжения плода материнской иммунной системы (env = синцитину-2). Преимущественно этот белок выполняет иммуносупрессивные функции в синцитиотрофобластах.
ERV-3 Фьюжин и образование синцитиобластов и возможный вклад в развитие функционально активной плаценты. Оценивается как не очень важный компонент генома.
HERV-K Экспрессируется в синцитиотрофобластов. Возможен вклад в развитие плаценты и иммунную протекцию плода.
HERV-E.PTN HERV интегрированный в ген, кодирующий ростовой фактор плейотрофин. Инсерция приводит к появлению нового промотора, направляющего экспрессию функциональных HERV-PTN транскриптов, которые транскрибируются и накапливаются в пролиферирующих и инвазивных трофобластов в беременной матке или в злокачественных трофобластах хорионкарциномы (хорионэпителиомы).
LTR10A-HERV-1 Эксклюзивный плацентарный ген, кодирующий NO-синтазу (NOS3).
HERV-H7/F(XA34) Специфический для трофобластов транскрипт с пониженной экспрессией в плаценте беременных женщин, страдающих гипертензией (преэклампсия), вызванной беременностью.
HERV-Fb1 Специфический для трофобластов транскрипт с пониженной экспрессией в плаценте женщин, страдающих гипертензией (преэклампсия), вызванной беременностью.
HERV-HML6-c14 Специфический для трофобластов транскрипт. В отличие от синцитина, HERV-Fb1 и HERV-H7/F (XA34) этот транскрипт локализуется в ядре и его экспрессия возрастает в плаценте у беременных женщин с гипертензией (преэксалмпсия).
Неизвестный HERV LTR Специфический для плаценты человека ген семейства Инсулинов-INSL4. В процессе дифференцировки цитотрофобластов в синцитий трофобласты ген INSL4 экспрессируется на высоком уровне под контролем HERV-3LTR.
HERV-E LTR Вносит вклад в экспрессию гена рецептора эндотелина В - одного из двух рецепторов, опосредующих вазоконстрикторный эффект Эндотелинов.
HERV-E LTR Альтернативный тканево-специфический транскрипционный регулятор гена человека Opitz (Midi 1), кодирующего белок, ассоциированный с микротрубулярным аппаратом цитоскелета.
* экспрессирующиеся в плаценте гены епу ЭРВ относятся к синцитинам 1 и 2 и являются гомологами вирусных белков епу [5].
Таблица 2. Мобильные генетические элементы, диспергированные в геноме человека [5].
Повторяющиеся мобильные генетические элементы Представительство в геноме человека
число копий содержание в геноме человека (%)
ДНК- транспозоны 294 3
LTR - ретротранспозоны 443 8
LTR-независимые ретротранспозоны: 2 426 34
LINE - (длинный диспергированный повтор) 868 21
SINE - (короткий диспергированный повтор) 1 558 13
Мобильные диспергированные генетические элементы играют важнейшую роль в регуляции экспрессии генов животных и человека и вовлечены в процессы транскрипционного и посттранскрипционного редактирования путём репрограммирования некодирующего транскриптома 14.
Происхождение и эволюция ЭРВ.
Известные РВ условно можно классифицировать на две основные группы: > с простой организацией геномов: альфа-, бета-, гамма- и эпсилонретровирусы; ^ со сложной организацией геномов: лентивирусы, дельтавирусы,
На рис. 2 представлены общие характеристики генома, интегрированной провирусной ДНК, физическая карта белка env [4].
Интегрированная в клеточные хромосомы провирусная ДНК ЭРВ фланкирована длинными концевыми обращенными повторами (LTR) и кодирует 4 основных белка: gag, pro, pol и env. Некоторые представители ретровирусов кодируют также неструктурные белки (rev, tat, nef и др.), синтез которых осуществляется через сплайсинг транскриптов вирусного генома [5, 6]. Эти ретровирусы относятся к инфекционным вирусам, вызывающим заболевания животных и человека.
Рисунок 2. Блок иллюстраций строения иммуносупрессивного домена [8].
свойств ЭРВ (HERV-W), белка env
На рис. 2.А представлена структура и обратная транскрипция полноразмерной геномной РНК ЭРВ, фланкированной с 5'-и 3'- концов последовательностями U5 и U3, соответственно. На концевых участках после этих последовательностей локализованы прямые повторяющиеся участки - прямые повторы - R (repeats). В процессе синтеза ДНК (обратная транскрипция) на
5'-и 3'- концах образуются так называемые LTR - длинные концевые повторы: U3-R-U5. LTR содержат сильные промоторы и энхансеры транскрипции, а также регуляторные последовательности для связывания транскрипционных факторов, включая такие, как рецептор стероидов, факторы процессинга и полиаденилирования. LTR также являются участниками процессов интеграции, катализируемых вирусной интегразой. На стыке LTR c кодирующей последовательностью обозначен сайт связывания природного праймера (тРНК) - PBS.
На рис. 2.Б представлена физическая карта интегрированной в геном провирусной, ДНК HERV с картой одного из продуктов экспрессии - белка env: обозначены основные домены, начиная с сигнального пептида (SP) и доменов ПД и ТМ, разделенных сайтом расщепления протеазой.
Рис. 2.В содержит карту расширенного ТМ домена, частично экспонированного над премембранной областью. На рисунке обозначены домены ПС - пептид слияния, ИСД -иммуносупрессивный домен и ТМД - трансмембранный (гидрофобная часть) домен. Коровый пептид ИСД выделен в рамку: R-LDLL---GG-CX6CC. Последовательность CX6CC -консервативный участок ИСД последовательности, предположительно относящийся с области инициации фьюжина.
Гомологи белков env ЭРВ - синцитины в результате дивергентной эволюции разделились на две линии: с доминантными фьюзогенными свойствами и сильно выраженной иммуносупрессивной активностью (envHERV-W - синцитин-1 и envHERV-FRD - синцитин-2) [16, 18-20]. На рис. 3 представлено филогенетическое древо белков env ЭРВ и синцитинов [20].
Синцитины 1 и 2 (Syncytin 1, 2 на рис. 3) являются гомологами, белка env ЭРВ человека: envHERV-W (синцитин-1) и envHERV-FRD (синцитин-2). На рис. 3 красным цветом выделен синцитин-Саг1 (Carnivora), который относится к наиболее ранним предшественникам синцитинов плацентарных животных и человека [ 18-20].
Известно, что от 8,0 до 20 % последовательностей генома человека представлены ретровирусными генами [5-7, 16]. Множественная интеграция ретровирусных геномов произошла на определенном этапе эволюции млекопитающих и закрепилась с выделением полезных для эволюции признаков [2]. Первичное инфицирование половых клеток этими вирусами с течением времени привело к дифференцировке некоторых из интегрированных генов первичных ретровирусов в направлении обеспечения репродуктивной функции млекопитающих [6, 19-20].
Читайте также:


