Когда был обнаружен вирусный гепатит

Вирусный гепатит С является серьезным и опасным заболеванием, требующим своевременной терапии и постоянного наблюдения у лечащего врача. Если заболевание запустить, повышается вероятность осложненного течения ВГС. В частности, повышается риск возникновения цирроза или фиброза печеночных тканей. Именно поэтому начать лечение вирусного поражения печени нужно как можно раньше.
Но для того, чтобы безошибочно выбрать терапию болезни, важно знать историю гепатита С. Что это за болезнь? Когда она была открыта? Как лечили ВГС раньше? Как в наше время обстоят дела с распространенностью и лечением этого заболевания? Подробный ответ на каждый из этих вопросов по истории болезни гепатит С вы сможете найти в нашей статье.
Что это за болезнь?
ВГС является вирусным заболеванием, характеризующимся воспалительными процессами в печени и общим недомоганием. Вирус гепатита С относится к семейству флававирусов. Наибольшая концентрация гепатовируса содержится в крови зараженного. Незначительное его количество обнаруживается в слюне, сперме, вагинальных выделениях и слизи зараженного человека.
Примерно у 15% из общего числа заболевших развивается острая форма ВГС. Для данного состояния характерна следующая симптоматика:
- Боли в области правого подреберья
- Желтушный оттенок кожных покровов и глазных яблок
- Общее недомогание, напоминающее состояние при гриппе
- Потемнение мочи до оттенка темного пива и обесцвечивание каловых масс
- Нарушения сна (бессонница, сонливость)
- Нарушения координации и вялость
- Депрессивные расстройства.
Несмотря на кажущуюся тяжесть острой фазы, именно в ее период организм активно борется с гепатовирусом.
Когда был обнаружен ВГС?
Позднее, в 1989 году, был сделан решающий шаг в выделении патогенного агента ВГС. В исследуемых образцах крови была обнаружена РНК возбудителя заболевания, характерная для семейства флававирусов. Именно этот патоген был назван вирусом гепатита С.
Как лечили заболевание раньше?
Первой схемой лечения, используемой при терапии вирусного гепатита С, является Интерферон-альфа + Рибавирин. Эти лекарственные средства напрямую на вирус не воздействуют, однако могут обеспечить стойкую ремиссию, благодаря медикаментозному усилению естественной защиты гепатоцитов. Интерферон применяется в виде инъекций, Рибавирин — в таблетированной форме.
Подобная схема лечения имеет массу недостатков:
- Выраженные побочные эффекты. Интерферон плохо воспринимается человеческим организмом. В процессе терапии пациент может значительно потерять в весе и лишиться волос.
- Длительность терапии. Лекарства применяются в течение 6-12 месяцев. Это может негативно повлиять на работу почек и эндокринной системы.
- Негативное влияние на биохимический состав крови больного. В значительной мере повышается уровень лимфоцитов и тромбоцитов, что может привести к злокачественной анемии. По этой причине пациентам приходится регулярно сдавать анализы крови и срочно прерывать терапию, если обнаруживается тревожная тенденция.
- Низкая эффективность. Купировать болезнь удается в 70 случаях, полностью вылечить гепатит при помощи Рибавирина и Интерферона практически не реально.
В настоящее время интерфероновая методика терапии ВГС используется в бюджетных медицинских учреждениях и постепенно устаревает.
Каков процент зараженных в настоящее время?
В настоящее время по истории болезни гепатит С известно 8 генотипов возбудителя заболевания. Наиболее распространены первые 6 из них. При этом процент заражения:
- 1, 2 и 3 gen выше на Европейском континенте, в частности, на территории бывшего ССССР
- 4 генотипом наиболее высок в США и на территории Северной Африки
- 5 gen все больше возрастает в Азиатских странах
- 6 генотипом высок в странах Южной Африки
В настоящее время хроническим гепатитом С страдает около 150 миллионов человек. Все эти больные подвергаются риску развития цирроза и фиброза печени.
Данные статистики в этом плане не утешительны. Ежегодно:
- Более 350 тысяч инфицированных умирает от осложнений, связанных с вирусным поражением печени.
- Более 3-4 миллионов людей заражаются при контакте с инфицированной кровью.
В настоящее время в России число больных ВГС составляет около 11 миллионов человек. К сожалению, эта цифра неуклонно растет. При этом, флававирус интенсивно мутирует. По данным исследований, в течение ближайших 10 лет количество зараженных может резко возрасти.
Разработка новых препаратов от ВГС
В 2011 году американская корпорация Gilead начала интенсивную разработку инновационных препаратов прямого противовирусного действия (ПППД). В 2013 году был выпущен Софосбувир, нуклеотидный аналог, являющийся прямым ингибитором полимеразы флававируса NS5B.
Лекарство было подвергнуто ряду лабораторных и клинических исследований, результаты которых показали, что Софосбувир одинаково эффективен как с Рибавирином, так и без него. Разработка нуклеотидного ингибитора позволила отказаться от опасных инъекций Интерферона-альфа.
Софосбувир не используется в монотерапии. В совокупности с ним применяются NS5A-ингибиторы, разработанные несколько позднее:
- Ледипасвир — применяется для лечения 1, 4, 5 и 6 генотипов. Разработан Gilead Sciences.
- Даклатасвир — применяется в терапии 1, 2, 3 и 4 генотипов. Разработан Bristol-Myers Squibb.
- Велпатасвир — эффективен при лечении любого генетического типа ВГС. Разработан Gilead Sciences.
В настоящее время производством оригинальных ПППД занимаются США и Индия.
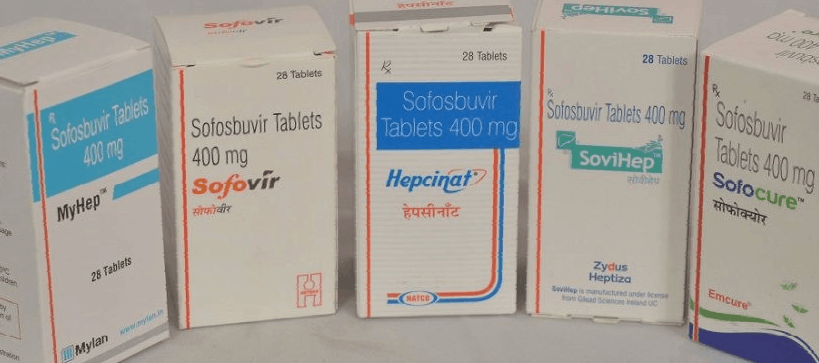
Американский Софосбувир (400 мг в 1 драже) вышел на мировой рынок под торговым названием Sovaldi в 2014 году. Чуть позднее были выпущены следующие лекарственные средства:
- Daclinza — 60 мг Даклатасвира в таблетке;
- Epclusa — 100 мг Велпатасвира, 400 мг Софосбувира;
- Harvoni — 90 мг Ледипасвира, 400 мг Софосбувира.
Новейшие ПППД отличались высочайшим качеством и эффективностью. Не менее 97% из общего числа больных выздоравливали после курса приема этих лекарственных средств. Курс их приема сравнительно краток — 12-24 недели. На биохимический состав крови лекарства не влияют, сильных побочных эффектов не вызывают.
Но есть у препаратов американского производства существенный недостаток. По причине того, что корпорациям приходится покрывать расходы на разработку, стоимость лекарств чрезвычайно высока. За одну упаковку Sovaldi, к примеру, придется заплатить не менее 126 000 рублей.
Чрезвычайно высокая стоимость ПППД из Америки вызвала шквал критики. Ведь основной процент инфицированных проживает на территории бедных стран. Эти люди не могут себе позволить настолько дорогие медикаменты.
Ситуацию спасло предоставление международной лицензии на производство лекарств для борьбы с хроническим гепатитом С индийским фармагигантам. Лицензия позволяет производить ПППД по оригинальной рецептуре, а так как Индия платит лишь за ежегодное продление договоренности, стоят производимые ею медикаменты в 20 раз дешевле американских.
Всего лицензионный договор получили 11 фармагигантов, в числе которых Zydus Heptiza, Natco Pharma, MyLan и Hetero. Ниже представлен перечень основной продукции этих концернов:
| Аналог из США | Zydus | Natco | Aprazer | Hetero | Mylan |
| Sovaldi / Совальди | Sovihep | Hepcinat | Sofokast | Sofovir | MyHep |
| Epclusa / Епклуса | SoviHep V | Velpanat | Velakast | Velasof | MyHep All |
| Daclinza / Даклинза | Dacihep | DaclaHep | Dacikast | Natdac | MyDacla |
| Harvoni / Харвони | LediHep | Hepcinat LP | Ledikadt | LediFos | MyHep LVIR |
Соглашение международного уровня позволяет изготовителям из Индии распространять свою продукцию за пределами своей страны. Однако по договоренности оптовые партии лекарств могут направляться лишь в 105 стран третьего мира, перечень которых указан в лицензии. Россия в этот список не входит, однако препараты можно легально заказать через официальное представительство Zydus Heptiza с прямой доставкой из Индии.
Индийские препараты от ВГС — новое слово в истории болезни гепатит С. Благодаря лицензии, полученной индийскими производителями, даже у малоимущих пациентов появляется шанс на быстрое выздоровление.
Заключение
Итак, современная история гепатита С достаточно противоречива. С одной стороны, количество зараженных постоянно растет. Вирус гепатита С постоянно мутирует, появляются новые штаммы. В особенной зоне риска находятся жители стран с очень низким уровнем экономического развития.
Однако есть и положительный момент. В наше время ВГС полностью излечим. К тому же, можно приобрести недорогие препараты, эффективность которых ничуть не ниже, чем у дорогостоящих.
Таким образом, можно сказать, что текущий период является переломным в истории гепатита С. Болезнь еще не побеждена полностью, однако, благодаря современным лекарствам, ее уже нельзя назвать неизлечимой и обрекающей зараженного на медленную и мучительную смерть.
При этом изучение вируса гепатита С не прекращается. Изучаются новые штаммы, разрабатываются дополнительные схемы лечения. Благодаря всему этому можно с уверенностью заявить, что вирусное воспаление печени — не приговор.
История гепатитов, желтуха - болезнь древняя
История гепатитов уходит глубоко в древность. Учение о вирусных гепатитах, зародившееся более 100 лет назад, развивалось в постоянной борьбе взглядов на причину и природу болезни. О существовании желтух и их массовом распространении было хорошо известно в древности и в средние века. Еще в V в. до н. э. Гиппократ писал о заразной форме желтухи. В середине первого тысячелетия нашей эры в письме папы римского Захарии рекомендовалось изолировать больных желтухой. В XVII—XIX вв. во время войн эпидемии желтух наблюдались во многих странах Европы и Америки. Они охватывали большие контингента войск и сопровождались высокой летальностью.
Согласно второй теории, желтухе приписывалось холедохогенное механическое происхождение — связь с воспалением желчных путей, их отеком, закупоркой, затрудняющими отток желчи. Впервые эту, до сего времени не лишенную интереса точку зрения высказал французский клиницист Broussai s (1829), связывавший появление желтухи с распространением воспалительного процесса с двенадцатиперстной кишки на желчные пути. Основным апологетом этой теории был крупнейший немецкий патологоанатом Virchow, который в 1849 г., отвергнув гематогенную, дискразическую концепцию, создал представление о механической природе желтухи — он связал ее с катаром общего желчного протока.
Virchow основывал свои представления на патологоанатомических находках (отек дистальной части общего желчного протока, его обтурация слизистой пробкой, расширение проксимальной части протока), хотя известно, что основой выдвинутой им теории послужило одно-единственное наблюдение, никем не подтвержденное в последующем. Однако авторитет Virchow был настолько велик, что потребовалось более 50 лет, прежде чем удалось опровергнуть этот ошибочный взгляд. ХотяVirchow не располагал никакими доказательствами правильности своей концепции, он счел возможным распространить ее на желтуху при сепсисе, пневмонии и даже отравлении гепатотропными ядами. Возникает вопрос, как мог Virchow впасть в заблуждение и находиться в плену столь шаткой и не подкрепленной фактами теории.
Отвечая на этот вопрос, Jl. А. Мясников (1956) предположил, что самому автору и его последователям импонировали подкупающая простота объяснения механизма желтухи и аналогия с заведомо механическими желтухами, наступающими при закупорке общего желчного протока камнем. Представления Virchow о механической природе желтухи, которую он назвал катаральной (название болезни, надолго утвердившееся в литературе), поддержали английские клиницисты (например, Graves, 1864), полагавшие, что в основе катаральной желтухи лежит гастродуоденит, а также немецкие клиницисты, и в частности Leyden (1866), считавший, что воспаление слизистой оболочки двенадцатиперстной кишки распространяется на желчные пути.
Болезнь Боткина
Наконец, сторонники третьей теории патогенеза эпидемических желтух полагали, что причиной заболевания является поражение печени — гепатит. Так, в 1839 г. англичанин Stokes высказал мысль, что болезнь связана с желудочно-кишечным катаром, причем печень симпатическим путем вовлекается в патологический процесс. Мысли о печеночной природе желтухи можно найти в трудах К. К. Зейдлица, H. Е. Флорентинского, А. И. Игнатовского, H. H. Кирикова и других русских клиницистов (см. Тареев Е. M., 1956). Однако первым в мировой науке, противопоставившим взглядам Virchow научно обоснованную концепцию, объединившую в себе верный взгляд на природу желтухи и на этиологию болезни, был выдающийся русский клиницист С. П. Боткин. В своей классической лекции в 1888 г. он сформулировал принципиально новые положения, охватывающие почти все стороны учения о вирусном гепатите.
Широко использовавшиеся в последующие годы советскими исследователями методы культур органов (Жданов B. М. с соавт., 1968; Ицелис Ф. Г. с соавт., 1968; Тимошенко Ж. П. с соавт., 1973) и культуры лейкоцитов человека (Шубладзе А. К., Баринский И. Ф., 1969) расширили возможности вирусологических и патогенетических исследований при болезни Боткина. Как и при других вирусных инфекциях, при болезни Боткина предпринимались многочисленные попытки воспроизведения инфекционного процесса заражением различных животных (см. Siede, 1958), а также людей-добровольцев. Было доказано, что материал, применяющийся для инокуляции, сохраняет заразность после ультрафильтрации, что подтверждало вирусную природу возбудителя.
Наиболее интересными представлялись опыты по пероральному заражению добровольцев взвесью кала больных вирусным гепатитом (Neefe, Stokes, 1945). В связи с тем что при болезни Боткина особенно часто выделяются аденовирусы, остро обсуждался вопрос о возможном значении их в качестве возбудителя указанной инфекции. Hennenberg (1967) обращал внимание на то, что аденовирусы вызывают в печени ряд патологических изменений, весьма сходных с теми, которые возникают при вирусном гепатите.
Гепатит В
Много позже удалось доказать, что обнаруженный в крови антиген е — это трансформированный (усеченный) антиген с; оба они кодируются одним участком ДНК и имеют одинаковую последовательность аминокислот в пептидной цепи, отличаясь лишь их числом. Уже в 1985 г. Feitelson обнаружил еще один антиген — х, принадлежность которого к вирусу гепатита В (HBV) можно считать установленной. Из других факторов, имеющих существенное значение для понимания патогенетических аспектов проблемы вирусного гепатита В, имеет значение обнаружение Imagi и Menson в 1979 г. полиальбуминовых рецепторов на HBV. Их открытие имеет двоякое значение: во-первых, в разработке еще одного теста активной репликации вируса, которую маркирует полиальбуминсвязывающая активность сыворотки крови, и, во-вторых, оно способствовало если не разгадке, то лучшему пониманию гепатотропизма HBV.
Восьмидесятые годы ознаменовались описанием трех аналогов HBV — возбудителей вирусных гепатитов животных (пекинских уток, канадских сурков и земляных белок) — и возникшим в связи с этим предложением Robinson с соавт. (1982) отнести эти возбудители к особой группе гепадна (печеночные ДНК-) вирусов. К 1986 г. большинство авторов склонялись к тому, что вирусы этой группы по своему строению и биологическим свойствам близки к ретровирусам, что проливает свет на их способность интегрировать в геном гепатоцита и вызывать злокачественное перерождение клетки. Среди особенностей строения гепаднавирусов следует указать на обнаруженную в структуре их ДНКполимеразу и обратную транскриптазу (Hirschman, 1971).
Гепатит А
Открытие вируса гепатита A (HAV) связано с работами Feinstone с соавт. (1973), идентифицировавших HAV методом электронной микроскопии, и Pursel l с соавт. (1973), впервые получивших очищенный препарат антигена вируса гепатита А. Большой вклад в изучение этиологии вирусных гепатитов внес М. С. Балаян, описавший вирус A1 , оказавшийся этиологическим агентом вирусного гепатита с фекально-оральным механизмом передачи. До сих пор не ясно, стоит ли он близко к HAV или является одним из возбудителей не идентифицированных до сих пор этиологических форм, каковыми являются гепатиты не Aне B. Новой страницей в учении о вирусных гепатитах явилось открытие Rizzetto в 1977 г. возбудителя новой формы вирусного гепатита — т. н. D-агента, или вируса D (HDV). Последний оказался вирусом-сателлитом, спутником HBV.
Как выяснилось впоследствии, этот вирус обладает некрозогенным свойством, и инфицирование им отягощает и затягивает течение вирусного гепатита B. Значимой вехой в изучении патогенеза вирусных гепатитов является толкование механизма развития патологического процесса с позиции вирусно-иммуногенетических отношений. Вирусно-иммуногенетическая теория патогенеза вирусного гепатита В была выдвинута в начале 70-х гг. советскими и зарубежными авторами (Dudley с соавт., 1972; Блюгер А. Ф., Векслер X. M., 1973). Важным доводом в ее пользу была показанная зависимость течения вирусного гепатита от Т-лимфоцитов. Важное значение для подтверждения этой теории имело полученное в ЛГЦ доказательство отсутствия цитолитических свойств у HBV в органокультуре печени человека (1973).
В развитии этой теории имели значение и данные Blumberg (1969) о генетической сцепленности частоты инфицированности различных групп населения HBV. Принципиальное значение для формирования новых представлений о патогенезе вирусного гепатита В имела выдвинутая в 1975 г. B. М. Ждановым, а годом позже Hirscham идея об интегративном характере инфекции. Впоследствии эти представления получили подтверждение, и патогенез стали понимать как фазовый, стадийный процесс, при котором могут последовательно развиваться или сосуществовать репликативные, интегративные и смешанные стадии инфекции (Hoofnagle, 1983).
Истоки диагностики
Впоследствии эти положения получили развитие во многих частных направлениях. Например, было доказано, что HBcAg является маркером репликативной фазы инфекции. Естественно, что таким же ее маркером является и HBeAg, вирусная ДНК и ДНК-полимераза крови. Были получены любопытные данные о наличии перекрестных антигенов у полиальбуминового рецептора HBV и липопротеина печени человека, а также между HBeAg и цитоплазматическим антигеном гепатоцитов. Эти данные представили большой интерес в свете представлений о роли аутоиммунных процессов в патогенезе вирусного гепатита В, начало которым было положено Meyer и BiischenfeIde еще в 1972 г. За 10 лет из патогенетических представлений это учение переросло в большую прикладную проблему.
В ЛГЦ был получен препарат липопротеина печени человека и на его основе созданы системы для тестирования клеточного и гуморального звеньев тех аутоиммунных реакций, которые развиваются при вирусном гепатите B. В продвижении вперед всего учения о вирусных гепатитах выдающуюся роль сыграли прижизненные морфологические исследования печени. Эпизодические пункции печени производились еще в прошлом столетии. В частности, в нашей стране первую пункцию печени осуществил в 1900 г. А. А. Белоголовый, Однако начало современного этапа применения этого метода было положено в 1928 г., когда была выполнена первая прицельная биопсия печени под контролем лапароскопа (Kalk, 1928). Лишь перед войной, в конце 30-х гг., метод начал постепенно внедряться в гепатологическую практику благодаря разработке техники слепой пункционной биопсии (Roholm, Iversen, 1939). В послевоенные годы метод стал широко применяться во многих клиниках, чему способствовало создание специальных игл и их модификаций (Vim, Silverman, Menghini, Блюгер А. Ф., Синельникова М. П. и др.). С этого времени метод занял прочное место в изучении патогенеза, патоморфологии и в диагностике вирусных гепатитов. В отечественной медицине он нашел широкое применение в клиниках Ε. М. Тареева, Χ. X. Мансурова, Е. С. Кетиладзе, А. С. Логинова.
Широко взят на вооружение этот метод и в ЛГЦ. В результате прижизненных морфологических исследований были пересмотрены традиционные взгляды на основной тип патологического процесса в печени при вирусных гепатитах. Опровергнуты ошибочные представления об исчезновении из печени гликогена и жировой инфильтрации, как субстрате болезни, показано, что основной тип поражения печени при вирусных гепатитах — это различные виды белковой дистрофии, причем обязательным компонентом процесса является мезенхимально-воспалительная реакция. Эти данные послужили основой для отказа от традиционных методов лечения вирусного гепатита — инсулиноглюкозотерапии (Билибин А. Ф. и Лобан К. М.) — и разработки новых подходов к диете и режиму для больных этой инфекцией.
Естественно, что широкий фронт исследований в области патологии вирусных гепатитов благотворно отразился и на изучении клинических проблем. За плечами многих советских исследователей большой опыт клинико-эпидемиологического изучения вирусных гепатитов как в части исследований механизма передачи инфекции (Громашевский Л. В., Башенин К. А., Жданов B. M., Богданов И. Л., Пакторис Ε. А.), так и широкого круга клинико-диагностических вопросов (Тареев Е. M., Мясников А. Л., Ясиновский Μ. А., Кассирский И. А., Билибин А. Ф., Руднев Г. П., Мусабаев И. К·, Нисевич H. И., Угрюмов Б. Л., Шувалова Е. П., Никифоров П. H., Кетиладзе Е. С., Фарбер H. А., Громашевская Л. Л., Учайкин B. Ф. и др.). Существенный прогресс в изучении гепатитов связан с методами молекулярной биологии и генетики и биотехнологической техники. В частности, этим методам обязаны своим рождением новые типы вакцин и иммунодиагностических препаратов.
Первые термически инактивированные вакцины против вирусного гепатита В были получены еще в 1971 г. Krugman. Этим же автором был продемонстрирован профилактический эффект специфического гамма-глобулина при вирусном гепатите B. Однако лишь с 80-х гг. техника приготовления вакцин путем очистки HBsAg, полученного из донорской крови, постепенно уступила место биотехнологическим методам их приготовления. Все более широкое применение в профилактике вирусного гепатита В находят вакцины третьего поколения. Большую роль в развитии этих методов в СССР сыграли работы B. М. Жданова и Э. Я. Грена с сотрудниками. На базе этих новых направлений родились и широко используются иммунологические методы выявления маркеров вирусных гепатитов А, В, D третьего поколения — радиоиммунный анализ и иммуноферментный анализ (Lander, Hoofnagle, Жданов B. M., Блохина И. H., Балаян М. С., Кукайне P. А., Елигулашвили P. К. и др.).
Наибольшее значение для нынешнего, а особенно для будущего этапа терапии вирусных гепатитов имеет привлечение иммунорегулирующих препаратов для лечения этих иммунологически опосредованных инфекций — интерлейкина-1, 2, интерферона и других иммунорегуляторов. Арсенал лечебных средств пополнился противовирусными препаратами, при лечении печеночноклеточной недостаточности и печеночной комы — методами гемосорбции с включением в колонку гепатоцитов свиньи (Маргулис М. С.), а в терапии опухолей печени и далеко зашедших циррозов ее вирусной природы — методами трансплантации печени.
Опасная для жизни болезнь проявляется по-разному: от слабовыраженных субклинических состояний до цирроза и рака печени. Важно выявить заболевание на раннем этапе развития, пока не возникли тяжелые осложнения. Обнаружить HBV-вирус помогают серологические способы – анализ отношения антител к HBS антигену вируса гепатита B.
Чтобы определить маркеры, исследуют кровь или плазму. Необходимые показатели получают, проведя реакцию иммунофлюоресценции и иммунохемолюминесцентный анализ. Тесты позволяют подтвердить диагноз, определить тяжесть течения болезни, дать оценку результатам лечения.
Антитела – что это
Чтобы подавить вирусы, защитные механизмы организма вырабатывают особые белковые молекулы — антитела, которые обнаруживают возбудителей болезни и уничтожают их.
![]()
![]()
Выявление антител к гепатиту В может указывать на то, что:
- заболевание находится на начальном этапе, течет скрытно;
- воспаление затухает;
- недуг перешел в хроническое состояние;
- печень поражена инфекцией;
- иммунитет сформировался после исчезновения патологии;
- человек является вирусоносителем – сам не болеет, но заражает окружающих его людей.
![]()
![]()
Данные структуры не всегда подтверждают наличие заражения или указывают на отступившую патологию. Они вырабатываются также после мероприятий по вакцинации.
Определение и образование антител в крови нередко связано с наличием других причин: различными инфекциями, раковыми новообразованиями, нарушенным функционированием защитных механизмов, включая аутоиммунные патологии. Подобные явления называют ложноположительными. Несмотря на наличие антител, гепатит В при этом не развивается.
Маркеры (антитела) продуцируются к возбудителю и его элементам. Различают:
- поверхностные маркеры anti-HBs (синтезируются к HBsAg – оболочкам вируса);
- ядерные антитела anti-HBc (продуцируются к HBcAg, входящему в состав сердцевины белковой молекулы вируса).
Поверхностный (австралийский) антиген и маркеры к нему
HBsAg – чужеродный белок, образующий внешнюю оболочку вируса гепатита Б. Антиген помогает вирусу цепляться за печеночные клетки (гепатоциты), проникать в их внутреннее пространство. Благодаря ему вирус успешно развивается и размножается. Оболочка поддерживает жизнеспособность вредоносного микроорганизма, дает ему возможность продолжительное время находиться в человеческом организме.
![]()
![]()
Белковая оболочка наделена невероятной устойчивостью к различным негативным воздействиям. Австралийский антиген выдерживает кипячение, не погибает при замораживании. Белок не утрачивает свойств, попав в щелочную или кислую среду. Он не разрушается от воздействия агрессивных антисептиков (фенола и формалина).
Выделение антигена HBsAg происходит в период обострения. Максимальной концентрации он достигает к концу инкубационного периода (примерно за 14 дней до его завершения). В крови HBsAg сохраняется на протяжении 1-6 месяцев. Затем численность патогена начинает сокращаться, и через 3 месяца его количество приравнивается к нулю.
![]()
![]()
Если австралийский вирус находится в организме свыше полугода, это свидетельствует о переходе заболевания в хроническую стадию.
Когда при профилактическом обследовании у здорового пациента обнаруживают антиген HBsAg, сразу не делают вывод о том, что он инфицирован. Сначала подтверждают анализ, проведя другие исследования на присутствие опасной инфекции.
Людей, у которых антиген обнаружен в крови спустя 3 месяца, относят к группе вирусоносителей. Примерно 5% переболевших гепатитом Б, становятся носителями инфекционного заболевания. Часть из них будет заразна до конца жизни.
Медики предполагают, что австралийский антиген, пребывая в организме продолжительное время, провоцирует возникновение раковых опухолей.
Определяют антиген HBsAg, используя Anti-HBs – маркер ответной реакции иммунитета. Если при исследовании крови получают положительный результат, это означает, что человек инфицирован.
Суммарные антитела к поверхностному антигену вируса находят у пациента при начавшемся выздоровлении. Происходит это после удаления HBsAg, обычно по прошествии 3-4 месяцев. Anti-HBs защищают человека от гепатита B. Они прикрепляются к вирусу, не позволяя ему разноситься по организму. Благодаря им иммунные клетки быстро вычисляют и убивают патогенных микроорганизмов, не дают прогрессировать инфекции.
Суммарная концентрация, появляющаяся после инфицирования, используется для выявления иммунитета после прививки. Нормальные показатели говорят о том, что целесообразно проводить повторную вакцинацию человека. Со временем суммарная концентрация маркеров этого вида понижается. Впрочем, встречаются здоровые люди, у которых антитела к вирусу существуют пожизненно.
Возникновение Anti-HBs у больного (когда количество антигена устремляется к нулю) считают положительной динамикой заболевания. Пациент начинает выздоравливать, у него появляется постинфекционный иммунитет к гепатиту.
Ситуация, когда при остром течении инфекции обнаружены маркеры и антигены, свидетельствует о неблагоприятном развитии болезни. В этом случае патология прогрессирует и усугубляется.
Определение антител проводят:
- при контролировании хронического гепатита В (тесты делают 1 раз в 6 месяцев);
- у людей, причисленных к группе риска;
- перед прививкой;
- для сравнения показателей вакцинации.
Нормальным считается отрицательный результат. Положительным он бывает:
- при наметившемся выздоровлении пациента;
- если возникла вероятность инфицирования другим типом гепатита.
Ядерный антиген и маркеры к нему
HBeAg – ядерная белковая молекула вируса гепатита Б. Проявляется в момент острого течения инфекции, чуть позднее HBsAg, а пропадает, наоборот, раньше. Низкомолекулярная белковая молекула, находящаяся в сердцевине вируса, указывает на заразность человека. При обнаружении его в крови женщины, вынашивающей ребенка, вероятность того, что малыш родится инфицированным, довольно велика.
На появление хронического гепатита Б указывают 2 фактора:
- высокая концентрация HBeAg в крови на раннем этапе болезни;
- сохранение и присутствие агента на протяжение 2 месяцев.
Определение Анти-HBeAg свидетельствует о том, что стадия обострения завершилась, а заразность человека понизилась. Его выявляют, делая анализ через 2 года после инфекции. При хроническом гепатите В маркеру Анти-HBeAg сопутствует австралийский антиген.
Этот антиген присутствует в организме в связанной форме. Его определяют по антителам, воздействуя на образцы специальным реагентом, или анализируя биоматериал, взятый при биопсии печеночных тканей.
Тестирование крови на маркер делают в 2 ситуациях:
- при обнаружении HBsAg;
- при контролировании протекания инфекции.
Нормальными признаны тесты с отрицательным результатом. Положительным анализ бывает, если:
- закончилось обострение инфекции;
- патология перешла в хроническое состояние, а антиген не обнаружен;
- больной выздоравливает, а в его крови наличествуют anti-HBs и anti-HBc.
Антитела не выявляются, когда:
- человек не инфицирован гепатитом Б;
- обострение заболевания находится на начальном этапе;
- инфекция проходит инкубационный период;
- в хронической стадии активизировалось репродуцирование вируса (тест на HBeAg положительный).
Выявляя гепатит В, исследование не проводят отдельно. Это дополнительный анализ к выявлению других антител.
Маркеры анти-НВе, анти-HBc IgM и анти-HBc IgG
С помощью анти-HBc IgM и анти-HBc IgG устанавливают характер протекания инфекции. Они обладают одним несомненным достоинством. Маркеры находятся в крови при серологическом окне – в момент, когда HBsAg исчезли, анти-HBs еще не появились. Окно создает условия для получения ложнонегативных результатов при анализе образцов.
![]()
![]()
Длится серологический период 4-7 месяцев. Плохим прогностическим фактором считается моментальное возникновение антител после пропадания чужеродных белковых молекул.
При остром развитии инфекции появляются антитела IgM анти-HBc. Иногда они выступают в роли одного единственного критерия. Еще их находят при обострившейся хронической форме недуга.
Выявить такие антитела к антигену непросто. У человека, страдающего ревматическими заболеваниями, при исследовании образцов получают ложноположительные показатели, что приводит к ошибочным диагнозам. Если титр IgG высок, IgM анти-HBcor находятся в недостатке.
После того как, из крови исчезнут IgM, в ней обнаруживаются IgG анти-HBc. Через определенный временной отрезок маркеры IgG станут доминирующим видом. В организме они остаются навсегда. Но не проявляют каких-либо защитных свойств.
Такая разновидность антител при определенных условиях остается единственным признаком инфекции. Обусловлено это образованием микс-гепатитов, когда HBsAg продуцируется в ничтожных концентрациях.
HBe – антиген, свидетельствующий о репродуктивной деятельности вирусов. Он указывает на то, что вирус активно размножается за счет строительства и удвоения ДНК-молекулы. Подтверждает тяжелое протекание гепатита Б. Когда у беременных обнаруживают белки анти-HBe, то предполагают высокую вероятность аномального развития плода.
Определение маркеров к HBeAg служит доказательством того, что у больного начался процесс выздоровления и удаления вирусов из организма. При хронической стадии заболевания обнаружение антител указывает на положительную динамику. Вирус прекращает размножаться.
При развитии гепатита Б возникает интересный феномен. В крови пациента поднимается титр антител анти-НВе и вирусов, однако при этом не возрастает численность антигена HBe. Подобная ситуация указывает на мутацию вируса. При таком аномальном явлении меняют схему лечения.
У людей, перенесших вирусную инфекцию, анти-HBe остается в крови на некоторое время. Период исчезновения длится от 5 месяцев до 5 лет.
Диагностика вирусной инфекции
Выполняя диагностику, врачи соблюдают следующий алгоритм:
- Скрининг делают с помощью тестов, позволяющих определить HBsAg, анти-HBs, антитела к HBcor.
- Выполняют тестирование на антитела к гепатиту, позволяющее углубленно исследовать инфекцию. Определяют антиген HBe и маркеры к нему. Исследуют концентрацию ДНК вируса в крови, используя методику полимеразной цепной реакции (ПЦР).
- Добавочные способы тестирования помогают выяснить рациональность терапии, скорректировать схему лечения. С этой целью делают биохимический анализ крови и биопсию печеночной тканей.
Вакцинация
Вакцина против гепатита Б представляет собой инъекционный раствор, содержащий белковые молекулы антигена HBsAg. Во всех дозах находится по 10-20 мкг обезвреженного соединения. Зачастую для прививок используют Инфанрикс, Энджерикс. Хотя средств вакцинации выпускается немало.
![]()
![]()
Из инъекции, попавшей в организм, антиген понемногу проникает в кровь. При таком механизме защитные силы приспосабливаются к чужеродным белкам, производят ответную иммунную реакцию.
Прежде чем антитела к гепатиту Б появятся после вакцинации, пройдет полмесяца. Инъекцию вводят внутримышечно. При подкожной вакцинации формируется слабый иммунитет к вирусной инфекции. Раствор провоцирует возникновение абсцессов в эпителиальной ткани.
После вакцинации по степени концентрации в крови антител гепатита В выявляют силу ответной иммунной реакции. Если количество маркеров выше 100 мМе/мл, утверждают, что прививка достигла отведенной ей цели. Хороший результат фиксируют у 90% привитых людей.
![]()
![]()
Пониженным показателем и ослабленной иммунной реакцией признана концентрация от 10 мМе/мл. Такую прививку считают неудовлетворительной. В этом случае вакцинация проводится повторно.
Концентрация менее 10 мМе/мл, говорит о том, что поствакцинальный иммунитет не сформировался. Людей с таким показателем необходимо обследовать на вирус гепатита В. Если они окажутся здоровыми, им нужно привиться еще раз.
Успешная вакцинация защищает на 95% от проникновения вируса гепатита Б в организм. Спустя 2-3 месяца после процедуры у человека вырабатывается устойчивый иммунитет к вирусной инфекции. Он защищает организм от вторжения вирусов.
Поствакцинальный иммунитет формируется у 85% привитых людей. У оставшихся 15% он будет недостаточным по напряжённости. Это означает, что они смогут заразиться. У 2-5% прошедших вакцинацию иммунитет не формируется совсем.
Поэтому спустя 3 месяца привившимся людям необходимо проконтролировать напряженность иммунитета к гепатиту В. Если прививка не дала нужного результата, им надо пройти обследование на вирус гепатита Б. В случае, когда антитела не выявлены, рекомендуют привиться повторно.
Привиться от вирусной инфекции надо всем. Эта вакцинация относится к категории обязательных прививок. Впервые инъекцию вводят в роддоме, через несколько часов после рождения. Затем ее ставят, придерживаясь определенной схемы. Если новорожденного не привили сразу, вакцинацию делают в 13-летнем возрасте.
![]()
![]()
- первую инъекцию вводят в назначенный день;
- вторую – спустя 30 дней после первой;
- третью – когда пройдет полгода после 1 вакцинации.
Вводят 1 мл инъекционного раствора, в котором находятся обезвреженные белковые молекулы вируса. Ставят прививку в дельтовидную мышцу, расположенную на плече.
![]()
![]()
При трехкратном введении вакцины у 99% привитых развивается устойчивый иммунитет. Он купирует развитие заболевания после инфицирования.
Группы взрослых людей, которых прививают:
- зараженных другими типами гепатита;
- всех, кто вступил в интимную связь с зараженным человеком;
- тем, у кого в семье есть заболевший гепатитом Б;
- медработников;
- лаборантов, исследующим кровь;
- больных, проходящих процедуру гемодиализа;
- наркоманов, использующих шприц для введения соответствующих растворов;
- студентов медучреждений;
- лиц с беспорядочными половыми связями;
- людей с нетрадиционной ориентацией;
- туристов, уезжающих на отдых в Африку и азиатские страны;
- отбывающих срок наказания в исправительных учреждениях.
Анализы на антитела к гепатиту B помогают выявить заболевание на ранней фазе развития, когда оно течет бессимптомно. Это увеличивает шанс на быстрое и полное выздоровление. Тесты позволяют определить формирование защищенного иммунитета после вакцинации. Если он выработался, вероятность заражения вирусной инфекцией ничтожно мала.
Читайте также:


