Комнаты для работы с вирусным материалом должны состоять из
Для вирусологического исследования в лабораторию направляют патологический материал, при взятии которого необходимо исходить из патогенеза заболевания (входные ворота, пути распространения вируса в организме, месте его размножения, пути выделения). Так, при вирусной диарее в лабораторию направляют от больных животных носовые истечения, кровь и фекалии, от трупа – слизистую носа, трахею, легкие, слизистую преджелудков, кишечника, печень, селезенку и мезентериальные лимфатические узлы. При инфекционном ринотрахеите от больных животных – истечения из носа и глаз, кровь, абортированные плоды с плодными оболочками и околоплодной жидкостью, а от трупа – слизистую носа, трахею, бронхи, легкие и в некоторых случаях головной мозг.
Патологический материал берут как можно быстрее после появления четких признаков болезни и не позднее 2-3 часов после смерти или убоя. Это связано с тем, что сразу после заболевания или в первые 1-2 дня значительно ослабевает барьерная роль кишечника, что способствует диссиминации кишечной микрофлоры. Пробы необходимо брать асептически, не допуская их загрязнения, в стерильный флакон. Каждую пробу необходимо брать в отдельный флакон. Масса каждой пробы должна быть не менее 5-10 мл (грамм). Все флаконы должны герметично закрываться пробками, обычно резиновыми, продезинфицированы снаружи, высушены и промаркированы
Кровь у крупного рогатого скота берут из яремной вены в верхней трети шеи в объеме не менее 5 мл в пробирки. Иглы перед взятием крови обязательно стерилизуют кипячением. Шерсть на месте взятия крови тщательно выстригают, кожу обрабатывают спиртом или 3%-ным раствором карболовой кислоты. Для серологических исследований необходимо иметь парные сыворотки, взятые в начале и конце болезни. Первую пробу берут как можно раньше – в инкубационный период или в начале проявления клинических симптомов болезни, вторую – во время выздоровления ил через 2-3 недели после заболевания. Для приготовления сыворотки нельзя применять антикоагулянты или консерванты, так как они могут сделать сыворотку антикомплементарной, а в реакции нейтрализации оказать нейтрализирующее действие на вирус, оказаться токсическим для культур клеток или нестерильными. Кровь в объеме 10-15 мл берут в стерильные пробирки с резиновыми пробками, выдерживают при комнатной температуре до образования сгустков, обводят стеклянной палочкой и переносят в холодильник при 4 о С на 18-20 часов.
Смывы со слизистой оболочки носа, глаз берут стерильными ватными тампонами, погружают их в пенициллиновые флаконы или пробирки, содержащие 3-5 мл раствора Хенкса или питательной среды для культуры клеток с антибиотиками (пенициллин и стрептомицин по 500 ЕД) и белковым стабилизатором (0,5%-ный раствор желатина или 0.5-1%-ным раствором альбумина бычьей сыворотки). Присутствие стабилизаторов необходимо для предотвращения быстрой инактивации некоторых вирусов.
Фекалии берут из прямой кишки при помощи шпателя или палочки и помещают в стерильную пробирку или пенициллированный флакон.
Кусочки внутренних органов необходимо брать очень быстро, так как при многих вирусных инфекциях наблюдаются случаи посмертной аутостерилизации, в результате чего вирус не обнаруживается или его количество становится незначительным и обычными методами не выделяется. Размер кусочков органов должен быть несколько см 3 и масса 10-20 грамм.
Транспортировка и хранение проб патологического материала. Необходимо создать для проб условия, обеспечивающие замедление процессов инактивации вирусов. Это достигается низкими температурами. Для этого пробирки с патологическим материалом, закрытые резиновыми пробками, надо поместить в термос со льдом, со смесью в равных частях сухого льда и этилового спирта (создается температура –70 о С, которая держится несколько дней). Можно использовать смесь льда и поваренной соли в соотношении 3:1 (температура –15. – 20 о С). Для консервации кусочков паренхиматозных органов и тканей используют химические консерванты – смесь в равных объемах стерильного глицерина и 0,85%-ного раствора поваренной соли, но употребление глицерина делает невозможным исследование патологического материала методом иммунофлюоресценции, поэтому необходимо отправлять мазки-отпечатки.
Патологический материал снабжают надежной и четкой этикеткой с указанием хозяйства, вида животного, вида материала и даты, надписи делают простым карандашом. Термос с патологическим материалом должен быть опечатан. Также патологический материал сопровождается письмом с подробной информацией о животном, от которого взяты пробы, об эпизоотологических данных хозяйства, о предположительном диагнозе и мерах, принятых для ликвидации болезни (лечение, вакцинация), также письмо должно содержать дату и фамилию врача. Патологический материал и сопроводительное письмо отправляют в лабораторию с нарочным.
Доставленный в лабораторию патологический материал сразу исследуют. Если нет возможности исследовать материал сразу, то его хранят при температуре –40. –70 о С. Если нет уверенности в том, что исследуемое инфекционное заболевание было вызвано только вирусом, то часть материала отдают для бактериологического и микологического исследования.
Ветеринарная лаборатория.
Вирусологический отдел Гагаринской ветеринарной лаборатории осуществляет диагностику вирусных инфекций, контролирует заболеваемость животных, вызываемую вирусами, учитывает состояние и напряженность специфического постинфекционного и поствакционального противовирусного иммунитета, участвует в организации и проведении профилактических мероприятий в борьбе с вирусными заболеваниями животных в Гагаринском районе Смоленской области.
Лаборатория размещается в одноэтажом здании на окраине города Гагарин Смоленской области, вирусологический отдел занимает отдельное крыло. Комната, где работают с вирусным материалом хорошо освещена и состоит из 2х отсеков (предбоксник и бокс), разделенных стеклянной перегородкой с дверью. В боксе размещены столы, стулья и принадлежности для работы. Поверхность столов покрыта стеклом, над рабочим местом установлены бактерицидные лампы, у входа в бокс лежит резиновый губчатый дезковрик, пропитанный дезраствором. В предбокснике держат стерильные халаты, шапочки, косынки, маски, тапочки, которые надевают перед работой в боксе и размещают оборудование, соответствующее назначению бокса (термостат, холодильник, водяная баня, центрифуга). Поля в лаборатории сделаны из плотного влагонепроницаемого, устойчивого к дезинфицирующему средству материала (линолеум). Стены и потолки покрыты легкомоющимся материалом (масляная краска). На окнах – сетка, препятствующая проникновению насекомых.
Для регистрации поступившего патологического материала имеется приемная, в которой стоит 2 стола, обитых жестью, и емкости с дезинфицирующими растворами (3%-ный раствор хлорамина).
Существует специальная комната – вскрывочная, где происходит вскрытие трупа и отбор патологического материала для дальнейшего исследования. Вскрытие делают на столе, на котором размещен сосуд с дезинфицирующим раствором. Также во вскрывочной располагается стеклянный шкаф с необходимыми инструментами, стерильной посудой для сбора материала и шкаф для спецодежды.
В автоклавной стерилизуют посуду, питательные среды, аппаратуру, приборы и обезвреживают инфекционный материал.
Моечная предназначена для мытья посуды, аппаратуры и приборов. Посуду, пипетки и инструменты, загрязненные инфицированным материалом моют только после обезвреживания.
Виварий имеет карантинное отделение, комнату для здоровых и экспериментальных животных, а также комнаты для мытья и дезинфекции клеток, для инвентаря и специальной одежды, для приготовления кормов и др. Помещения для здоровых и экспериментальных животных изолированы друг от друга и имеют самостоятельные входы и выходы. Лабораторные животные содержаться в клетках. На каждой клетке имеется отметка о дате поступления в виварий, массе. На клетках с подопытными животными дополнительно отмечают дату заражения и вид вируссодержащего материала, № экспертизы и количество зараженных животных.
ВИРУСОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ — учреждение, занимающееся изучением вирусов и вирусных заболеваний или производством вирусных препаратов (вакцин, диагностикумов, противовирусных иммунных сывороток и т. п.).
В. л. отделились от бактериологических и стали существовать в виде самостоятельных единиц в 20 в. В СССР первые В. л. были созданы в 30-х годах. Сейчас в стране имеется несколько ин-тов мед. вирусологии, объединяющих В. л. различных профилей, где изучаются вирусные заболевания, исследуется природа вирусов, разрабатываются и производятся вирусные препараты (Ин-т вирусологии им. Д. И. Ивановского, Ин-т полиомиелита и вирусных энцефалитов, Всесоюзный НИИ гриппа, Московский НИИ вирусных препаратов и др.). В. л. есть также в большинстве союзных и республиканских ин-тов микробиологии и эпидемиологии, обычно профилированных в отношении изучения одного или нескольких заболеваний. Кроме того, имеется ок. 150 В. л. при республиканских, областных и городских сан.-эпид, станциях, а также лаборатории при крупных леч. учреждениях; в основном они занимаются диагностической работой. Помимо мед. В. л., существуют лаборатории для изучения вирусных инфекций животных и растений.
Размеры и штаты В. л. зависят от назначения и объема работы. Во всех случаях обязательно обеспечение безопасности персонала и возможности проведения работы в стерильных условиях.

В. л. состоит из собственно лаборатории и подсобных помещений — для обработки и стерилизации посуды, приготовления питательных сред (для выращивания клеточных культур, выявления бактерий и мико-плазм), лиофилизации вирусов, инкубатора, вивария и др. Если В. л. входит в состав более крупного учреждения (ин-та, сан.-эпид, станции и др.), подсобные помещения могут быть общими для ряда лабораторий или всего учреждения.
Собственно В. л. строится по типу бактериологической лаборатории (см.) с учетом специфики работы — выращивания клеточных и тканевых культур, ультрацентрифугирования, хранения вирусов при низких температурах и др. Она оборудуется для диагностической работы (выделения вирусов и серологических реакций), для изучения свойств вирусов, их структуры, проведения генетических исследований и т. п.
Помещение В. л. должно легко мыться и обрабатываться дезинфицирующими растворами. С этой целью стены красят масляной краской или облицовывают плиткой, пол покрывают линолеумом или плиткой. Помещение оборудуют приточно-вытяжной вентиляцией примерно с 10-кратным обменом воздуха; оно должно быть обеспечено холодной и горячей водой, а также светильным газом. Желательно иметь централизованную систему сжатого воздуха (давление до 1,0—1,2 атм) и вакуума (до 700— 760 мм рт. ст. остаточного давления). Должны быть предусмотрены душевые комнаты для сотрудников. При работе с особо опасными вирусами необходимо обезвреживание (путем кипячения) сточных вод.
В В. л. обязательно наличие отдельного помещения для стерильной работы, состоящего из двух отделений, разделенных стеклянной перегородкой. Внутреннее помещение — бокс— должно быть небольшим (6—8 м 2 ), с низким потолком (см. Боксы, микробиологические). Дверь должна открываться в предбоксник, служащий для одевания дополнительной одежды, отделенный второй перегородкой от остального помещения. Для стерилизации бокса и предбоксника используют бактерицидные лампы из увиолевого стекла с преобладающей длиной волны 254 нм (см. Бактерицидные облучатели). Для этой цели можно использовать лампы БУВ, которые устанавливают из расчета 2—2,5 вт на 1 м 3 помещения; средний срок службы лампы 1500 час. Обязательно обеспечение боксов стерильным воздухом за счет приточной вентиляции при 4—5-кратном обмене; для стерилизации воздуха могут быть использованы фильтры ЛАИ К из ткани Петрянова — тип ФПП.
В боксе должны находиться лишь необходимые для работы инструменты и посуда, стерилизатор для инструментов, широкогорлые банки с дезинфицирующим раствором, бак с крышкой для зараженного материала. При работе с возбудителями особо опасных инфекций (натуральная оспа, энцефалиты и т. д.) в боксе устанавливают дополнительно настольный бокс, в к-ром стерилизуется путем фильтрации как поступающий, так и оттекающий воздух. Основные правила работы с особо опасными возбудителями регламентируются специальной инструкцией.
Для дезинфекции в В. л. используют чаще всего лизол 1 — 5%, хлорамин 1—5%, формалин 2,5—5%.
Помимо обычной бактериологической посуды, В. л. должны иметь гомогенизатор для измельчения тканей, магнитные мешалки, микроскопы (световые для исследования в обычном и ультрафиолетовом свете, а также электронные), центрифуги различной мощности (на 3—5 тыс. об/мин, а также с охлаждением на 12—15 тыс. и 60 тыс. об/мин), имеющие набор роторов. Необходимы термостаты, одновременно работающие при различной температуре (от 25 до 40°), в т. ч. с подачей углекислого газа, или термостатные комнаты. В. л. оборудуется рефрижераторами или холодильными камерами с t° +4°, —20° и —40°. Для хранения культур клеток необходимы сосуды Дьюара с жидким азотом или холодильники с температурой ниже —90°.
Лаборатории, изучающие биохимию вирусов, оборудуются по типу химических. Работа с радиоактивными изотопами производится в специально оборудованном помещении.
Виварий (см.) должен быть отделен от помещения собственно В. л. В нем необходимо иметь комнаты для карантина поступающих животных, для их заражения и отдельно для вскрытия. Работа с мелкими лабораторными животными производится за защитным стеклом. Обеззараживание клеток для содержания животных лучше производить паром. Необходимо также иметь крематорий для сжигания трупов животных и мусора.
Библиография: Кравченко А. Т. Принципы организации и режим работы вирусологических и риккетсиозных лабораторий, Руководство по Лаборат, диагностике вирусных и риккетсиозных болезней, под ред. П. Ф. Здродовского и М. И. Соколова, с. 219, М., 1965; Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., с. 9, 123 и др., М., 1974; Guide to the laboratory diagnosis of smallpox for smallpox eradication programmes, Geneva, WHO, 1969; Virologische Praxis, hrsg. v. G. Starke, Jena, 1968, Bibliogr.
При работе с вируссодержащим материалом необходимо выполнять следующие требования:
· не допускать рассеивания вирусов во внешней среде;
· предотвратить контаминацию (загрязнение) вируссодержащего vатериала посторонней микрофлорой;
· обеспечить личную безопасность.
Режим работы вирусологической лаборатории регламентируется законами Российской Федерации, международными правилами проведения диагностических лабораторных исследований, правилами внутреннего распорядка. Весь персонал лаборатории проходит инструктаж и обучение безопасным методам труда, обеспечивается спецодеждой, спецобувью, средствами санитарной защиты и защитными приспособлениями в соответствии с действующими нормами. Вход в производственные помещения посторонним лицам категорически запрещен. Сотрудники вирусологической лаборатории обязаны соблюдать правила работы, предупреждающие загрязнения бактериями и грибами исследуемого материала, возможность заражения персонала и распространения инфекции.
Запрещено выходить за пределы лаборатории в халатах и спецобуви или надевать верхнюю одежду на халат, курить, принимать пищу в производственных помещениях и хранить в них продукты питания. В боксе работают в стерильном халате, маске, шапочке, в некоторых случаях надевают очки и перчатки. Обязательно меняют обувь. Не допускаются хождение и разговоры во время работы.
Весь материал, поступающий в лабораторию на исследование, должен рассматриваться как инфицированный!
С инфекционным материалом следует обращаться крайне осторожно. При распаковке его банки необходимо протирать снаружи дезинфицирующим раствором и ставить их на поднос или в кювет. Рабочее место на столе покрывают несколькими слоями марли, увлажненной 3 – 5 % раствором хлорамина. Жидкости, содержащие вирусы, переливают над кюветами с дезинфицирующим раствором. При работе с пипеткой пользуются грушей. Пипетки, предметные стекла, стеклянную посуду и резиновые изделия, задействованные в работе с инфекционным материалом, обеззараживают погружением в 5 % раствор хлорамина или растворы фенола, лизола, серной кислоты. Запрещается выносить из лаборатории оборудование, инвентарь, материалы и т. д. без предварительной их дезинфекции. По окончании работы рабочее место приводят в порядок и дезинфицируют. Вируссодержащий материал, необходимый для дальнейшей работы, ставят на хранение в холодильник и опечатывают. Руки в перчатках промывают в банке с 5 % раствором хлорамина, затем перчатки снимают, обеззараживают вторично, дезинфицируют и моют.
ТРЕБОВАНИЯ К РАБОЧИМ ПОМЕЩЕНИЯМ И ОБЕСПЕЧЕНИЕ УСЛОВИЙ РАБОТЫ
Современные требования к лабораторным диагностическим комплексам и отдельным составляющим (полы, стены, потолки, системы отопления, вентиляции, водоснабжения и канализации) изложены в правилах лабораторной практики GLP.
Вирусологические отделы лабораторий и научно-исследовательских ветеринарных станций призваны осуществлять лабораторную диагностику вирусных инфекций, контролировать заболеваемость животных, вызываемую вирусами в межэпизоотический период, а также учитывать состояние и напряженность специфического постинфекционного и поствакцинального противовирусного иммунитета, участвовать в организации и проведении профилактических мероприятий в борьбе с вирусными и хламидийными заболеваниями животных в обслуживаемом регионе.
Структура вирусологической лаборатории определяется задачами и особенностями ее деятельности. Размещать лабораторию желательно в двухэтажном здании или в изолированном отсеке. Боксы предпочтительнее располагать с северной, теневой стороны здания, чтобы избежать попадания в них прямых солнечных лучей, или следует застеклить окна боксов молочным или матовым стеклом. Полы в коридорах и комнатах для сотрудников могут быть паркетными, покрытыми лаком; в остальных – из плотного, влагонепроницаемого, устойчивого к дезинфектантам материала. Деревянные полы покрывают пластиком. Стены и потолки лаборатории должны быть также устойчивыми к дезинфектантам, легко подвергаться мойке. В боксах всю площадь целесообразно отделывать кафельной плиткой. Двери боксов должны быть раздвижными. Это позволяет сэкономить площадь и избежать колебания воздуха. В плоскости двери устраивают окошко с небольшой площадкой Целесообразно иметь боксы следующего назначения: для получения и культивирования клеток – 1–2 бокса; для заражения культуры клеток – 1–2, для заражения куриных эмбрионов – 1–2 бокса; для заражения подопытных животных – 1 бокс; для вскрытия подопытных животных – 1 бокс; для склада стерильного стекла – 1 помещение.
Основные диагностические работы должны проводиться в настольных или стационарных ламинарных боксах (разного класса) с системой защиты оператора, предупреждения контаминации исследуемого материала, защиты окружающей среды от вредных и опасных выбросов.
Помещения несколько больших размеров (примерно 4х4 м) выделяют для серологических исследований, уничтожения инфекционного материала, приготовления и стерилизации лабораторной посуды и других материалов, приготовления питательных сред и растворов, а также для сотрудников.
Лаборатория (отдел) вирусологии должна быть обеспечена холодной и горячей водой, желательны подача пара и газа, наличие централизованного вакуум-провода и подачи воздуха под давлением.
Каждый бокс комплектуют соответствующей мебелью и оборудованием. Примерная схема размещения оборудования и приборов представлена на рисунке 1. Наиболее важен стол, размер которого зависит от выполняемых на нем работ. В связи с тем, что многие работы приходится выполнять вдвоем, стол рекомендуется располагать параллельно стене, чтобы два работника сидели друг против друга, или ставить его к стене в виде буквы Т, что позволяет более экономно использовать площадь стола. Шкафчики для стеклянной посуды и мелкого инвентаря можно устроить под столом или повесить на стену. Покрытие лабораторного стола должно быть устойчивым к действию дезинфицирующих веществ. Лабораторные стулья лучше всего металлические, так как они легко очищаются и дезинфицируются. Над рабочим местом устанавливают бактерицидные лампы (БУВ-30). У входа в бокс кладут резиновый губчатый коврик, пропитанный дезраствором. В предбокснике находятся стерильные халаты, колпаки, косынки, маски и тапочки, перчатки, которые надевают перед работой в боксе, и, в зависимости от назначения бокса, соответствующее оборудование (термостат, холодильник, водяная баня, центрифуга и пр.).
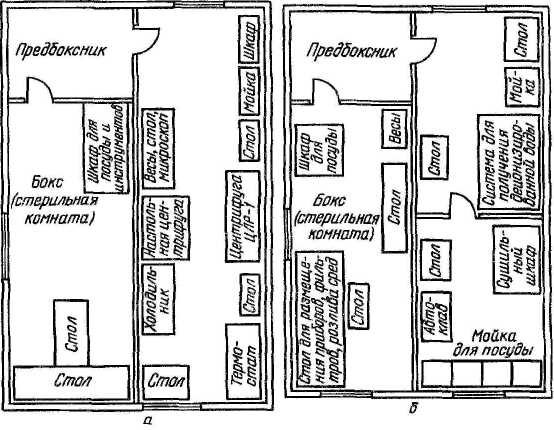
Рисунок 1 - Схема размещения оборудования: а – для работы с культурами клеток, б – для изготовления сред и растворов для культур клеток

Рисунок 2 - Микробиологический защитный бокс I класса:1 – вытяжной вентилятор; 2 - высокоэффективный воздушный фильтр; 3 - смотровая стеклянная панель; 4- открытый проем для рук работающего; 5 - штуцера для подводок воды, воздуха

Рисунок 3 - Бокс с ламинарной подачей стерильного воздуха:1 – газовая горелка, 2 – матрас, 3 – резиновая груша
Ограничить численность бактерий можно с помощью бактерицидных лампБУВ-15 и БУВ-30. Значительного снижения количества бактерий в воздухе боксов и предбоксников, на поверхности столов и другого оборудования можно достигнуть обработкой аэрозолем перекиси водорода и некоторых других веществ. Уборку помещений проводят влажным способом: полы, стены, мебель протирают марлей, увлажненной дезраствором.
Для вирусологической лаборатории любого типа обязательной частью оборудования должен быть настольный бокс, содержащий бактерицидную лампу, еще лучше – ламинарный шкаф с подачей стерильного воздуха (рис. 2, 3).
При работе в вирусологической лаборатории необходимо строго соблюдать методы и правила асептики и антисептики!
Асептика – система мероприятий и приемов работы, предупреждающих попадание микроорганизмов и вирусов из окружающей среды в организм человека, а также в исследуемый материал. Она предусматривает использование стерильных инструментов и материалов, обработку рук сотрудников, соблюдение особых санитарно-гигиенических правил и приемов работы.
Антисептика – комплекс мероприятий, направленных на уничтожение микроорганизмов и вирусов, способных вызвать инфекционный процесс при попадании на поврежденные или интактные участки кожи и слизистых оболочек. В качестве антисептиков используют различные химические вещества: 70%-ный этиловый спирт, 5%-ный спиртовой раствор йода, 0,5–3%-ный раствор хлорамина, 0,1%-ный раствор перманганата калия, 0,5–1%-ный раствор формалина, 1-2%-ные спиртовые растворы метиленового синего или бриллиантового зеленого.
Дезинфекция – обеззараживание объектов окружающей среды путем уничтожения патогенных для человека и животных микроорганизмов и вирусов физическими способами и с помощью химических веществ: растворами хлорной извести (0,1–-10%-ным), формалина, хлорамина (0,5-5%-ным), фенола (3–5%-ным), лизола (3–5%-ным), едкой щелочи (2–3%-ным) и др. Выбор дезинфицирующего вещества и его концентрации зависит от материала, подлежащего дезинфекции.
В лабораториях для дезинфекции боксов чаще всего применяют пары формалина (30–35 мл 40%-ного раствора формальдегида на 1 м 3 помещения), ß-пропиолактон (1,1 л на 100 м 3 помещения) или испаряют карболовую кислоту (не реже одного раза в неделю) и ежедневно делают влажную уборку с применением растворов хлорамина, гидроксида натрия и др.
Стерилизация – обеспложивание, т. е. полное уничтожение микроорганизмов и вирусов в различных материалах. Стерилизацию проводят физическими (воздействием высокой температуры, путем ультрафиолетового облучения, фильтрацией жидкостей через бактериальные фильтры) и химическими методами.
Физические методы стерилизации:
а) прокаливание в пламени спиртовки или горелки. Данный способ применяют для стерилизации препаровальных игл, петель из аппарата Такачи, пинцетов, горловин культуральных сосудов и т. д.;
б) стерилизация кипячением. Этим методом стерилизуют шприцы, мелкий хирургический инструмент, предметные и покровные стекла и другие предметы. Кипятят не менее 30 мин. Однако данный метод не обеспечивает полной стерилизации, так как некоторые вирусы, например вирус гепатита, и споры бактерий могут остаться при этом жизнеспособными;
в) стерилизация сухим жаром в сушильном шкафу. Метод основан на действии нагретого до 165–180°С воздуха. Сухим жаром стерилизуют стеклянную посуду;
г) стерилизация в автоклаве паром под давлением. Это один из наиболее эффективных методов стерилизации, поэтому он широко применяется;
д) стерилизация в аппарате Коха или автоклаве текучим паром (давление 100–150 кПа (1–1,5 атм.), экспозиция 30 мин). Применяют для стерилизации материалов, не выдерживающих воздействия высокой температуры, например питательных сред с витаминами и углеводами;
е) стерилизация ультрафиолетовыми лучами. Метод основан на бактерицидном действии УФ-лучей с длиной волны 260– 300 мкм. Для стерилизации воздуха в боксах используют лампы БУВ-15, БУВ-30. Обычно облучение проводят 1–2 ч;
ж) фильтрование жидкостей через бактериальные фильтры. Этим методом пользуются для освобождения питательных сред, сыворотки крови, витаминов и т. д. от бактерий, но не от вирусов.


Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
2.3. Общие требования к помещениям
и оборудованию лабораторий
2.3.1. Лаборатории, где проводят работу с ПБА, размещают в отдельно стоящем здании или в изолированной части здания, имеющей независимый вход. На входной двери лаборатории должны быть обозначены название (номер) лаборатории и знак "Биологическая опасность" (красного или красно-оранжевого цвета на желтом фоне). Входная дверь должна иметь запирающее устройство.
2.3.2. Лаборатории, проводящие диагностические исследования, оборудуют двумя входами - для сотрудников и для получения материала. Допускается также получение материала через передаточное окно или передаточный шлюз.
В лабораториях, проводящих экспериментальные исследования в "заразной" зоне, допускается один вход.
2.3.3. Строительство и реконструкция действующих лабораторий (подразделений) осуществляются в соответствии с проектной документацией.
2.3.4. Лаборатории должны быть обеспечены системами водоснабжения, специальной канализации, электроснабжения, отопления, приточно-вытяжной вентиляции, телефонной связью, а также оснащены охранной и пожарной сигнализацией.
2.3.5. Все помещения лаборатории должны быть обеспечены естественным и (или) искусственным освещением, создающим уровень освещенности в зависимости от вида работ.
2.3.6. Помещения лаборатории подразделяются на "заразную" зону, где осуществляются манипуляции с ПБА и их хранение, и "чистую" зону, где не проводятся работы с ПБА.
Планировочные решения и размещение оборудования должны обеспечивать поточность продвижения ПБА, персонала и выполнение иных требований настоящих санитарных правил.
2.3.7. В "чистой" зоне лабораторий необходимо располагать:
- гардероб для верхней одежды;
- помещения для проведения подготовительных работ (препараторская, моечная, приготовление и разлив питательных сред и др.);
- помещение для стерилизации питательных сред и лабораторной посуды (стерилизационная);
- помещение с холодильной камерой или холодильниками для хранения питательных сред и диагностических препаратов;
- комнаты для работы с документами и литературой;
- кабинеты заведующего и сотрудников;
В "заразной" зоне располагают:
- блок для работы с инфицированными животными, состоящий из комнаты для приема, разборки и первичной обработки поступающего материала, комнаты для работы с этим материалом (заражение, вскрытие, посев), комнаты для содержания зараженных животных, комнаты для обеззараживания инвентаря (клетки, садки и др.). Блок для работы с инфицированными животными должен быть отделен от остальной части "заразной" зоны комнатами для надевания и снятия защитной одежды и средств индивидуальной защиты;
- боксированные помещения для проведения микробиологических исследований, состоящие из бокса и предбоксника;
- боксированные помещения для проведения серологических исследований;
- боксированные помещения для люминесцентной микроскопии;
- боксированные помещения для проведения зооэнтомологических работ;
- боксированные помещения для проведения генодиагностических исследований;
- автоклавную для обеззараживания материала;
- термостатную (термальную) комнату;
- комнату для ведения записей в рабочих журналах;
2.3.8. На границе "чистой" и "заразной" зон необходимо располагать санитарный пропускник, состоящий из помещения для личной одежды, душевой и помещения для рабочей одежды. На границе зон на входе в помещение душевой необходимо устанавливать герметичную дверь, на которую должен быть нанесен знак "Биологическая опасность".
2.3.9. Набор помещений и их оснащение оборудованием могут варьироваться в зависимости от конкретных целей и задач каждой лаборатории (номенклатура и объем исследований, характер выполняемых работ, наличие централизованной лаборатории инфицированных животных, автоклавной, моечной и др.).
2.3.10. При наличии в организации на одной территории нескольких лабораторий разрешается размещение и оборудование централизованных автоклавных и стерилизационных.
2.3.11. При расположении в одном блоке нескольких профильных лабораторий общими для них могут быть: блок для работы с инфицированными животными, санитарный пропускник, автоклавные или установки для обеззараживания отходов, моечные, комнаты для приготовления питательных сред и другие помещения.
2.3.12. В научно-исследовательских учреждениях, имеющих единые санитарные пропускники, централизованные автоклавные и прочее, обслуживающие несколько лабораторий, допускается размещение в "заразной" зоне вспомогательных помещений, в которых не проводят работы, связанные с использованием или хранением ПБА I - II групп. Набор помещений определяется функциональными задачами подразделений. Режим обеспечения биологической безопасности в названных помещениях "заразной" зоны определяется в соответствии с реальной биологической опасностью документом, утверждаемым руководителем организации после согласования с Комиссией данной организации.
2.3.13. В "заразной" зоне в помещениях, где не проводится непосредственная работа с ПБА, персонал работает в рабочей одежде. В помещениях, где проводится работа с ПБА, дополнительно надевается защитная одежда. Тип защитной одежды зависит от характера выполняемой работы.
Надевание и снятие защитной одежды производят в предбоксе.
2.3.14. В предбоксах (шлюзах), а также в комнатах для снятия защитной одежды устанавливаются водопроводные краны (рукомойники) и емкости с дезинфицирующими растворами для текущей дезинфекции, связанной со снятием защитной одежды, и на случай аварии и хранится резерв запасной защитной одежды. На полу размещается коврик, смоченный дезинфицирующим раствором.
2.3.15. Лабораторное оборудование и мебель (столы, стеллажи для содержания животных, стулья и прочее) должны быть гладкими, без острых краев и шероховатостей и иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь швов и трещин.
2.3.16. Ширина проходов к рабочим местам или между двумя рядами выступающего оборудования должна быть не менее 1,5 м.
2.3.17. Для защиты рабочих столов от попадания прямого солнечного света используются светозащитные пленки, жалюзи из материала, устойчивого к дезинфицирующим средствам.
2.3.18. Помещения лабораторий должны быть непроницаемы для грызунов и насекомых.
2.3.19. В помещениях блока для работы с инфицированными животными предусматриваются высокие (30 см) пороги, недоступные для проникновения грызунов.
2.3.20. Лаборатория обеспечивается средствами тушения пожара и оборудуется пожарной сигнализацией.
2.3.21. Помещения, где проводится работа с ПБА, оборудуются бактерицидными облучателями для обеззараживания воздуха и поверхностей в соответствии с руководством по использованию ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях. Допускается дополнительное использование иного сертифицированного специализированного оборудования, обеспечивающего биологическую очистку воздуха помещений "заразной" зоны, а также непрерывную инактивацию микроорганизмов с эффективностью не менее 99%.
2.3.22. Электрические розетки в помещениях "заразной" зоны должны быть с пылевлагозащитными крышками, светильники - герметичны.
2.3.23. Помещения "заразной" зоны лаборатории оборудуются аварийной звуковой и/или световой сигнализацией, которая выводится в помещения "заразной" и "чистой" зон, где постоянно находится персонал.
2.3.24. В помещениях "заразной" зоны выступающие и проходящие трубы (батареи отопления) располагаются на расстоянии от стен с целью возможности проведения их дезинфекции, места ввода инженерных коммуникаций герметизируют и закрашивают под основное покрытие стен, пола или потолка. Для обеспечения надежной герметизации стыков всех конструктивных элементов должны применяться упругие прокладки и строительные герметики, соответствующие условиям эксплуатации стыкуемых элементов конструкции и отвечающие требованиям пожарной безопасности.
2.3.25. Окна и двери помещений "заразной" зоны лаборатории должны быть из устойчивых к дезинфекционной обработке материалов и плотно закрывающимися.
2.3.26. На окна цокольного и первого (при необходимости) этажей устанавливают металлические решетки, не нарушающие правил пожарной безопасности. Наличие охранной сигнализации не исключает необходимости установки решеток. Двери должны иметь запирающие устройства.
2.3.27. В помещениях "заразной" зоны не допускается устройство подпольных каналов и подвесных потолков, не отвечающих указанным требованиям и не обеспеченных доступом в запотолочное пространство для периодической дезинфекционной обработки.
2.3.28. Проверка ОСК на герметичность проводится в два этапа - визуально (обмыливанием) и по методу падения давления.
Визуальный, приборный и инструментальный контроль над возможным появлением локальных утечек воздуха через ОСК в процессе эксплуатации необходимо проводить не реже 1 раза в 12 месяцев во время проведения планово-предупредительного ремонта (ППР).
При обнаружении локальных утечек воздуха через ОСК необходимо принять меры по их ликвидации.
2.3.29. В помещениях "заразной" зоны, где проводятся работы с ПБА, не допускается установка системы водоснабжения, не защищенной техническими средствами для предотвращения обратного тока воды.
2.3.30. Из помещений "заразной" зоны запрещается слив (сток) необеззараженных жидкостей и жидких отходов в канализационную сеть (приложение 11).
2.3.31. Все вакуумные линии, линии сжатого воздуха и газов в "заразной" зоне обеспечиваются фильтрами очистки воздуха не менее класса H13.
2.3.32. Помещения "заразной" зоны лабораторий должны быть оборудованы системами приточно-вытяжной механической вентиляции, обеспечивающими:
- необходимые санитарно-гигиенические и микроклиматические условия;
- локализацию ПБА внутри технологических блоков;
- очистку удаляемого из рабочих помещений и от боксирующих устройств воздуха путем оснащения систем вытяжной вентиляции фильтрами очистки воздуха (далее - ФОВ) класса не менее H14 или сертифицированными специализированными установками, обеспечивающими фильтрацию не менее класса H14, а также непрерывную инактивацию микроорганизмов с эффективностью не менее 99%, задержанных фильтрами;
- очистку подаваемого в рабочие помещения воздуха фильтрами класса не менее H11;
- кратность воздухообмена в рабочих помещениях не менее установленной нормативной документацией;
- направление воздушных потоков в сторону более "грязных" помещений;
- бесперебойную работу систем приточно-вытяжной вентиляции;
- автоматическое (или ручное) включение резервных вентиляторов при выходе из строя рабочих;
- создание и поддержание требуемой величины отрицательного давления (разрежения) относительно окружающей среды в рабочих и лабораторных помещениях;
- блокировку двигателей вентиляторов с электроприводами запорных устройств в составе каждой вентиляционной установки, оснащенной ФОВ.
2.3.33. Основные контролируемые параметры работы систем вентиляции:
- величина разрежения в помещениях "заразной" зоны должна составлять не менее:
- 50 Па (5 мм водяного столба) для лабораторий, проводящих диагностические работы с ПБА I (кроме вирусов) и II групп патогенности;
- 100 Па (10 мм водяного столба) для лабораторий, проводящих экспериментальные работы с ПБА I (кроме вирусов) и II групп патогенности.
Перепад давлений между помещениями лабораторий различного уровня опасности не менее 50 Па (5 мм водяного столба);
- средняя скорость воздушного потока в открытых дверных проемах на границах зон в санитарных пропускниках лабораторий, проводящих экспериментальные работы с ПБА I (кроме вирусов) и II групп, должна быть не менее 0,4 м/сек. Периодичность проверки - 1 раз в 6 месяцев;
- аэродинамическое сопротивление фильтров;
- эффективность фильтрации воздушных фильтров;
контроль - регулярно в соответствии с графиком организации;
- эффективность УОВ по инактивации микроорганизмов;
2.3.34. Автономные системы вентиляции следует предусматривать для помещений блока по работе с инфицированными животными, помещений содержания инфицированных животных.
2.3.35. Кондиционирование воздуха помещений "заразной" зоны допускается секциями кондиционирования (охлаждения, осушения), предусмотренными в составе приточных вентиляционных систем до фильтров очистки воздуха не менее класса H11 - H13 (в случае их наличия).
Установка оконных кондиционеров и сплит-систем на границе помещений "заразной" и "чистой" зон не допускается.
2.3.36. В существующих зданиях лабораторий, проводящих диагностические работы с ПБА I (кроме вирусов) - II групп патогенности при отсутствии в помещении "заразной" зоны приточно-вытяжной вентиляции или фильтров очистки воздуха на выходе вытяжной вентиляции, допускается использовать боксы МБ II A2 класса, а для исследований на чуму - боксы МБ II B2 или III класса совместно с автономными устройствами обеззараживания и очистки воздуха, обеспечивающими эффективность фильтрации класса не менее H14 и непрерывную инактивацию микроорганизмов с эффективностью не менее 99%, задержанных фильтрами.
2.3.37. Работы, связанные с высоким риском образования аэрозоля (центрифугирование, гомогенизация, измельчение, интенсивное встряхивание, обработка ультразвуком, вскрытие емкостей с ПБА, большие объемы и высокая концентрация ПБА и др.), проводят в боксах МБ III класса или защитных боксирующих устройствах (ЗБУ). Внутри боксов МБ устанавливается необходимое оборудование. Боксы МБ могут быть соединены между собой, создавая замкнутые технологические линии. Места ввода коммуникаций и соединения боксов между собой герметизируются.
2.3.38. Основные работы с ПБА I - II групп рекомендуется проводить в боксах микробиологической безопасности I, II или III класса в зависимости от вида выполняемых работ.
2.3.39. Защитная эффективность боксов микробиологической безопасности I, II и III классов подтверждается не реже одного раза в год на основании положительных результатов проверок их эксплуатационных характеристик на соответствие требованиям, указанным в пункте 2.6.11, а также в следующих случаях:
- после монтажа и подготовки к использованию;
- после перемещения, замены фильтров или ремонта бокса.
Аэродинамическое сопротивление фильтров, установленных в боксах МБ, проверяется при наличии в конструкции бокса МБ специальных штуцеров или устройств для проверки.
К эксплуатационным характеристикам боксов МБ относятся:
- для боксов I класса: скорость и направленность входящего потока воздуха, защитная эффективность фильтров для очистки воздуха;
- для боксов II класса: скорость, однородность и направленность нисходящего потока воздуха, скорость и направленность входящего потока воздуха, защитная эффективность фильтров для очистки воздуха;
- для боксов III класса: защитная эффективность фильтров для очистки воздуха, расход забираемого воздуха на единицу объема бокса, уровень разряжения внутри рабочей камеры бокса, скорость входящего потока с одной снятой перчаткой.
Помимо проверки эксплуатационных характеристик, боксы МБ III класса должны проходить периодические испытания в нижеследующем объеме проверок:
- ежегодная проверка герметичности корпуса бокса МБ путем обмыливания мест уплотнения и герметизации при создании избыточного давления в боксе (не менее 200 Па по отношению к давлению в помещении). Критерий соответствия - отсутствие пузырьков;
- ежегодная поверка манометра, показывающего величину отрицательного давления в рабочей камере бокса;
- еженедельная проверка работоспособности основных систем бокса (уровень разряжения внутри рабочей камеры бокса при работающем вентиляторе, срабатывание аварийных индикаторов сигналов тревоги по спецификации производителя, включение освещения и работоспособность системы по обеззараживанию воздуха. При наличии - проверка работоспособности систем водоснабжения, подачи дезинфицирующих растворов и газов).
Подключаемые к вытяжной системе вентиляции ЗБУ после монтажа, ремонта и подключения, а далее ежегодно должны проходить аттестацию, включающую в себя проверку защитной эффективности ФОВ, сертификационное тестирование воздушных потоков и работоспособность основных систем устройства.
Эксплуатационные характеристики боксов микробиологической безопасности должны соответствовать требованиям пункта 2.6.11 настоящих санитарных правил.
На передней панели бокса МБ и ЗБУ вывешивается информация, в которой должны быть представлены:
- дата проведения испытаний;
- срок проведения последующих испытаний;
- номер протокола и наименование организации, проводившей испытания.
Оценку защитной эффективности на основании проверки эксплуатационных характеристик бокса МБ и ЗБУ могут осуществлять юридические лица, индивидуальные предприниматели, эксплуатирующие проверяемые боксы МБ и ЗБУ и имеющие соответствующие аттестаты аккредитации или область деятельности в соответствии с учредительными документами, самостоятельно либо с привлечением организации (лаборатории), имеющей соответствующий аттестат аккредитации и область деятельности в соответствии с учредительными документами.
Защитная эффективность бокса МБ подтверждается на основании положительных результатов проверок эксплуатационных характеристик. Защитная эффективность бокса МБ не подтверждается, если хотя бы одна из проверок его эксплуатационных характеристик имеет отрицательный результат. Результаты проверок эксплуатационных характеристик и подтверждение или неподтверждение защитной эффективности заносятся в протокол проверки защитной эффективности по форме, приведенной в приложении 9.
Методики проведения испытаний бокса МБ приведены в приложении 9.
2.3.40. Ограждающие строительные конструкции, внутренняя отделка помещений, инженерно-техническое оснащение лабораторий должны соответствовать санитарно-гигиеническим требованиям СНиП 31-06-2009, а для помещений "заразной" зоны - дополнительно требованиям рекомендуемого приложения 11 к санитарным правилам, устанавливающим требования к инженерно-техническим системам биологической безопасности.
Читайте также:


