Культивирование бактерий и вирусов
Микроорганизмы в окружающей нас природе находятся повсеместно: в почвах, водоемах, на поверхностях всевозможных предметов, ими населены люди и животные. Все это может служить источниками загрязнения микробами продуктов питания, лекарств, производственных линий. Культивирование бактерий необходимо для изучения их свойств, потребностей, особенностей. Это в свою очередь является важным этапом в разработке различных лекарственных препаратов, лабораторной диагностике заболеваний, расчете производственных реакторов и многого другого.
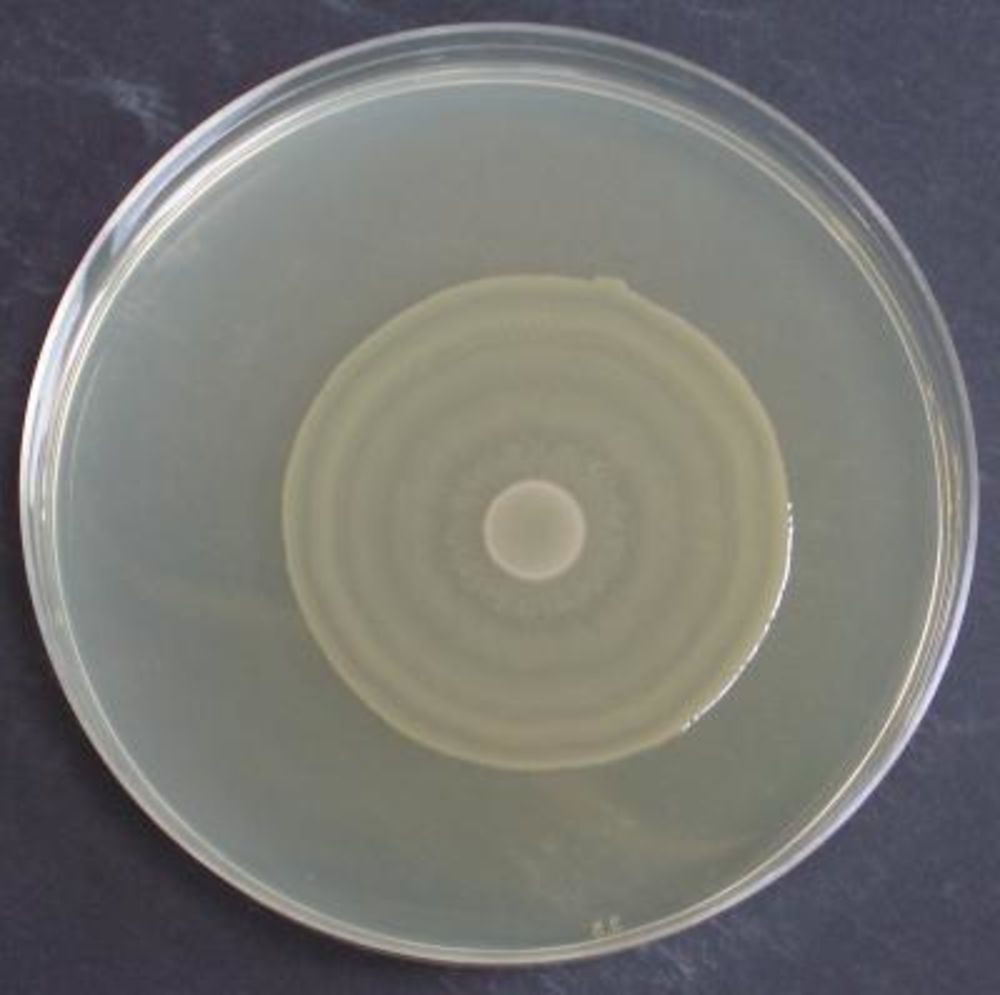
Общие понятия
Под культивированием бактерий в микробиологии понимают выращивание микроорганизмов, осуществляемое в лабораторных условиях. В свою очередь микробы, которые выросли на подобранной питательной среде, называют культурой. Культуры могут быть смешанными, если они образованы разными видами микроорганизмов, и чистыми, если представлены только одним видом бактерий.
Если в питательную среду помещают только одну клетку, а получают в результате ее размножения группу особей, то эту совокупность микроорганизмов называют клоном. Когда клон развивается до такого уровня, что становится виден невооруженным глазом, такое скопление бактерий называют колонией.
Обычно культивирование бактерий, выделенных из различных источников, производят отдельно друг от друга. Каждую такую отдельно выращенную группу микробов называют штаммом. Так, если один вид стафиллококка выделен из трех источников (или разных порций одного и того же продукта, разных человек), говорят о трех штаммах этого вида стафилококка.
Факторы роста бактерий
К ним относят различные аминокислоты, липиды, пуриновые основания и другие соединения, необходимые для развития микроорганизмов. Некоторые микробы могут самостоятельно вырабатывать необходимые им вещества, а другим необходимо получать их в готовом виде. По потребности микроорганизмов в тех или иных ростовых факторах проводят идентификацию и дифференциацию бактерий. Также этот параметр важен для правильного изготовления питательной среды в целях проведения лабораторных и биотехнологических работ:
- Аминокислоты. Бактерии могут нуждаться в одной конкретной аминокислоте или какой-либо группе кислот. Так, клостридиям необходим лейцин и тирозин, стрептококкам - лейцин и аргинин. Микроорганизмы, которым для роста необходимо получение аминокислот извне, называют ауксотрофными.
- Пуриновые и пиримидиновые основания, а также их производные (аденин, гуанин и другие). Они являются важным фактором роста многих видов стрептококков.
- Витамины. Они входят в состав коферментов, требуемых бактериям. Так, никотиновая кислота, а также ее амид, входящие в состав НАД и НАДФ, нужна коринебактериям дифтерии, шигеллы. Тиамин, как составная часть пирофосфата, требуется золотистому стафилококку, пневмококку, бруцеллам. Пантотеновая кислота, входящая в кофермент КоА, требуется бациллам столбняка и отдельным видам стрептококка. Цитохромы, а значит, образующие их фолиевая кислота, гемы и биотин, необходимы микобактериям туберкулеза и гемофильным бактериям.
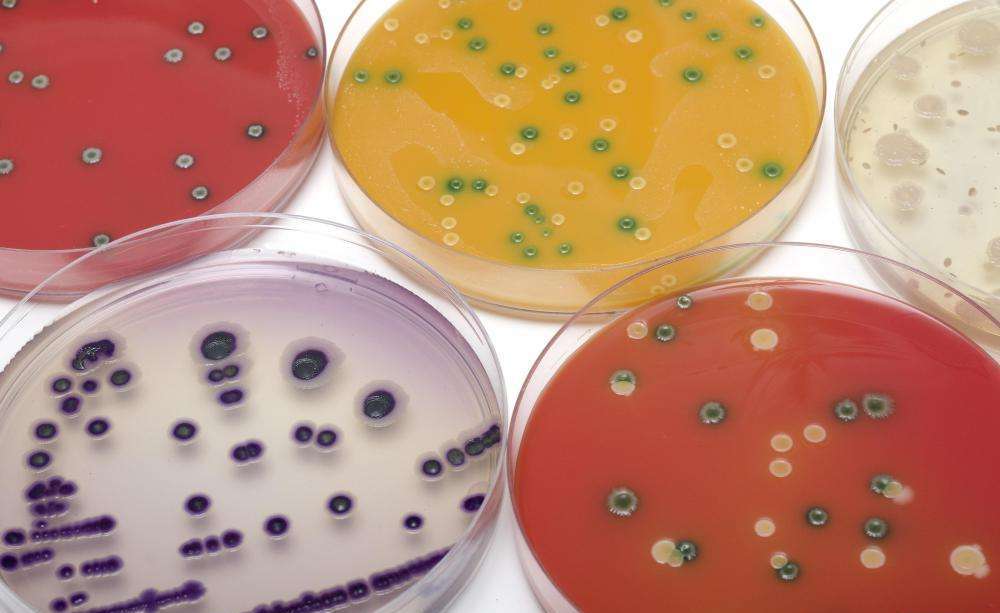
Требования к средам
Условия, предъявляемые к питательным средам для культивирования бактерий:
- Питательность. Они должны содержать вещества, причем находящиеся в легко усвояемом виде, необходимые микроорганизмам для питания и пополнения энергии. К ним относят органогены и минеральные вещества. Для некоторых микроорганизмов дополнительно необходимы витамины и аминокислоты, которые они не могут синтезировать.
- Оптимальный уровень рН. Он влияет на проницаемость клеточной оболочки и, соответственно, на возможность усвоения питательных веществ бактерией. Чаще всего значение водородного показателя должно быть на уровне 7,2–7,4. Многие микроорганизмы в ходе своей жизнедеятельности вырабатывают продукты с кислой или щелочной реакций, и для того, чтобы рН питательной среды не изменялся, она должна обладать буферностью.
- Изотоничность. Осмотическое давление в питательной среде для культивирования бактерий должно иметь те же значения, что и внутри микробных клеток. Обычно оно соответствует 0,5 % раствору NaCl.
- Стерильность. Связано это с тем, что появление посторонних бактерий исказит результаты изучения анализируемого штамма.
- Уровень влажности. Этот показатель наряду с консистенцией среды должен иметь оптимальные характеристики для конкретного вида бактерий.
- Окислительно-восстановительный потенциал (RH2). Он показывает соотношение веществ, которые отдают и которые принимают электроны, а также уровень насыщения кислородом питательной среды. Для аэробов и анаэробов условия культивирования бактерий несколько разнятся по данному показателю. Анаэробные микроорганизмы лучше всего размножаются при значениях RH2, не превышающих 5, а аэробные – не менее 10.
- Унифицированность. Важно, чтобы питательная среда содержала неизменные количества отдельных ее ингредиентов. Кроме того, предпочтительны прозрачные растворы, на которых легче отслеживать рост культуры или заметить ее загрязнение.
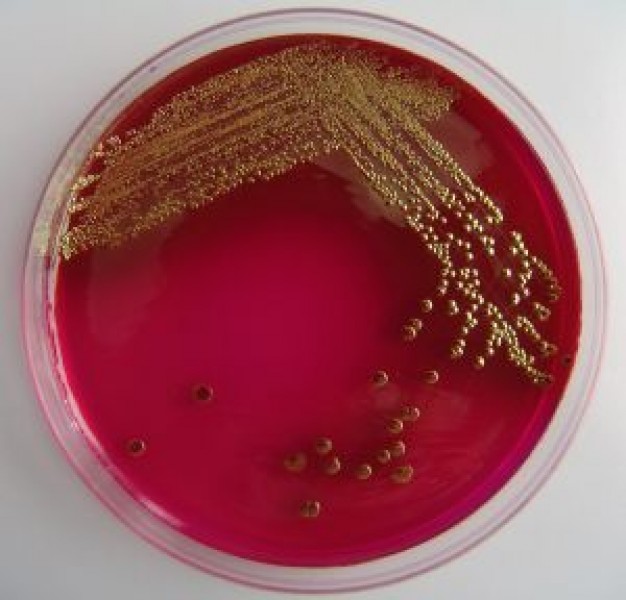
Виды питательных сред
На выбор той или иной среды для выращивания микроорганизмов влияет множество факторов, среди которых - особенности их питания и цели исследования. Основными признаками, положенными в основу классификации питательных сред, являются:
1. Компоненты. По исходным веществам, используемым для создания субстрата, различают:
- натуральные, которые готовятся из продуктов животного или растительного происхождения (например, мяса, молока, фруктов) и удобны для выращивания смешанных культур;
- полусинтетические, в которых дорогостоящие натуральные пищевые продукты заменены на непищевые (например, костную муку, сгустки крови), и которые оптимальны для культивирования бактерий отдельных видов или выделения из среды продуктов их жизнедеятельности;
- синтетические, которые готовятся из точных количеств химических соединений, имеют известный постоянный состав и легко воспроизводятся.
2. Консистенция (плотность). Различают среды:
Последние две готовят из специальных растворов или жидких веществ с добавлением агар-агара или желатина для создания необходимой плотности. Кроме того, плотной средой для роста бактерий является свернутая сыворотка крови, картофель, среды с силикагелем, каррагинан.
3. Состав. По данному признаку среды бывают:
- простые, список которых короток - это мясопептонный бульон (МПБ), бульон и агар Хоттин-гера, мясопептонный агар (МПА), питательный желатин и пептонная вода.
- сложные, приготовляемые из простых с добавлением крови, сыворотки, углеводов и другие веществ.
4. Назначение. Выделяют следующие питательные среды:
- основные служат для выращивания многих патогенных микробов (обычно простого состава);
- специальные применяют для выделения и культивирования бактерий, которые не растут на простых субстратах;
- элективные (они же избирательные) подходят для выделения конкретного вида бактерий и подавляют рост сопутствующих микробов (селективность создается путем прибавки к средам некоторых веществ, например антибиотиков или солей, или коррекцией рН);
- дифференциально-диагностические дают возможность отличить один вид бактерий от другого путем оценки ферментативной активности, например, среды;
- консервирующие нужны для первичного посева с последующей транспортировкой образцов, поскольку предотвращают отмирание микроорганизмов, а также подавляют рост других бактерий.
Приготовление питательных сред
Важнейшим этапом культивирования анаэробных бактерий является приготовление подходящей питательной среды. После того, как выбраны оптимальные параметры, переходят к следующим стадиям:
- взвешивание, путем отбора навески компонентов на аналитических весах;
- растворение, проводимое в подогретой до 70 °С дистиллированной воде, причем отдельно растворяют фосфаты, микро- и макросоли;
- кипячение, осуществляемое на водяной бане на протяжении двух минут;
- определение pH, выполняемое индикаторной бумагой или потенциометром;
- фильтрация, производимая через смоченный матерчатый или бумажный фильтры для жидких, а также расплавленных плотных сред, и через ватно-марлевый фильтр для агаровых;
- розлив, выполняемый на 3/4 емкости;
- стерилизация, зависящая от состава среды;
- контроль на стерильность осуществляется путем отстаивания в течение двух суток в термостате с последующим просмотром;
- химический контроль для установления рН и содержания необходимых элементов;
- биологический контроль путем пробного засева.
Стерилизация посуды и сред
Одним из основных принципов культивирования бактерий является стерильность. Рост и развитие посторонних микроорганизмов может повлиять на характеристики питательной среды путем изменения ее химического состава и рН. Стерилизация является главным условием выращивания чистых культур. На практике под этим термином подразумевают методы уничтожения абсолютно всех жизненных форм на поверхности и в объеме стерилизуемых объектов. Стерилизации подвергается посуда, применяемые инструменты, среды, а также другие предметы, используемые в ходе исследования.
Некоторые виды стерилизации:
- Прокаливание. Стерилизацию петель и игл для посева, предметных стекол, некоторого инструмента можно выполнять с помощью горелки или спиртовки.
- Кипячение. Годится для обработки шприцов, игл, пищевых продуктов, но не убивает споры бактерий.
- Сухожаровая стерилизация. Проводится в особом сушильном шкафу и подходит для обработки колб, пробирок и прочей лабораторной посуды.
- Стерилизация паром. Проводимый в автоклаве этот метод является высокоэффективным. Но он не годится для питательных сред, в состав которых входят белки или какие-либо другие соединения, разрушающиеся при высоких температурах. Более щадящей можно назвать тиндализацию. Она проводится в кипятильнике Коха и сочетает проращивание спор с их уничтожением.
- Пастеризация. Применяется для сред, меняющих свои свойства при кипячении (например, молоко, вино, пиво), способна избавить их от неспороносных микроорганизмов. Температура обработки составляет всего 50-60 °С на протяжении пятнадцати-тридцати минут. В некоторых случаях применяют холодную стерилизацию, осуществляемую с помощью фильтров или УФ-лучей.

Условия культивирования бактерий
Рост и развитие бактерий возможны лишь при определенных факторах и значениях каждого из них:
1. Температура. Различают три группы бактерий, отличающихся температурными предпочтениями:
- термофилы, или теплолюбивые микробы, растут при 45-90°С, а значит, не размножаются в организмах человека и животного;
- психрофилы, или холодолюбивые микроорганизмы, предпочитают температуру в интервале 5-15 °С и выращиваются в холодильных камерах;
- мезофилы, развиваются при температуре 25-37 °С, к ним относится основная масса бактерий.
2. Свет. Является особенностью культивирования бактерий-фототрофов, поскольку они осуществляют фотосинтетический процесс. Но для большинства микробов освещение не является обязательным условием. И даже наоборот, солнечный ультрафиолет может подавлять их развитие.
3. Вода. Всем микроорганизмам необходима вода в доступной (жидкой) форме. Вот почему в замороженных продуктах бактерии практически не развиваются.
4. Кислотность среды. Этот принцип культивирования бактерий уже был подробно разобран выше.
5. Аэрация. Кислород, как химический элемент, является составной частью воды и немалого количества соединений, применяемых для выращивания микроорганизмов. Газообразный кислород также может содержаться в воде и прочих жидкостях в растворенном виде. Существенная часть бактерий нуждается в постоянном поступлении молекул кислорода. Но ряду микроорганизмов он без надобности, или, хуже того, газообразный кислород токсичен для них, поскольку они не имеют каталазы и пероксидазы, разрушающих токсичные продуты дыхания. Поэтому важнейшим этапом культивирования анаэробных бактерий является удаление молекул О2 из питательной среды.
6. Культивирование микроорганизмов. Выращивание аэробных и анаэробных бактерий проводится в различных слоях среды и в разных режимах.
Выращивание аэробных микроорганизмов
Для культивирования аэробных бактерий требуется молекулярный кислород. Для получения чистых культур аэробов, которые можно успешно применять в медицине и пищевой промышленности, используются следующие методы:
- поверхностное выращивание на плотных средах или в жидких средах (их тонком слое), когда кислород поступает прямо из воздуха;
- глубинное культивирование в жидких средах, когда повышения количества растворенного в них кислорода добиваются путем постоянной аэрации.
Выращивание анаэробных микроорганизмов
Основным принципом культивирования бактерий этого типа является минимальный их контакт с кислородом воздуха. Обеспечить условия их роста гораздо сложнее, чем для аэробов. Для изоляции анаэробов от молекулярного О2 применяются следующие методы:
- Физические. Этот метод культивирования анаэробных бактерий сводится к их выращиванию в специальном вакуумном аппарате - микроанаэростате. Воздух в нем заменен на особую газовую смесь из азота с добавлением 10 % водорода и 5 % углекислого газа.
- Химические. К ним относятся: использование поглощающих агентов (например, Fe, Na2S2O4, CuCl) или восстанавливающих агентов (например, аскорбиновая кислота).
- Биологические. Сводится к совместному выращиванию аэробов и анаэробов в закрытой системе. Этот метод культивирования бактерий предполагает засевание одной половины чашки Петри каким-то из аэробных видов бактерий, а второй - изучаемым анаэробом. Развитие его начнется в тот момент, когда истратится весь кислород.
Для культивирования анаэробных бактерий подходят следующие способы посева:
- в поверхностном слое;
- в поверхностном слое с заливкой стерильным парафином;
- в толще плотной питательной среды;
- в глубинных слоях вязких сред.

Получение чистой культуры
Микробиологи в своей работе обычно имеют дело с образцами, заселенными множеством различных видов микробов. Однако для определения систематического положения микроорганизмов (семейство, род, вид), а также изучения их особенностей необходимо их изолировать и вырастить чистую культуру. Они имеют важнейшее значение во многих пищевых производствах, например, сыра, хлеба, кваса, вина и т. д. Культивирование молочнокислых бактерий позволяет получить важнейший компонент для производства кисломолочных продуктов, теста, какао, силоса и даже пластика.
Способ выделения чистой культуры в плотной среде основан на механическом отделении клеток микроорганизмов с последующим их изолированным выращиванием. Образец переносится в стерильный объем воды или физраствора (объемом 10—100 мл), а затем встряхивается на протяжении двух минут. Чтобы извлечь микроорганизмы, находящиеся в толще исследуемого материала (например, колбасы или сыра), сначала выполняют растирание кусочков образца стерильными инструментами с песком. Материал, прошедший предварительную подготовку, массой 1 г или объемом 1 мл разбавляют стерильной водой в 10, 100, 1000 и т. д. раз. Выбирают ту степень разведения, которая дает концентрацию клеток, соответствующую возможностям метода.
Последующее выращивание микроорганизмов заключается в подготовке питательной среды. Обычно выбирается плотная среда (МПА). Ее предварительно расплавляют и остужают до 45—50 °С, а уже потом разливают в несколько чашек Петри (три-пять штук), на дно которых помещены смывы с исследуемого вещества различных концентраций. Далее проводят перемешивание еще не застывшей питательной среды и внесенного в нее материала. Так добиваются фиксирования клеток в различных точках объема субстрата.
Далее чашки Петри помещают в термостат на 2 суток при 22 °С. За это время клетки размножаются до такой степени, что колония, образованная каждой из клеток, становится видна невооруженным глазом. Каждая из них является чистой культурой того вида бактерий, из клеток которого она выросла.
После этого с чашек Петри микроорганизмы пересевают в отдельные пробирки, наполненные питательной средой. Таким образом проводится выделение чистых культур из смешанного образца. Этот метод носит имя своего разработчика - Р. Коха. Также его принято называть чашечным методом, или истощающим посевом. После получения чистых культур различных видов бактерий выполняют установление их формы, обнаружение спор, семейства.
Все работы должны выполняться согласно принципам асептики. Чтобы избежать преждевременного развития микроорганизмов, исследование необходимо проводить сразу после отбора проб. Водопроводную воду анализируют после слива первых порций, поскольку в них могут находиться накопившиеся в трубах и кранах микробы. Микрофлора фруктов, ягод и овощей преимущественно размещена на поверхности (кожуре), поэтому выполняют смывы с нее. Для этого в стерильную емкость помещают плод и заливают его необходимым количеством воды. Затем их довольно энергично встряхивают и сливают воду в другую емкость. Посевы с матерчатых изделий также получают смывами, но предварительно из них вырезают кусочки заданного размера.
Выделение чистой культуры аэробных бактерий
В условиях естественного обитания чистые культуры микроорганизмов встречаются довольно редко. Тем не менее, основная часть современных представлений о свойствах бактерий, а также их взаимоотношениях получена при изучении чистых культур. Поэтому совершенно необходимой задачей является выделение чистых культур различных видов бактерий, существующих в естественных условиях. Для выделения чистых культур большинства бактерий обычно затрачивается не более 2-3 суток, однако для некоторых (например, бактерии туберкулеза), этот процесс может затягиваться до 4 - 6 недель.Чистой культурой микроорганизмов называют популяцию бактерий одного вида, представляющую потомство одной клетки.
Методы, применяемые для выделения чистой культуры:
1) Методы, основанные на принципе механического разделения микроорганизмов:
а) механическое разобщение бактериальных клеток на поверхности плотных питательных сред шпателем (по Дригальскому), рассев штрихами калиброванной петлей (по Гольду) или тампоном после забора им исследуемого материала;
б) метод фильтрации, основан на пропускании исследуемого материала через специальные фильтры с определенным диаметром пор и разделение содержащихся микроорганизмов по величине. Этот метод применяется главным образом для очистки вирусов от бактерий, а также при получении фагов и токсинов (в фильтрате - чистый фаг, очищенный токсин).
2) Метод, основанный на получении серийных разведении в жидкой среде с последующим высевом на чашки с агаром (метод пластинчатых разводок по Коху).
3) Методы, основанные на биологических свойствах микроорганизмов:
а) избирательном подавлении размножения сопутствующей микрофлоры при низкой температуре для получения культур психрофильных бактерий;
в) метод прогревания: позволяет отделить спорообразующие бациллы от неспоровых форм. Прогревают исследуемый материал на водяной бане при 80°С 10-15 мин. (При этом погибают вегетативные формы, а споры сохраняются и при посеве на соответствующую питательную среду прорастают);
г) бактериостатический метод (метод ингибирования): основан на различном действии некоторых химических веществ и антибиотиков на микроорганизмы - определенные вещества угнетают рост одних микроорганизмов и не оказывают влияния на другие, например, небольшие концентрации пенициллина задерживают рост грамположительных микроорганизмов и не влияют на грамотрицательные, смесь пенициллина и стрептомицина позволяет освободить нитчатые грибы и дрожжи от бактериальной флоры, серная кислота (5% раствор) быстро убивает большинство микроорганизмов, а туберкулезная палочка выживает в этих условиях;
д) метод заражения лабораторных животных или растений: основан на способности некоторых бактерий быстро размножаться в организме чувствительных к ним лабораторных животных (биопроба); применяют в целях выделения и идентификации патогенных микроорганизмов и отделения их от сапрофитной флоры; для заражения подбирают наиболее восприимчивые к предполагаемому возбудителю инфекции виды животных или сорта растений, после появления у зараженных организмов признаков болезни их убивают и производят посев органов и тканей на питательные среды. При выделении и изучении облигатных паразитов этот метод является основным и единственным.
Методы культивирования облигатных внутриклеточных бактерий (риккетсий, хламидий) и вирусов
Для культивирования вирусов (так же, как и для других облигатных паразитов - риккетсий и хламидий) используют куриные эмбрионы, культуры тканей и лабораторных животных.
Куриный эмбрион - удобная модель для культивирования вирусов в целях получения вирусов и для приготовления диагностических, профилактических и лечебных препаратов - диагностикумов и вакцин. Куриные зародыши используют в возрасте от 8 до 12 дней, перед заражением инфекционным материалом скорлупу яйца над воздушной камерой обрабатывают 70% спиртом, обжигают, смазывают йодом (2% настойка), вторично протирают спиртом и обжигают. Вируссодержащий материал, обработанный для удаления бактериальной флоры, в асептических условиях наносят на хорион-аллантоисную оболочку или вводят в желточный мешок, аллантоисную полость, либо в амнион (ткань эмбриона). После заражения в аллантоисную полость через отверстие заливают парафин; если материалом заражают хорион-аллантоис, отверстие в скорлупе закрывают стерильным покровным стеклом, края которого замазывают парафином. После инфицирования эмбрионы помещают в термостат при 37°С. Признаки репродукции вируса проявляются особенно четко в месте заражения на хорион-аллантоисной оболочке в виде очагов поражения и геморрагий или для его обнаружения применяют специальные реакции (например, реакцию гемагглютинации - РГА).
Культуры клеток (тканей) получают из тканей животных и человека. Их делят на первичные, которые используют в течение одной генерации, и перевиваемые, которые поддерживают путем пассажей (перевивок) длительное время. Клетки перевиваемой культуры ткани готовят из нормальных (чаще эмбриональных) и злокачественных линий клеток, они способны сравнительно прочно прикрепляться к стеклу флакона, образовывать монослой клеток и многократно размножаться in vitro. Для поддержания жизнеспособности клеток применяются специальные синтетические среды (например, среда 199, среда Хэнкса), содержащие аминокислоты, витамины, глюкозу, минеральные соли с добавлением 5 -10% коровьей или лошадиной сыворотки. Трипсин используется при получении культуры клеток для дезагрегации тканей, т.е. для разобщения клеток. Репродукция вирусов в культуре клеток сопровождается так называемым цитопатическим действием (ЦПД), которое проявляется в изменении морфологии клеток и их гибели или образования синцития, а в некоторых случаях - в возникновении в инфицированных клетках клеточных включений. Характер и время проявления ЦПД зависит от вида вируса.
Для создания моделей вирусных инфекционных болезней и выделения вирусов используют лабораторных животных (белых мышей, хомяков, крыс, кроликов и др.). Чувствительность животных к вирусам зависит от вида животного и его возраста.
Культивирование риккетсийРиккетсии являются облигатными паразитами, их культивирование возможно только в живых тканях. Обычно их выращивают в желточном мешке куриного эмбриона.
Культивирование хламидийХламидии можно размножать в желточном мешке куриного эмбриона или в культурах тканей позвоночных. Размножение в куриных эмбрионах происходит в температурных границах 33 - 41°С и даже более широких, но чувствительность к обеим крайним температурам и оптимум для роста варьирует от вида к виду.
Техника посева бактерий на питательные среды, выделение и идентификация чистых культур бактерийЧистую культуру бактерий получают для проведения диагностических исследований - идентификации, которая достигается путем определения морфологических, культуральных, биохимических и других признаков микроорганизмов.
Морфологические и тинкториальные признаки бактерий изучают при микроскопическом исследовании мазков, окрашенных разными методами, и нативных препаратов.
Культуральные свойства характеризуются питательными потребностями, условиями и типом роста бактерий на плотных и жидких питательных средах. Они устанавливаются по морфологии колоний и особенностям роста культуры.
Биохимические признаки бактерий определяются набором конститутивных и индуцибельных ферментов, присущих определенному роду, виду, варианту. В бактериологической практике таксономическое значение имеют чаще всего сахаролитические и протеолитические ферменты бактерий, которые определяют на дифференциально-диагностических средах.
При идентификации бактерий до рода и вида обращают внимание на пигменты, окрашивающие колонии и питательную среду в разнообразные цвета. Например, красный пигмент образуют Serratia marccescens, золотистый пигмент – Staphylococcus aureus (золотистый стафилококк), сине-зеленый пигмент – Pseudomonas aeruginosa (синегнойная палочка).
Для установления биовара (хемовара, серовара, фаговара) проводят дополнительные исследования по выявлению соответствующего маркера-определению фермента, антигена, чувствительности к фагам.
Посев уколом. Посев уколом в агар столбиком применяется для выращивания анаэробов или выявления характерного признака микроба, так как рост по уколу типичен для ряда бактерий. При посеве уколом в столбик желатины наблюдается разжижение ее бактериями, обладающими протеолитическим ферментом. Посев уколом в полужидкий агар практикуется также с целью длительного хранения культур.
При посеве уколом пробирку с агаром или столбиком желатины держат дном кверху, вынимают пробку и обжигают край пробирки. Материал, содержащий микробы, забирают обожженной на пламени платиновой иглой и прокалывают ею столбик питательной среды снизу вверх почти до самого дна пробирки
Посев петлей (посев штрихами). Берут одну чашку Петри с питательным агаром и делят ее на 4 сектора, проводя разграничительные линии на внешней стороне дна чашки. Исследуемый материал петлей вносят в первый сектор и проводят ею параллельные линии по всему сектору на расстоянии одна от другой около 5 мм. Этой же петлей, не изменяя ее положения по отношению к агару, проводят такие же линии на других секторах чашки. В том месте, где на агар попало большое количество микробных клеток, рост микроорганизмов будет в виде сплошного штриха. На секторах с небольшим количеством клеток вырастают отдельные колонии.
Выделение чистых культур бактерий по методу Дригальского. Берут 3 чашки Петри с питательной средой. В одну из чашек на питательный агар пастеровской пипеткой или петлей наносят каплю исследуемого материала и растирают стерильным шпателем по всей поверхности агара. Затем шпатель переносят во 2-ю чашку и втирают оставшуюся на шпателе культуру в поверхность питательной среды. Далее шпатель переносят в 3-ю чашку и аналогичным образом производят посев, после чего чашки помещаются в термостат. В последующем, в извлеченных из термостата чашках в зависимости от содержания микробных клеток в исследуемом материале на одной из чашек вырастают отдельные колонии различных бактерий, отличающиеся между собой по форме, цвету, величине, консистенции, пригодные для выделения чистой культуры микроорганизма. Отдельную (изолированную) "подозрительную", интересующую исследователя колонию снимают и засевают на скошенный агар. Из остатка колонии готовят микропрепарат и изучают при окраске по Граму. У выросших на скошенном агаре бактерий (как правило, одного вида) определяют биохимические, тинкториальные, антигенные свойства и делают заключение о выделенной культуре бактерий.
При выделении чистой культуры бактерий по Гольду, внесенной на один из 4-х секторов пластинчатого агара в чашке Петри, материал равномерно штрихами засевается по всему сектору и петля прожигается. Охлажденной петлей материал снимается с одного из штрихов первого сектора и переносится во второй, где производится равномерный штриховой посев, аналогичный первому. В третий и четвертый сектор посев делается соответственно из второго и третьего секторов аналогично засеву второго сектора.
После инкубации в термостате наиболее густой рост бактерий выявляется в области первых штрихов первого сектора. В каждом последующем секторе выявляется менее густой рост бактерий, чем в предыдущем, или рост отдельных колоний. Отдельную колонию отвивают на скошенный агар и идентифицируют по тинкториальным, биохимическим, серологическим свойствам.
Данный метод применяется в тех случаях, когда одновременно с выделением чистой культуры необходимо определить количество бактерий в исследуемом материале. Определение количества бактерий всех видов в 1 г (1 мл) материала производят по числу выросших на соответствующей среде колоний с учетом объема посевного материала и степени его разведения. Количество микроорганизмов в 1,0 г = n'а'b', где n - число колоний, выросших на питательной среде; а - коэффициент посевной дозы (при посеве 0,1 мл а=10, при посеве 0,05 мл а=20); b - степень разведения посевного материала.
Метод серийных разведений (пластинчатых разводок) по Кохутакже применяет для определения количества микробов в исследуемом материале, чаще всего в жидких средах.
Читайте также:


