Литература вирус бактерии антибиотики
Муниципальный конкурс научно-исследовательских работ
и творческих проектов учащихся
Исследовательская работа на тему:
имени Адмирала Ушакова
Руководитель: Яламова Е.В.
учитель МБОУ СОШ №2
имени Адмирала Ушакова
Геленджик 2016 г
Изучение вредных микроорганизмов:
в) сравнительный анализ.
Основные подходы к лечению.
Список использованной литературы.
Исследовать главные возбудители инфекционных заболеваний, их сходство, различие и главные подходы к их лечению.
Изучить вирусы и бактерии.
Исследовать различия методов лечения вирусных и бактериальных заболеваний.
Выяснить, в чем опасность для человеческого организма при неправильном лечении.
Определить методы профилактики.
Предположим, что человечество можно спасти от вымирания (т.е. от развития устойчивости к антибиотикам) грамотной диагностикой и правильным назначением лечения.
Объект исследования: вирусы и бактерии.
Подбор информации в интернете и в литературе.
Изучение собранных данных.
Анализ собранных данных.
Изучение вредных микроорганизмов.
Для того, чтобы мы начали разговор о главных возбудителях инфекционных заболеваний, стоит вначале сказать о том, что представляют из себя сами инфекционные заболевания. Итак, инфекционные болезни – это болезни, вызванные проникновением в организм вредных микроорганизмов, т.е. заражением . Вот об этих микроорганизмах и пойдет речь.
Начнем с вирусов. Вирусы – это неклеточные формы жизни, которые оживают только при контакте с живой клеткой. В переводе с латинского virus означает "яд, ядовитое начало". Вирус представляет собой микроскопическую частицу, состоящую из генетического вещества (молекул ДНК или РНК), которое окружено защитным слоем белка .
Так выглядит вирус под микроскопом.

Вне живого организма, вне клетки вирусы совершенно безобидны. Они не проявляют никаких признаков жизни: не питаются, не размножаются и не двигаются.
Его нельзя увидеть не только простым глазом, но и в очень сильный микроскоп. Некоторые под микроскопом выглядят как пауки, другие – как колючие мячики .
Попадая в здоровую клетку, вирус начинает быстро размножаться внутри нее и разрушает ее, а выброс вирусов из поврежденных клеток вызывает заболевание. Организм превращается в своеобразный завод по производству вирусов.
Вирусы поражают все типы организмов: человека, животных, растения. По предположениям учёных, существуют миллионы их видов. Вирусы являются самой многочисленной биологической формой. Изучением вирусов занимается наука вирусология , раздел микробиологии. Вирусы по своей сути – это паразиты , они могут жить и размножаться только в живых клетках. В чистом виде они существуют в форме кристаллов. По размеру вирусы гораздо меньше клеток и проще их по строению.
Бактерия — это самостоятельный, живой микроорганизм, состоящий из одной клетки. В среднем размер бактерии составляет около 0,001 мм в диаметре. Некоторые из них настолько малы, что их даже невозможно разглядеть в обычный микроскоп. Большинство бактерий бесцветно. Только немногие окрашены в пурпурный или в зелёный цвет.
Так выглядит бактерия под микроскопом.

Бактерии переносят низкие и высокие температуры и могут жить в самых экстремальных условиях. Например, единственные организмы, обнаруженные в Мертвом море, — это именно бактерии. В помещении в каждом кубометре воздуха содержится до 1 млн. бактерий.
Первые бактерии появились, вероятно, более 3,5 млрд лет назад и на протяжении почти миллиарда лет были единственными живыми существами на нашей планете.



Изогнутая в виде запятой


Бактерии отличаются по форме, в таблице мы привели основные
Размножение бактерий совершается путем деления ; каждая клетка получает поперечную перегородку и затем распадается на две новые. При благоприятных условиях это происходит очень быстро. И если ничего этому не мешает, одна бактерия может заполнить своим потомством громаднейшие пространства. Размножение продолжается до тех пор, пока есть питание.

Бактерии обитают везде: в почве, воздухе и даже в нашем организме. Большинство из них не причиняет вреда.
Полезные свойства бактерий:
Бактерии защищают наш организм.
Бактерии, вызывающие гниение мертвых растений и животных, разлагают мертвые ткани на простые соединения, без них земля покрылась бы бесполезным мертвым веществом, и не осталось бы места для живого.
Другие бактерии вызывают ферментацию. Сюда можно отнести скисание молока (кефир, йогурт и т.д.), брожение сладких фруктовых соков (вино), созревание сливок (сливочное масло), изготовление сыров.
Растения не могут жить без бактерий, которые соединяют азот с другими элементами, чтобы получать нитраты, используемые растениями.
Но есть и такие бактерии, которые могут вызывать болезни, их называют патогенами . Патогены проникают в организм с капельками влаги в воздухе, который мы вдыхаем, через порезы и царапины на коже, с пищей и питьевой водой. В теле болезнетворные бактерии питаются, размножаются и выделяют токсины, разрушающие клетки. Именно токсины вызывают у больного болезненные симптомы.
Определим сходства и различия наших микроорганизмов, а также болезней, которые они вызывают.

И вирусы, и бактерии не видны невооруженным глазом, хотя бактерии во много раз больше вирусов.
Бактерии иногда могут быть как полезными, а вирусы всегда вредные.
Бактерии могут размножаться самостоятельно, а вирусы – нет.
Бактерии имеют собственную клеточную структуру, а вирусы – нет.
Распространяются вирусы и бактерии примерно одинаково:
— воздушно-капельным путем: при кашле или чихании,
— с кожи на кожу: при прикосновениях и рукопожатиях,
— с кожи на продукты: при прикосновениях к пище грязными руками вирусы и бактерии могут попасть в кишечник ,
— через жидкости организма: кровь и слюну.
Некоторые болезни, вызываемые вирусами и бактериями, имеют схожие симптомы. А вот лечение бактериальных и вирусных заболеваний разное .
Основные подходы к лечению.
Вирусы и антибиотики? Антибиотики не действуют на вирусные инфекции . Эти лекарственные препараты можно использовать только для борьбы с вредными бактериями. Если болезнь, вызванную вирусом, лечить антибиотиком, т.е. применять его не по делу, то в человеческом организме возникнет привыкание к этому виду лекарств . А когда случится болезнь, требующая лечения этим самым антибиотиком, то он не поможет, потому что бактерии, живущие в организме человека, уже привыкли к этому лекарству и не боятся его. Лекарство не подействует, болезнь станет неизлечимой, и человек может погибнуть. Вот об этом и говорил ученый. Сейчас очень часто люди, схватив обычную простуду, глотают таблетки, не разбираясь в них. Антибиотики – очень сильное лекарство, мощное оружие. Только применять их надо грамотно.
Вывод. В ходе исследований я теоретически подтвердила свою гипотезу, что при грамотной диагностике и правильном лечении риск вымирания людей при развитии устойчивости к антибиотикам можно свести к минимуму.
Кирилл Стасевич, биолог
Какие слабые места антибиотики находят у бактерий?
Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.)
Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией
Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей.
Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном.
Почему же антибиотики не действуют на вирусы?
Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию.
До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии).
Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает.
Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль.
Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой.
Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки.
Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики.
Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен.
Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента.
Ликбез мы подготовили вместе с инфекционистом Викторией Валиковой, руководящей клиниками в Гватемале и Никарагуа. Естественно, он полон грубых упрощений.

Сергей Абдульманов
Кто такие вирусы?
Это такая офигеть какая маленькая форма жизни. Они повсюду, и их очень много. В литре обычной морской воды их примерно 250.000.000.000 штук. И каждый из них занят двумя вещами:
- Переработкой клеток на свои копии.
- Путешествиями в поиске новых клеток.

Мимивирус с размером кода 2,5 Мегабазы (бит четвертичной системы). Фото: public domain
Можно ли вылечить вирус антибиотиком?
Антибиотик почти ничего не сделает вирусу.
А что делает антибиотик?
Убивает бактерии! Вирусы и бактерии — это разные штуки. Вирус маленький (чаще всего) и больше похож на мини-робота. Бактерии — большие (в сравнении с ним) живые штуки. Антибиотики эффективны против них, но не против вирусов.
Если еще упростить, считайте антибиотики управляемым ядом, который уничтожает определенные формы жизни. К счастью, мы достаточно сильно отличаемся от патогенных бактерий, поэтому нас, как систему, он уничтожает медленнее.
Примерно 2,5 килограмма бактерий, если вы подходите под список Шиндлера (76,9 кг из расчета грузоподъемности лифта Шиндлер: 1000 кг на 13 персон).

картинка нашего состава из Nature
Там огромное разнообразие организмов, которые участвуют в критичных процессах от переваривания пищи до иммунитета. Если убрать из человека часть бактерий — он будет жить либо очень недолго, либо очень печально.
Да никак. Идет и мочит все по своему профилю.
Антибиотики широкого спектра действуют на как можно большее количество бактерий. Предполагается, что если у вас внутри есть что-то в небольшом количестве, что легко убить, то они помогут (поэтому их назначают после операций, для общей защиты). Второй вариант использования — когда это что-то опасное, но непонятно, что именно. Предполагается, что существенная потеря вашей микробиоты не так важна, как существенная потеря жизни.
Узкий спектр, как и широкий, тоже дает дисбиоз и прочие неприятные спецэффекты. На практике это кроме всего прочего означает, что принимая антибиотик не в тему, вы ослабляете организм, что делает его менее устойчивым к новым внешним микробиологическим угрозам.
Как антибиотики убивают микрофлору?
- Останавливают рост бактерий (например, макролиды, тетрациклины, левомицетин и так далее). Предполагается, что если бактерия не размножается, то скоро она умрет по естественным причинам — либо уже пора, либо ее рано или поздно нащупает и добьет наш иммунитет.
- Убивают сами бактерии (пенициллины, цефалоспорины, фторхинолоны аминогликозиды, например) за счет прямых атак (например, разрушения их стенок), нарушения их среды.
Не бывает лекарств с одним четким действием, это биохимия, тут всегда мир, полный сюрпризов и сложных взаимосвязей. Просто запомните: если заболевание вирусное, лечить его в подавляющем большинстве случаев антибиотиком имеет смысл только тогда, когда вы желаете пациенту побыстрее умереть. И, желательно, мучительно.
Почему тогда назначают антибиотики при вирусных заболеваниях?
По двум причинам:
- Либо непонятно, что за патоген вызвал болезнь.
- Либо вирус часто ослабляет организм так, что цепляется бактериальная инфекция.
Общие тезисы лечения инфекций:
Виктория Валикова, врач-инфекционист, основатель клиник в Никарагуа и Гватемале
«В реальности это выглядит так: почти всегда врач перестраховывается и назначает антибиотик в схеме лечения. В маленьких больницах и поликлиниках нужно долго ждать анализы. Да, конечно, в крупном центре в Москве можно получить лабораторные анализы сразу, но часто даже время посева нельзя терять. Да, опытный врач может легко определить тип возбудителя. Например, схожи проявления симптомов на горле у гриппа, ОРВИ или герпеса. Специалист определяет тип возбудителя верно примерно в 90% случаев. В части случаев происходят ошибки. В части случаев может быть параллельное заболевание, сразу две инфекции.
Вторая особенность — и в России, и в Бельгии, и в Африке мы часто изначально назначаем несколько препаратов, чтобы человек повторно не шел к врачу, чтобы предотвратить возможные частые осложнения.
Например, в ряде схем по COVID-19 есть макролиды — они нужны, потому что в результате всего происходящего есть высокая вероятность поймать стафилококка, который только и ждет удачной возможности. Будет как-то глупо вылечиться от коронавируса, чтобы затем сразу умереть от вторичной инфекции, поэтому с ней тоже надо бороться. Но вовремя и под контролем.

Магазин в Микронезии, в котором можно купить лекарства. Фото: Сергей Абдульманов
Были женщины, которые не знали, что они беременны. У одной 4 месяца не было месячных, она все равно ходила на рынок и покупала что-то от цистита. Судя по описанию, ципрофлоксацин. По итогу родился ребенок с дефектом. Не знаю, от этого или потому что наследственность, у нас тут генетических тестов родителей нет. Доксициклин тут тоже часто попадается, он вызывает серьезные дефекты костной ткани.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
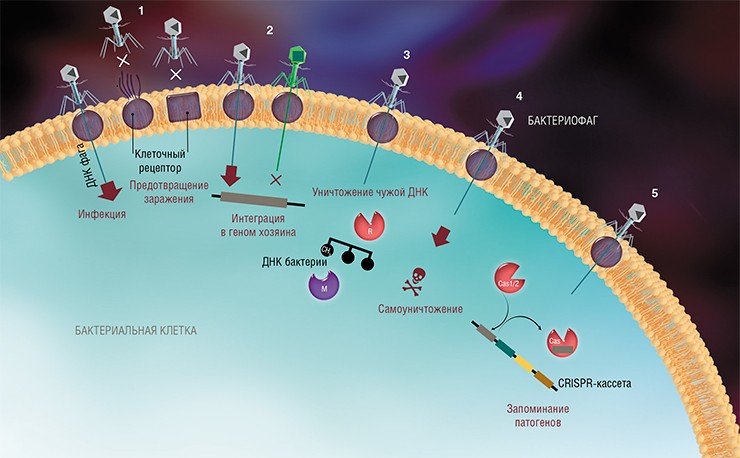
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Читайте также:


