Матриксный белок вируса что это
Особенности структуры матриксного белка М1 вируса гриппа, определяющие его полифункциональность на различных этапах жизненного цикла вируса НИР
- Руководитель НИР: Баратова Л.А.
- Участники НИР: Кордюкова Л.В., Ксенофонтов А.Л., Радюхин В.А., Федорова Н.В.
- Подразделение: Отдел хроматографического анализа
- Срок исполнения: 28 марта 2013 г. - 31 декабря 2015 г.
- Номер договора (контракта, соглашения): 13-04-00290-а
- Номер ЦИТИС: 01201355559
- Тип: Фундаментальная
- Приоритетное направление научных исследований: Структура и функционирование клетки. Межклеточные взаимодействия. Молекулярные механизмы клеточной дифференцировки, иммунитета и онкогенеза. Взаимодействие вирус-клетка.
- ПН России: Науки о жизни
- Направление технологического прорыва России: Медицинские технологии и лекарственные средства
- Рубрики ГРНТИ:
- 31.23.27 Пептиды, белки
- 34.15.15 Пространственная структура и свойства биополимеров
- 34.15.31 Молекулярная биология вирусов
- Ключевые слова: вирус гриппа, матриксный белок м1
- Описание:
Вирусное инфицирование – многостадийный процесс, обеспечивающий как проникновение вирусного генома внутрь клетки, так и морфогенез дочерних вирионов. М1 белок вируса гриппа – мажорный белок, играющий круциальную роль во многих аспектах репликации вируса. Согласно общепринятой модели вирусной сборки М1 белок внутри вириона ассоциирован с мембраной и слой белка стабилизирован рядом белок-белковых и липид-белковых взаимодействий. На ранних стадиях инфицирования в результате белок-липидных трансформаций происходит деполимеризация слоя М1 белка, что делает возможным выход вирусных РНК в цитоплазму клетки. Однако структурный аспект всех этих взаимодействий изучен явно недостаточно. Что тормозит наше продвижение в понимании процессов молекулярных перестроек в вирионе, приводящем к инфицированию клеток? Во-первых, отсутствие детальной структурной информации об in situ пространственной организации полноразмерного белка М1 в составе вириона, а, значит, и отсутствие корректных представлений об участках мономеров белка М1, ассоциированных с вирусной мембраной. Во-вторых, крайне слабо изучена структурно-функциональная роль взаимодействий М1-М1, М1-НА, М1-НА-липидная мембрана в формировании функционально компетентных вирионов. И наконец, тот факт, что белок М1 является ключевой адаптерной молекулой между вирусными белками и компонентами клетки хозяина в процессе вирусной репликации, взаимодействие между которыми еще очень слабо изучено. Проект направлен на решение следующих трех основных задач. Во-первых, это изучение структурных особенностей белка М1, определяющих его полифункциональность. Мы придаем высокую значимость поиску и изучению у белка М1 участков, которые могут пространственно трансформироваться в процессе жизненного цикла вируса и обеспечивать ключевые роли во многих аспектах вирусной репликации. Мы планируем также наладить гетерологичную экспрессию белка М1 в Е. coli и далее использовать сайт-направленный мутагенез гена белка М1 с внесением изменений в проблемной области (с 154 по 174 аминокислотный остаток) с последующим изучением влияния произведенных изменений на возможность кристаллизации и проявление специфических активностей белка. Вторая задача непосредственно связана с изучением функционального ассоциативного комплекса между М1 белком и его функциональным партнером, неструктурным вирусным белком NS2, имеющим сигнал ядерной локализации. Постулируется, что формирование этого комплекса определяет экспорт из ядер инфицированных клеток вновь синтезированных РНП-частиц для сбора дочерних вирионов. Третья задача связана с исследованием тонких взаимодействий матриксного белка М1 с липидным бислоем. С этой целью мы планируем постановку экспериментов с использованием плоских мембраноподобных моделей, так называемых бицелл, предполагаем исследовать поверхностную полимеризацию белка М1 в растворе и на различных подложках. И наконец, на примере уже полученного в России так называемого холодо-адаптированного штамма вируса гриппа с мутацией в одном их холестерин связывающих консенсусов белка М1, мы планируем изучить его базовые характеристики, такие как способность к сборке вирионов, почкование, инфекционность и другие особенности в сравнении с природным штаммом вируса гриппа.
ИК РАН Соисполнитель ИХФ РАН Соисполнитель грант РФФИ Для прикрепления результата сначала выберете тип результата (статьи, книги, . ). После чего введите несколько символов в поле поиска прикрепляемого результата, затем выберете один из предложенных и нажмите кнопку "Добавить".
Вирус гриппа человека выделен в 1933 г. Смитом, Эндрюсом и Лейдлоу путем заражения хорьков смывами носоглотки больного гриппом Вильсона Смита (отсюда название первого штамма WS).
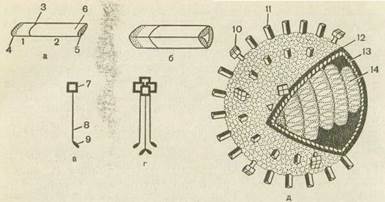
Морфология. Вирус имеет сферическую форму, диаметр вирусной частицы 80—120 нм (см. рис. 7, а). В препаратах свежевыделенных от больного вирусов встречаются нитевидные формы значительной длины. Вирус содержит липопротеидную оболочку, покрытую шипи-ками длиной около 10 нм. Шипики образованы двумя гликопротеидами — гемагглютинином и нейраминидазой. Шип гемагглютинина образован тремя молекулами белка, шип нейраминидазы образован четырьмя молекулами белка (рис. 43).
Внутренним компонентом вирионов является нуклео-капсид спиральной симметрии с диаметром около 9 нм. Он уложен в виде двойной спирали с диаметром 50—60 нм с односпиральной петлей на конце.
В соответствии с 8 фрагментами генома имеется 8 фрагментов нуклеокапсида. В составе вирионов между фрагментами существует слабая связь.
Химический состав и физико-химические свойства.Вирус содержит по массе 1—2%РНК, 50—70% белков, 18—37% липидов, 5—9% углеводов. Липиды содержатся в липопротеидной оболочке, углеводы — в составе гликопротеидов. И липиды и углеводы имеют клеточное происхождение.
![]()
Рис. 43. Строение вириона гриппа (схема). а—мономер гемагглютинина: 1—малая субъединица гемагглютинина; 2— большая субъединица гемагглютинина; 3— место нарезания гемагглютинина-. предшественника; 4— С-конец малой гемагглютинирующей субъединицы, погруженный в липиды; 5— N-конец большой гемагглютинирующей субъединицы, взаимодействующий с рецепторами клетки; б— антигенная детерминанта;
6 — тример гемагглютинина; в — мономер нейраминидазы; 7— гидрофильный участок нейраминидазы; 8 — стержень нейраминидазы; 9 — гидрофобный участок нейраминидазы; г — тетрамер нейраминидазы; 10 — нейраминидаза в составе вириона; 11—гемагглютинин в составе вириона; 12—липидный бислой наружной оболочки вириона; 13 — слой матриксного белка; 14 — рибонуклеопротеид.
Молекулярная масса вирусной частицы 250- 10 6 , плавучая плотность в сахарозе 1,19 г/см 3 . Фрагменты нуклеокапсида имеют длину от 50 до 130 нм; плавучая плотность нуклеокапсида в хлориде цезия 1,34—1,35 г/см 3 .
Определена первичная структура всех генов вируса гриппа.
Белки, антигены. В составе вируса гриппа содержится 7 белков.
Мономер гемагглютинина имеет форму палочки длиной 14 нм и диаметром 4 нм, которая одним концом (С-конец легкой цепи) погружена в липидный бислой (рис. 44). Субъединица гемагглютинина представляет собой тример.
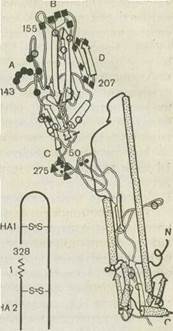
Гемагглютинин синтезируется в виде предшественника, который нарезается протеолитическими ферментами на две субъединицы, тяжелую цепь (НА1) и легкую (НА2) с молекулярными массами примерно 50 000 и 25 000, связанные дисульфидными связями.
С помощью рентгеноструктурного анализа кристаллизованного НА, сделанного Д. Скейлом с соавт., предложена его пространственная модель. Согласно этой модели в тримере НА обнаруживаются два структурных участка — стебель и глобула. Глобула содержит антигенный и рецепторный участки (см. рис. 44). Она состоит только из НА1, а стебель — из обеих субъединиц (НА1 и НА2).
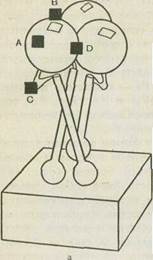
Обнаружено четыре предполагаемые зоны антигенов А, В, С, D. Зона антигена А является петлей, которая образуется между тримерами. Эти зоны соответствуют четырем антигенным детерминантам. Все они связаны с тяжелой цепью гемагглютинина. Две из них являются последовательными, а две образуются при взаимодействии мономеров. Третья обусловлена третичной структурой, четвертая — четвертичной структурой и формируется путем взаимодействия трех мономеров (см. рис. 44). Наиболее активными антигенными детерминантами являются 1-я и 2-я.
Гемагглютинин является основным специфическим антигеном вируса, определяющим, наряду с нейрамини-дазой, подтип вируса и вызывающий образование про-тективных антител. Свойство гемагглютинина,к антигенной изменчивости обусловлено двумя генетическими процессами — дрейфом и шифтом. В результате' дрейфа происходят незначительные изменения генаНА, обусловленные точечными мутациями, а - антигенные свойства
![]()
![]()
Рис. 44. Гемагглютинин вируса гриппа.
а — тример с четырьмя антигенными детерминантами (черные квадратики^ и участком взаимодействия с клеточным рецептором (белый квадратик — рецепторный карман); б — структура мономера по данным рентгеноструктур-ного анализа. Цифры обозначают порядковый номер аминокислот, кружки, квадраты и треугольники—4 антигенные детерминанты (А, В, С и D), 1—' место нарезания предшественника (N-конец. малой субъединицы), S-S-дисуль" фидные связи.
меняются незначительно, но при продолжительном периоде циркуляции вируса под влиянием коллективного иммунитета селекционируются варианты, значительно отличающиеся по антигенным свойствам от прототипного штамма. Шифт возникает в результате полной смены гена и обусловлен их пересортировкой при одновременной репродукции в клетке двух вирусов гриппа.
Вирус агглютинирует эритроциты кур, морских свинок, человека и многих других видов животных. При низких значениях рН (5,0—5,5) вирус вызывает гемолиз эритроцитов.
Нейраминидаза является ферментом, катализирующим отщепление сиаловой кислоты от субстрата. Мономер нейраминидазы под электронным микроскопом имеет вид
барабанной палочки и состоитиз головки, обращенной кнаружи, размером 4Х4Х4 нм и ножки длиной 10 нм. Соединение двух мономеров происходит за счет дисуль-фидных связей, а двух димеров в тетрамере — за счет межмолекулярных связей. Активные центры и антигенные детерминанты находятся на головках мономеров.
Нейраминидаза может изменяться независимо от гемагглютинина, в основе антигенной изменчивости также лежат процессы дрейфа и шифта. Антитела против нейраминидазы не оказывают такого защитного действия, как антитела против гемагглютинина, однако, они частично нейтрализуют вирус и ослабляют инфекционный процесс.
Нуклеопротеид (NP) — основной внутренний белок вируса, формирующий субъединицы капсида.Он интимно связан с геномом в течение всего периода репродукции вируса, но не препятствует экспрессии генома. Этот белок является типоспецифическим антигеном, общим для всех вирусов типа А. Антитела к NP не оказывают защитного действия и применяются с целью диагностики инфекции.
Матриксный белок — самый низкомолекулярный белок в составе вириона, локализованный на внутренней поверхности липопротеидной мембраны вируса. m|-белок играет роль медиатора при сборке вирусной частицы. Mi-белок является стабилизирующим фактором, при его отсутствии или уменьшении концентрации вирусная частица становится хрупкой и быстро распадается.
Матриксный белок, как и NP, является типоспецифическим антигеном, общим для всех вирусов типа А. Белок М2, который кодируется тем же седьмым геном, является неструктурным и локализован в клеточной оболочке.
Белки ns] и NSz — неструктурные вирусные белки, которые хотя и кодируются одним (восьмым) геном, имеют уникальные последовательности аминокислот благодаря трансляции со сдвигом рамки. Белок ns) синтезируется на самых ранних этапах репродукции. В ядре и цитоплазме он накапливается в больших количествах и образует включения.
Чувствительность к физическим и химическим факторам. Вирус гриппа относительно стабилен и может сохраняться при температуре 4° С в течение недели. Инфекционная активность сохраняется продолжительное время при хранении при температуре —70° С. Прогревание при температуре 50—60° С уничтожает его активность
в течение нескольких минут. Вирусы чувствительны к эфиру, детергентам. При низких значениях рН (3,0 и ниже) инфекционная активность теряется.
Репродукция. Вирус адсорбируется на клеточных рецепторах, содержащих сиаловую кислоту (гликопро-теидах или ганглиозидах). Проникновение вируса в клетку Осуществляется обычно по механизму рецепторного Эндоцитоза с последующим слиянием вирусной мембраны со стенкой вакуоли и выходом нуклеокапсида в цитоплазму, а затем в ядро. Слияние происходит при низких значениях рН, которые создаются в эндоцитарной вакуоли — рецептосоме. Транскрипция и репликация генома происходят в ядре в составе нуклеокапсида.
На ранней стадии с наибольшей скоростью синтезируются иРНК для белков NS и NP, на поздней стадии — иРНК для белков НА, NA, М. Соответственно белки NS и NP являются ранними, а НА, NA и М — поздними. Белки Р синтезируются на протяжении инфекционного цикла с одинаковой скоростью.
Нуклеокапсиды транспортируются из ядра в цитоплазму и затем к клеточной оболочке к тем ее модифицированным участкам, на которых снаружи находятся вирусные гликопротеиды, а со стороны цитоплазмы — Mi-белок. Вирус выходит из клетки путем почкования.
Патогенез и клиника. Вирус гриппа попадает в организм через дыхательные пути вместе с каплями влаги и частицами пыли. Чем меньше величина капель и частиц, тем глубже проникает вирус в дыхательные пути. Благодаря короткому инфекционному циклу вируса (6—8 ч) при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 ч количество инфекционного потомства достигает 10 3 , а к концу первых суток — 10 27 . Эти расчеты объясняют столь короткий инкубационный период при гриппе — 1—2 сут. Репродукция вируса происходит в клетках эпителия слизистой оболочки дыхательных путей.
Может развиться первичная пневмония с некрозом Эпителия бронхиол. Пораженные клетки отторгаются, а продуктыих распада всасываются, попадают в кровь, вызывая интоксикацию организма и лихорадочное состоя
ние. Вирус проникает в кровь и разносится по всему организму. Активация вирусом всей системы протеолиза и повреждение клеток эндотелия капилляров приводит к повышенной проницаемости сосудов, кровоизлияниям и дополнительному повреждению ткани. Возникают патологические изменения в почках, мозге. В результате повышенной проницаемости сосудов может возникнуть отек мозга с летальным исходом. Это случай так называемого молниеносного гриппа, когда смерть наступает на 2—3 сут. Вирус гриппа, попадая в кровь, вызывает угнетение кроветворения и иммунной системы, развивается лейкопения, может присоединиться интеркурентное заболевание, наблюдаются осложнения, вызванные бактериями и другими вирусами — затяжные риниты, гнойные синуситы, отиты, вторичные вирусные бронхиты и. пневмонии.
Для клинического течения гриппа характерно быстрое развитие инфекции с высокой температурой, общей интоксикацией, воспалительными процессами в дыхательных путях. Температура достигает 38—39° С и более. Общая интоксикация выражается в головной боли, боли в глазных яблоках, резком угнетении. Развиваются симптомы местного поражения дыхательных путей — насморк, кашель, боли за грудиной. Поражение эндотелия стенок кровеносных сосудов приводит к точечным кровоизлияниям в верхних дыхательных путях, трахее, бронхах. Если развивается первичная гриппозная пневмония, она имеет геморрагический характер, и мокрота содержит прожилки крови.
Иммунитет. Пассивный иммунитет, передаваемый от матери, сохраняется у детей на протяжении первых месяцев жизни. После перенесенного заболевания возникает стойкий иммунитет.
Повторные заболевания гриппом обусловлены не кратковременностью иммунитета, а появлением новых серовариантов вируса гриппа, против которых у населения нет иммунитета.
В иммунитете против гриппа большую роль играют антитела классаIgA, накапливающиеся в секрете слизистой оболочки полости носа.
Эпидемиология. Эпидемиология гриппа своеобразна и не имеет аналогов среди других инфекционных заболеваний. Грипп передается воздушно-капельным путем. Больной или носитель (часть зараженных переболевает гриппом в инаппарантной или стертой форме) выделяют вирус вместе со слизью носоглотки и верхних дыхательных путей не только при кашле и чиханье, но и при разговоре. Так как инкубационный период болезни очень короток и не превышает 1—2 дней, то возникшая эпидемия распространяется довольно быстро, охватывая все новые и новые восприимчивые контингенты населения. Дальнейшее развитие эпидемии регулируется иммунитетом, который развивается после болезни через 1—1 '/2 нед, и поэтому по мере нарастания иммунной прослойки эпидемия гриппа идет на убыль. В условиях даже большого города на это уходит около месяца, а при нынешних широких связях между странами и быстрых транспортных средствах эпидемии гриппа в течение немногих месяцев охватывают население многих стран, нередко — все полушарие или даже всю планету. Такие обширные эпидемии называются пандемиями.
Причиной повторных эпидемий гриппа и повторных заболеваний является уникальная изменчивость белков вирусов гриппа (гемагтлютинина и нейраминидазы) в результате шифта и дрейфа. Люди, болевшие ранее гриппом, полностью восприимчивы к новому сероварианту вируса, к которому нет коллективного иммунитета, он начинает безудержно распространяться среди населения всего земного шара, вызывая пандемию гриппа.
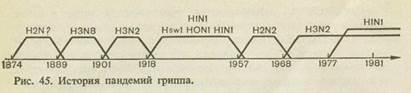
' Первая достоверно документированная пандемия гриппа (ретроспективно мы знаем, что это был грипп типа А) возникла в 1889 г. Предполагается, что она началась в Китае, а затем в течение ближайших 1 '/2— 2 лет распространилась на все страны мира.
Следующая пандемия гриппа возникла через 29 лет — в 1918 г. За два года она распространилась во все страны мира и от нее погибло около 20 млн. человек. Никогда до этого и после этого грипп не протекал так тяжело.
![]()
вирусы были выделены летом 1977 г. в Китае. История пандемий показана на рис. 45.
Начав циркулировать среди населения, новый вариант вируса не остается стабильным: его гликопротеиды НА и NA из года в год претерпевают антигенный дрейф, который приводит к тому, что через 2—3 года, а иногда и ранее выработанный иммунитет обеспечивает лишь частичную защиту от заболевания. Коллективный иммунитет (иммунологический пресс) является тем фактором, в результате которого селекционируются новые антигенные варианты, т. е. является движущей силой антигенного дрейфа.
По основному вопросу — источнику появления новых вариантов вируса гриппа в результате шифта — существуют две основные концепции. Согласно одной из них варианты, исчезнувшие из человеческой популяции, на самом деле продолжают циркулировать среди населения. Фактов, подтверждающих это предположение, нет. Другая гипотеза объясняет появление новых антигенных вариантов возвращением в человеческую популяцию вирусов, циркулирующих у животных. Во время эпидемии человек массивно выделяет вирус гриппа в биосферу и эпидемии и пандемии гриппа обычно сопровождаются эпизоотией среди домашних и диких животных, особенно птиц. Установлены экологические и эволюционные связи между вирусами человека и животных, и (благодаря секвени-рованию гена гемагглютинина) природа шифтов, которые привели к появлению азиатского и гонконгского серо-вариантов вирусов. Азиатский вирус сохранил четыре гена своего предшественника H1N1 — гены р|, Р2, Рз и NP, и получил новые четыре гена от предполагаемого партнера — гены НА, NA, M и NS. У гонконгского вируса H3N2 остались неизменными семь генов предшественника и только один ген НА был заменен в ходе рекомбинации. Возможными источниками этого гена были названы два вируса: вирус Hav7Neq2, выделенный от уток на Украине, и вирус Heq2Neq2, выделенный от лошадей в Майами (США).
Лабораторная диагностика. Материалом для исследования является отделяемое носоглотки, которое берут в первые 3 дня болезни ватными или марлевыми тампонами с задней стенки глотки, и мазки-отпечатки слизистой оболочки носовой полости. В летальных случаях используют кусочки пораженной легочной ткани, соскоб слизистой оболочки трахеи и бронхов.
Быстрая диагностика основана на выявлении вирусного антигена в эпителии слизистой оболочки верхних дыхательных путей. Наиболее широко используют метод ИФ. Антиген выявляют в мазках-отпечатках или эпителии, полученных из отделяемого носоглотки с помощью прямого и непрямого методов, используя коммерческие флюоресцирующие иммуноглобулины. Специфический антиген обнаруживается в цитоплазме в виде ярко светящихся конгломератов. Серологический вариант вируса гриппа (типов А, В или С) можно определить с помощью ИФ. Разработаны методы быстрой диагностики с помощью непрямой иммуноферментной реакции, основанные на идентификации типоспецифических антигенов (M и NP) в смывах носоглотки больных.
Выделение вируса. В связи со сменой серо-вариантов вируса гриппа желательно выделение его при вспышках и эпидемиях. Основным методом выделения вируса гриппа из смывов носоглотки является заражение 10—11-дневных куриных эмбрионов в амнион.
Идентификацию вируса проводят в РТГА или в РСК.
В сыворотках животных содержится большое количество неспецифических ингибиторов гемагглютинации, как термолабильных, которые разрушаются при прогревании сывороток при температуре 58°С, так и термостабильных. Вирусы гриппа могут быть как чувствительными, так и устойчивыми к ингибиторам. В первом случае иммунные сыворотки для удаления ингибиторов обрабатывают углекислотой, перийодатом калия или фильтратом холерного вибриона. Вирусы гриппа агглютинируют эритроциты с разной интенсивностью (авидностью) и в зависимости от этого их делят на авидные и неавидные штаммы. Для неавидных штаммов лучше использовать эритроциты человека группы 0. Для выделения вируса используют также культуры клеток эмбриона человека (почек и легких), почек обезьяны, МДСК и др. Индентификацию вируса проводят в РТГА, ИФ.
Серологическая диагностика заключается в обнаружении прироста антител в парных сыворотках больных. Используют РСК и РТГА, в качестве антигенов используют стандартные диагностикумы. Во второй сыворотке больного может быть обнаружен прирост антител сразу к двум или большему количеству используемых антигенов. В этом случае возбудителем заболевания считают тот штамм, к которому во второй сыворотке выявлен наивысший титр антител. Серологическую диагностику осуществляют также с помощью РН и ИФ в культуре клеток, реакции преципитации в геле, РРГ, ИФА. В РН используют наиболее чувствительные к вирусу культуры клеток почек собаки (MDCK) или быка (MDBK), а также клетки почек человека и обезьяны.
в сутки в течение 2—3 дней. Лечение следует начинать как можно раньше после начала заболевания. Для лечения и профилактики гриппа используют интраназальное введение интерферона.
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Все представители царства Vira имеют разнообразную форму и размеры, которые колеблются в диапазоне от 20нм (у самых маленьких пикорнавирусов до) до 400нм (крупных поксвирусов). Они могут иметь сферическую, многогранную, палочковидную, пулевидную, нитевидную, булавовидную формы.
Различают просто устроенные (простые, безоболочечные вирусы) и сложно устроенные (оболочечные вирусы). У тех и у других в центре находится молекула нуклеиновой кислоты (РНК или ДНК), окруженная белковой оболочкой капсидом. Вся такая структура называется нуклеокапсид.
Защитная белковая оболочка-капсид состоит из множества однородных белков субъединиц. Такое строение капсида имеет большой биологический смысл, так как при такой укладке расходуется сравнительно мало генетической информации, что очень важно для вирусов, обладающих маленькими размерами генома . Нуклеокапсиды вирусов построены по спиральному или кубическому и смешанному типу симметрии в зависимости от расположения белковых субъединиц.
Спиральный тип укладки капсомеров наиболее надежно защищает нуклеиновую кислоту вируса, а кубический тип – рыхлая укладка: у таких вирусов быстро происходит депротеинизация (разрушение оболочки) в фагосоме клетки.
Химический состав вириона. Основные компоненты вирусов нуклеиновая кислота и белки. Простые вирусы состоят только из них. В состав сложных вирусов дополнительно входят липиды и углеводы.
В зависимости от типа НК вирусы подразделяются на ДНК-геномные и РНКгеномные . Для вирусных НК в отличие от клеточных характерно большое разнообразие строения и форм, различиющееся у разных вирусов.
ВИРУСНЫЕ НК.
Вирусные ДНК обычно бывают двунитевыми, реже однонитевыми. Двунитевые ДНК бывают: линейными с замкнутыми концами, линейные с незамкнутыми концами, циркулярно-замкнутые (кольцевидные), циркулярнозамкнутые с одной неполной нитью ДНК.
На концах ДНК имеются прямые или инвертированные (повернутые на 180 градусов) повторы. Они представлены теми же нуклеотидами, которые располагаются в начальном участке ДНК. Нуклеотидные повторы являются своеобразным маркерами, позволяющими отличить вирусную ДНК от клеточной. Функциональное значение этих повторов состоит в способности замыкаться в кольцо. В этой форме она реплицируется, транскрибируется, может встраиваться в клеточный геном.
Вирусные РНК чаще однонитевые, но имеются и двунитевые РНК с фрагментированным геномом. РНК бывают: цельные линейные, фрагментированные линейные, кольцевые сигментированные.
Различают РНК с + геномом (плюс РНК) и отрицательным геномом минус РНК. Плюс РНК одновременно выполняет функции генома и информационной РНК (и-РНК), которая служит матрицей для синтеза дочерних геномов. Минус РНК свойственна только геномная функция, т.е. она служит матрицей для синтеза как геномной, так и и- РНК.
Вирусные РНК состоят из нескольких фрагментов (например, РНК вируса гриппа) или представлены нефрагментированной молекулой ( РНК парамиксовирусов).
У двунитевых как ДНК, так и РНК содержащих вирусов информация обычно записана в одной цепи. Однако, существуют вирусы, у которых информация может быть частично закодирована и во второй цепи. Таким образом, достигается экономия генетического материала.
ФУНКЦИИ НК
1. хранитель генетической информации (независимо от типа НК);
2. функция и РНК у РНК + нитей.
Вирусные белки подразделяются на структурные ( VP ) и неструктурные ( NS ). Структурные белки входят в состав вириона это:
- капсидные белки – формирующие капсид;
- внутренние белки - геномные белки и ферменты (белки полимеразного комплекса участвующие в процессе репликации;
- матриксные белки сложных вирусов, образующие М – слой и участвующие в заключительных этапах самосборки вирионов и в их стабилизации;
- суперкапсидные поверхностные белки – гликопротеины, ответственные за прикрепление вирионов к клеточным рецепторам и их проникновение в клетку.
Неструктурные белки синтезируются в инфицированной клетке для обеспечения процесса репродукции и в состав вирионов не входят, это : - вирусиндуцированные ферменты, обслуживающие транскрипцию и трансляцию вирусного генома; - регуляторные белки;
- нестабильные белки – предшественники, из которых формируются структурные белки вириона; Ферменты вирусов.
В отличие от прокариот и клеток всех других организмов, вирусы лишены ферментов, участвующих в многочисленных метаболических реакциях. Однако многие вирусы содержит в составе капсидов одну или две группы ферментов. К первой группе относятся ферменты репликации и транскрипции, ко второй ферменты, участвующие в проникновение вирусной НК в клетку хозяина и выходе образовавшихся вирионов из клнтки. Ферменты вирусов подразделяются на две группы:
- вирионные – ферменты транскрипции и репликации (ДНК и РНК- полимеразы), имеющиеся почти у всех вирусов, а также обратная транскриптаза ретровирусов. У некоторых вирусов к вирионным относятся еще эндо – и экзонуклеазы, АТФ-азы, нейраминидазы.
- вирусиндуцированные – относятся те ферменты, структура которых закодирована в вирусном геноме, но продуцирующихся соответствующими структурами зараженной клетки.
Функции вирусных белков:
- защитная;
- рецепторная (адресная и якорная у белков суперкапсидной оболочки, а если ее нет, капсидной);
- антигенная;
- ферментативная.
Примеры:
1.ДНК-зависимая ДНК-полимераза - осуществляет синтез ДНК на матрице ДНК.
2.ДНК-зависимая РНК-полимераза - осуществляет синтез мРНК на матрице ДНК.
3.РНК зависимая РНК-полимераза – осуществляет синтез РНК на матрице РНК. Выполняет функции транскриптазы и репликазы.
4.Обратная транскриптаза или ревертаза или РНК зависимая ДНК полимераза осуществляет синтез ДНК на матрице РНК.
5.Хеликаза - осуществляет расплетение двухнитевой структуры ДНК.
6.Протеиназы - ферменты, участвующие в посттрансляционном процессе. Медленные инфекции
Различают две группы медленных инфекций, отличающихся по этиологии.
1.группа – возбудители обычные (канонические) вирусы (вирус кори, краснухи, цитомегаловирус и т.д.).
2 группа – возбудители инфекционные белки, называемые прионами.
1.Медленные вирусные инфекции, вызываемые обычными вирусами могут развиваться после перенесенных вирусных инфекций, таких как корь, краснуха, клещевой энцефалит, цитомегаловирусная инфекция, ВИЧ-инфекция. Развитию этой группы инфекций способствует длительное персистирование вирусов в организме, особенно в клетках нейроглии. Например, через несколько лет после перенесенной кори у детей и подростков может развиваться подострый склерозирующий панэнцефалит.
Читайте также: