Метаболический синдром и гепатит с
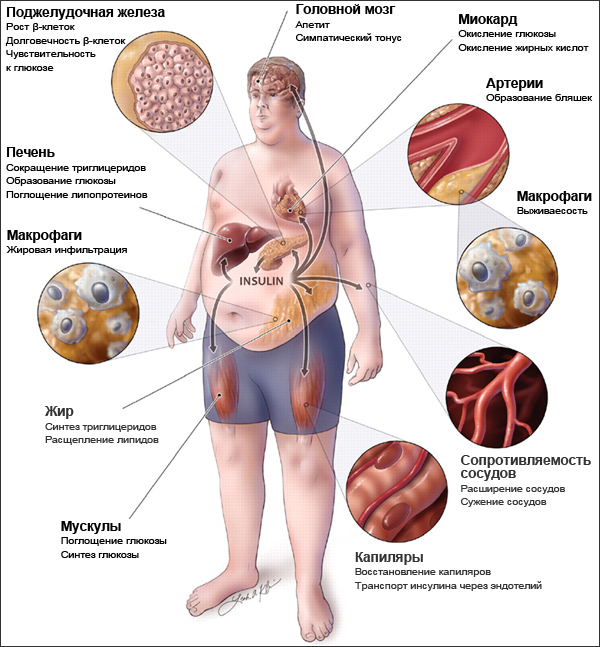
Метаболический синдром развивается у 40 % людей в основном пенсионного возраста и у всех, кто ведет малоподвижный образ жизни и неправильно питается. Распространенность метаболического синдрома продолжает расти.
В основе метаболического синдрома и его проявлений лежит инсулинрезистентность. Резистентность (устойчивость) к инсулину заключается в том, что для поддержания нормального метаболизма требуется большее количество инсулина.
Отмечено, что инсулинрезистентность часто встречается у больных с хроническим вирусным гепатитом С (ХГС), что свидетельствует о тесной связи этих двух состояний. Поскольку ХГС больны более 170 млн. человек, сочетание инфекции с инсулинрезистентностью представляет серьезную проблему мирового здравоохранения.
С резистентностью к инсулину связано также развитие у больных ХГС стеатоза – жирового перерождения печени, которое почти в 2 раза чаще, чем в среднем у населения. Стеатоз связан также с повышением индекса массы тела (ИМТ), сахарным диабетом 2 типа, возрастом старше 40 лет, гепатитом С, вызванным вирусом С генотипа 3 и фиброзом.
Генотип вируса 3 оказывает прямое стеатогенное действие, у пациентов с другими генотипами вируса основную роль в формировании стеатоза играет инсулинрезистентность.
Независимо от того, что развивается первым, резистентность к инсулину является основным фактором риска тяжелого фиброза печени и рассматривается как важный прогностический фактор формирования цирроза печени.
Резистентность к инсулину играет основную роль в формировании сахарного диабета 2 типа, поэтому не удивительно, что среди больных гепатитом С он встречается в 2 раза чаще.
Резистентность к инсулину ухудшает результаты лечения ХГС. Для оценки инсулинрезистентности используют индекс HOMA-IR. При значении этого индекса больше 4 эффективность лечения (частота устойчивого вирусологического ответа – УВО) снижалась на 40 %. У пациентов с индексом HOMA-IR меньше 2 ранний вирусологический ответ определялся у всех пациентов.
Жировой гепатоз также значительно ухудшает прогнозы на выздоровление.
Поскольку на успех противовирусной терапии значительно влияют степень ожирения, резистентность к инсулину и стеатоз печени, следует оценивать эти факторы при назначении терапии. Если они присутствуют, то для достижения наилучшего терапевтического эффекта требуется коррекция резистентности к инсулину и лечение стеатоза.
Симптомы метаболического синдрома
Нарушения, объединенные рамками метаболического синдрома, длительное время протекают бессимптомно. Наиболее ранними проявлениями метаболического синдрома являются дислипидемия и повышение артериального давления. Часто не все компоненты метаболического синдрома встречаются одновременно:
- абдоминально-висцеральное ожирение (окружность талии более 102 см у мужчин и более 88 см у женщин);
- инсулинорезистентность при высоком уровне инсулина;
- дислипидемия (сочетание гипертриглицеридемии — больше 1,7, низкого уровня ХЛ ЛВП и повышения фракции мелких ХЛ ЛНП;
- артериальная гипертензия (артериальное давление выше 130/85 мм рт. ст.);
- ранний атеросклероз и ишемическая болезнь сердца.
Возможные жалобы на повышенную утомляемость, апатию, одышку, повышенный аппетит, жажду, учащенное мочеиспускание, головную боль, сухость кожи, потливость.
Лечение метаболического синдрома
Лечение назначают в зависимости от степени обменных нарушений и тех заболеваний, которые выявлены у пациента. Лечение направлено на коррекцию углеводного обмена, снижение массы тела, купирование артериальной гипертонии и симптомов сахарного диабета.
Немедикаментозное лечение метаболического синдрома
Первым этапом лечения метаболического синдрома является изменения стиля жизни, в первую очередь правильное питание и повышение физической нагрузки. Первым шагом и его обязательным звеном должно быть снижение таким образом массы абдоминально-висцерального жира, который играет ключевую роль в развитии и прогрессировании метаболического синдрома.
Снижение общей массы тела на 10-15% от исходной сопровождается уменьшением висцеральной жировой ткани, т. е. жира, расположенного не в подкожном слое, а вокруг внутренних органов. Это, как правило, ведет к повышению чувствительности тканей к инсулину, улучшению показателей липидного и углеводного обмена, нормализации повышенного артериального давления.
Снижение массы тела должно быть постепенным. Быстрый и резкий сброс массы тела на 10-20 кг приводит к снижению гормона лептина и к возникновению труднопреодолимого чувства голода, и в результате к возврату лишних килограммов, иногда даже в большем количестве, чем до терапии.
Потеря массы тела снижает содержание свободных жирных кислот в печени, что приводит к снижению инсулинрезистентности, повышает внепеченочную чувствительность к инсулину, уменьшает воспаление в жировой ткани.
Медикаментозное лечение метаболического синдрома
Дополнительным лечением метаболического синдрома является назначение урсодезоксихолевой кислоты и витамина Е, которые оказывают антиоксидантное действие и улучшают результаты лечения ХГС.
Препараты, повышающие чувствительность к инсулину (тиазолидиндиолы и метформин) снижают резистентность к инсулину и уменьшают выраженность фиброза и степени жирового гепатоза у больных гепатитом С.
Все это улучшает результаты терапии противовирусными препаратами.
Поэтому обследование пациентов, готовящихся к противовирусной терапии, в особенности с генотипом 3, обязательно должно включать анализ на инсулинрезистенстность (индекс HOMA-IR), оценку степени метаболического синдрома и всех его компонентов с обязательной последующей коррекцией желательно до начала терапии.
Тактика лечения пациентов с ожирением и метаболическим синдромом при гепатите С
При выявлении у пациентов с HCV сопутствующего поражения печени в результате метаболического синдрома (неалкогольная жировая болезнь печени - стеатоз) необходимо провести дополнительное обследование на показатели обменных и гормональных нарушений, характерных для этого заболевания.
Рекомендуется для оценки степени поражения печени использовать исследование крови – Фибромакс, которое дает возможность оценить отдельно степень поражения печени вирусом и отдельно метаболическим синдромом.
Тактика лечения зависит от степени поражения печени в целом, и отдельно каждым повреждающим фактором. Лечение противовирусными препаратами может быть назначено сразу, а дальнейшее лечение метаболического синдрома после получения УВО.
Если степень поражения печени вирусом значительно меньше, чем метаболическим синдромом, возможно начинать противовирусную терапию после лечения метаболического синдрома.
В случаях наличия сопутствующих заболеваний печени необходимо ставить целью лечения не только получение УВО, но и сохранение и восстановление печени, пострадавшей от других патологических факторов.
РФ, г. Архангельск
РФ, г. Архангельск
РФ, г. Архангельск

АННОТАЦИЯ
В данной статье предлагается анализировать и оценить роль гепатотропных вирусов в формировании метаболического синдрома и отдельных его компонентов на основании представления проведенных исследований и их выводов.
Вирусные гепатиты В и С - опасные для жизни инфекции печени. Вирусный гепатит B является глобальной проблемой здравоохранения. Гепатит В наиболее распространен в Западной части Тихого океана и в Африканском регионе, в которых инфицировано 6.2 % и 6.1 % взрослого населения соответственно. В Регионе Восточного Средиземноморья, Регионе Юго-Восточной Азии и Европейском регионе инфицировано соответственно 3,3%, 2,0% и 1,6% населения [1]. По информации ВОЗ по состоянию на 2017 г. с хроническим гепатитом жили около 325 млн человек, в том числе 257 млн человек жили с вирусом гепатита B, а 71 миллион — с вирусом гепатита С В 2017 году количество новых инфицирований составило 1,1 млн. человек [2].
Еще одной значимой и стремительно прогрессирующей проблемой является увеличение числа людей, страдающих сахарным диабетом и ожирением. Совокупность факторов абдоминального ожирения (АО), гиперинсулинемии, нарушения толерантности к глюкозе, низкий уровень холестерина (ХС) липопротеидов высокой плотности (ЛПВП) и высокая распространенность артериальной гипертонии (АГ) приводят к формированию метаболического синдрома (МС), распространенность которого среди населения старше 30 лет составляет 10-30%[3].
Хронический гепатит С и неалкогольная жировая болезнь печени, являющаяся печеночным проявлением метаболического синдрома – наиболее встречаемые болезни печени. Они представляют большое социальное, экономическое и медицинское значения. Больные с хроническим гепатитом С с частотой от 30% до 80% имеют ожирение гепатоцитов, или печеночный стеатоз.
В клинике им. Е.М. Тареева (г. Москва) в 2006-2009 гг. было проведено исследование. В исследовании участвовало 123 пациента с хроническим гепатитом С. В исследование включались проспективно больные ХГС, поступавшие в клинику с 2006 по 2009 гг.
Диагноз ХГС устанавливался на основании анамнеза, клинического обследования, результатов дополнительных методов диагностики (вирусологическое исследование) (положительные результаты на антитела к HCV и HCVRNA) с определением генотипа HCV и вирусной нагрузки.
Результаты этого исследования показали, что преобладали мужчины (м/ж - 73/50), возраст пациентов составил от 18 до 76 лет (ср. возраст 44+13,57 лет). У 26 (21,1 %) пациентов был диагностирован цирроз печени. У 58 из 123 (47,2%) больных наряду с ХГС установлен диагноз метаболический синдром. Группу сравнения составили больные хроническим гепатитом С без метаболического синдрома, однако некоторые их них имели отдельные компоненты метаболического синдрома.
Абдоминальное ожирение – самый часто встречаемый компонент метаболического синдрома, который был выявлен у 52% пациентов. 43,9% пациентов имели избыточную массу тела, при этом частота ожирения 1, 2 и 3 степени составила 25,2% , 9,8% и 1,6% соответственно. Также обращает на себя внимание высокая частота артериальной гипертензии (43,9%), атерогенной дислипидемии – (гипертриглицеридемия у 47,2%, понижение ЛПВП у 48% пациентов и нарушений углеводного обмена – гипергликемия натощак выявлялась у 17,1%, в том числе у 9,8% пациентов диагностирован сахарный диабет II типа. Среди пациентов, имеющих сахарный диабет II типа, преобладали женщины (58,3%), лица старшего возраста (средний возраст 55,2+13,9 лет), пациенты с метаболическим синдромом (91,7%).
Анализируя группы пациентов с хроническим гепатитом С с метаболическим синдромом и без него установлено, что метаболический синдром чаще встречался у женщин, лиц старшего возраста, ассоциировался со всеми компонентами метаболического синдрома, а также с более высокими уровнями HOMA-IR, лептина и наличием стеатоза печени. Наличие метаболического синдрома не было связано с параметрами вирусной инфекции - вирусной нагрузкой и генотипом HCV (метаболический синдром был диагностирован у 4 из 9 больных с хроническим гепатитом С, обусловленным 3 генотипом HCV), с активностью печеночного процесса (уровнями АСТ и АЛТ, ИГА) и стадией фиброза.
При исследовании инсулинорезистентности у пациентов с хроническим гепатитом С выявили, что уровень инсулина составил в среднем 11,83+13,11 мкМЕ/мл. Уровни инсулина не отличались значимо в группах пациентов с хроническим гепатитом С с метаболическим синдромом и с хроническим гепатитом С без метаболического синдрома, что вероятно обусловлено снижением уровней инсулина при развитии сахарного диабета II типа у некоторых пациентов с метаболическим синдромом.
В данном исследовании выявлена высокая частота метаболического синдрома (47,2%), превышающая частоту метаболического синдрома (25-35%) в популяционных исследованиях взрослого населения экономически развитых стран. Несмотря на разноречивость данных, предполагается, что HCV-инфекция влияет на увеличение частоты МС в популяции, что связано с доказанной самостоятельной ролью HCV в развитии инсулинорезистентности и СД2, способствующих развитию абдоминального ожирения и, вероятно, других компонентов МС. [4]
Еще в одном исследовании, цель которого оценить частоту инсулинорезистентности по индексу HOMA-IR у больных ХГС и ее связь с нарушением жирового обмена, были включены 75 больных ХГС (35 мужчин и 40 женщин) в возрасте от 20 до 55 лет. Диагноз ХГС устанавливали при обнаружения в крови маркеров вируса: суммарных антител (HCV-Ab), РНК-HCV и по совокупности клинико-анамнестических, биохимических, инструментальных, эпидемиологических данных согласно классификации хронических гепатитов (Лос-Анджелес, 1994). В исследовании инсулинорезистентность (HOMA-IR ≥ 2,27) была диагностирована у 27 (36,0%) больных ХГС.
Увеличение индекса массы тела было у 52% обследованных. Средние значения HOMA-IR выше у пациентов с хроническим гепатитом С в возрасте старше 40 лет. Значительное увеличение средних значений HOMA-IR наблюдалось у пациентов с индексом массы тела ≥ 25 кг/м² и абдоминальным ожирением. У таких пациентов инсулинорезистентность выявлялась чаще (51,5–56,4%), чем у пациентов без аналогичных признаков (соответственно 23,4–13,9%). Результаты анализа подтвердили высокую связь инсулинорезистентности у пациентов хроническим гепатитом С с признаками нарушения жирового обмена.
Результаты исследования показали, что у пациентов с признаками биохимической активности ХГС отмечается тенденция к более высокому показателю HOMA-IR. При выраженном фиброзе печени имела место тенденция к более высокому значению HOMA-IR.
Учитывая связь инсулинорезистентности и нарушений жирового обмена, особый интерес представлял анализ величины HOMA-IR у 36 больных ХГС с нормальной массой тела и отсутствием абдоминального ожирения. Так, у 13,9% пациентов из этой группы HOMA-индекс был ≥ 2,27, указывающее на наличие инсулинорезистентности. У этих же больных отмечался более высокий средний уровень активности АлАТ 138,2 ± 47,7 (р 5% гепатоцитов, отсутствие СП, если жировое перерождение гепатоцитов составляло 2,77.
Результатам исследования выявили, что среди больных ХВГВ преобладали пациенты 20-49 лет (88,7%). Медиана возраста составляла 35,4 (27; 45,7) года. У 4 (7,5%) обследованных выявлен ЦП, у 8 (15,5%) - СД-2. МС и ИР (НОМА-ИР >2,77) наблюдались соответственно у 22,6 и 26,4% обследованных. В контрольной группе МС выявляли у 24,5% и ИР у 29% лиц (5=0,519 и р=0,79). Вирусная нагрузка ДНК HВV составляла 4,6 (4,4-5,7) log10 МЕ/мл Избыточная масса тела (ИМТ >25 кг/м 2 ) наблюдалась у 49% пациентов с ХВГВ и 36% человек контрольной группы (р=0,265).
Абдоминальное ожирение выявлено у 50,1% больных. На фоне АО как обязательного компонента МС выявлена тенденция к более высокому показателю НОМА-ИР. Вместе с тем у больных этой группы в 5 раз чаще наблюдались ИР и СП.
В этой группе НОМА-ИР в 1,8 раза превышал показатели пациентов с нормальным АД; в 6,7 раза чаще встречалась ИР, в 3,8 раза – СП.
По результатам многих исследований метаболический синдром является наиболее частым последствием резистентности к инсулину. В настоящем исследовании наличие МС, ИР и ожирения у больных ХВГВ наблюдалось не чаще, чем в контрольной группе.
При анализе сопряженности признаков выявлена четкая зависимость между высокой вирусной нагрузкой, МС, СД-2 и тяжелым ФП.
Анализ полученных результатов показывает, что распространенность МС и ИР у больных ХВГВ не превышала таковой в контрольной группе. МС выявлен у 22,6% больных ХВГВ, ИР у - 26,4%, АО - у 50,1%. Число больных ХВГВ с МС увеличивалось с возрастом и длительностью заболевания. ИР и СП чаще наблюдались у пациентов с АО. ИР не ассоциировалась с выраженным ФП при ХВГВ. При АО без МС наблюдались более низкая активность печеночных ферментов и ИГА Knodell. С более выраженным ФП (>3 баллов METAVIR) ассоциированы большая продолжительность заболевания, высокая вирусная нагрузка, МС, ожирение и СД-2. Это обусловливает необходимость своевременного начала противовирусной терапии, а также коррекции метаболических нарушений у пациентов данной категории. [3].
Выводы. Метаболический синдром это сложная комбинация наиболее важных факторов риска развития сердечно-сосудистых заболеваний: ожирение, нарушение углеводного обмена, артериальную гипертензию и дислипидемию[6].
На большинство из этих факторов несомненно оказывает прямое или косвенное влияние сопутствующая патология в виде вирусного гепатита В и С.
По данным ВОЗ Вирусный гепатиты В и С продолжают оставаться одной из глобальных проблем современного здравоохранения. Вирусный гепатит С характеризуется высокой частотой хронизации, длительным субклиническим или малосимптомным течением и прогрессированием патоморфологических изменений в печени с исходом в цирроз печени. В связи с этим нередко гепатит С впервые диагностируют на далеко зашедших стадиях, иногда в дебюте декомпенсации на цирротической стадии заболевания.
Эти обстоятельства объясняют пристальное внимание исследователей к механизмам развития инфекционного процесса и инициации и прогрессирования фиброза печени при хроническом гепатите С, что имеет большое значение для клинической практики.
В этой связи в последнее время широко обсуждается наличие инсулинорезистентности при хронической HCV-инфекции, представляющей собой метаболическое нарушение, характеризующееся снижением реакции на инсулин инсулинчувствительных тканей при его достаточной концентрации, приводящее к хронической компенсаторной гиперинсулинемии. Инсулинорезистентность определяется как состояние, которое характеризуется потребностью в более высокой концентрации инсулина, чем в норме, для реализации своих биологических эффектов, или как состояние, при котором нормальное содержание инсулина не обеспечивает его метаболические функции (при снижении чувствительности тканей к инсулину). Инсулинорезистентность рассматривается как основа такого широко распространенного в популяции патологического состояния, как метаболический синдром, который характеризуется сочетанием ожирения, пограничной гипергликемии натощак, артериальной гипертензии и дислипопротеидемии. Показано, что именно инсулинорезистентность при метаболическом синдроме имеет существенно более тесную связь с риском развития сердечно-сосудистых заболеваний, чем другие отдельные его компоненты [3].
Многочисленные данные подтверждают сложное взаимоотношение метболического синдрома и хронических гепатитов. Их изучение имеет большое практическое значение, так как вирус гепатита может увеличивать частоту метаболического синдрома и его осложнений. В свою очередь метаболический синдром и инсулинорезистентность будут способствовать ускоренному прогрессированию хронического гепатита.
Вирусный гепатит С продолжает оставаться одной из глобальных проблем современного здравоохранения. По расчетным данным, в мире число инфицированных достигает 500 млн человек. К клиническим особенностям гепатита С в первую очередь следует отнести высокую частоту хронизации (85%), что обеспечивает неуклонное увеличение числа больных хронической инфекцией. Другой особенностью заболевания является длительное субклиническое или малосимптомное его течение при одновременном прогрессировании патоморфологических изменений в ткани печени с исходом в цирроз печени. Вследствие этого нередко гепатит С впервые диагностируется на далеко зашедших стадиях, иногда в дебюте декомпенсации на цирротической стадии заболевания.
Вирусный гепатит С продолжает оставаться одной из глобальных проблем современного здравоохранения. По расчетным данным, в мире число инфицированных достигает 500 млн человек. К клиническим особенностям гепатита С в первую очередь следует отнести высокую частоту хронизации (85%), что обеспечивает неуклонное увеличение числа больных хронической инфекцией. Другой особенностью заболевания является длительное субклиническое или малосимптомное его течение при одновременном прогрессировании патоморфологических изменений в ткани печени с исходом в цирроз печени. Вследствие этого нередко гепатит С впервые диагностируется на далеко зашедших стадиях, иногда в дебюте декомпенсации на цирротической стадии заболевания.
Эти обстоятельства объясняют пристальное внимание исследователей к механизмам развития инфекционного процесса и, в частности, инициации и прогрессирования фиброза печени при хроническом гепатите С (ХГС), что имеет большое значение для клинической практики. В настоящее время уже установлен ряд факторов, влияющих на прогрессирование заболевания, среди которых выделяют возраст больных (старше 40 лет), длительность инфекции, мужской пол, генотип вируса (генотип 1) и употребление алкоголя [1]. Повышенный интерес представляют характеристики макроорганизма, которые могут оказывать влияние на темпы развития инфекционного процесса, имеют патогенетическое значение в формировании и прогрессии фиброза печени.
В этой связи в последнее время широко обсуждается наличие инсулинорезистентности при хронической HCV-инфекции, которая представляет собой метаболическое нарушение, характеризующееся снижением реакции инсулинчувствительных тканей на инсулин при его достаточной концентрации, приводящее к хронической компенсаторной гиперинсулинемии. Инсулинорезистентность определяют также как состояние, характеризующееся потребностью в более высокой концентрации инсулина, чем в норме, для реализации его биологических эффектов, или как состояние, при котором нормальное содержание инсулина не обеспечивает его метаболические функции (снижается чувствительность тканей к инсулину). Инсулинорезистентность рассматривается как основа такого широко распространенного в популяции патологического состояния, как метаболический синдром, который характеризуется сочетанием ожирения, пограничной гипергликемии натощак, артериальной гипертензии и дислипопротеидемии. Показано, что именно инсулинорезистентность при метаболическом синдроме имеет существенно более тесную связь с риском развития сердечно-сосудистых заболеваний, чем другие отдельные его компоненты (ожирение, сахарный диабет, артериальная гипертензия, дислипопротеидемия) [2]. При этом данные о встречаемости метаболического синдрома у пациентов с хронической HCV-инфекцией неоднозначны. Имеются сведения о более частом, примерно в 25% случаев, обнаружении метаболического синдрома при ХГС в сравнении с 22% случаев в популяционных исследованиях, проведенных на Среднем Западе США [3].
Не меньший интерес представляет другой, специфический для гепатита С механизм развития резистентности к инсулину. Убедительно доказана ее непосредственная связь с инфицированием вирусом гепатита С и развитием гепатита – это так называемая вирусная инсулинорезистентность [8, 9, 10, 11, 12].
Инсулинорезистентность (как вирусиндуцированная, так и метаболическая) приводит к развитию гиперинсулинемии, которая является важным аспектом формирования фиброза печени. Гиперинсулинемия стимулирует синтез внеклеточного матрикса звездчатыми клетками, что приводит к прогрессированию процессов фиброгенеза [16]. Эти данные свидетельствуют о важной роли инсулинорезистентности при ХГС как фактора, влияющего на течение патологического процесса.
Кроме того, гиперинсулинемия как следствие инсулинорезистентности нарушает метаболизм липидов в гепатоците и, следовательно, способствует формированию стеатоза и стеатогепатита, с повышением рисков развития сахарного диабета.
Стеатоз печени в последние годы стали рассматривать как фактор прогрессирования ХГС. Важно понимать, что при стеатозе печени включаются механизмы формирования фиброза, в развитии которого ключевая роль отводится окислительному стрессу, что привлекает к себе внимание как точка приложения средств фармакокоррекции. Известна высокая частота обнаружения стеатоза печени при ХГС (от 30 до 80%), особенно при инфицировании генотипом 3 вируса [21, 22, 23].
Таким образом, определение роли различных характеристик макроорганизма в формировании патологического процесса прогрессирования инфекции и его исходов является условием разработки перспективных способов фармакологической коррекции. Это может быть существенным дополнением современных схем противовирусной терапии в плане повышения ее эффективности.
Цель исследования: оценить частоту инсулинорезистентности по индексу HOMA-IR у больных ХГС и ее связь с нарушением жирового обмена.
Материалы и методы
В исследование были включены 75 больных ХГС (35 мужчин и 40 женщин) в возрасте от 20 до 55 лет. Средний возраст обследованных составил 36,1 ± 9,2 лет.
Диагноз ХГС устанавливался на основании обнаружения в крови маркеров вируса: суммарных антител (HCV-Ab), РНК-HCV, а также по совокупности клинико-анамнестических, эпидемиологических, биохимических, инструментальных данных согласно классификации хронических гепатитов (Лос-Анджелес, 1994).
У 76% больных гепатит С был впервые выявлен при скрининговом обследовании на маркеры вирусов гепатитов, и 24% пациентов были обследованы целенаправленно в связи с наличием каких-либо клинико-лабораторных отклонений (умеренное повышение активности аланинаминотрансферазы (АлАТ), обнаружение гепатомегалии по данным УЗИ, реже – ухудшение самочувствия в виде астеновегетативного и диспепсического синдромов).
Критериями исключения при подборе пациентов для проведения исследования были признаки субкомпенсированного и декомпенсированного цирроза печени (по Сhild-Pugh, 1973), хронические заболевания печени другой этиологии (в том числе вирусный гепатит В), хронический алкоголизм, сахарный диабет, симптоматическая артериальная гипертензия, тяжелая сопутствующая соматическая патология, а также потребление наркотических средств и ВИЧ-инфекция.
Практически у половины пациентов (44,6%) давность гепатита составила более 8 лет, у 27% – от 3 до 8 лет, у 18,9% – до 3 лет, у 9,5% продолжительность заболевания установить не удалось.
ХГС у 52,4% пациентов был обусловлен 1b генотипом ВГС, у 46% – 3а генотипом. Об активности гепатита судили по биохимическим показателям – активности АлАТ (МЕ/л) и уровню тимоловой пробы (ЕД), отражающим выраженность цитолитического и мезенхимально-воспалительного синдромов. У 20 пациентов была оценена степень фиброза печени по шкале METAWIR по результатам биопсии печени, эластографии печени и Фибромакс-теста.
У всех больных рассчитывали индекс массы тела (ИМТ) методом Кетле (кг/м²). Согласно критериям ожирения ВОЗ (1997), распределение пациентов по ИМТ оказалось следующим: у 36 больных ХГС (48%) масса тела была нормальной, у 31 (41,3%) обнаружена избыточная масса тела; у 6 пациентов (8,0%) диагностировано ожирение 1-й степени, у 2 (2,6%) – ожирение 2-й степени.
Наличие абдоминального ожирения устанавливали путем измерения обхвата талии в соответствии с IDF-критерием 2005 года (у мужчин > 94 см, у женщин > 80 см). На этом основании у 33 больных ХГС (44%) диагностировано абдоминальное ожирение. Уровень глюкозы в венозной крови определяли натощак ферментативным колориметрическим методом. Содержание иммунореактивного инсулина в плазме крови определяли натощак методом ИФА с использованием тест-системы DRG Insulin ELISA (США). Для оценки инсулинорезистентности использовали индекс HOMA-IR (D. Matthews, 1985). Показатели HOMA-IR ≥ 2,27 свидетельствовал о наличии инсулинорезистентности.
Результаты исследования и обсуждение
Инсулинорезистентность (HOMA-IR ≥ 2,27) диагностирована у 27 (36,0%) больных ХГС. Результаты анализа значений HOMA-IR и частоты выявления инсулинорезистентности в зависимости от возраста пациентов, наличия признаков нарушения жирового обмена представлены в таблице 1.
Следует отметить, что у 52% обследованных пациентов было повышение ИМТ разной степени выраженности. Как видно из данных таблицы 1, средние значения HOMA-IR были достоверно выше у больных ХГС старшей возрастной группы (старше 40 лет). Существенное повышение средних значений HOMA-IR выявлялось у пациентов с повышенным ИМТ (≥ 25 кг/м²) и наличием абдоминального ожирения. У этих пациентов частота выявления инсулинорезистентности была достоверно выше (51,5–56,4%), чем у больных без аналогичных признаков (соответственно 23,4–13,9%). Результаты корреляционного анализа подтвердили тесную связь инсулинорезистентности у больных ХГС с признаками нарушения жирового обмена. Также была получена положительная корреляция между значениями HOMA-IR и ИМТ (p
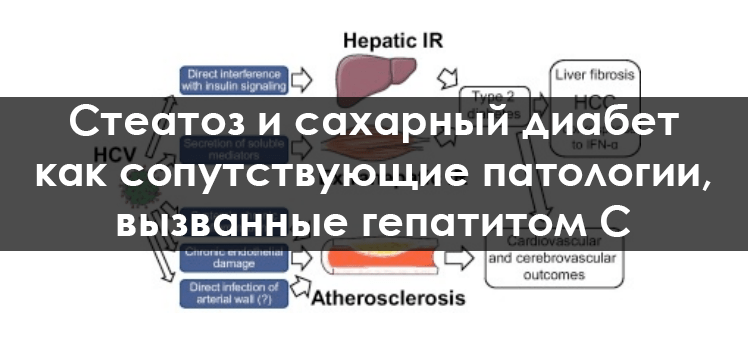
Введение
Вирус гепатита С (ВГС) является основной причиной возникновения цирроза и гепатоцеллюлярной карциномы во всем мире. В недавнем систематическом обзоре литературы глобальная распространенность ВГС оценивалась в 2,8% среди всего населения земного шара, что примерно соответствует 185 000 000 инфицированных. В том же исследовании сообщалось, что в Европейском Союзе на 2010 год уровень смертности связанный с вирусным гепатитом в 10 раз превышал уровень связанный с вирусом иммунодефицита человека (ВИЧ), причем две трети смертей от вирусного гепатита были связаны с ВГС. Аналогичные данные были получены в США, где смертность, связанная с ВГС, превзошла смертность от ВИЧ в 2007 году. Этот и без того тревожный уровень смертности неизбежно возрастет, так как осложнения перенесенных заболеваний печени возникают спустя десятилетия после инфицирования.
Хотя исследования экономической эффективности мер, направленных на борьбу с эпидемией ВГС, в основном сосредоточены на расходах, связанных с патологиями печени, они не учитывают ряд сопутствующих и связанных с ВГС заболеваний. Среди них следует отметить диабет 2-го типа и атеросклероз — два известных осложнения метаболического синдрома, поскольку ВГС прямо связана с их патогенезом. Кроме того, ВГС также вызывает стеатоз, который, как предполагают, повышает риск сердечно-сосудистых заболеваний. В связи с этим возникает закономерный вопрос о том, может ли успешное лечение ВГС повлиять на отдаленные последствия и уровень смертности вследствие диабета и атеросклероза. Целью настоящего обзора является обсуждение некоторых аспектов, связанных с сопутствующими заболеваниями.

Стеатоз
Хронический гепатит С ассоциирован со стеатозом. Об этом свидетельствует сильная связь стеатоза с 3 генотипом ВГС: у пациентов с этим генотипом вероятность развития стеатоза от умеренной до тяжелой степени значительно выше, чем у пациентов с другими генотипами, что указывает на наличие нуклеотидной последовательности ответственные за изменение липидного обмена. Возникновение и тяжесть стеатоза у пациентов с 3 генотипом коррелирует с вирусной нагрузкой и ответом на противовирусные препараты: стеатоз значительно уменьшается или исчезает полностью у пациентов, достигающих устойчивого вирусологического ответа (УВО) и появляется вновь при рецидивах инфекции. Частично объясняет тесную связь зависимость репликации и распространения ВГС от липидного обмена пациента: специфические виды липидов необходимы для жизненного цикла ВГС, так как их истощение ингибирует репликацию вирусов; сборка и выход вириона зависят от липидов и использует механизм секреции липопротеинов гепатоцитов; ВГС циркулирует в крови, в связанной с липопротеинами форме, образующими так называемые липовирочастицы; последние связываются с гепатоцитами посредством взаимодействия, в том числе с рецептором липопротеинов низкой плотности (ЛПНП).
Хотя ВГС изменяет липидный метаболизм хозяина в пользу его собственной репликации, эти патофизиологические изменения являются общими для всех вирусных генотипов, в то
время как стеатоз более часто встречается и тяжелее протекает при инфецировании 3 генотипом, что предполагает вовлечение дополнительных механизмов в случае инфекции с этим генотипом. Несмотря на то, что для возникновения вирусного стеатоза было предложено несколько механизмов, ни одна экспериментальная модель не воспроизводит изменения наблюдаемый у человека. Существует несколько причин, объясняющих различия между in vivo и in vitro: последовательности используемые для вызова метаболических изменений приводящих к стеатозу зачастую являются производными от 3 генотипа; кроме того, редко выполняется прямое сравнение между различными генотипами как с использованием модели так и в экспериментальных условиях.
Наконец, некоторые утверждения основанные на наблюдениях собранных in vitro, противоречат наблюдениям сделанным у людей. Типичный случай представлен активацией факторов транскрипции, ответственных за неолипогенез, таких как SREBF1 и SREBF2. Хотя эти факторы неоднократно были обнаружены активированными в модельных клетках экспрессирующих белки ВГС, как ни странно, их содержание в печени имело обратную корреляцию с тяжестью стеатоза. Это говорит о том, что их активации, хотя и необходима для жизненного цикла ВГС, но ее может быть недостаточно для возникновения стеатоза.
Каким бы ни был механизм, вирусный стеатоз, по-видимому, не влияет на скорость прогрессирования фиброза печени, хотя 3 генотип ВГС независимо ассоциирован с прогрессированием фиброза. Вирусный стеатоз не ухудшает реакции на интерферон-α (ИНФ-а) и препараты прямого противовирусного действия. В тоже время, стеатоз, обусловленный метаболическим синдромом, связан как с ускоренным прогрессированием фиброза, так и с плохим ответом на терапию на основе ИНФ-а. Отдельной проблемой является связь между стеатозом и гепатоцеллюлярной карциномой (ГЦК). Несколько исследований, связали стеатоз с повышенным риском развития ГЦК при хроническом гепатите С. Из-за малочисленности пациентов с 3 генотипом, включенных в эти исследования, сделать какой-либо вывод о причинной связи между вирусным стеатозом и ГЦК проблематично. Более вероятно, что эта связь могла быть объяснена известной связью между избыточным весом (приводящей к стеатозу) и ГЦК. С другой стороны, 3 генотип ВГС действительно ассоциирован с повышенным риском развития ГЦК, но связано ли это с вирусным стеатозом, неизвестно. Ассоциация не подразумевает причинно-следственной связи и, кроме того, стеатоз часто снижается или отсутствует на поздних стадиях заболевания печени, т. е. в момент возникновения ГЦК. Таким образом, отсутствуют доказательства, подтверждающие аргумент о том, что вирусный стеатоз непосредственно приводит к ГЦК. У некоторых пациентов с 3 генотипом может наблюдаться дерегуляция внутриклеточных путей, ведущая как к стеатозу, так и к ГЦК: активация увеличения выроботки активных форм кислорода или снижение активности супрессора опухоли PTEN.
Исходя из вышеизложенного, представляется важным с прогностической точки зрения, отличить вирусный стеатоз от стеатоза иного происхождения в том числе метаболического (Таблица 1). К сожалению, вирусный стеатоз не обладает четкими гистопатологическими особенностями, позволяющими его дифференцировать. Таким образом, дифференциальный диагноз должен основываться на анамнезе, наличии факторов риска, биохимических анализах сыворотки крови и реакции на противовирусные препараты. У пациентов с ВГС, как правило, более низкие уровни липопротеинов, таких как холестерин, особенно у пациентов с 3 генотипом. Этот специфический липидный профиль восстанавливается после успешной терапии, но точная корреляция между
гипохолестеринемией и стеатозом регистрируется редко.

Пациенты с хроническим гепатитом С и неалкогольным стеатогепатитом (НАСГ) имели более высокие показатели стеатоза и фиброза, более высокие уровни триглицеридов и более низкие уровни холестерина, липопротеинов общей и высокой плотности, чем пациенты со стеатозом. Интересно, что что данная группа пациентов чаще заражались 3 генотипом. Авторы пришли к выводу, что пациенты с хроническими гепатитами С и НАСГ являются отдельной категорией пациентов с более агрессивной болезнью печени.
В мета-анализе White показал, что ВГС ассоциирован с повышенным риском развития диабета 2 типа по сравнению как с неинфицированным, так и с инфицированным вирусом гепатита В (ВГВ) и контрольной группой. Среди многочисленных исследований по этой теме знаковое межсекторальное, популяционное исследование, проведенное Mehta, показало, что ВГС ассоциирован с сахарным диабетом 2 типа среди лиц в возрасте 40 лет и старше. Продольные исследования у лиц с патологиями иммунной системы и у пациентов, перенесших трансплантацию печени или почек, также подтвердили, что ВГС является основным фактором риска развития сахарного диабета 2 типа, особенно у лиц, подверженных риску из-за ожирения. ВГС предшествует диабету, а не является ятрогенной инфекцией у пациентов с высоким уровнем медикаментозного лечения диабета. В целом, ВГС, по-видимому, ускоряет возникновение диабета 2 типа у предрасположенных к нему людей: так, среди лиц с иммунносупрессией, статистически, это происходит на десятилетие раньше по сравнению с неинфицированным контролем.
Механизмом, посредством которого ВГС индуцирует диабет обусловлены возникновением инсулинорезистентность (ИР). Пациенты с гепатитом С имеют значительно более высокие показатели ИР (измеренные по модели гомеостаза для оценки ИР [HOMA-IR]) по сравнению с неинфицированным контролем или пациентами с хроническим гепатитом В, сопоставимыми по другим факторам риска ИР, такими как: ИМТ, окружность талии, возраст и пол. Методы определения ИР различаются в ряде исследований, а наблюдения, сделанные у людей, инфицированных ВГС, противоречивы в зависимости от используемого метода. Измерение HOMA-IR для оценки ИР очень удобно для охвата больших популяций, но, похоже, завышает долю пациентов с ИР. Однако наличие ИР у больных хроническим гепатитом С без метаболического синдрома достоверно подтверждено с помощью метода зажима глюкозы, более трудоемкого и не пригодного для рутинной диагностики. Эти исследования также показали, что различные генотипы ВГС имеют сопоставимые уровни возникновения ИР.
Более высокая оценка HOMA-IR ассоциирована с более низким показателями достижения УВО среди пациентов, получавших схемы лечения на основе ИНФ-а, независимо от генотипа ВГС. Однако прямая причинно-следственная связь между ИР и ИНФ-а резистентностью маловероятна, так как коррекция ИР пиоглитазоном не влияет на уровень РНК ВГС или вирусологический ответ на терапию. В тоже время, терапия с использованием метформина, по-видимому, влияет на ранний вирусологический ответ. Наблюдается связь между ИР и вирусологическим ответом среди пациентов получавших схемы лечения, содержащие противовирусные препараты прямого действия, такие как телапревир. Монотерапия данопревиром показала, что снижение HOMA-IR в основном шло параллельно снижению РНК ВГС, а исходные уровни HOMA-IR не влияли на достижение УОВ. Вполне вероятно, что ИР не влияет на достижение УВО препаратами прямого противовирусного действия.
Если ВГС изменяет метаболизм глюкозы, лечение хронического гепатита С должно привести к снижению частоты возникновения диабета 2 типа среди пациентов в группе риска. Большинство отчетов, за некоторыми исключениями, действительно показали, что достижение УВО ассоциируется с улучшеннием показателей ИР и сниженным риском нарушений метаболизма глюкозы, включая диабет 2 типа. Большое исследование, проведенное на 2842 пациентах с хроническим гепатитом С, получавших различные схемы, в том числе содержащие ИНФ-а, показало, что вирусная эрадикация привела к снижению риска развития диабета 2-го типа, независимо от возраста, наличия цирроза и преддиабета перед терапией. Кроме того, лечение ВГС может существенно снизить риск осложнений диабета, таких как почечная недостаточность и возникновение инсульта, о чем свидетельствует большое популяционное исследование проведенное в Тайване.
Тем не менее, терапия ВГС у пациентов с метаболическим синдромом не должна препятствовать управлению ИР и диабета 2 типа, в том числе с помощью ряда мер направленных на изменение образа жизни пациента и применения конкретных лекарств, таких как метформин. Повышенная физическая активность достоверно может снизить ИР и другие проявления метаболического синдрома. Интересно, что у пациентов с НАСГ после терапии ВГС с использованием физической нагрузки средней и низкой интенсивности улучшался метаболический профиль независимо от изменений массы тела. С другой стороны, интенсивная программа снижения массы тела и физических упражнений позволила снизить показатели стеатоза и фиброза печени в небольшой выборке пациентов. Наконец, был отмечен положительный эффект для метформина, который, как было показано, значительно снижает (примерно на 50%) риск развития ГЦК. Оптимальное управление гликемией играет ключевую роль в снижении этого риска, поскольку частота ГЦК была значительно выше среди пациентов с уровнем гликозилированного гемоглобина 7%, чем у пациентов с уровнем 7%.
Читайте также:


