Метаболизм клеток зараженных вирусом
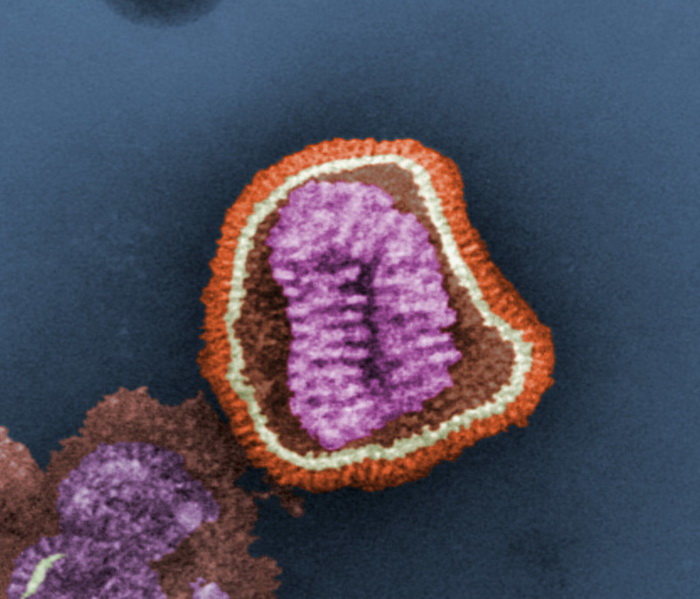
Вирус гриппа под электронным микроскопом.
Глюкоза помогает синтезировать иммунные сигналы, стимулирующие противовирусное воспаление.
Мы часто слышим, что пациенты с новым коронавирусом страдают от слишком сильного иммунного ответа – защитная иммунная реакция начинает вредить незаражённым тканям, что особенно опасно при хронических заболеваниях. Но такой неоправданно сильный иммунный ответ имеет место не только при коронавирусной инфекции, но и, например, при гриппе. Более того, иммунитет порой продолжает бушевать даже после того, как инфекция пошла на спад. Мы говорили, что так может происходить оттого, что вирус долгое время остаётся незамеченным: некоторые коронавирусы умеют подавлять сигналы тревоги от заражённых клеток. Другая причина может быть в особенностях самой иммунной системы: как известно, в иммунитет встроены самоограничители, которые регулируют силу иммунных реакций, стараясь, чтобы они были адекватны угрозе. Если есть проблемы с клетками и молекулами, которые работают регуляторами-ограничителями, то есть большая вероятность, что иммунная система при первой возможности пойдёт вразнос.
И ещё одна причина слишком сильного иммунного ответа связана с особенностями обмена веществ. Этот слишком сильный иммунный ответ развивается оттого, что повышается уровень сигнальных белков-цитокинов: их становится всё больше и больше, воспаление всё усиливается и усиливается, иммунные клетки, которые выделяют токсичные вещества для убийства заражённых клеток, выделяют их всё больше и больше, убивая здоровые клетки. Повышенный уровень воспалительных цитокинов и последствия, к которым это приводит, называют цитокиновым штормом.
Но ведь воспалительные цитокины тоже откуда-то берутся – их синтезируют клетки в ответ на вирусную инфекцию. Цитокины, как и любые белки, закодированы в ДНК. Гены цитокинов, как и любые другие гены, могут быть более активными и менее активными. Активность генов зависит от специальных регуляторных белков, называемых транскрипционными факторами: они садятся на ДНК в начале гена и взаимодействуют с белками, которые синтезируют РНК – которая потом пойдёт в цитоплазму и станет матрицей для сборки белков. Синтез РНК называется транскрипцией, и белки-транскрипционные факторы могут транскрипцию подавлять или усиливать.
На генах воспалительных цитокинов транскрипцию усиливает фактор под названием IRF5, или интерферон-регулирующий фактор 5. Но и сам IRF5 тоже может быть активным или неактивным. Сотрудники Уханьского университета пишут в Science Advances, что IRF5 становится активным, когда к нему присоединяется молекула под названием уридиндифосфат-N-ацетилглюкозамин, или UDP-GlcNAc. Исследователи экспериментировали с мышами, которых после заражения вирусом гриппа ждал цитокиновый шторм – но если у мышей отключали ген фермента, который активировал IRF5, то мыши переносили инфекцию спокойно (как, кстати, и при отключении гена самого IRF5).
Откуда берётся UDP-GlcNAc – активатор IRF5? Он берётся из серии метаболических реакций, которые называются гексозаминовым путём. Синтез UDP-GlcNAc начинается с глюкозы, и тут становится понятно, как связаны вирусная инфекция и слишком сильная иммунная реакция на неё. И вирусу, и иммунным клеткам нужно много глюкозы: во-первых, это источник энергии, во-вторых, она нужна для реакций, в которых создаётся строительное сырьё для более сложных молекул. Но чем больше глюкозы поступает в клетки, тем активнее идут и гексозаминовые реакции, увенчивающиеся UDP-GlcNAc. С одной стороны, всё правильно: против вируса нужны активные действия, и, следовательно, нужны иммунные сигналы-цитокины. С другой стороны, инфекция может уже идти на спад, а IRF5 будет продолжать стимулировать синтез цитокинов, потому что сам будет активирован UDP-GlcNAc.
Как можно догадаться, повышенный уровень глюкозы в крови будет здесь серьёзным фактором риска. Уровень глюкозы повышается при диабете, и хотя при диабете ей трудно проникать в клетки (из-за проблем с инсулином), всё же, если глюкозы оказывается слишком много, она может чрезмерно разогнать реакции синтеза UDP-GlcNAc, и клетка получит слишком активный IRF5.
- 4371
- 3,7
- 0
- 8
Нейродегенеративные и онкологические болезни — самые распространенные возрастные патологии после болезней сердца и сосудов. Как показывают исследования, эти патологии тесным образом связаны с энергетическим обменом и митохондриальной дисфункцией. Детальное и масштабное изучение изменений клеточного метаболизма при развитии этих патологий способствует разработке более совершенных диагностических инструментов, позволяющих обнаруживать заболевание на самой ранней его стадии.

Биоэнергетика
Наверное, у каждого, кто начинает знакомиться с удивительной организацией наших клеток, возникает чувство восхищения невероятной сложностью внутриклеточного мира. Каждую секунду в миллиардах наших клеток протекают сложные и строго скоординированные процессы. И одним из таких очень важных процессов является производство в митохондриях главной энергетической молекулы — аденозинтрифосфата, или АТФ. Сегодня уже хорошо известно, что работа митохондрий очень тесно связана со здоровьем и продолжительностью жизни [1]. Митохондрии производят энергию для поддержания жизни, но при этом они же служат основными источниками активных форм кислорода, избыток которых для клеток губителен.
Энергетический обмен
Любой живой организм находится в постоянной связи с окружающей средой, непрерывно обмениваясь с ней веществом. В этом процессе можно выделить три этапа:
- поступление веществ;
- метаболизм;
- выделение конечных продуктов.
Внутриклеточный метаболизм, в свою очередь, включает в себя два типа реакций: катаболизм и анаболизм.
На первом этапе катаболизма под воздействием пищеварительных ферментов сложные органические соединения (белки, полисахариды, жиры) распадаются на более простые — аминокислоты, моносахариды, жирные кислоты и глицерин, — которые клетка использует для реакций анаболизма (пластического обмена) и получения энергии. Аминокислоты идут на синтез белков. Жирные кислоты выполняют энергетическую функцию, входят в состав клеточных мембран и служат субстратом для синтеза эйкозаноидов
На втором этапе происходит гликолиз — расщепление молекул глюкозы (рис. 1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
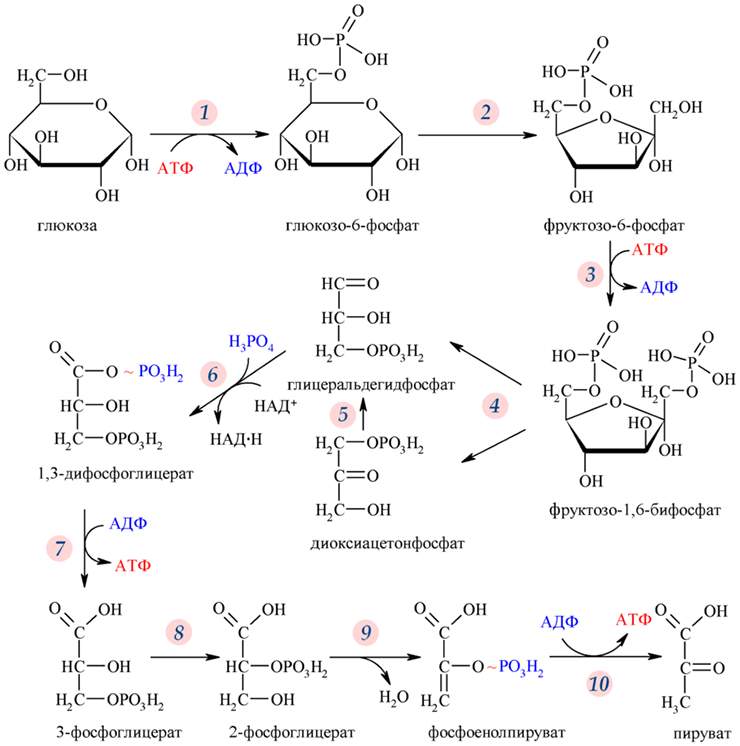
Если же кислород в клетке есть, ПВК будет расщепляться на углекислый газ и воду и тоже высвобождать заключенную в углеводной молекуле энергию. Этот процесс называется аэробным клеточным дыханием и проходит в специальных органеллах — митохондриях. Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Митохондрии и производство АТФ
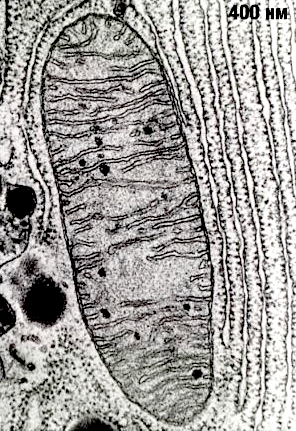
Рисунок 2. Митохондрия под электронным микроскопом.
Строение мембран очень важно для процесса дыхания. Внешняя мембрана митохондрий — гладкая, а внутренняя — многократно складчатая. Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание. Вначале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Работа же дыхательных белков-ферментов похожа на работу насосов: передавая электроны друг другу, они перекачивают протоны в межмембранное пространство (см. видео 1). В результате внутренняя мембрана митохондрии заряжается подобно конденсатору. Создаются потенциалы: электрический (положительные заряды — снаружи митохондриальной мембраны, отрицательные — внутри органеллы) и химический (возникает разница концентраций протонов: внутри митохондрии их меньше, снаружи — больше). Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Видео 1. Как работает митохондрия
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию — туда, где их концентрация ниже. Однако они могут проходить только по специальным каналам АТФ-синтазы, встроенной во внутреннюю мембрану: протонный канал (ротор) этого фермента закреплен в мембране, а каталитический комплекс торчит внутрь митохондрии, в матрикс (рис. 3). Поток протонов раскручивает ротор, как река водяную мельницу. В результате ротор вращается с невероятной скоростью — 300 оборотов в секунду (см. видео 2)! И именно это вращение приводит к образованию высокоэнергетической молекулы — АТФ [6]. Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
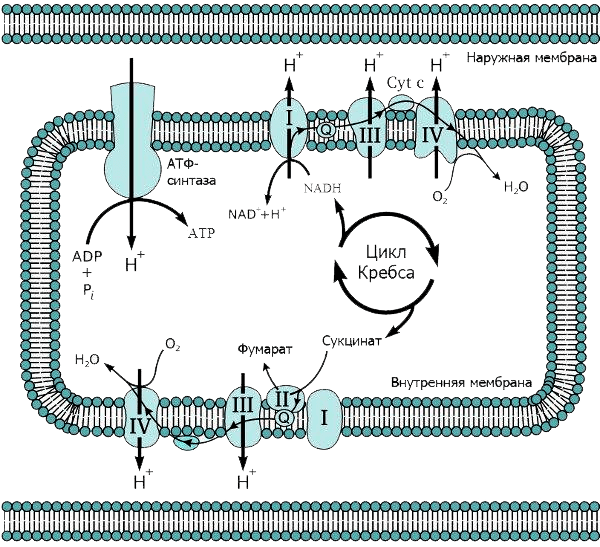
Рисунок 3. Схема дыхательной цепи митохондрий.
Видео 2. Работа АТФ-синтазы в мембране митохондрии
Жирные кислоты и дисфункция митохондрий
То, что старение и возрастные патологии сопровождаются дисфункцией митохондрий, которые начинают производить меньше АТФ и хуже обновляться, уже ни у кого не вызывает сомнения. Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
Ну и наконец, избыток жирных кислот вызывает стресс эндоплазматического ретикулума (ЭПР) — внутриклеточного органоида, участвующего в синтезе белков и множестве других процессов. При стрессе ЭПР в цитоплазму высвобождаются ионы кальция, способные вызывать дисфункцию и гибель митохондрий [11]. Ионы кальция могут накапливаться в клетке и по другой причине — из-за ухудшения работы ионных насосов, откачивающих кальций из клетки. А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ. Такая исключительная чувствительность нейронов к дефициту энергии и повышению генерации АФК объясняется несколькими причинами.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин. На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера [13], [14].
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
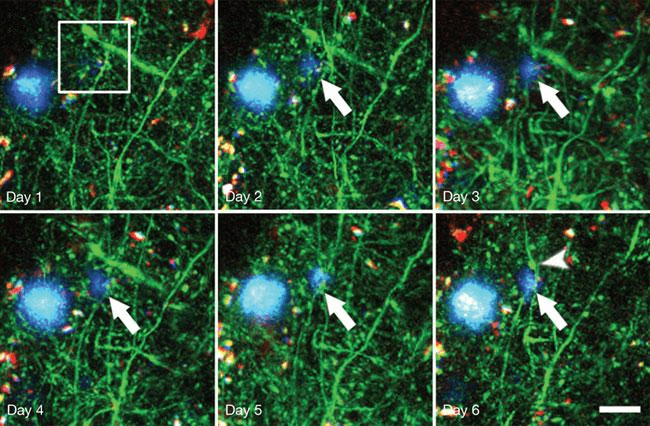
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви. Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания. Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути. Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных). Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран. Известно, что β-амилоид может связывать гем, а это ведет к дефициту гема в клетке, из-за чего нарушается работа гем-содержащего IV комплекса электронтранспортной цепи митохондрий [26].
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП. Дефектные формы τ-белка и хантингтина тоже мешают нормальной работе митохондрий, ухудшая тем самым энергообеспечение отростков нервных клеток и синаптическую передачу, вызывая дегенерацию синапсов [29].
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Эффект Варбурга
И напоследок стόит коснуться еще одного момента, связанного с патологиями и изменением клеточного метаболизма. В 1926 году немецкий биохимик Отто Варбург сравнил скорости образования молочной кислоты (лактата) в нормальных и опухолевых клетках. Оказалось, что опухолевые клетки потребляют очень много глюкозы, образуя при этом лактат. И делают это они гораздо быстрее, чем нормальные клетки: злокачественная ткань в эксперименте производила молочную кислоту в восемь раз активнее, чем это происходит в мышце, выполняющей физическую работу. Варбург установил, что раковые клетки используют гликолиз для получения энергии вне зависимости от доступности кислорода (рис. 5) [30]. В честь первооткрывателя этот феномен назвали эффектом Варбурга [2].
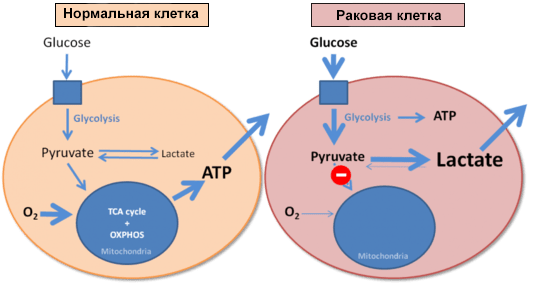
Рисунок 5. Энергообеспечение нормальной и раковой клеток. Синим квадратом обозначена поступающая в клетку глюкоза.
Обнаружив этот эффект, Варбург логично предположил, что его можно объяснить дисфункцией митохондрий в опухолевых клетках и нарушением окислительного фосфорилирования. Сегодня эта точка зрения ставится под сомнение, так как и в перерожденной ткани обнаруживают большое количество нормально работающих митохондрий. Около половины всей энергии опухолевые клетки получают из молекул АТФ, произведенных в митохондриях [31]. Эффект Варбурга проявляется в клетках уже в самом начале их трансформации в опухолевые. И это дает возможность проводить раннюю диагностику неопластических процессов: как только клетка начала расходовать глюкозу в повышенных масштабах, пора бить тревогу. Обнаружить эти процессы можно с помощью позитронно-эмиссионной томографии с использованием фторированного аналога глюкозы, 2-( 18 F)-2-дезокси-D-глюкозы.
Молекулярная онкология, преимплантационный скрининг, цитогенетика, пренатальные и постнатальные исследования, диагностика инфекций, наследственных, мультифакторных заболеваний, детекция генномодифицированных источников и бактериального загрязнения в продуктах питания, криминалистические приложения — это лишь неполный перечень областей, которые входят в сферу интересов отдела.
Основные направления деятельности отдела:
- комплексная поставка ПЦР- и иного оборудования для всех этапов анализа — пробоподготовки, амплификации, различных вариантов детектирования и архивирования результатов;
- запуск оборудования и обучение персонала;
- поставка расходных материалов и реагентов для диагностики и научных исследований;
- поиск и поставка тест-систем для решения уникальных задач или использующих передовые технологии, не имеющие пока широкого распространения в диагностической практике.
Отдел работает как с инновационной продукцией (MLPA, PGS и NGS исследования, клеточная биоэнергетика Agilent Seahorse Bioscience), так и с зарекомендовавшими себя мировыми брендами — Beckman Coulter, Bio-Rad, Molecular Devices, UVP, Thermo Fisher Scientific.

Вирусы очень интересные существа. Они не имеют клеток, с точки зрения науки не считаются живыми… да и наука до сих пор точно не может сказать что это такое.
Всё что касается вирусов — очень сложно! Поэтому мы и наблюдаем такой ажиотаж!
Чтобы по минимуму в этом разбираться, нужно хотя бы знать следующие термины:
1) Дезоксирибонуклеиновая кислота;
2) Рибонуклеи́новая кислота;
3) капсид;
4) рецепторы и корецепторы;
5) мембрана;
6) связь ключ-замок;
7) интеграза;
8) протеаза;
9) обратная транскриптаза;
10) домен;
11) транскрипция;
12) мессенджер;
13) цитоплазма;
14) репликация;
Вирусы размножаются в клетке. Но каждый вирус специализируется на определенных клетках!
Так ВИЧ заражает Т-лимфоциты, Грипп поражает эпителий гортани и легких, коронавирус поражает эпителий верхних дыхательных путей, легких и желудочно-кишечного тракта, Герпесы поражают нервы и вызывают нейроинфекции, гепатиты поражают клетки печени и т.д.
Как вирус проникает в клетку:
Т.е. 1 вирус попав в клетку организма, превращает её в фабрику по производству новых вирусов.
Как реагирует иммунитет? Обычно если вирусов немного, то зараженные клетки успевают уничтожить лимфоциты и натуральные киллеры.
Но если доза вирусов досталась большая или иммунитет ослаблен стрессом от слива депозита во время кризиса на рынках, то фабрика эта вирусная успешно запускается!
Но не всё так плохо! В организме есть сигнализация! Если вирус попадает в клетку, то клетка начинает индуцировать и выбрасывать вокруг себя особые белки интерфероны. Эти белки дают сигнал соседний клеткам и клетки блокируют свои мембраны, не давая вирусам попасть внутрь себя. Также подается сигнал иммунным клеткам, что тут что-то не так и надо начинать работу.
Что касается интерферонов, то тут вообще всё очень сложно:
Кроме того, особыми клетками иммунитета В-лимфоцитами начинают продуцироваться особые белки иммуноглобулины (в народе — антитела), которые блокируют белки вируса, превращая их в беспомощные цели для макрофагов.
Иммуноглобулины классов A, M, G (IgA, IgM, IgG) или антитела — белки, которые вырабатываются иммунной системой организма в ответ на внедрение бактерий, вирусов, грибов и других чужеродных агентов (антигенов).
Антитела специфичны и вырабатываются к каждому конкретному антигену. Выработкой иммуноглобулинов сопровождается и аллергическая реакция. При аутоиммунных заболеваниях антитела продуцируются к собственным тканям.
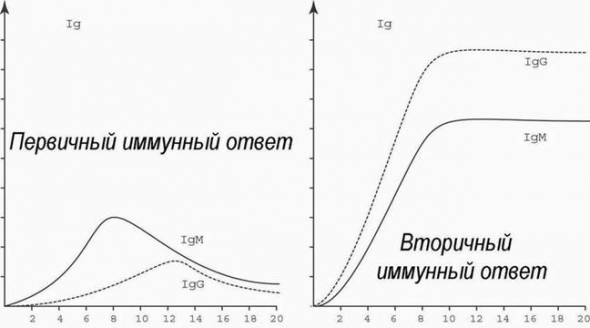
Существуют пять классов антител, среди которых наибольшее диагностическое значение имеют IgA, IgG и IgM.
IgA-антитела синтезируются в дыхательных путях, желудочно-кишечном тракте, влагалище и других органах. Эти антитела защищают организм от вторжения чужеродных агентов извне. На долю иммуноглобулинов класса А приходится 10-15% всех антител. У небольшого числа людей IgA-антитела не вырабатываются — селективный дефецит иммуноглобулина A.
IgM-антитела находятся в крови и лимфатической жидкости. При попадании антигена именно иммуноглобулины М вырабатываются в первую очередь. Уровень IgM антител составляет 5-10%.
IgG-антитела обнаруживаются во всех жидкостях организма. Они являются самыми маленькими, но наиболее распространенными антителами (около 75-80% от всех иммуноглобулинов в организме). Только IgG-антитела могут проникать через плаценту беременной женщины, а, значит, и защищать плод — приблизительно до 6-месячного возраста.
Низкий уровень иммуноглобулинов может свидетельствовать о недостаточности иммунной системы. Повышенное количество иммуноглобулинов может вырабатываться при множественной миеломе (IgG, IgA), макроглобулинемии (IgM), первичном системном амилоидозе и других состояниях.
Как работают антитела:
Обычно это всё выглядит вот так: 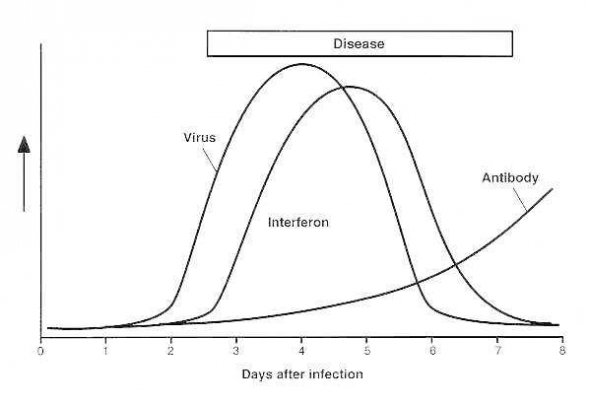
После выработки достаточно антител класса IgG — у вас теперь есть долгосрочный иммунитет от вируса!
Обычно на это у организма уходит 10-14 дней! Если вы не умерли в первые 5-8 дней, значит у вас хорошие шансы на выздоровление!
(исключение — люди болеющие СПИДом, наркоманы, алкоголики, голодающие, а также лица проживающие в неблагоприятных экологических условиях)
Теперь я надеюсь всем понятно, почему у нас столько много людей выздоровевших после коронавируса и почему всех сажают на карантин именно на 2 недели?
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Азаренок А. А., Еропкина Е. М., Прочуханова А. Р., Шалджян А. А., Козлова Н. М.
Современные эпидемические штаммы вирусов гриппа подтипов H5N1, H3N2, H1N1 способны снижать метаболизм клеток эндотелия в пределах от 20 до 60% (по сравнению с контролем). Степень снижения активности дегидрогеназ зависела от дозы заражения клеток вирусом и от времени его репродукции. Гемагглютинин и нейраминидаза также активно снижали метаболизм клеток в пределах от 5 до 60%, что зависело от концентрации белков и времени их воздействия на клетку. По МТТ-тесту нейраминидаза оказалась активнее гемагглютинина (при концентрации белков 50 мкг/мл).
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Азаренок А. А., Еропкина Е. М., Прочуханова А. Р., Шалджян А. А., Козлова Н. М.
The Influenza Viruses and Their Surface Proteins Impact on the Metabolism of Human Blood Vessel Endothelium Cells
The modern influenza virus subtypes H3N2, H5N1, and H1N1 reduced the metabolism of the endothelial cells within the range from 20% to 60% (compared with control). The degree of the activity of the dehydrogenase reduction depended on the dose of virus and time of virus reproduction. HA and NA also actively reduced the metabolism of the cells ranging from 5% to 60%, depending on the concentration of the proteins and time of their impact on cells. Neuraminidase was more active than hemagglutinin in the MTT test (at concentration 50 μg protein/ml).
5. Du L., Zhou Y., Jiang S. Research and development of universal influenza vaccines. Microb. Infect. 2010; 12: 280-6.
6. Iwasaki A., Medzhitov R. Toll-like receptor control of the adaptive immune response. Nat. Immunol. 2004; 5: 987-95.
7. Fan J., Liang X., Horton M.S. et al. Preclinical study of influenza virus A M2 peptide conjugate vaccines in mice, ferrets, and rhesus monkeys. Vaccine. 2004; 22: 2993-3003.
8. Feng T., Cong Y., Alexander K., Elson C.O. Regularion of toll-like receptor 5 gene expression and function on mucosal dendritic cells. PLoS One. 2012; 7: e35918.
9. FiletteM., Fiers W., Martens W. et al. Improved design and intranasal delivery of an M2e-based human influenza A vaccine. Vaccine. 2006; 24: 6597-601.
10. Fiers W., De Filette M., El Bakkouri K. et al. M2e-based universal influenza A vaccine. Vaccine. 2009; 27: 6280-3.
11. Honko A.N., Sriranganathan N., Lees C.J. et al. Flagellin is an effective adjuvant for immunization against lethal respiratory challenge with Yersinia pestis. Infect. immun. 2006; 74: 1113-20.
12. Huleatt J.W., Jacobs A.R., Tang J. et al. Vaccination with recombinant fusion proteins incorporating Toll-like receptor ligands induces rapid cellular and humoral immunity. Vaccine. 2007; 25: 763-75.
13. Huleatt J.W., Nakaar V., Desai P. et al. Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a re-
combinant fusion protein linking influenza M2e to the TLR5 ligand flagellin. Vaccine. 2008; 26: 201-14.
14. Jegerlehner A., SchmitzN., Storni T. et al. Influenza A vaccine based on the extracellular domain of M2: weak protection mediated via antibody-dependent NK cell activity. J. Immunol. 2004; 172: 5598605.
15. Mozdzanowska K., Feng J.Q., EidM. et al. Induction of influenza type A virus specific resistance by immunization of mice with a synthetic multiple antigenic peptide vaccine that contains ectodomains of matrix protein 2. Vaccine. 2003; 21: 2616-26.
16. Osterhaus A., Fouchier R., Rimmelzwaan G. Towards universal influenza vaccines? Phil.Trans. R. Soc. B. 2011; 366: 2766-73.
17. Rudolph W., Ben-Yedidia T. Human vaccines: policy. Hum. Vaccines. 2011; 7: 10-1.
18. PumpensP., GrensE. HBV core particles as a carrier for B cell/T cell epitopes. Intervirology. 2001; 44: 98-114.
19. Schotsaert M., De Filette M., Fiers W., Saelens X. Universal M2 ectodomen-based influenza A vaccines: preclinical and clinical developments. Expert. Rev. Vaccines. 2009; 8: 499-508.
20. TalbotH.K., RockM.T., Johnson C. et al. Immunopotentiation of trivalent influenza vaccine when given with VAX102, a recombinant influenza M2e vaccine fused to the TLR5 ligand flagellin. PLoS One. 2010; 5: e14442.
А. А. Азаренок, Е. М. Еропкина, А. Р. Прочуханова, А. А. Шалджян, Н. М. Козлова, К. Н. Козелецкая,
Воздействие вирусов гриппа А и их поверхностных белков на метаболизм клеток эндотелия кровеносных сосудов человека
Современные эпидемические штаммы вирусов гриппа подтипов H5N1, H3N2, H1N1 способны снижать метаболизм клеток эндотелия в пределах от 20 до 60% (по сравнению с контролем). Степень снижения активности дегидрогеназ зависела от дозы заражения клеток вирусом и от времени его репродукции. Ге-магглютинин и нейраминидаза также активно снижали метаболизм клеток в пределах от 5 до 60%, что зависело от концентрации белков и времени их воздействия на клетку. по МТТ-тесту нейраминидаза оказалась активнее гемагглютинина (при концентрации белков 50 мкг/мл).
Ключевые слова: вирус гриппа, белки, клетки эндотелия, метаболизм, активность дегидрогеназ
The influenza Viruses and Their surface Proteins impact on the Metabolism of human Blood Vessel Endothelium cells
A. A. Azarenok, E. M. Eropkina, A. R. Prochukhanova, A. A. Shaldzhyan, N. M. Kozlova,
K. N. Kozeletskaya, I. N. Zhilinskaya
Federal State Research Institute of Influenza, Ministry of Health and Social Development of the Russian Federation, St.
the modern influenza virus subtypes H3N2, H5N1, and H1N1 reduced the metabolism of the endothelial cells within the range from 20% to 60% (compared with control). the degree of the activity of the dehydrogenase reduction depended on the dose of virus and time of virus reproduction. HA and NA also actively reduced the metabolism of the cells ranging from 5% to 60%, depending on the concentration of the proteins and time of their impact on cells. Neuraminidase was more active than hemagglutinin in the MTT test (at concentration 50 pg protein/ml).
Key words: influenza virus, proteins, endothelium cells, metabolism, activity of dehydrogenases
Общеизвестно, что поражение вирусом гриппа кровеносных сосудов, приводящее к тромбогеморрагическому синдрому, является одним из признаков тяжело протекающей гриппозной инфекции [8]. Однако этому аспекту патогенеза гриппа ранее уделялось недостаточ-
но внимания. За последнее десятилетие появился ряд данных, указывающих на взаимодействие вируса гриппа с эндотелием кровеносных сосудов, в частности на возможность репродукции вируса в клетках эндотелия с последующим развитием их дисфункции [2, 3, 11].
Жилинская Ирина Николаевна, д-р биол. наук, вед. науч. сотр., ст. науч. сотр.; e-mail: irina@influenza.spb.ru
Вместе с тем не только сам вирус, но и отдельные белки могут оказывать действие на эндотелиальные клетки, вызывая нарушение их жизнедеятельности [4—7].
Цель нашей работы состояла в сравнительном исследовании влияния вирусов гриппа А и их поверхностных белков на метаболизм эндотелиальных клеток перевиваемой линии EAhy926.
Материалы и методы
Вирусы. Исследовали 3 штамма вирусов гриппа: эпидемический штамм вируса гриппа человека А/Брисбен/10/2007 (H3N2); реассортантный штамм вируса гриппа птиц А/курица/Курган/5/05 NSl-81/5:3 (этот штамм получен методом обратной генетики; геном включает следующие гены: а) полимераз РВ2 и РА, нуклеопротеина (NP), неструктурных белков (NS) от вируса A/PR/8/34(H1N1); полимеразы РВ1 от вируса А/Техас/1/77 (H3N2); б) гемагглютинина (НА) от дикого штамма А/курица/Курган/5/05 (H5N1), модифицированного по сайту расщепления; в) нейрамини-дазы (NA) и мембранных белков (М) от дикого вируса птиц А/курица/Курган/02/05 (H5N1)); пандемический штамм А/Санкт-Петербург/2/2009(HlNlpdm). Все вирусы получены из лаборатории эволюционной изменчивости вирусов гриппа.
Определение инфекционной активности вируса гриппа в культуре клеток. Инфекционную активность вирусов гриппа определяли титрованием вируссодержащего материала в суточной культуре EAhy926 с коэффициентом 10 и рассчитывали по методу Рида и Менча (1938). Инфекционную активность вирусов оценивали по ТЦД50 и в РГА с куриными эритроцитами по общепринятому методу через 72 ч после заражения.
Клеточные культуры. Репродукцию вирусов изучали на культуре клеток эндотелия человека EAhy926, любезно предоставленной д-ром Корой Джин Эйджел из Отдела патологии университета Северной Каролины. Клеточная линия EAhy926 воспроизводит основные морфологические, фенотипические и функциональные характеристики, присущие эндотелиальным клеткам сосудов [9].
Белки вируса гриппа. Гемагглютинин (НА) и ней-раминидазу (NA) выделяли из концентрированного и очищенного вируса гриппа. С этой целью вирусы ресуспендировали в Na-ацетатном буфере (50 мМ
Метаболизм клеток эндотелия оценивали с помощью метилтетразолиевого теста (МТТ) на общую активность внутриклеточных дегидрогеназ, который широко используется для биохимической оценки выживаемости клеток в культуре [10]. Метод основан на восстановлении диметилтиазолил-дифенилбромид тет-разолия митохондриальными и цитоплазматическими дегидрогеназами метаболически активных клеток.
Клетки EAhy926 вносили в 96-луночные планшеты в концентрации 32 000 кл/лунка в 100 мкл культуральной среды. На следующий день клетки либо заражали вирусами по общепринятой методике, либо обрабатывали поверхностными белками исследуемых вирусов в разной концентрации при разном времени экспозиции. После экспозиции клеток или с вирусом, или с белком культуральную среду удаляли, к клеткам добавляли раствор МТТ-реактива в бессывороточной культуральной среде в концентрации 5мг/мл и инкубировали 3 ч в СО2-инкубаторе. Затем раствор красителя сливали и заменяли 96o спиртом на 30 мин. Далее планшету помешали в спектрофотометр Thermofisher VarioScan и снимали показания при длине волны 540 нм.
Статистическую обработку данных проводили с помощью программного обеспечения Microsoft Excel.
Время после заражения, ч
Рис. 1. Изменение общей дегидрогеназной активности в культуре клеток EAhy926 при воздействии исследуемых вирусов гриппа
а - вирус гриппа А/Брисбен/10/2007(Н3^); б - вирус гриппа А/курица/Курган/5/05 NS1-81/5:3(H5N1); в - вирус гриппа A/CanCT-
Читайте также:


