Методы культивирования вирусов индикация и идентификация вирусов
| Культивирование вирусов в организме чувствительных животных | Культивирование вирусов на куриных эмбрионах | Культивирование вирусов в культурах клеток |
| Животные: взрослые или новорожденные (белые мыши, хомяки, кролики, обезьяны и др); Способы заражения: подкожно, внутримышечно, интраназально, интрацеребрально и т.д.) | Куриные эмбрионы 5-12 дневные; Заражают в: · Амниотическую полость · Аллантоисную полость · Желточный мешок · Эмбрион · На хорион-аллантоисную мембрану | Для приготовления культур клеток используют: 1.Эмбриональные ткани человека и животного; 2. Клетки злокачественных образований; 3. Нормальные ткани человека, обезьян и др. животных. |
| Методы индикации: u Клиническая картина u Патоморфологические изменения в органах и тканях, u Реакция гемагглютинации (РГА) с суспензией органов. Недостатки: видовая невосприимчивость животных ко многим вирусам человека, контаминация животных посторонними микробами, экономические и этические. | Методы индикации: u Гибель эмбриона u Специфические поражения оболочек и тела эмбриона (бляшки, оспины, кровоизлияния) u Реакция гемагглютинации (РГА). Недостатки: многие вирусы не размножаются в эмбрионах птиц. | Методы индикации: u Цитопатогенного действия (ЦПД), u Образование внутриклеточных включений, u Реакция гемадсорбции, u Реакция гемагглютинации, u Цветная реакция, u Бляшкообразование. |
| Методы идентификации (типирования) РН, РГА | Методы идентификации (типирования) РН (в т.ч. РТГА), РСК | Методы идентификации (типирования) РН (в т.ч. РТГА), РСК, РИФ |
*Индикациявирусовлабораторный процессустановления присутствия неидентифицированныхвирусовв иссл.материале или в системе культивированиявирусов.
Условия выращивания клеточных культур:
u Соблюдение правил асептики;
u Использование лабораторной посуды из нейтрального стекла или специальных реакторов;
u Использование сложных питательных сред (среда 199, Игла), содержащих минеральные соли, аминокислоиты, витамины, глюкозу, сыворотку крови животных и человека, буферные растворы для поддержания рН;
u Добавление антибиотиков к питательной среде;
u Соблюдение оптимальной температуры (36 – 38,5 С) роста клеток
Типы клеточных культур
n Однослойныекультуры клеток – клетки прикрепляются и размножаются в виде монослоя на поверхности химически
нейтрального стекла;
n Суспензионныекультуры клеток – клетки размножаются во всем объеме питательной среде;
n Органныекультуры – цельные кусочки органов и тканей.
Однослойные клеточные культуры: по числу генераций различают:
n Первичные культуры– способны размножаться только в первых генерациях, т.е. выдерживают не более 5-10 пассажей после выделения из тканей.
n Перевиваемыеили стабильные культуры – способны размножаться в лабораторных условиях десятки лет.
n Полуперевиваемые культуры– выдерживают 40-50 пассажей.
Вироиды и прионы. Пролиферация прионов. Прионные болезни.
Близкие к вирусам инфекционные агенты если:
1. только НК = вироид,
2. только белок = прион.
Терминология
Вироиды это - инфекционные агенты, состоящие только из кольцевой РНК. Вироиды это лишенные оболочки небольшие молекулы кольцевой, обычно одноцепочечной РНК. Вироиды способны автономно инфицировать клетки хозяина.
Прионы - особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот.
Пролиферация патологических прионов: превращение прионов в измененные формы происходит при нарушении кинетически контролируемого равновесия между ними. Процесс усиливается при возрастании количества патологического (РгР) или экзогенного приона. РгР является нормальным белком, заякоренным в мембрану клетки. РгР' - глобулярный гидрофобный белок, образующий агрегаты с собой и с РгР'' на поверхности клетки: в результате РгР' преобразуется в РгР'' и далее цикл продолжается. Патологическая форма РгР''' накапливается в нейронах, придавая клетке губкообразный вид.
Нозологические формы прионных болезней человека:
n болезнь Крейтцфельдта-Якоба (БКЯ)
n Куру
n синдром Герстманна-ШтреусслераШейнкера (СГШШ)
n фатальная семейная инсомния (ФСИ)
7. Общая характеристика и строение бактериофагов. Этапы взаимодействия вирулентного фага с бактерией-хозяином.
8. Умеренные бактериофаги: особенности, репродукция. Лизогения и лизогенная конверсия.
9. Применение бактериофагов в медицине.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Культивирование вирусов человека проводят с целью лабораторной диагностики вирусных инфекций, для изучения вопросов патогенеза и иммунитета, для получения диагностических и вакцинных препаратов.
Для культивирования вирусов используют лабораторных животных, развивающиеся куриные эмбрионы, культуры клеток.
Лабораторных животных разными способами заражают (учитывают тропизм вирусов: ортомиксовирусами заражают интраназально, нейровирусами – субдурально). На основании типичных признаков заболевания и патоморфологических изменений органов животных можно судить о репродукции вирусов, т.е. проводить индикацию вирусов.
Куриный эмбрион является удобной моделью для культивирования вирусов, т.к. полости его стерильны, защищены твердой оболочкой. Индикацию вируса в курином эмбрионе проводят: по гибели эмбриона; помутнению хорион-аллантоисной оболочки; образованию бляшек на оболочке; в реакции гемагглютинации (происходит склеивание эритроцитов под действием гемагглютинина вирусов, который расположен в шипах суперкапсида).
Метод культур клеток. Для приготовления культур клеток используют различные ткани человека и животных. Чаще применяют культуры клеток из эмбриональных (куриные фибробласты, человеческие фибробласты) и опухолевых (злокачественно перерожденных) тканей, обладающих активной способностью к росту и размножению.
Различают три типа культур клеток: однослойные культуры клеток; культуры суспензированных клеток; органные культуры.
Однослойные культуры клеток по числу жизнеспособных генераций разделяют на первичные или первично трипсинизированные (куриные и человеческие фибробласты); перевиваемые (способны размножаться в лабораторных условиях длительное время); полуперевиваемые диплоидные (способны размножаться в течение 40-50 пассажей).
Для культивирования клеток необходимы питательные среды, которые по своему назначению делятся на ростовые и поддерживающие. В составе ростовых питательных сред должно содержаться больше питательных веществ, чтобы обеспечить активное размножение клеток для формирования монослоя. Поддерживающие среды должны обеспечивать лишь переживание клеток в уже сформированном монослое при размножении в клетке вирусов.
Широкое применение находят стандартные синтетические среды, например, синтетическая среда 199 и среда Игла. Независимо от назначения все питательные среды для культур клеток конструируются на основе сбалансированного солевого раствора. Чаще всего им является раствор Хенкса. Неотъемлемый компонент большинства ростовых сред – наличие 5-10 % сыворотки крови животных (телячьей, бычей, лошадиной), без наличия которой размножение клеток и формирование монослоя не происходит. В состав поддерживающих сред сыворотка не входит.
Культуры суспензированных клеток растут и размножаются во взвешенном состоянии при постоянном интенсивном перемешивании среды. Они используются для накопления вирусов.
Некоторые вирусы размножаются в органных культурах – это кусочки органов, выращенные вне организма и сохраняющие структуру данного органа.
О размножении вируса в культуре клеток судят по следующим признакам: цитопатогенному действию (ЦПД); образованию в клетках включений; появлению бляшек; феномену гемадсорбции; цветной пробе.
Цитопатогенное действие может проявляться полной дегенерацией клеток – слущиванием клеток с поверхности стекла после их гибели (энтеровирусы полиомиелита, Коксаки); частичной дегенерацией – округлением клеток, слиянием и образованием симпластов (вирус кори).
Образование включений в клетках – это скопление вирионов или отдельных компонентов в цитоплазме или в ядре клеток, выявляемые под микроскопом при специальном окрашивании. Вирус натуральной оспы образует цитоплазматические включения – тельца гварниери, вирусы герпеса, аденовирусы – внутриядерные включения.
Появление бляшек – зоны клеток, разрушенных вирусом (негативные колонии вирусов), обнаруживают в клеточных культурах, растущих на стекле и покрытых тонким слоем агара. Бляшки различаются по величине, форме, времени появления, поэтому данный тест используют для дифференциации вирусов.
Реакция гемадсорбции заключается в способности клеток, зараженных вирусами, адсорбировать на своей поверхности эритроциты, потому что эти клетки несут на поверхности гемагглютинины вируса.
Цветная реакция основана на изменении цвета питательной среды с индикатором, используемой для культур клеток. При росте клеток, не пораженных вирусом, идет накопление продуктов метоболизма, которые изменяют цвет питательной среды. При репродукции вирусов в культуре нарушается метаболизм клеток, и среда сохраняет первоначальный цвет.
При отсутствии ЦПД можно поставить реакцию интерференйии – исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительная), если в исследуемом материале вируса не было, наблюдается ЦПД.
Лабораторная диагностика вирусных инфекций.Используют методы экспресс-диагностики для обнаружения возбудителя или его антигенов в клиническом материале (ИФА, РИА, метод молекулярной гибридизации, ИФА, ПЦР, ВИЭФ, РПГА, электронной микроскопии, иммуно электронной микроскопии).
Выделение вируса и его индикацию и идентификацию проводят в вирусологическом методе диагностики. С этой целью необходимо обеспечить взятие материла от больного, правильную транспортировку его в лабораторию и грамотного заполнения сопроводительных документов. Выделение вируса из клинического материала проводят путем заражения культур клеток куриных эмбрионов и лабораторных животных. Индикацию вирусов проводят по гибели эмбрионов, постановке РГА, ЦПД в культуре клеток.
Идентификацию вирусов проводят с помощью серологических методов (постановки РТГА, РСК, ИФА, РИА, РН). Серологическая диагностика вирусных инфекций проводится с парными сыворотками больного, взятыми в острой фазе заболевания и через 10-14 дней. Обнаружение четырехкратного и более повышения титра антител рассматривается как диагностический признак острой вирусной инфекции.
Принципы химиотерапии и химипрофилактики вирусных инфекций.Мишенью действия противовирусных препаратов являются процессы адсорбции, проникновения вируса в клетку, депротеинизации, транскрипции, репликации и сборки вирусов.
1. Аномальные нуклеозиды ингибируют функции вирусных полимераз (иоддезоксиуредин, ацикловир при лечении герпеса).
2. Производные адамантамина гидрохлорида. Ремантадин ингибирует репролукцию вирусов гриппа, кори, краснухи
3. Тиосемикарбазон подавляет синтез вирусных белков и сборки вирусных частиц, активен против вирусов натуральной оспы.
4. Ингибиторы протеаз (гордокс, контрикал, аминокапроновая кислота).
5. Нарушают синтез вирусных белков – интерфероны.
Бактериофаги (от бактерий и греч, рhagos-пожиратель) – вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их лизис. Они не размножаются в эукариотических клетках.
В 1910 г. Ф. д’Эрелль обнаружил лизис бактерий дизентерии после добавления к ним бесклеточного фильтрата испражнений больных дизентерией и назвал фактор лизиса бактериофагом.
Бактериофаги широко распространены в природе, их обнаруживают в воде, почве, пищевых продукта, в различных выделениях из организма человека и животных.
Морфология. Большинство фагов под электронным микроскопом напоминают по форме головастика или сперматозоида; имеют головку и отросток (рис. 8), но встречаются и другие морфологические варианты. Размеры фагов – 20-200 нм. Выделяют пять основных типов бактериофагов. К 1 типу относятся ДНК-овые фаги нитевидной формы, которые лизируют бактерии, содержащие F- или R-плазмиду; II тип – РНК-содержащие фаги с рудиментом отростка; III тип – фаги ТЗ, Т7 с коротким отростком; IV тип – фаги с несокращающимся чехлом отростка и двунитевой ДНК (Т1, Т5 и др.); V тип – ДНК-содержащие фаги с сокращающимся чехлом отростка, который заканчивается базальной пластинкой. Наиболее изучены Т-фаги (англ. type – типовые) E.coli – группа коли-дизентерийных фагов, включающая 7 представителей Т1-Т7.
Структура. Фаги имеют нуклеиновую кислоту (ДНК или РНК) и белок. Двунитевая ДНК фагов замкнута в кольцо и упакована в головке. Некоторые фаги содержат однонитевую ДНК или РНК. Капсид головки фага образован белками по кубическому типу симметрии.
В частицах некоторых фагов под чехлом дистальной части отростка (фаг T2) содержится фермент лизоцим, АТФ-аза и ионы кальция. Внутри головки (фаг T2) имеется внутренний белок, связанный с нуклеиновой кислотой, который содержит полиамины (спермин, путресцин). Он обеспечивает суперспирализацию фаговой ДНК и ее упаковку в головке фага. Отросток (хвост) фага имеет полый белковый стержень (построен по типу спиральной симметрии), покрытый сократительным чехлом. Белки чехла связаны с молекулами АТФ и ионами кальция. Чехол способен сокращаться. Под чехлом в конце отростка может находиться лизоцим. Отросток обычно заканчивается базальной пластинкой, имеющей короткие зубцы, от которых отходят тонкие нити – структуры, обеспечивающие адсорбцию фага на бактерии.
Резистентность к факторам окружающей среды. Фаги более устойчивы к действую физических и химических факторов, чем бактерии и вирусы. Они выдерживают давление до 6 000 атм, сохраняют свою активность при рН от 2,5 до 8; не все дезинфицирующие вещества (0,5% раствор фенола, 1% раствора сулемы, этиловый спирт, эфир, хлороформ) разрушают фаги. Однако ультрафиолетовые лучи и ионизирующая радиация, 1% раствор формалина, температура 65-70°С инактивируют их. Они сохраняются длительное время при высушивании в запаянных ампулах, замораживании, в глицерине при температуре 185°С.
Антигенные свойства. Бактериофаги обладают иммуногенными свойствами, вызывают синтез антител (AT), которые не дают перекрестных реакций с антигенами (АГ) бактерий, инфицированных фагами. Для идентификации фагов применяют реакцию нейтрализации с гомологичной антисывороткой, реакцию преципитации, реакцию агглютинации. По антигенам фаги делятся на серотипы.
Взаимодействие фагов с бактерией включает несколько стадий.
Адсорбция фагов на бактерии осуществляется рецепторами фага, имеющимися на конце отростка, которые связываются с поверхностными структурами бактериальной стенки. Бактериофаги не адсорбируются на бактериях, лишенных клеточной стенки (протопластах). Некоторые фаги адсорбируются на F-пилях бактерий. Адсорбция фагов зависит от рН среды, температуры, наличия некоторых веществ (триптофана для Т2-фага). На одной клетке может адсорбироваться до 300 фагов.
Внедрение нуклеиновой кислоты фага (инъекция фага). Базальная пластина отростка и его лизоцим лизируют участок клеточной стенки бактерии. Одновременно в чехле высвобождаются ионы кальция, активирующие АТФ-азу, происходит сокращение чехла и вталкивание стержня отростка через мембрану в бактерию. При этом фаговая ДНК (РНК) через стержень впрыскивается в цитоплазму клетки, белки головки и отростка остаются снаружи.
Репродукция фага. Проникнув в клетку ДНК фага переходит в латентное состояние (скрытая – эклипс-фаза). В этот период она подавляет синтетические клеточные процессы клетки и индуцирует синтез фаговых белков.
Синтез фаговых белков. Бактериальная РНК-полимераза транскрибирует фаговую ДНК в мРНК, по которой в рибосомах синтезируются ранние белки фага и его РНК-полимераза. Последняя обеспечивает транскрипцию поздних белков оболочки..
Репликацию фаговой нуклеиновой кислоты осуществляют синтезированные в клетке ДНК-полимеразы. ДНКбактерии нередко расщепляется и служит материалом для синтеза нуклеиновой кислоты фага.
Взаимодействие фагов с бактериальной клеткой характеризуются высокой специфичностью. Моновалентные фаги взаимодействуют только с бактериями определенного вида, а типовые фаги – только с отдельными вариантами (типами) данного вида бактерий. Типоспецифические бактериофаги используют для выявления соответствующих бактерий – т.е. для их фаготипирования. Поливалентные фаги могут взаимодействовать с родственными видами бактерий.
Умеренные фаги и лизогения.Взаимодействие фага с клеткой иногда ведет к интеграции его генома в геном бактерии. Фаги, вызывающие данный тип взаимодействия, называют умеренными. ДНК умеренного фага встраивается в ДНК бактерии и такой фаг называют профагом. Таким образом, умеренные фаги бывают в трех состояниях: зрелый фаг, вегетативный фаг и профаг. Профаг, ставший частью хромосомы бактерии, при ее размножении реплицируется синхронно с ее геномом, но не вызывает бактериолизиса, а передается по наследству от клетки к клетке неограниченному числу потомков.
Явление интеграции генома бактерии с умеренным фагом в состоянии профага называется лизогенией, а бактерии, несущие профаг – лизогенными. Бактериальная клетка, несущая в себе профаг, становится резистентной к действию идентичного фага. В клетке вырабатываются репрессоры – белки генома профага, препятствующие его размножению и проникновению в клетку идентичных фагов. Связь генома профага и бактерии непостоянна и под действием ультрафиолетовых лучей, радиации, некоторых химических веществ возможно образование зрелых форм фага и лизис бактерии. Эти фаги, бывшие профагами, могут со своей ДНК переносить группы генов бактерии в другую бактерию, в которой они снова переходят в профаг. Бактерия, зараженная таким фагом, приобретает новые свойства за счет генов предыдущей бактерии, перенесенных дефектным фагом. Изменение свойств микроорганизмов под влиянием профага обозначается как фаговая лизогенная конверсия. Она может происходить у многих видов микроорганизмов и сопровождается изменением их различных свойств: культуральных, биохимических, антигенных, токсигенных, чувствительности к антибиотикам. Причиной ее может быть наряду с переносом генов других бактерий с помощью фага, также активация молчащих генов бактерий, когда гены профага выступают в роли промоторов.
Явление переноса генов бактерий умеренными фагами называют трансдукцией. Эти фаги обычно неспособны образовывать фаговое потомство, если в их нуклеиновую кислоту встроилась часть нуклеиновой кислоты бактериальной клетки. Трансдуцирующие фаги используют в качестве векторов (переносчиков) в генной инженерии. С их помощью в бактерии переносят гены человеческих клеток, синтезирующие гормоны, цитокины и др.
Получение фагов. Для получения вирулентного фага готовят фильтрат исходного материала (вода, фильтрованная суспензия фекалий и др.), пропуская его через бактериальные фильтры.
Фильтрат вместе с соответствующей бактериальной культурой засевают в бульон и инкубируют при 37 0 С в течение 18-24 часов. Фаги размножаются, и после лизиса культуры оставшиеся бактериальные клетки удаляют центрифугированием или фильтрацией через бактериальный фильтр.
Титрование бактериофаговпроводят в жидкой (метод Аппельмана) или твердой (метод Грациа) питательной среде.
В пробирках с МПБ готовят десятикратные разведения бактериофага. В каждую пробирку вносят соответствующую бактериальную культуру по 0,1 мл. Через сутки инкубации в термостате при 37 0 С оценивают результаты. Наибольшее разведение фага, в котором отсутствует рост бактерий, принимаются за титр фага.
По методу Грациа на чашки с МПА наносят смесь фагов и бактерий. Для этого к расплавленному и остуженному до 45°С агару добавляют деситикратные разведения бактериофага и соответствующую тест культуру. Смесь быстро выливают на поверхность МПА. После застывания второго слоя агара чашки инкубируют при 37°С. Незараженные фагом бактерии, размножаясь, образуют сплошной газон роста на поверхности агара.
Каждая инфицированная фагом бактерия лизируется и освобождает потомство фага, состоящие из сотен новых фаговых частиц. Они внедряются в интактные клетки и весь цикл повторяется. В результате лизиса клеток фагом на сплошном бактериальном газоне появляются стерильные пятна. Число этих пятен соответствуют количеству фаговых частиц в засеянной смеси. Титр фага – максимальное разведение фага, при котором еще отмечаются стерильные пятна лизиса.
Практическое использование фагов.Применение фагов основано на строгой специфичности их действия. Фаги используют в диагностике инфекционных болезней: проводят идентификацию выделенных культур микроорганизмов – фаготипирование, т.е. устанавливают с помощью фага принадлежность неизвестной выделенной культуры бактерии к определенному виду или типу. Фаготипирование имеет большое эпидемиологическое значение, так как позволяет установить источник и пути распространения инфекций; с помощью тест-культуры можно определить неизвестный фаг в исследуемом материале, что указывает на присутствие в нем соответствующих возбудителей.
Фаги применяют для лечения и профилактики инфекционных болезней. Налажено производство брюшнотифозного, сальмонеллезного, дизентерийного, протейного, синегнойного, стафилококкового, стрептококкового, коли-фагов и комбинированных фагов. Фаги выпускают в жидком виде, в таблетках с кислотоустойчивым покрытием, в форме мазей, аэрозолей, свечей.
Бактериофаги используют для изучения структуры генома бактерий и в генной инженерии в качестве вектора – переносчика генов человека в бактерии. В настоящее время получены культуры бактерий, синтезирующие интерферон, интерлейкины, гормоны человека.
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
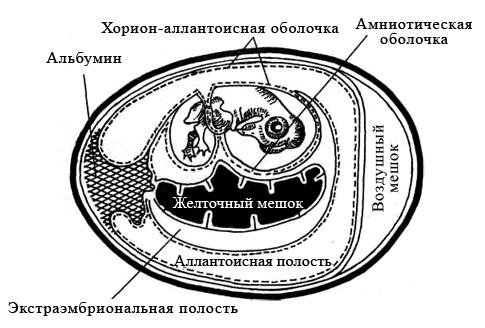
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
13 Назовите способы постановки реакций нейтрализации вирусов.
Читайте также:


