Микст инфекция вирусно бактериальная инфекция
В настоящее время острые кишечные инфекции (ОКИ), являясь одной из важных медицинских и социальных проблем, вносят значительный вклад в формирование экономического ущерба для общества [1, 2]. В последние годы в этиологической структуре ОКИ возросла роль вирусных гастроэнтеритов. Молекулярно-генетическое разнообразие вирусов, формирование нестойкого, типоспецифического иммунитета, частое бессимптомное течение инфекции у взрослого населения способствуют сохранению ведущего положения вирусных диарей в общей структуре ОКИ детского возраста [3, 4], при этом главная роль принадлежит ротавирусам [5].
Высокая частота повторного заражения ротавирусной инфекцией (РВИ) детей первого года жизни и раннего возраста (30–70%), подчас длительное вирусоносительство после клинического выздоровления, влияние на формирование хронической патологии желудочно-кишечного тракта (ЖКТ) у детей [6–8] определяют необходимость дальнейшего изучения тактики ведения пациентов с моно- и микст-вариантами РВИ.
Цель исследования — изучить катамнез детей, перенесших моно- и микст-варианты РВИ.
Материал и методы
Данное исследование проводилось в отделении кишечных инфекций детского инфекционного стационара МУЗ ОГКБ № 1 им. А. Н. Кабанова г. Омска. Критериями включения больных в исследование являлось наличие клиники кишечной инфекции вирусной этиологии; возраст от одного месяца до трех лет; обращение за медицинской помощью в первый-второй день заболевания; отсутствие у больных хронической патологии и врожденных пороков развития со стороны органов ЖКТ.
В соответствии с критериями клинико-катамнестическое наблюдение проведено за 58 детьми (30 девочек и 28 мальчиков), из которых 39 детей перенесли острый моновариант РВИ, 19 детей — микст-вариант РВИ. Средний возраст детей с моновариантом РВИ составлял 20,8 ± 10,1 мес, с микст-вариантом РВИ 9,8 ± 17,6 мес.
Результаты и обсуждение
Генетическая идентификация изолятов ротавируса, выделенных из фекальных проб от 53 детей, показала, что генотип G4 преобладал и составил 56,6% (p = 0,000), вторым по встречаемости был генотип G2 — 16,9%. Генотипы G1 и G3 встречались реже — 5,7% и 11,3% соответственно. Среди P-генотипов преимущественно встречался генотип P [8] — 69,8% (p = 0,000), следующим генотипом был P [4] — 16,9%, в двух пробах (3,9%) не был определен P-генотип, в пяти пробах (9,4%) не определялись оба генотипа — нетипируемый генотип. При микст-варианте РВИ условно-патогенная флора была представлена Klebsiella pneumonia, Pseudomonas aeruginosa, Citrobacter amalanaticus, Enterobacter cloacae, Proteus vulgaris, P. mirabilis. У всех наблюдаемых детей с моно- и микст-вариантом РВИ острый период заболевания характеризовался клинической картиной средней степени тяжести. При этом тяжесть течения заболевания оценивалась по балльной шкале T. Vesikari и T. Ruusaka (1990) (табл. 1) [9].
Оценка степени тяжести в соответствии со шкалой Т. Vesikari для моноварианта РВИ составила в среднем 8,9 балла, для микст-варианта — 9,3 балла.
Всем пациентам с моно- и микст-вариантом РВИ при поступлении в стационар проводилась в соответствии с рекомендациями ВОЗ общепринятая базисная терапия (диета, оральная регидратация, ферментативные препараты, симптоматические средства). Детям, находящимся на естественном вскармливании, сохранялось питание грудным молоком, при искусственном вскармливании на острый период болезни назначались безлактозные (NAN Безлактозный, Нутрилон Безлактозный) и низколактозные смеси (Нутрилон Низколактозный, Нутрилак Низколактозный). У детей старшего возраста из питания исключались молочные, богатые углеводами продукты и продукты, усиливающие перистальтику кишечника (свежие овощи и фрукты, в том числе соки).
Регидратационную терапию при моно- и микст-варианте РВИ проводили по общепринятым правилам. Оральная регидратация при эксикозе 1–2 степени проводилась с использованием глюкозосолевых растворов Оралит, Регидрон, Гастролит. Инфузионная терапия назначалась при эксикозе 2–3 степени и неукротимой рвоте. Объем вводимых растворов зависел от степени обезвоживания и массы тела ребенка.
При моноварианте РВИ назначались индукторы интерферонов (Кипферон суппозитории per rectum детям до 12 лет — в средней разовой дозе 50000 МЕ/кг массы тела, но не более 1 млн МЕ/сут (2 суппозитория)). При микст-варианте РВИ дополнительно антибактериальные препараты: нифуроксазид (Энтерофурил суспензия 5 мл/200 мг, детям в возрасте от одного до шести месяцев — 100 мг (1/2 мерной ложки) 2–3 раза в день, от 7 месяцев до двух лет — 100 мг (1/2 мерной ложки) 4 раза в день. Эрцефурил суспензия 5 мл/220 мг; детям от одного до 30 месяцев — 220–660 мг (1–3 мерных ложки) за 2–3 приема, старше 30 месяцев — 220 мг (1 мерная ложка) 3 раза в день. Курс лечения — не более 7 дней), а также парентеральные антибиотики: цефалоспорины 1–2 поколения (цефазолин 20–50 мг/кг, в/м 3 раза в день, курс лечения 5–7 дней).
Детям, находящимся на грудном вскармливании или получавшим низколактозные смеси, с первых дней заболевания назначались ферментативные препараты (Лактаза — при грудном вскармливании, перед началом кормления грудью в 30 мл предварительно сцеженного грудного молока добавляют 1/6 капсулы). При выраженных копрологических признаках нарушения пищеварения, с 3–4 дня заболевания назначались препараты на основе панкреатина (Панкреатин детям до одного года — 0,10–0,15 г, до двух лет — 0,20 г, на прием 3–4 раза в день до еды).
Дети основной группы (30 человек) дополнительно к базисной терапии получали энтеросорбент смектит диоктаэдрический (Неосмектин — детям до одного года — 1 пакетик в сутки (3 г), 1–2 лет — 2 пакетика в сутки (6 г), старше двух лет — 2–3 пакетика в сутки (6–9 г)) до нормализации частоты и характера стула. Курс лечения составил 3–5 дней. Контрольную группу (18 человек) составили дети, сопоставимые по возрасту и степени тяжести заболевания, но получавшие только базисную терапию.
При сравнительном анализе купирования основных симптомов заболевания, в группе детей, получавших в лечении смектит диоктаэдрический, симптомы интоксикации у 22 детей (73%) купировались на 2-й день, а на 3-й день — у 28 пациентов (93%), в то время как в группе сравнения лишь у 6 детей (χ 2 = 6,54, p = 0,016). У детей, получавших энтеросорбент, быстрее прекращалась рвота и купировались явления метеоризма, происходила нормализация стула. На 3-й день лечения рвота прекратилась у 83,3% пациентов основной группы, в то время как в группе сравнения рвота в эти сроки купировалась только у 70% (p 0,05).
Сравнительная характеристика жалоб детей, находившихся под наблюдением в течение трех месяцев после перенесенного острого моно- и микст-варианта РВИ, позволила выявить, что купирование основных жалоб в период реконвалесценции у детей с моновариантом РВИ отмечалось уже на 1-м месяце наблюдения (восстановление аппетита (p = 0,01), купирование абдоминальной боли (p = 0,03), нормализация функции кишечника (p = 0,02)), на 2-м месяце наблюдения полностью восстановилась функция кишечника (p = 0,004) по сравнению с детьми, перенесшими микст-вариант РВИ, у которых неустойчивый характер стула отмечался на 3-м месяце наблюдения (табл. 2).
Таким образом, дети после перенесенного острого моноварианта РВИ нуждаются в диспансерном наблюдении в течение не менее двух месяцев, а дети с перенесенным острым микст-вариантом РВИ в течение трех месяцев, так как в этот период сохраняются как общие жалобы, так и жалобы со стороны ЖКТ не только у детей, которые продолжают выделять Ag ротавируса, но и у детей без выделения Ag ротавируса. Дети, выделяющие Ag ротавируса более 14 дней, независимо от перенесенного микст- или моноварианта РВИ, нуждаются в обязательном контрольном обследовании в течение 30 дней после выписки, при одновременном обследовании родителей и/или ближайшего окружения на ротавирусную инфекцию с целью оценки возможного риска реинфецирования.
Литература
- Rheingans R. D. et al. Economic costs of rotavirus gastroenteritis and cost-effectiveness of vaccination in developing countries // J. Infec. Dis. 2009. Vol. 200, № 1. P. 16–27.
- Chai P. F., Lee W. S. Out-of-pocket costs associated with rotavirus gastroenteritis requiring hospitalization in Malaysia // Vaccine. 2009. Vol. 27, № 5. P. 112–115.
- Tran A. et al. Prevalence of Rotavirus, Adenovirus, Norovirus and Astrovirus Infections and Co-infections Among Hospitalized Children in Northern France // J. Clin. Microbiol. 2010. Vol. 26, № 1. P. 26–30.
- Ushijima H. Diagnosis and molecular epidemiology of viral gastroenteritis in the past, present and future // Uirusu. 2009. Vol. 59, № 1. P. 75–90.
- Anderson E. J. Prevention and treatment of viral diarrhea in pediatrics/E. J. Anderson // Expert. Rev. Anti. Infect. Ther. 2010. Vol. 8, № 2. P. 205–217.
- Учайкин В. Ф. и др. Роль ротавирусов в хронической гастроэнтерологической патологии у детей // Детские инфекции. 2003. № 1. С. 10–12.
- Turck D. Prevention and treatment of acute diarrhea in infants // Arch. Pediatr. 2007. Vol. 14, № 11. P. 1375–1378.
- Newton H. Viral diarrhea can be infectious for a long time // Child. Health. Alert. 2007. Vol. 25, № 2. P. 4–5.
- Ruuska T. et al. Rotavirus disease in Finnish children: use of numerical scores for clinical severity of diarrhoeal episodes // Scand. J. Infect. Dis. 1990. Vol. 22, № 3. P. 259–267.
Ю. Б. Белан, доктор медицинских наук, профессор
Н. А. Полянская
Сложные случаи смешанных типов заболеваний тяжело диагностировать и тем более лечить. К такому виду воспалительных процессов относятся проявления микст-инфекции у детей. Под этим названием подразумевается несколько вирусов и бактерий, оказывающих одновременное взаимное влияние на здоровье ребёнка.
Для каждого смешанного вида болезней разрабатывается особый подход в проведении анализов. Микст-инфекция отличается искажёнными показателями при использовании методов ИФА и ПЦР. Часто нужно погасить симптомы одного вируса или бактерии, чтобы приступать к лечению второго.
Проблема смешанных вирусов и бактерий
Среди популярных заболеваний, передающихся половым путём, выделяются бактериальные микст-инфекции, лечение которых осложняется из-за различных комбинаций:
- хламидий;
- уреаплазм;
- гарднерелл;
- микоплазм;
- гонококковых вирусов;
- кандид;
- трихомонад.

К бактериальным проявлениям добавляются вирусы, они должны также учитываться при выборе типа комплексной терапии и вида препаратов. Неправильный подход к диагностике приведёт к ложноположительным или ложноотрицательным результатам. По ним будет проведено лечение, по окончании которого возникнет рецидив.
Особое внимание уделяется в случаях, когда обнаружена микст-инфекция у детей. Молодой организм чувствителен к сильным антибиотикам, и лишний приём препаратов им ни к чему. Во время диагностики состояния здоровья назначают анализы на обширный список вирусов.
Что происходит при смешении бактерий и вирусов?
Микст-инфекция у ребенка может образоваться при смешении следующих пар:
- бактерии — бактерии;
- бактерии — вирусы;
- вирусы — вирусы;
- паразиты — бактерии;
- паразиты — паразиты;
- паразиты — вирусы;
- более сложные производные.
Если моноинфекции давно изучены, опытным путем установлены основные симптомы болезней, то микст-инфекция может проявлять себя как угодно. Возможны следующие виды сценариев развития:
- однотипные инфекции могут угнетающе влиять друг на друга и проходить вовсе бессимптомно и без осложнений;
- сложные комбинации вирусов, бактерий и паразитов порождают новые состояния, не поддающиеся диагностике;
- угнетение острых симптомов, проявляющихся при моноинфекции, происходит за счет стимулирования иммунных сил организма одним видом;
- чаще происходит стремительное развитие тяжелых симптомов, воздействовать на которые приходится одновременным приемом большого количества препаратов.
Что ожидать после смешения бактерий и вирусов?
В результате сложных комбинаций, включающих даже два вида микроорганизмов, образуется новая микст-инфекция. Определение симптоматики начинается с диагностики общего состояния организма. У каждого человека будут свои признаки воспалительного процесса после заражения.

Выраженные симптомы наблюдаются только у небольшого числа людей, у остальных воспаление проходит по своему сценарию. Но установлена взаимосвязь инфекций, когда можно с небольшой долей вероятности утверждать, произойдет угнетение или нарастание острых состояний. Так, выделяют микст-инфекции, дополняющие друг друга:
- корь с дифтерией;
- менингококковая инфекция + грипп;
- стрептококки и туберкулёз;
- паратиф + брюшной тиф.
Однако дополнение симптоматики происходит не по простому закону сложения, а по постоянно изменяющемуся характеру развития. Это осложняет формирование статистики заболеваний, и в каждом конкретном случае вырабатывается индивидуальный подход к лечению пациента.
Тройное смешение бактерий
Часто микст-инфекция образуется под влиянием:
Эти три вида бактерий легко передаются половым путём между женщинами и мужчинами. Также они влияют на строение плода у беременных и могут перейти будущему ребёнку при рождении.

Диагностика перед беременностью должна обязательно включать обширный список инфекций, чтобы исключить развитие осложнений. Перечисленные виды бактерий практически всегда сопровождались кандидами и гарднереллами у женщин. Лечение начиналось с уничтожения последних микроорганизмов, переход на более сильные антибиотики осуществлялся позже.
Смешанные типы бактерий и вирусов приобретают неизвестные формы, проявляющиеся новыми симптомами. Последствиями таких состояний практически всегда становится очередной рецидив. Иммунитет к тройной атаке часто неустойчив.
Передача бактерий насекомыми
Северные районы страны с густой растительностью имеют огромное количество людей, у которых наблюдалась сборная микст-инфекция: пневмококк, менингоэнцефалита, клещ боррелиоза. Эти три вида заболеваний тяжело диагностируются при таком сочетании ввиду малых случаев проведённых наблюдений за пациентами с острыми состояниями. Можно выделить лишь некоторые из них:
- Развитие воспалительного процесса происходит стремительно, с проявлениями лихорадочных состояний.
- Часто образуется поражение суставных тканей.
- Повышение температуры тела сопровождается головной болью и рвотой.

При смешанном типе провести диагностику с точными показателями не представляется возможным. Лечение начинают курсовой терапией, включающей препараты против всех возбудителей. Картина заболевания вырисовывается только через 14 дней.
Смешение вирусов
Сильное снижение иммунитета у детей происходило, если появлялась микст-герпетическая инфекция. Обследование пациентов проводилось с двумя видами вирусов:
- Эпштейн-Барра + цитомегаловирус.
- Эпштейн-Барра + герпес простого типа.
Два вида вирусов усиливали симптомы моноинфекций. Во время наблюдений выделили основные острые состояния:
- Нарушения в работе головного мозга, развивается церебральный симптом у детей.
- Возникают проблемы выработки лимфоцитов.
- Повышается риск приобрести другие вирусы и бактерии. Организм становится слаб перед атакой внешних микроорганизмов.
- Возникновение внутренних проблем в пищеварительной системе: начальное развитие язв, эрозий внутренних стенок органов.
- Повышение частоты рецидивов герпесных инфекций.
- Повышенный риск развития заболеваний верхних дыхательных путей.
- Нарушения в работе сердца и центральной нервной системы.
- Также наблюдается проблема с движением лейкоцитов.

Микст-инфекция герпесвирусов чрезвычайно опасна для беременных и людей, имеющих заболевания иммунной системы. Однако из многочисленных наблюдений были установлены эффективные методы лечения при условии правильной диагностики.
Осложнения дыхательных путей
Выделяется микст-инфекция: пневмония + грибы (дрожжеподобные или плесневелые) или сочетание с другими микроорганизмами. Бактериально-вирусное смешение приводит в отдельных случаях к взаимному угнетению симптомов, тогда как отдельный вид привел бы к более острым состояниям.
Так, обычный кашель при тщательном обследовании может представлять собой совокупность опасных бактерий, которые нужно уничтожать до начала роста наиболее преобладающей инфекции. Опасными смешениями являются следующие виды вирусов, бактерий:
- установлен диагноз острого респираторно-вирусного заболевания;
- обнаружены хламидии в лёгких;
- выявлена очаговая пневмония;
- токсоплазмы.

Смешение всех перечисленных условий приводило к смертельным исходам. Для правильного лечения выбирается поэтапное воздействие на самый активный компонент с периодическими пересдачами анализов на возбудителей. Эти методы часто не помогали, и у детей образовывались тяжелые последствия от микст-инфекции:
- резкое повышение температуры выше 39 градусов;
- рвота, тошнота, одышка;
- поносы сменялись запорами;
- наблюдались очаговые поражения верхних дыхательных путей;
- патологические изменения во внутренних органах.
Проблема диагностики смешанных бактерий и вирусов
Во время выраженных симптомов моноинфекций проводить диагностику нужно в отношении всех возможных возбудителей. Но такие методы обследования пациентов очень затратны, и не каждый человек сможет себе такое позволить. На практике чаще назначают анализы на основные вирусы и бактерии. Порой исключается вероятность паразитарного осложнения без проведения лабораторных методов.
В результате узконаправленного лечения в отношении одного вида возбудителя у человека в будущем происходит повтор воспалительного процесса в осложненной форме. На сегодняшний день микст-инфекции не изучены полностью, на этом поприще медицине придется ещё столкнуться с новыми видами ассоциаций вирусов, бактерий и паразитов.
Смешанная этиология у малышей
Проблема микст-инфекций особенно остро стоит при лечении новорожденных детей. Уделяется внимание исследованию состояния организма ещё формирующегося плода. Внутриутробное заражение приводит к самым печальным последствиям для будущих мам. Дети становятся неполноценными, имеют патологии в своем развитии.

Причинами летальных исходов новорожденных становится неполное обследование на возбудителей болезненного состояния. Часто лечение проводится в отношении наиболее встречающихся бактерий и вирусов без учета их взаимного влияния. Выделяют систематическое поступление больных с микст-инфекцией, образованной следующими типами возбудителей:
- вирусы простого герпеса + цитомегаловирус;
- вирусы простого герпеса + Эпштейн-Барра + цитомегаловирус.
Эти комбинации инфекций находят более чем у 50 % новорожденных.
Правильный подход к лечению
Исключить патологические осложнения у малышей можно только путем комплексного обследования на огромный ряд возбудителей. А диагностические методы включают несколько видов анализов на один и тот же тип инфекции. Повторное обследование проходят в том же месте, где были выявлены положительные результаты. Это требование врачей нужно для исключения ложных показателей.
Методика лечения выстраивается с учетом следующих факторов:
- взаимное влияние антибиотиков друг на друга;
- применение противобактериальных и противовирусных препаратов, исключающих усиление побочных эффектов;
- лечение самой активной формы с последующей пересдачей на обнаруженные инфекции.
Микст-инфекция – это болезнь, вызванная несколькими патогенными микроорганизмами, которые тесно взаимодействуют друг с другом и вовлекают в этот процесс нормальную флору в организме человека. Данные медицинских исследований показали, что микст-инфекция диагностируется в 52% случаях, треть из которых – это сочетание 3-х и более возбудителей. Подробнее о заболевании и его лечении читайте далее.
Что это такое?
Микст-инфекция является воспалительным заболеванием, который вызывается двумя или более патогенными микроорганизмами, вступающими друг с другом в сильную реакцию. В число агентов часто входят:

Микст-инфекция является принципиально новой формой инфекции, то есть это не суммация разных моноинфекций. Это определяется в зависимости от численного соотношения патогенных и условно-патогенных микроорганизмов, их взаимодействия и активации одних агентов на фоне других. При этом действия одних возбудителей создают положительные условия для того, чтобы в организм попадали и размножались другие инфекции.
Виды микст-инфекций
Существует большое количество взаимосвязей патогенных агентов, которые вызывают микст-инфекцию, поэтому их точную классификацию привести невозможно, но далее можно отметить наиболее частые варианты:
- Гонококковая инфекция тесто связана с инфицированностью такими возбудителями – микоплазмой и уреаплазмой. Так, на поверхности колоний гонококков активно размножаются колонии данных возбудителей.
- Высока вероятность синергического действия уреаплазмы и гарднереллы у беременных, которые страдают преэклампсией и гипертонией.
- Взаимодействие трех возбудителей – микоплазм, хламидий и уреаплазмы – часто становится причиной микст-инфекции. Как правило, эти возбудители передаются при половом контакте. Они же станут причиной изменения строения плода у беременной и даже могут перейти к малышу во время родов.
- Микст-герпетическая инфекция часто наблюдается у детей с сильно пониженным иммунитетом. Она провоцируется двумя парами вирусов: Эпштейна-Барр и цитомегаловируса или Эпштейна-Барр и герпесом простого типа. В таком состоянии высока вероятность появления и развития других вирусов и бактерий, поскольку организм значительно ослабевает и не в состоянии защититься от атак внешних агентов. Такая инфекция наблюдается у 50% новорожденных и может привести к летальному исходу.
- Сборная микст-инфекция, при которой организм поражается пневмококком, клещом боррелиоза и менингоэнцефалитом. Такая болезнь характеризуется стремительным развитием воспалительного процесса, поражением суставных тканей, лихорадочным состоянием, головной болью и рвотой.
- Микст-инфекция, связанная с осложнениями дыхательных путей. Выделяют сочетание пневмонии с грибами – дрожжеподобными или плесневелыми. Возможны комбинации с другими агентами. Такое сочетание часто приводит к угнетению симптомов. Когда же вирусы и бактерии поражают организм одиночно, отмечаются острые проявления болезни. В связи с этим даже простой кашель может свидетельствовать об опасном сочетании разных бактерий.

Симптомы
Микст-инфекция не имеет определенных клинических проявлений, поскольку ей далеко не всегда свойственен комплекс симптомов, характерных для каждой моноинфекции. Как правило, она проявляется активацией патологического процесса. Часто выделают дополняющие друг друга инфекции:
- корь с дифтерией;
- грипп с менингококковой инфекцией;
- аденовирусная инфекция со стафилококками;
- туберкулез со стрептококками или пневмококками;
- брюшной тиф с паратифом.
Однако не во всех случаях смешанным инфекциям характерны изменения патологического процесса, что нельзя сказать о моноинфекциях. При отсутствии такой симптоматики при микст-инфекции возможно развитие антагонистического отношения между агентами – кишечной палочкой и сальмонеллой или шигеллой, холерным вибрионом и кишечными бактериями и проч.
Диагностика
Чтобы диагностировать микст-инфекцию, требуется сопоставить клиническую картину и результаты лабораторных исследований. Они заключаются в изоляции возбудителей и изучении серологических реакций и сдвигов, то есть прироста титра антител к определенному возбудителю.

Так, лабораторная диагностика, прежде всего, заключается в выявлении типов агентов. Для этого, как правило, материал больного специалисты изучают на наличие трех групп вероятных возбудителей одной болезни. Чтобы выявить и идентифицировать вирусы, хламидии и микоплазмы, применяется комплексный метод. Он состоит из следующих лабораторных диагностик:
- полимеразная цепная реакция (ПЦР);
- лигазная цепная реакция (ЛЦР);
- иммуноферментный анализ (ИФА);
- прямая иммунофлюоресценция (ПИФ);
- бактериологический посев (культуральный метод) и т. д.
Все обследования до и после лечения стоит проходить в одной лаборатории, где будут применять одни и те же диагностические методы. Отмечается, что повторно тесты следует сдавать спустя 1,5-2 месяца после лечения, чтобы точно установить, вылечена болезнь полностью или нет.
Как проводится лечение?
Микст-инфекции характерно увеличение инкубационного периода, при этом ситуация усложняется тем, что симптомы заболевания неоднозначны и могут модифицировать. Чтобы не допустить осложнений такого состояния, требуется корректное лечение, но подобрать его грамотно достаточно сложно. Это обусловлено наличием нескольких возбудителей, ведь один препарат может быть эффективным относительного одного агента и никак ни действовать относительного другого.
Например, гонококки могут попасть внутрь трихомонада, где они защищены от действия противотрихомонадных средств, которые не воздействуют на агентов гонореи. Отмечается и обратная ситуация, когда антибиотики для уничтожения гонококков бездейственны относительно трихомонад.
Исходя из перечисленных нюансов, смешанная инфекция не может быть вылечена классическими подходами. Так, если против бактерий принимаются антибиотики, против грибов – Нистатин, а против простейших – Метронидазол, при диагностировании микст-инфекции требуется комплексное лечение. В приоритете лекарства, которые могут одновременно воздействовать на несколько возбудителей. В их число входят:
- таблетки Макмирор;
- вагинальные свечи и крема Макмирор Комплекс;
- иммуномодуляторы с иммунокорригирующим, противовирусным и индуцирующим свойствами (Интерферон, Амиксин);

Часто терапевтические схемы предполагают сочетание местных и системных препаратов. В их число могут входить:
- антибиотики;
- эубиотики;
- нестероидные противовоспалительные препараты;
- десенсибилизирующие и витаминные препараты;
- антиоксиданты;
- антимикотики.
Стоит отметить, что лечение предполагает два этапа, первый из которых заключается в уничтожении анаэробной флоры и трихомонад, а второй – в воздействии на внутриклеточные микроорганизмы.
Прием медицинских препаратов часто приводит к снижению количества полезной лактобациллы, которая отвечает за выработку молочной кислоты, препятствующей размножению возбудителей. Это приводит к дисбактериозу, поэтому при попадании в беззащитную среду 1-2 агентов организм вновь будет поражен инфекцией. Чтобы избежать этого, в течение нескольких месяцев после лечения важно регулярно обследоваться и укреплять иммунитет.
Итак, микст-инфекция часто характеризуется сложным процессом взаимодействия между 2-мя или более патогенными агентами и организмом человека. Такое заболевание протекает тяжело и не имеет однозначных симптомов, что значительно усложняет его лабораторную диагностику, лечение и профилактику.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Ежегодно в России регистрируется 27,3–41,2 млн случаев острых респираторных заболеваний (ОРЗ), при этом доля вируса гриппа как возбудителя ОРЗ составляла в первом XXI в. около 6,2–12,6%. Расходы на лечение гриппа и его осложнений в мире ежегодно составляют около 14,6 млрд долларов. В России экономические потери от гриппа в год оцениваются в 10 млрд руб. [1]. ОРЗ являются причиной смерти в 19% случаев у детей младше 5 лет, особенно в странах Африки, Латинской Америки. 20% медицинских консультаций у детей связаны с ОРЗ, в 30% случаев ОРЗ является причиной нетрудоспособности [10].
При респираторного тракта чаще высеваются Streptococcus (S.) pneumoniae, Staphylococcus (Staph.) aureus, Haemophilus (H.) influenzae, Moraxella (М.) catarrhalis или Neisseria catarrhalis [3, 4].
Природным резервуаром S. pneumoniae является носоглотка человека, возбудитель передается путем. Каждый ребенок инфицирован одним или несколькими штаммами S. pneumoniae и может быть переносчиком инфекции, особенно в первые годы жизни, в промышленно развитых странах — и в возрасте 6 мес. Чаще всего инфицирование не приводит к развитию клинических проявлений, а проходит бессимптомно. Клинические проявления начинаются при распространении инфекции из носоглотки в другие органы. Большинство инфекционных заболеваний возникает не после длительного носительства, а после инфицирования новыми серотипами, чувствительность организма зависит от состояния иммунной системы и вирулентности штамма возбудителя. Высокий уровень пневмококковых инфекций наблюдается у детей и пожилых людей, относящихся к группе риска по развитию иммунодефицита. Пневмококковая инфекция, по данным ВОЗ, приводит к смертельным исходам у 1,6 млн человек в год, при этом около 50% случаев составляют дети в возрасте от 0 до 5 лет. У 76% взрослых (0,5 млн случаев в год) и у 90% детей (70 тыс. случаев) пневмония вызывается пневмококковой инфекцией [2]. Особой тяжестью отличается пневмококковый менингит, частота которого составляет 8 на 100 тыс. детей до 5 лет. 30–40% острых средних отитов у детей вызывается пневмококком [2].
Большинство штаммов H. influenzae являются микроорганизмами. У новорожденных и маленьких детей H. influenzae типа В () вызывает бактериемию, пневмонию и острый бактериальный менингит. В ряде случаев развиваются воспаление подкожной клетчатки, остеомиелит, инфекционный артрит.
M. catarrhalis (или Neisseria catarrhalis) — грамотрицательная бактерия, вызывает инфекционные заболевания респираторного тракта, среднего уха, глаз, центральной нервной системы и суставов. M. catarrhalis относится к микроорганизмам, представляет угрозу для человека и персистирует в респираторном тракте. M. catarrhalis в 15–20% случаев вызывает острый средний отит у детей.
- до года — 4 и более эпизодов ОРЗ в год;
- до лет — 6 и более эпизодов ОРЗ в год;
- 4–5 лет — 5 и более эпизодов ОРЗ в год;
- старше 5 лет — 4 и более эпизодов ОРЗ в год.
Нами среди ЧБД выделена группа ЧБД с хроническими заболеваниями () [3].
- с заболеваниями рото- и носоглотки;
- с заболеваниями верхних дыхательных путей;
- с заболеваниями нижних дыхательных путей.
По данным , у ЧБД на слизистых происходит вытеснение сапрофитной флоры микроорганизмами, включая S. pneumoniae, Staph. аureus, H. influenzae. В контрольной группе в основном из носо- и ротоглотки высевались S. viridens — у 26%, S. mutans — у 23,3%, S. salivaricus — у 20% детей. У ЧБД эти возбудители высевались в 15,3; 16,6; 9,7% случаев. Доминирующими микроорганизмами являются Staph. aureus — 52,7%; S. pyogenes — 23,6%; Candida albicans — до 50% ЧБД. Повышается плотность заселения слизистых микроорганизмами: S. pneumoniaе — lg=3,5±0,97 КОЕ; H. influenzaе — lg=2,4±0,48 КОЕ; Staph. aureus — lg=3,5±0,87 КОЕ. Лишь 36,5% штаммов M. catarrhalis чувствительны к ампициллину. H. influenzaе была резистентна к ампициллину в 36,5% случаев. Разница представленных показателей была статистически достоверна. Смена сапрофитной флоры на , высевание Candida albicans, резистентность флоры к антибактериальной терапии затрудняют лечение и реабилитацию ЧБД [4, 5].
Микрофлора, высеваемая из зева ЧБД, представлена в таблице 1.
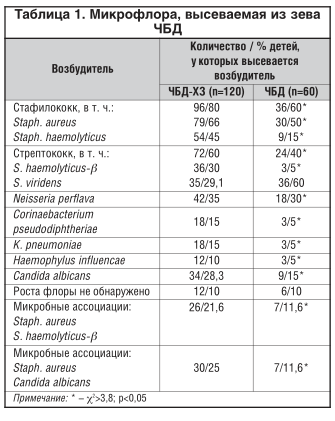
Обследовано и отобрано 60 ЧБД, согласно классификации , (1986) на основании частоты ОРЗ [13], и 120 с частотой ОРЗ 6 и более раз в год и хроническими заболеваниями носо- и ротоглотки. Было проведено сравнение персистенции флоры у ЧБД и . В мазках из зева монокультура выделена у 40% , 2 и более возбудителя — у 46,6%, Candida albicans — у 28,3%, сочетанная бактериальная и грибковая флора — у 25%. Количество возбудителей колебалось от 105хКОЕ до 108хКОЕ/мл. С уменьшением числа эпизодов ОРЗ уменьшаются частота и спектр высеваемых микроорганизмов. Сравнение частоты высеваемости Staph. haemolyticus и Staph. aureus, S. haemolyticus-β, Neisseria perflava в группах статистически достоверно (χ2>3,8; p 3,8; p Литература
- Зайцев А.А., Синопальников А.И. Грипп: диагностика и лечение // РМЖ. 2008. Т. 16. № 22. С. 1494–1502.
- Таточенко В.К., Озерецковский Н.А., Федоров А.М. Иммунопрофилактика – 2014. М.: ПедиатрЪ, 2014. 199 с.
- Маркова Т.П. Применение изопринозина для профилактики повторных респираторных инфекций у часто болеющих детей // Фарматека. 2009. № 6. С. 46–50.
- Хлынина Ю.О. Часто болеющие дети: микроэкологическое обоснование подходов к лечению и реабилитации: Автореф. дисс. … канд. мед. наук. Волгоград, 2012. 25 с.
- Хлынина Ю.О. Резидентное стафилококковое бактерионосительство в популяции человека, живущего в крупных промышленных городах // Вестник новых медицинских технологий. 2009. № 1. С. 43–45.
- Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Клинико-социальные аспекты, пути оздоровления. Саратов: Медицина, 1986.
- Mellioli J. Deciders in pulmonology (Принятие решений в пульмонологии) // Giorn. It. Mal. tor. 2002. Vol. 56 (4). Р. 245–268.
- Маркова Т. П., Чувиров Д. Г., Гаращенко Т.И. Механизм действия и эффективность бронхо-мунала в группе длительно и часто болеющих детей // Иммунология. 1999. № 6. С. 49–52.
- Maul J. Stimulation of immunoprotective mechanisms by OM-85 BV // Respiration. 1994. Vol. 61 (Suppl. 1). Р. 15.
- Del-Rio Navarro B.E., Espinosa-Rosales F.J., Flenady V., Sienra-Monge J.J.L. Immunostimulants for preventing respiratory tract infection in children (Review) // The Cochrane Collaboration. The Cochrane Library. 2011. Issue 6.
- Evans S.E., Tuvin M.J., Dickey B.F. Induciblе innate resistance of lung epithelium to infection // Ann. Rev. Physiol. 2010. Vol. 72. P. 413–435.
- Levy O. Innate immunity of the newborn: basic mechanisms and clinical correlates // Nat. Rev. Immunol. 2007. Vol. 7. P. 379–390.
- Заплатников А.Л., Гирина А.А., Бурцева Е.И. и соавт. Иммунопрофилактика гриппа и других острых респираторных вирусных инфекций в достижении контроля над течением бронхиальной астмы у детей // Педиатрия. 2013. Т. 92. № 1. С. 51–56.
- Olivieri D., Fiocchi A., Pregliasco F. et al. Safety and tolerability of ribosome-component immune modulator in adults and children // Allergy Asthma Proc. 2009. Vol. 30. Р. 33–36. doi: 10.2500/aap.2009.30.3247.
- Mora R., Dellepiane M., Crippa B. et al. Ribosomal therapy in the treatment acute adenoiditis // Eur.Arch.Otorhinolaryngol. 2010. Vol. 267. P. 1313–1318.
- Akikusa J.D., Kemps A.S. Clinical correlates of response to pneumococcal immunization // J.Paediatr. Child Health. 2001. Vol. 37 (4). Р. 382.
- Геппе Н.А. Рибосомальный комплекс в профилактике частых респираторных заболеваний у детей // Фарматека. 2013. № 1. С. 65–70.
- Fiocchi A., Omboni S., Mora R. et al. Efficacy and safety of ribosome-component immune modulator for preventing of recurrent respiratory infections in socialized children // Allergy Asthma Proc. 2012. Vol. 33 (2). P. 197–204.
- Сорока Н.Д. Особенности иммунотерапии затяжных и рецидивирующих болезней у детей // Педиатр. фармакология. 2008. Т. 5. № 5. С. 38–41.
- Алексеева А.А., Намазова-Баранова Л.С., Торшхоева Р.М. Рибосомальный комплекс в профилактике и лечении острых респираторных инфекций у детей // Вопр. совр. педиатрии. 2010. Т. 9. № 6. С. 127–130.
Только для зарегистрированных пользователей
Читайте также:


