Моноциты и вирус герпеса
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург

Как показывает статистика, более 90% населения Земли инфицировано вирусом простого герпеса. Однако проявления герпеса наблюдается далеко не у всех. С чем это связано? Дело в том, что иммунитет у здоровых людей обычно сдерживает распространение вируса. Однако в последнее время у многих людей иммунитет ослаблен, и тогда мы встречаемся с проявлениями герпеса.
От чего может снижаться противогерпесный иммунитет:
- инфекционные заболевания (ОРЗ, грипп)
- переохлаждение
- стресс
- вирусные заболевания
- изменение гормонального фона (например, при беременности)
- и, главное, нарушение целостности и эффективной работы барьеров. В первую очередь, кишечного барьера.
На своей оболочке вирус простого герпеса (ВПГ) имеет антирецепторы, благодаря чему он присоединяется к тканям экто- и энтодермального происхождения (пантропизм), т. е. он поражает кожу, слизистые, центральную и периферическую нервные системы, печень, эндотелий сосудов, клетки крови (Т-лимфоциты, эритроциты, тромбоциты).
Вирус простого герпеса (ВПГ), как ДНК содержащий вирус, может интегрировать генетический аппарат клеток хозяина и вызывать злокачественную трансформацию клеток.
Вирусов герпеса несколько
Альфа-герпесвирусы включают: вирус простого герпеса 1 типа (ВПГ-1), вирус простого герпеса 2 типа (ВПГ-2). Плюс ВирусVaricellaZoster, к которому относятся ветряная оспа и опоясывающий лишай, инфецирующие нейроны и сохраняющиеся в них. Любимая локализация корешковые участки спиномозговых нервов, ганглии тройничного нерва. В клинической картине часто присутствует болевой синдром в районе позвоночника, лица, шеи, в областях и органах, соответствующих иннервации данного, поражённого вирусом нерва.
Гамма-герпес вирусы: вирус Эпштейна Барр (ВЭБ) и вирус герпеса человека 8 типа (ВГЧ-8), способны инфицировать моноциты и приводить к нарушению апоптоза клеток хозяина при латентной инфекции. В первую очередь проявления иммунодефицита.
Бета герпес вирусы отличаются менее выраженной цитопатичностью клеток, длительным циклом репликации и пожизненной персистенцией в клетках хозяина. Они вызывают манифестную и латентную инфекции в слюнных железах, почках и других органах; могут быть причиной генерализованных поражений у новорожденных, детей и взрослых при иммунодефицитных состояниях. Вялая, неприятная, многолетняя инфекция.
Патогенные для человека представители данной группы — ВГЧ-6, ВГЧ-7 и цитомегаловирус (ЦМВ) — характеризуются способностью к латентной инфекции в клетках моноцитарно-макрофагальной системы и лимфоцитах. Нарушен первичный иммунный ответ. Опасность возникновения и развития сопутствующих (опортунистических) инфекций, как будто самого вируса мало.
Согласно международной классификации, принятой в 2012 г., вирус герпеса человека 6А типа (ВГЧ-6А) и вирус герпеса человека 6В типа (ВГЧ-6В) являются самостоятельными таксономическими единицами.
ВГЧ-6В описан как более нейровирулентный, может являться этиологическим фактором развития энцефалита, отторжения трансплантата, внезапной экзантемы.
Вирусы обладают различной чувствительностью к терапии, в частности, к интерферонам (ИФН).
В 2004 году группой ученых из Канады на примере первичных изолятов и лабораторных штаммов была продемонстрирована резистентность ВГЧ-6В к интерферонам а/р, при выраженном противовирусном эффекте по отношению к ВГЧ-6А.

Инфицированность вирусами простого герпеса — эпидемия мирового масштаба. Несколько млрд человек в мире инфицированы вирусами простого герпеса типов 1 и 2 (ВПГ-1 и ВПГ-2) — основными возбудителями генитального и орофациалного герпеса. При том, исследования показали, что, ориентируясь только по топографо — анатомической локализации инфекции, нельзя судить о типе поражающего вируса! Известно, что вирус Herpes labialis может поражать кожу и слизистые гениталий, и наоборот, вирус Herpes genitalis может вызывать герпетические высыпания на коже лица.
Только 3,6% всех случаев генитального герпеса диагностированы и лечатся адекватно.
Генитальный герпес — потенциальная опасность для жизни будущего ребенка. В мире от 42 до 97% женщин инфицированны ВПГ 1 либо ВПГ 2
Методы диагностики вируса герпеса

1. ПЦР (полимеразная цепная реакция) — процесс, состоящий из повторных циклов амплификации (копирования) специфической последовательности молекул ДНК с целью создания большого количества копий, с последующей стадией электрофореза.
Преимуществами данного метода являются: высокая чувствительность (95-97%), специфичность (90-100%) и быстрота проведения (1-2 часа). В качестве материала для исследования служит соскобэпителиальных клеток из уретры или цервикального канала.
Недостатком ПЦР являются ложноположительные реакции из-за загрязнения посторонней ДНК.
В настоящее время существует метод, лишенный выше перечисленных недостатков — это метод ПЦР в реальном времени (REAL — Time PCR). Сущность метода заключается в
исследовании с помощью специального прибора, особенностью которого является возможность детектировать процесс флюоресценции в каждом цикле деления, без последующего электрофореза. Отсутствие стадии электрофореза позволяет максимально снизить число ложноположительных результатов.
2. Иммуноферментный анализ (ИФА). Он имеет большое значение с учетом того, что выделение вируса из урогенитального тракта не постоянно и зависит то формы заболевания и реактивности организма, в то время, как наличие антител в крови остается пожизненно.
3. ПИФ (метод прямой иммунофлюоресценции) -позволяет проводить дифференциальную диагностику генитального герпеса и сифилиса. ПИФ: экономически доступен, специфичен (90%), может выполняться быстро (1-2 часа).
Недостатки: субъективен, не всегда высокое качество тест-систем.
Вирус простого герпеса (ВПГ)
ВПГ оказывает выраженное влияние на иммунную систему в виде ее угнетения.
Иммуносупрессию вызывают следующие факторы:
- прямое повреждающее действие вируса на клетки иммунной системы (лимфоциты, макрофаги и натуральные киллеры);
- угнетающее влияние факторов, высвобождаемых из инфицированных вирусом клеток;
- нарушение распознавания инфицированных клеток цитотоксическими лимфоцитами и снижение их активности как основного звена противовирусной защиты;
- некоторые белки ВПГ блокируют активацию системы комплемента (иммуносупрессия неспецефической защиты).
Лечение простого вируса герпеса: классическое и нутрициологическое.
Классический подход: группа препаратов Ацикловир, Интерфероны, адаптогены.
Ацикловир.
В свое время разработчики препарата были удостоены Нобелевской премии.
Однако, сила воздействия препарата на различные вирусы семейства неодинакова. Если в САМОМ НАЧАЛЕ развития заболевания Вам удалось воспользоваться препаратом, то он более-менее сработает для блокировки деления ВПГ 1 и 2, слабее действует на вирус ветряной оспы, еще хуже – на цитомегаловирус и вирус Эпштейна-Барра. На остальные вирусы этой группы — нет!
Побочные действия:
Аллергические реакции, головная боль, головокружения, нарушения работы ЖКТ – тошнота, понос, рвота.
Ни в коем случае нельзя совмещать прием препарата с приемом алкоголя…
Лекция врача-нутрициолога Аркадия Бибикова
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Таблица 10.
Характеристика герпесвирусов человека (ГВЧ) (семейство Herpesviridae)
| Подсемейство | Название вируса (общепринятое и официальное) | Цитопатология | Локализация резервуаров в организме | Латентная инфекция | Клинические проявления | |
| Alphaherpesvirinae | Herpes simplex virus тип 1 (вирус простого герпеса) | ГВЧ-1 | Цитолиз эпителия | Ганглии тройничного нерва | Нейроны | Оральный герпес, офтальмо-герпес, энцефалит |
| Herpes simplex virus тип 2 (вирус простого герпеса) | ГВЧ-2 | Ганглии крестцово-подвздошного сочленения | Генитальный герпес, менинго-энцефалит | |||
| Varicella-zoster virus (вирус ветряной оспы – опоясывающего герпеса) | ГВЧ-3 | Спинно-мозговые корешки | Ветряная оспа, опоясывающий герпес (лишай) | |||
| Betaherpesvirinae | Цитомегаловирус | ГВЧ-5 | Цитомегалия | Лейкоциты, эпителий, слюнные железы, почечные канальцы | Моноциты, лимфоциты | Цитомегалия, поражения ЦНС, пневмонии, гепатиты, рак предстательной железы |
| Herpes lymphotropic virus | ГВЧ-6 | Лимфо-пролиферативное действие | В-лимфоциты | Т-клетки | Внезапная экзантема младенцев (до 2 лет), синдром хронической усталости | |
| Герпесвирус человека 7 тип | ГВЧ-7 | Неизвестна | ||||
| Gammaherpesvirinae | Вирус Эпсайна-Барр | ГВЧ-4 | Лимфо-пролиферативное действие | В-лимфоциты, эпителий носоглотки | В-клетки | Инфекционный мононуклеоз, лимфома Беркитта, назо-фарингеальная карцинома, В-клеточная лимфома |
| Герпесвирус человека 8 тип | ГВЧ-8 | Неизвестна | В-клетки, лимф. ткани | Саркома Капоши |
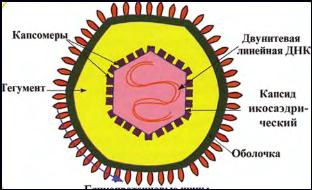 |
Структура.Вирион герпесвируса имеет овальную форму диаметром 150-200 нм. В центральной части вириона находится двунитевая линейная ДНК, окруженная икосаэдрическим капсидом, состоящим из 162 капсомеров. Снаружи вирус окружает оболочка с гликопротеиновыми шипами, сформированными из внутреннего слоя ядерной мембраны клетки. Пространство между капсидом и оболочкой называется тегумент (содержит вирусные белки и ферменты, необходимые для инициации репликации) (рис.27).
Рис. 27. Структура герпесвируса.
Геном – двунитевая линейная ДНК. Она состоит: у ВПГ и ЦМВ – из двух фрагментов: короткого S и длинного L, каждый из которых у ВПГ заключен между двумя наборами инвертированных повторов, позволяющим геному рекомбинировать с образованием 4 изомеров; у вируса ветряной оспы и опоясывающего герпеса ДНК также состоит из двух фрагментов, но содержит один набор инвертированных повторов, поэтому формируется две изомерные формы.
Репродукция. После прикрепления к рецепторам клетки оболочка вириона сливается с клеточной мембраной (рис. 28, 1, 2). Освободившийся нуклеокапсид (рис. 28, 3) доставляет в ядро клетки ДНК вируса. Далее происходит транскрипция части вирусного генома (с помощью клеточной ДНК-зависимой РНК-полимеразы); образовавшиеся иРНК (рис. 28, 4) проникают в цитоплазму, где происходит синтез (трансляция) самых ранних альфа-белков (рис. 28, I), обладающих регулирующей активностью. Затем синтезируются ранние бета-белки (рис. 28, II) – ферменты, включая ДНК-зависимую ДНК-полимеразу и тимидинкиназу, участвующие в репликации геномной ДНК вируса. Поздние гамма-белки (рис. 28, III) являются структурными белками, включая капсид и гликопротеины (А, В, C, D, E, F, G, X). Гликопротеины диффузно прилегают к ядерной оболочке (рис. 28, 5). Формирующийся капсид (рис. 28, 6) заполняется вирусной ДНК и почкуется через модифицированные мембраны ядерной оболочки (рис. 28, 8). Перемещаясь через аппарат Гольджи,
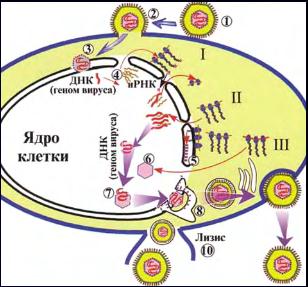 |
вирионы транспортируются через цитоплазму и выходят из клетки путем экзоцитоза (рис. 28, 9)или лизиса клетки (рис. 28, 10).
Рис. 28. Репродукция герпесвируса.
ВПГ вызывает простой герпес (Herpes simplex), характеризующийся везикулезными высыпаниями на коже, слизистых оболочках, поражением глаз, ЦНС и внутренних органов, а также пожизненным носительством (персистенцией) и рецидивами болезни.
Различают два типа вируса – ВПГ-1 и ВПГ-2, которые повсеместно распространены и поражают большую часть населения земли. ВПГ-1 чаще поражает слизистые оболочки ротовой полости и глотки, глаза, вызывает энцефалиты, а ВПГ-2 – половые органы, за что и получил название генитального штамма. ВПГ относится к роду Simplexvirus, семейству Herpesviridae. Открыт У. Грютером в 1912 г.
Структура ВПГ сходна с другими герпесвирусами. На поверхности вириона расположены гликопротеины gA, gB, gC, gD, gH, gF.
Различают структурные белки, белки слияния (gB), иммунные белки уклонения (gC, gE, gI) и др. Например, СЗ-компонент комплемента связывается с gC, а Fc-фрагмент IgG – с gE/gI-комплексом, маскируя вирус и вирусинфицированные клетки. Некоторые гликопротеины имеют общие антигенные детерминанты (gB и gD) для HSV-1 и HSV-2 и типоспецифические – gC.
Культивирование. Вирус герпеса культивируется в хорион-аллантоисной оболочке куриного зародыша, вызывая образование воспалительно-некротических очагов. Хорошо развивается в культуре человеческой эмбриональной легочной и почечной ткани. В инфицированных клетках формируются внутриклеточные включения, образуются симпласты.
Антигенная структура. Вирус герпеса содержит два антигена: V-антиген, прочно связанный с вирусной частицей, и растворимый S-антиген.
Резистентность. Резистентность вируса невысокая. Он погибает при температуре 52 °С и от высушивания при температуре 90 °С в течение 30 минут, чувствителен к действию 0,5 % раствора формалина, 1 % раствора фенола, перманганата калия, эфира, хлороформа, алкоголя и других дезинфицирующих веществ. Длительно сохраняется в 50 % растворе глицерина, при низких температурах и в высушенном состоянии.
Эпидемиология. Источник инфекции - больной или носитель. Оба типа вирусов могут вызывать оральный и генитальный герпес. Вирусы передаются контактным путем (с везикулярной жидкостью, при поцелуях со слюной, при половых контактах с секретами слизистых оболочек, спермой), через предметы обихода, реже воздушно-капельным путем, через плаценту при рождении ребенка. У 80-90 % взрослых людей обнаруживаются антитела к ВПГ. Герпес широко распространен в виде спорадических случаев и небольших вспышек в детских коллективах, больницах. Возможна реактивация вируса при снижении иммунитета (рецидивирующий герпес). Начальное инфицирование ВПГ-2 происходит в жизни позже, чем инфицирование ВПГ-1, и коррелирует с возрастанием половой активности.
Патогенез. Основные входные ворота для вируса – кожа и слизистые оболочки. Чаще вирус вызывает бессимптомную или латентную инфекцию. Различают первичный и рецидивирующий простой герпес.
При первичной инфекции инкубационный период составляет 2-12 суток. Обычно появляются везикулы с дегенерацией эпителиальных клеток. Основу везикулы составляют многоядерные клетки. Пораженные ядра клеток содержат тельца Каудри (эозинофильные включения). Верхушка везикулы через некоторое время вскрывается, образуется язвочка, которая вскоре покрывается струпом, корочкой. Далее наступает заживление.
При инфицировании вирусы, минуя входные ворота эпителия, проходят через чувствительные нервные окончания с дальнейшим передвижением нуклеокапсидов вдоль аксона к телу нейрона в чувствительных ганглиях. Репликация вируса в нейроне приводит к его гибели. Некоторые вирусы герпеса вызывают латентную инфекцию, при которой нейроны содержат в себе вирусный геном, но не погибают.
Латентная инфекция чувствительных нейронов – характерная особенность нейротропных герпесвирусов ВПГ и вируса герпеса Зостер. Большинство людей (70-90 %) являются пожизненными носителями вируса, который сохраняется в ганглиях, вызывая в нейронах латентную персистирующую инфекцию. Наиболее изучена латентная инфекция, вызванная ВПГ-1. В латентно инфицированных нейронах около 1 % клеток в пораженном ганглии несет вирусный геном. При этом вирусная ДНК существует в виде свободных циркулярных эписом (около 20 копий в клетке). ВПГ-1 обнаруживается в узлах тройничного и обонятельного нервов, а ВПГ-2 – в сакральных ганглиях.
Реактивация герпесвирусов и обострение (рецидив) вызываются различными факторами, снижающими иммунитет (переохлаждение, лихорадка, травма, стресс, сопутствующие заболевания, УФ-облучение, лечение иммунодепрессантами и др.). В результате геном герпесвирусов проходит обратно по аксону к нервному окончанию, что способствует репликации вируса в эпителиальных клетках.
Клиническая картина. Болезнь начинается с появления на пораженных участках зуда, отека и пузырьков, заполненных жидкостью. При образовании везикулы ощущается жгучая боль. После подсыхания пузырьков и отторжения корочек рубцы не образуются. ВПГ поражает кожу (везикулы, экзема), слизистые оболочки рта, глотки (стоматит) и кишечника, печень (гепатиты), глаза (кератит и др.) и ЦНС (энцефалит, менингоэнцефалит). Рецидивирующий герпес обусловлен реактивацией вируса, сохранившегося в ганглиях. Он характеризуется повторными высыпаниями и поражением органов и тканей.
Генитальный герпес – результат аутоинокуляции из других пораженных участков тела, но наиболее часто встречается половой путь заражения. Образуются быстро изъязвляющиеся везикулы. У мужчин чаще поражаются головка и тело полового члена, а у женщин – половые губы и вагина, иногда шейка матки. Ранее предполагали, что ВПГ-2 может вызывать рак шейки матки, однако доказано, что эта роль принадлежит папилломавирусам.
Вирус простого герпеса, в основном ВПГ-2, проникает во время прохождения новорожденного через родовые пути матери, вызывая неонатальный герпес (герпес новорожденных), который обнаруживается на 6-й день после родов, т.е. с момента заражения. Вирус диссеминирует во внутренние органы с развитием генерализованного сепсиса. Основой предупреждения развития неонатального герпеса являются выявление и лечение генитального герпеса матери или кесарево сечение при наличии выраженных клинических симптомов инфекции.
Иммунитет в основном клеточный. Развивается гиперчувствительность замедленного типа. Организм человека реагирует на гликопротеины вируса, продуцируя цитотоксические Т-лимфоциты (CD8 + ), а также T-хелперы (CD4 + ), активирующие В-лимфоциты с последующей продукцией специфических вируснейтрализующих антител. Важную роль в ранней защите играют NK-клетки. Антитела матери, передающиеся через плаценту, смягчают последствия неонатального герпеса.
Диагностика. Исследуют содержимое герпетических везикул, слюну, соскобы с роговой оболочки глаз, кровь, спинномозговую жидкость и мозг при летальном исходе. В мазках, окрашенных по Романовскому-Гимзе, наблюдают гигантские многоядерные клетки (синцитий), клетки с увеличенной цитоплазмой и внутриядерными включениями Каудри. Для идентификации вируса используют также ПЦР. Вирус выделяют, заражая клетки HeLa, Hep-2, человеческие эмбриональные фибробласты. Цитопатический эффект становится видимым через сутки после заражения: клетки округляются с последующим прогрессирующим поражением всей культуры клеток. Заражают также куриные эмбрионы или мышей-сосунков, у которых после внутримозгового заражения развивается энцефалит. Вирус идентифицируют в РИФ и ИФА с использованием моноклональных антител.
Серологическую диагностику проводят с помощью РСК, РИФ, ИФА и реакции нейтрализации по нарастанию титра антител больного. Возможно применение иммуноблоттинга.
Лечение. Применяют противовирусные химиотерапевтические препараты (ацикловир, фамцикловир, валацикловир, идоксуридин, видарабин, теброфеновую и флореналевую мазь и др.), препараты интерферонов и индукторы интерферонов.
Профилактика. Специфическая профилактика рецидивирующего герпеса осуществляется в период ремиссии многократным введением инактивированной культуральной герпетической вакцины из штаммов ВПГ-1 и ВПГ-2.
Читайте также:


