Оборудование для изучения вирусов

Россия готовится к тотальному тестированию, новые тест-системы позволяют быстро провести масштабную проверку на вирус. К массовому выпуску приступил один из разработчиков нового продукта, два других начинают производство. Олег Гусев, ведущий научный сотрудник Научно-клинического центра прецизионной и регенеративной медицины Казанского федерального университета и института физико-химических исследований RIKEN (Япония) помог РБК Тренды разобраться в том, как устроено тестирование на коронавирус в России и в мире.
Что предлагает ВОЗ
Глава Всемирной организации здравоохранения Тедрос Гебреисус еще в середине марта призвал страны проводить как можно больше тестов на вирус, который вызывает заболевание SARS-CoV-2, даже людям без симптомов. Согласно руководству ВОЗ, анализы на коронавирус COVID-19 должны проводиться методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией. Как говорится в рекомендациях, на сегодня это самый точный и надежный метод диагностики вирусной инфекции. Он позволяет определить даже очень небольшое количество РНК вируса в биологическом материале человека. Это помогает выявить болезнь в инкубационном периоде.
Изобретенный в 1983 году метод и сейчас считается фундаментальным в молекулярной диагностике. Американский ученый, который придумал способ значительного увеличения малых концентраций фрагментов ДНК в биологической пробе, получил за него Нобелевскую премию. Выявление ДНК/РНК методом ПЦР позволяет диагностировать такие заболевания, как ВИЧ, вирусные гепатиты, инфекции, передающиеся половым путем, туберкулез, боррелиоз, энцефалит и многие другие. Метод используют в археологии, криминалистике, генетике.
Как работает ПЦР-тест
Для анализа из физиологических жидкостей извлекают одноцепочечную РНК, моделируют на ее основе двуцепочечную ДНК и многократно дублируют с помощью специального фермента (полимеразы). Увеличение числа копий ДНК называется амплификацией. В результате концентрация определенных фрагментов ДНК/РНК в биологическом образце, изначально минимальная, значительно увеличивается. При исследовании копируется только необходимый для теста участок ДНК. И, конечно, дублирование происходит только в том случае, если искомый участок вирусной ДНК или РНК присутствует в исследуемом биоматериале. В случае с коронавирусом мазок для анализа берут из ротоглотки или носоглотки, поскольку в крови или в кале вирус появляется на более продвинутой стадии болезни.
Тест-система EMG — продукт совместной разработки российских и японских разработчиков, проводившейся с 2016 года, рассказывает Олег Гусев. На данный момент эти тесты включены в систему обязательного медицинского страхования в Японии.
В ближайшее время планируется производить до 2,5 млн. тестов и 1 тыс. портативных лабораторий в неделю. Сами тесты, как и многие реагенты производятся в России. Планируется, что цена на тесты EMG будет в среднем в пять раз меньше, чем на стандартные ПЦР-тесты в Европе.
Российско-японские тесты основаны на методе изотермальной молекулярной диагностики SmartAmp, превосходящем метод ПЦР по скорости работы в восемь раз, а переносная лаборатория позволяет тестировать до 20 пациентов в час, говорит Гусев.
Ключевое отличие теста EMG в том, что многие тесты, которые производятся сейчас, это тесты ИФА (имунноферментный анализ), а не ПЦР. Данные системы определяют антитела, которые организм начинает вырабатывать не ранее, чем через неделю после заражения. Российско-японская разработка позволяет получать результат уже за 30 минут, с точностью, равной почти 100%. Кроме того, тест EMG позволяет определить наличие вируса уже на самых ранних стадиях, в то время как другие системы диагностики короновируса обладают меньшей чувствительностью и не могут выявлять вирус на ранней стадии инфицирования.
Принцип технологии российско-японского теста, по сути, не отличается от классической ПЦР — это наращивание количества целевых фрагментов ДНК и их детекция. Однако в изотермической амплификации, в отличие от классической ПЦР, где необходимы циклы нагрева и охлаждения, все происходит при одной температуре. Это позволяет многократно увеличивать скорость реакции. Метод SmartAmp был изобретен более 15 лет назад (как и LAMP — другая популярная технология изотермальной амплификации, предшествующая SmartAmp). Впервые для инфекционных заболеваний эту технологию применили в 2009 году для быстрого выявления пандемического гриппа (H1N1) в Японии.
Повторные тесты необходимы при любом методе. Отрицательный тест на COVID-19 не гарантирует, что человек не заразится этим вирусом на следующий день. Поэтому, например, в японских лабораториях персонал тестируют каждые несколько дней. Повторный тест нужен и для того, чтобы подтвердить, что человек излечился.
Эта тест-система будет использоваться для диагностики COVID-19 не только в России и Японии. 40 тыс. тестов закупила Австрия, поступили заказы из других стран Европы, Ближнего Востока, и Латинской Америки. Подана заявка в Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) для поставок в эту страну.
На данный момент в России прошли регистрацию еще три теста на коронавирус.
По некоторым данным, в Москве проводится около 700 тестов на коронавирус в сутки. В планах у московских властей увеличить этот показатель до 10 тыс. тестов в сутки, а затем довести его до 25—28 тыс. тестов ежедневно.
Новые разработки за рубежом
Компания Bosch выводит на рынок свой тест на коронавирус, который сначала будет доступен в Германии, а вскоре появится в других странах. В его основе лежит диагностический аппарат Vivalytic, который, по словам изготовителей, станет первым автоматизированным тестом на COVID-19. Тест распознает не только коронавирус, но еще шесть респираторных заболеваний, например, вирусы гриппа А и B. Во время лабораторных испытаний аппарата его точность составила 95%.
Как пишет издание ZME Science, анализ может проводиться прямо в стационаре или медицинском центре — не нужно отправлять образцы в лабораторию и ждать, пока придет ответ. Врачи смогут быстрее идентифицировать и изолировать зараженных, а пациентам не придется пребывать в неизвестности несколько дней. Тест прост в обслуживании и не требует специальной подготовки. Медперсоналу нужно только взять мазок из носа или горла пациента, нанести его на картридж, содержащий реагент, и вставить картридж в анализатор. Каждый аппарат может выполнять до десяти анализов за 24 часа.
Еще более оперативный тест на COVID-19 разработали в Великобритании. Он позволяет выявить COVID-19 всего за 30 минут. Чтобы провести его, достаточно портативного оборудования стоимостью около $120 и набора полосок для мазков из носа и горла по $5 каждая. Одновременно проходить тест могут до шести человек.
FDA в экстренном порядке одобрило сверхбыстрый тест на коронавирус, разработанный калифорнийской компанией Cepheid. С его помощью диагноз можно будет поставить всего за 45 минут. Как отмечает Business Insider, для обработки результатов теста не требуется специальное обучение. Нужен лишь доступ к системе Cepheid GeneXpert — в США их 5 тыс., а по всему миру — 23 тыс.
Начало тотального тестирования людей на COVID-19 во всем мире — хорошая новость как для людей, так и для национальных органов здравоохранения. До сих пор в мире нет четкого представления о том, сколько людей заражены коронавирусом и выявление тех, у кого он уже есть: их госпитализация или отправка на домашний карантин позволит быстрее оценить масштаб угрозы и вовремя принять правильные меры.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
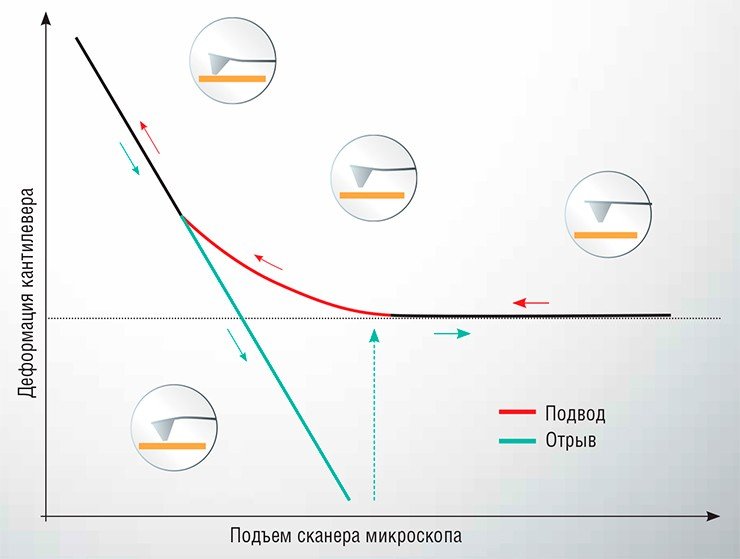
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
В публикации использованы фото автора
Введение
Все микробиологические, биохимические и моле-кулярно-биологические исследования микроорганизмов проводят в специальных лабораториях, структура и оборудование которых зависят от объектов исследования (бактерий, вирусов, грибов, простейших), а также от их целевой направленности (научные исследования, диагностика заболеваний). Изучение иммунного ответа и серодиагностика заболеваний человека и животных осуществляют в иммунологических и серологических (serum — сыворотка крови) лабораториях.
Бактериологические, вирусологические, микологические и серологические (иммунологические) лаборатории входят в состав санитарно-эпидемиологических станций (СЭС), диагностических центров и крупных больниц. В лабораториях СЭС выполняют бактериологические, вирусологические и серологические анализы материалов, полученных от больных и контактировавших с ними лиц, обследуют бактерионосителей и проводят санитарно-микробиологические исследования воды, воздуха, почвы, пищевых продуктов и т.д.
В бактериологических и серологических лабораториях больниц и диагностических центров проводят исследования с целью диагностики кишечных, гнойных, респираторных и других инфекционных заболеваний, осуществляют микробиологический контроль за стерилизацией и дезинфекцией.
Диагностику особо опасных инфекций (чума, туляремия, сибирская язва и др.) проводят в специальных режимных лабораториях, организация и порядок деятельности которых строго регламентированы.
В вирусологических лабораториях диагностируют заболевания, вызванные вирусами (грипп, гепатит, полиомиелит и др.), некоторыми бактериями — хламидиями (орнитоз и др.) и риккетсиями (сыпной тиф, Ку-лихорадка и др.). При организации и оборудовании вирусологических лабораторий учитывают специфику работы с вирусами, культурами клеток и куриными эмбрионами, требующую строжайшей асептики.
В микологических лабораториях проводят диагностику заболеваний, вызываемых патогенными грибами, возбудителями микозов.
Лаборатории обычно размещаются в нескольких помещениях, площадь которых определяется объемом работ и целевым назначением.
В каждой лаборатории предусмотрены:
а) боксы для работы с отдельными группами возбудителей;
б) помещения для серологических исследований;
в) помещения для мойки и стерилизации посуды, приготов
ления питательных сред;
г) виварий с боксами для здоровых и подопытных живот
ных;
д) регистратура для приема и выдачи анализов.
Наряду с этими помещениями в вирусологических лабораториях имеются боксы для специальной обработки исследуемого материала и работы с культурами клеток.
Лаборатории снабжены рядом обязательных приборов и аппаратов.
1. Приборы для микроскопии: биологический иммерсионный микроскоп с дополнительными приспособлениями (осветитель, фазово-контрастное устройство, темнопольный конденсор и др.), люминесцентный микроскоп.
2. Термостаты и холодильники.
3. Приборы для приготовления питательных сред, растворов и т.д.: аппарат для получения дистиллированной воды (дистиллятор), технические и аналитические весы, рН-метры, аппаратура для фильтрования, водяные бани, центрифуги.
4. Набор инструментов для манипуляций с микробами: бактериологические петли, шпатели, иглы, пинцеты и др.
5. Лабораторная посуда: пробирки, колбы, чашки Петри, матрацы, флаконы, ампулы, пастеровские и градуированные пипетки и др., аппарат для изготовления ватно-марлевых пробок.
Крупные диагностические комплексы имеют автоматические анализаторы и компьютеризированную систему оценки полученной информации.
В лаборатории выделено место для окраски микроскопических препаратов, где находятся растворы специальных красителей, спирт, кислоты, фильтровальная бумага и др. Каждое рабочее место снабжено газовой горелкой или спиртовкой и емкостью с дезинфицирующим раствором. Для повседневной работы лаборатория должна располагать необходимыми питательными средами, химическими реактивами, диагностическими препаратами и другими материалами.
В крупных лабораториях имеются термостатные комнаты для массового выращивания микроорганизмов, постановки серологических реакций. Для выращивания, хранения культур, стерилизации лабораторной посуды и других целей используют следующую аппаратуру.
1. Термостат. Аппарат, в котором поддерживается постоянная температура. Оптимальная температура для размножения большинства патогенных микроорганизмов 37 "С. Термостаты бывают воздушными и водяными.
2. Микроанаэростат. Аппарат для выращивания микроорганизмов в анаэробных условиях.
3. С02 -инкубатор. Аппарат для создания постоянной температуры и атмосферы определенного газового состава. Предназначен для культивирования микроорганизмов, требовательных к газовому составу атмосферы.
4. Холодильники. Используют в микробиологических лабораториях для хранения культур микроорганизмов, питательных сред, крови, вакцин, сывороток и прочих биологически активных препаратов при температуре около 4 °С. Для хранения препаратов при температуре ниже О °С применяют низкотемпературные холодильники, в которых поддерживается температура —20 °С или —75 "С.
5. Центрифуги. Применяют для осаждения микроорганизмов, эритроцитов и других клеток, для разделения неоднородных жидкостей (эмульсии, суспензии). В лабораториях используют центрифуги с различными режимами работы.
6. Сушилъно-стерилизационный шкаф (печь Пастера). Предназначен для суховоздушной стерилизации стеклянной лабораторной посуды и других жаростойких материалов.
7. Стерилизатор паровой (автоклав). Предназначен для стерилизации перегретым водяным паром (под давлением). В микробиологических лабораториях используют автоклавы разных моделей (вертикальные, горизонтальные, стационарные, переносные).
БАКТЕРИОЛОГИЧЕСКИЕ, ВИРУСОЛОГИЧЕСКИЕ, МИКОЛОГИЧЕСКИЕ, ИММУНОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ. УСТРОЙСТВО СОВРЕМЕННЫХ МИКРОСКОПОВ. МЕТОДЫ МИКРОСКОПИИ. МЕТОДЫ ИЗУЧЕНИЯ МОРФОЛОГИИ МИКРООРГАНИЗМОВ
1. Правила работы и организация микробиологических (бактериологических, вирусологических, микологических) лабораторий.
2. Основные приборы и оборудование микробиологической лаборатории.
3. Микроскопы и микроскопическая техника. Правила работы с иммерсионным микроскопом (объективами).
Демонстрация
1. Устройство и применение основных приборов и оборудования, используемого в микробиологических лабораториях: термостата, центрифуг, автоклава, сушильного шкафа, инструментария и посуды.
2. Устройство биологического микроскопа. Различные методы микроскопии: темнопольная, фазово-контрастная, люминесцентная, электронная.
3. Препараты микробов (дрожжей и бактерий) при различных методах микроскопии.
1. Микроскопировать и зарисовать препараты дрожже-подобных грибов рода Candida, используя различные виды микроскопии.
Методические указания
Работу в микробиологической лаборатории медицинского учреждения проводят с возбудителями инфекционных заболеваний — патогенными микроорганизмами.
Поэтому для предохранения от заражения персонал обязан строго соблюдать правила внутреннего распорядка:
1. Все сотрудники должны работать в медицинских халатах, шапочках и сменной обуви. Вход в лабораторию без халата категорически воспрещен. В необходимых случаях работающие надевают на лицо маску из марли. Работа с особо опасными микробами регламентируется специальной инструкцией и проводится в режимных лабораториях.
2. В лаборатории запрещается курить и принимать пищу.
3. Рабочее место должно содержаться в образцовом порядке. Личные вещи сотрудников следует хранить в специально отведенном месте.
4. При случайном попадании инфицированного материала на стол, пол и другие поверхности это место необходимо тщательно обработать дезинфицирующим раствором.
5. Хранение, наблюдение за культурами микробов и их уничтожение должны производиться согласно специальной инструкции. Культуры патогенных микробов регистрируют в специальном журнале.
6. По окончании работы руки следует тщательно вымыть, а при необходимости обработать дезинфицирующим раствором.
Микроскопы и методы микроскопии
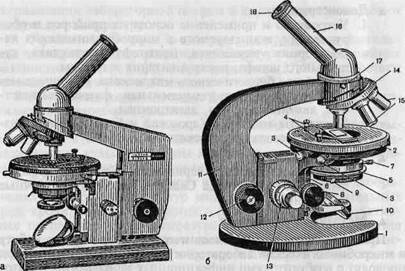
Рис. 1.1. Микроскопы.
а — общий вид микроскопа "Биолам"; б — микроскоп МБР-1: 1 — основание микроскопа; 2 — предметный столик; 3 — винты для перемещения предметного столика; 4 — клеммы, прижимающие препарат; 5 — конденсор; 6 — кронштейн конденсора; 7 — винт, укрепляющий конденсор в гильзе; 8 — рукоятка перемещения конденсора; 9 — рукоятка ирисовой диафрагмы конденсора; 10 — зеркало; 11 — тубусодержатель; 12 — рукоятка макрометричес-кого винта; 13 — рукоятка микрометрического винта; 14 — револьвер объективов; 15 — объективы; 16 — наклонный тубус; 17 — винт для крепления тубуса; 18 — окуляр.
Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцентный, электронный) и специальные методы микроскопии (фа-зово-контрастный, темнопольный).
В микробиологической практике применяют микроскопы отечественных марок: МБР-1, МБИ-2, МБИ-3, МБИ-6, "Биолам" Р-1 и др. (рис. 1.1). Они предназначены для изучения формы, структуры, размеров и других признаков различных микробов, величина которых не менее 0,2—0,3 мкм.
Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло, вода), имеющую высокий коэффициент преломления, близкий к таковому стекла, препятствует рассеянию света от объекта.
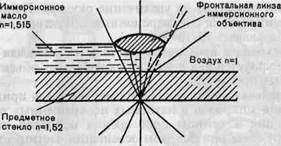
Рис. 1.2. Ход лучей в иммерсионной системе, п — показатель преломления.
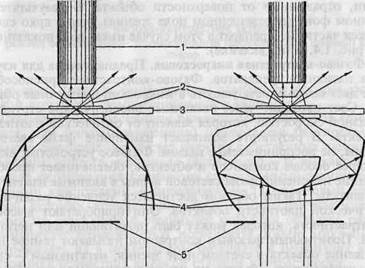
Рис. 1.3. Ход лучей в темнопольных конденсорах, а — параболоид-конденсор; б — кардиоид-конденсор; 1 — объектив; 2 — иммерсионное масло; 3 — препарат; 4 — зеркальная поверхность; 5 — диафрагма.
Таким образом достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, снабженные меткой (МИ — масляная иммерсия, ВИ — водная иммерсия). Предельная разрешающая способность иммерсионного микроскопа не превышает 0,2 мкм. Ход лучей в иммерсионной системе показан на рис. 1.2.
Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90 x 10 = 900.
Микроскопия в проходящем свете (светлопольная микроскопия) используется для изучения окрашенных объектов в фиксированных препаратах.
Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе (рис. 1.3). При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Препарат в этом случае имеет вид, показанный на рис. 1.4, б (на вклейке).
Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне (см. рис. 1.4; на вклейке).
Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4 (рис. 1.5), а также специальные осветители.
Люминесцентная (или флюоресцентная) микроскопия. Основана на явлении фотолюминесценции.
Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминес-цирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта.
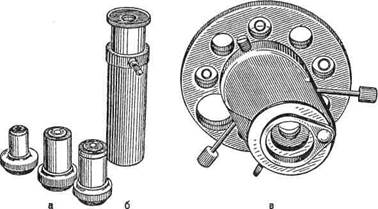
Рис. 1.5. Фазово-контрастное устройство, а — фазовые объективы; б — вспомогательный микроскоп; в — фазовый конденсор.
Длина волны излучаемого света (цвет люминесценции) зависит от физико-химической структуры люминесцирующего вещества.
Первичная люминесценция биологических объектов (собственная, или биолюминесценция) наблюдается без предварительного окрашивания за счет наличия собственных люминес-цирующих веществ, вторичная (наведенная) — возникает в результате окрашивания препаратов специальными люминесци-рующими красителями — флюорохромами (акридиновый оранжевый, ауромин, корифосфин и др.). Люминесцентная микроскопия по сравнению с обычными методами обладает рядом преимуществ: возможностью исследовать живые микробы и обнаруживать их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности.
В лабораторной практике люминесцентную микроскопию широко применяют для выявления и изучения многих микробов.
Электронная микроскопия. Позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Электронный микроскоп применяют для изучения вирусов, тонкого строения различных микроорганизмов, макромолекулярных структур и других субмикроскопических объектов. Световые лучи в таких микроскопах заменяет поток электронов, имеющий при определенных ускорениях длину волны около 0,005 нм, т.е. почти в 100 000 раз меньше длины волны видимого света. Высокая разрешающая способность электронного микроскопа, достигающая 0,1-0,2 нм, позволяет получить общее полезное увеличение до 1 000 000.
Наряду с приборами "просвечивающего" типа используют сканирующие электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов "просвечивающего" типа.
Правила работы с микроскопом
Работа с любым световым микроскопом включает установку правильного освещения поля зрения и препарата и его микроскопию различными объективами. Освещение может быть естественным (дневным) или искусственным, для чего используют специальные источники света — осветители разных марок.
При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка:
1) на приготовленный на предметном стекле и окрашенный мазок нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами;
2) повернуть револьвер до отметки иммерсионного объектива 90х или 10Ох;
3) осторожно опустить тубус микроскопа до погружения объектива в каплю масла;
4) установить ориентировочный фокус при помощи макрометрического винта;
5) провести окончательную фокусировку препарата микро метрическим винтом, вращая его в пределах только одного оборота. Нельзя допускать соприкосновения объектива с пре
паратом, так как это может повлечь поломку покровного стекла или фронтальной линзы объектива (свободное расстояние иммерсионного объектива 0,1—1 мм).
По окончании работы микроскопа необходимо удалить масло с иммерсионного объектива и перевести револьвер на малый объектив 8х.
Для темнопольной и фазово-контрастной микроскопии используют нативные препараты ("раздавленная" капля и др., см. тему 2.1); микроскопируют с объективом 40х или специальным иммерсионным объективом с ирис-диафрагмой, позволяющей регулировать численную апертуру от 1,25 до 0,85. Толщина предметных стекол не должна превышать 1 — 1,5 мм, покровных — 0,15—0,2 мм.
Читайте также:


