Окраска вирусов по морозову
Как известно, вирусы не могут быть рассмотрены в световом микроскопе. Поэтому изучению в обычном микроскопе подвергают включения, или ткани, пораженные вирусом. Изучение изменений, происходящих в тканях, проводят с помощью методов и приемов гистологического исследования, которые рассматриваются в соответствующих руководствах.
Препараты для микроскопии элементарных телец и включений готовят из мазков и отпечатков органов и тканей.
Предметные стекла готовят, как указано выше.
Приготовленные мазки немедленно фиксируют. С этой целью применяют простые и сложные фиксаторы. Среди простых чаще других употребляют метиловый спирт, смесь этилового (абсолютного) спирта и эфира (поровну), ацетон.
Среди сложных применяют:
1) смесь Дюбоска — Бразиля — Буэна: пикриновой кислоты 1 г, продажного (40%) формалина 60 мл, спирта (80°) 150 мл и ледяной уксусной кислоты 15 мл;
2) сулемовые смеси:
а) Шаудина: 2 части насыщенного раствора сулемы и 1 часть абсолютного спирта;
б) Ценкера: сулемы 5 г, двухромовокислого калия 2,5 г, сернокислого натрия 1 г, ледяной уксусной кислоты 5 мл, дистиллированной воды 100 мл. Уксусную кислоту добавляют в смесь перед употреблением;
в) Хелли — Максимова: сулемы 5 г, двухромовокислого калия 2,5 г. неоазведенного продажного формалина 10 мл, 2% раствора осмиевой кислоты 10 мл, дистиллированной воды 100 мл.
Формалин и осмиевую кислоту добавляют в смесь перед употреблением.
Из методов окраски распространены следующие.
Окраска по Романовскому.
Высушенные на воздухе препараты без фиксации опускают на 1—2 минуты в раствор неразведенного красителя Романовского. Затем их промывают дистиллированной водой, высушивают на воздухе и микроскопируют с иммерсионной системой.
Элементарные тельца, окрашиваемые этим способом, имеют синий цвет на голубом фоне препарата.
Окраска по Муромцеву.
Влажные мазки или отпечатки фиксируют 1—2 часа в этиловом или метиловом спирте комнатной температуры или 15—20 минут в спирте, подогретом до 50—70". После промывания дистиллированной водой красят 5—10 минут синькой Мансона,разведенной в 40 раз.
Синька Мансона: в 100 мл кипящей воды растворить 5—8 г химически чистой буры, добавить 2 г метиленового синего. Окрашенный препарат, не промывая, дифференцируют 5—10 минут в водном растворе танина (5—10%). После приобретения препаратом голубоватого оттенка его промывают дистиллированной водой и подсушивают фильтровальной бумагой. Препарат проводят через абсолютный спирт или 50% смесь абсолютного спирта с ацетоном, после чего он готов для микроскопии.
В окрашенном этим способом препарате фон и цитоплазма клеток бледно-голубые, тельца Бабеша — Негри резко очерчены, фиолетовые с розовым оттенком, ядра синие, ядрышки темно-синие, эритроциты оранжево-красные.
Окраска по Морозову.
Приготовление реактивов и порядок окраски см (Серебрение по Морозову). При окраске этим методом элементарные тельца имеют вид темно-коричневых, почти черных зерен на светло-коричневом фоне.
Окраска по Селлеру.
Влажный мазок или отпечаток без фиксации 10 секунд окрашивают смесью из насыщенных растворов в метиловом спирте основного фуксина (3—5 мл) и метиленового синего (15 мл) и чистого метилового спирта (25 мл). Промывают проточной водой, сушат на воздухе, и препарат готов для микроскопии.
Тельца Бабеша — Негри пурпурно-красные, цитоплазма ядра и ядрышка синяя, эритроциты кирпично-красные.
Окраска по Пигаревскому.
Препарат, высушенный на воздухе в течение 10 минут и нефиксированный, окрашивают 1 минуту смесью, состоящей из насыщенных растворов метилового зеленого (3,2 мл), пиронина (6 мл), оранжевого Ж (1 мл) и дистиллированной воды (75 мл).
После промывания проточной водой дальнейшая окраска, как по Селлеру (см. выше).
При микроскопии протоплазма клеток сиреневого цвета, цитоплазматические включения ярко-красные.
Окраска по Павловскому.
Препараты окрашивают в течение 3—5 секунд красителем, приготовленным из 10 мл дистиллированной воды, 1 капли насыщенного спиртового раствора основного фуксина и 8 капель насыщенного спиртового или водного раствора метиленового синего.
Краситель смывают проточной водой и препараты высушивают на воздухе.
| Реактивы: I | |
| 40% формалина (продажного) | 1 мл |
| Дистиллированной воды | 100 мл |
| II | |
| Танина | 5 г |
| Дистиллированной воды | |
| Карболовой кислоты (расплавленной) | 1 мл |
(Клемпарская предлагает применять, во избежание осадков, протраву в виде 2,5—3% раствора танина.)
Раствор аммиачного серебра (III) готовят по следующей методике: 4 г азотнокислого серебра растворяют в 80 мл дистиллированной воды; затем к нему по каплям добавляют крепкий (25%) аммиак, пока образующийся темно-коричневый, а затем буро-черный осадок не растворится и останется лишь легкая опалесценция. Раствор очень стоек. Хранить в темной склянке с притертой пробкой (защищать от пыли!). Перед окраской реактив разбавляется 1 : 10 дистиллированной водой.
Приготовление бактериальной взвеси. Как правило, жгутики в старых культурах теряются. Иногда необходимы частые систематические пересевы в течение долгого времени на жидкие среды (ежедневные пересевы на свежие среды), пока подвижность микробов не восстановится. Хорошей средой для пересевов является также обыкновенный или кровяной агар, свежий, с влажной поверхностью.
На границе с конденсационной водой осторожно захватывают петлей немного бактериальной массы, переносят ее в пробирку, где налито 0,1—0,2 мл 1% формалина (реактив I), легкими движениями петли распределяют микробные тела в жидкости. До окраски приготовленную эмульсию держат при 37° в течение 2 часов и более (сохраняется годами).
Приготовление стекол. Рекомендуют готовить препарат только на новых, еще не бывших в употреблении, безукоризненно чистых предметных стеклах. Стекла обрабатывают (для очистки) концентрированной соляной кислотой в течение 15 минут; затем кислоту сливают, остатки ее нейтрализуют крепким аммиаком, стекла промывают дистиллированной водой и переносят в чистый винный спирт. Вынутые из спирта (пинцетом!) стекла тщательно протирают мягкой чистой тряпочкой. В чашечку или бюксу, где налито 3—4 мл дистиллированной воды, очень тонкой пипеткой вносят 1 каплю формалиновой бактериальной взвеси. Отсюда маленькой петлей наносят 5—6 отдельных капель взвеси на центральную часть предметного стекла, не касаясь петлей его поверхности и не размазывая капли. Когда капли высохнут на воздухе, приступают к их окраске.
Техника окраски
1) на препарат (пинцет Корнэ!) наливают протраву (реактив II) и в течение 1—2 минут подогревают до появления паров;
2) тщательно смывают протраву дистиллированной водой (удалению протравы способствуют, протирая стекло вокруг мазка кусочком фильтровальной бумаги);
3) обрабатывают препарат в течение 2—2,5 минут раствором серебра (реактив III) при легком подогревании, пока на препарате не станут видны весьма слабо окрашенные в коричневый цвет округлые пятна (рассматривать белом фоне или при проходящем свете!). Тщательно промывают мазок дистиллированной водой и высушивают на воздухе.
Микроскопическая картина: тела бактерий—угольно-черного цвета, жгутики—в виде тончайших волнообразно извитых нитей коричневого или янтарно-черного цвета на прозрачном или желтоватом гомогенном фоне.
Если жгутики не окрасились, удаляют масло с препарата ксилолом и вторично повторяют процедуру окраски, так как жгутики обнаруживаются только при особенно интенсивной окраске.
В препарате могут быть осадки или грязный фон вследствие переноса на стекло частиц агара, конденсационной воды или при употреблении плохо очищенных стекол, грязного пинцета, наконец, в том случае, если была плохо отмыта протрава.
Если бактериальная эмульсия слишком густа, то бактерии в мазке будут скучены и картина флагелляции вследствие беспорядочного сплетения жгутиков будет неясна. Желательно подобрать такую концентрацию, чтобы в одном поле зрения находилось от 5 до 10 отдельно расположенных бактерий с хорошо расправленными жгутиками.
Заготовляемые для хранения препараты заключают в парафиновое масло или чистый канадский бальзам под покровным стеклом, иначе они быстро обесцветятся под действием света. Несмотря на то, что окрашивание жгутиков считается одной из тонких микробиологических операций, окраска по Морозову при известной пунктуальности выполнения даже в руках начинающих дает прекрасные результаты.
Способ Уварова
Особенность данного способа окраски жгутиков—отсутствие в протраве танина.
1. Культуру освежают двух- трехкратными пересевами на свежий агар и выращиванием при 37° в течение 15—16 часов.
2. Для приготовления эмульсии в физиологический раствор, налитый в чистую пробирку в количестве 5 мл, осторожно погружают петлю со свежей культурой для получения слабой эмульсии. Легкими круговыми вращениями пробирки между ладонями эмульсию равномерно смешивают, затем добавляют в нее одну каплю формалина.
3. Для окраски приготовляют:
а) насыщенный водный раствор калийных квасцов;
б) раствор: сульфаниловой кислоты 0,5 г + соляной кислоты 1,5 мл + 100 мл дистиллированной воды;
в) раствор Мюра: насыщенного водного раствора калийных квасцов 25 мл + насыщенного спиртового раствора генцианвиолета - 5 мл;
Микроскопическая картина: жгутики—ярко красно-фиолетового или розовато-фиолетового цвета, тела бактерий—густо фиолетовые.
Способ Леффлера
Приготовленный препарат осторожно фиксируют на пламени горелки и обрабатывают при подогревании в течение 0,5—1 минуты протравой следующего состава: 20% водного раствора танина – 100 мл + насыщенного на холоду водного раствора сернокислого закисного аммиачного железа 50 мл + насыщенного спиртового раствора основного фуксина 10 мл. Препарат тщательно обмывают слабой струей воды и слегка высушивают на воздухе, затем окрашивают карболовым раствором фуксина при подогревании в течение 2—3 минут, промывают водой и высушивают.
Способ Инуйе
Препарат, приготовленный со всеми предосторожностями, подогревают до появления паров в течение 1—1,5 минут в леффлеровской протраве (см. выше способ Леффлера). Затем протраву смывают водой до прекращения отхождения краски и окрашивают мазок в растворе Мюра, предварительно смешанном и профильтрованном (см. способ Уварова), над пламенем в течение 1-2 минут. Препарат после окраски промывают водой.
Бактерии окрашиваются в темно-фиолетовый, а жгутики—в бледно-фиолетовый, красноватый цвет.
Способ Бениньетти и Джино
За 2—3 дня до окраски готовят следующие растворы:
1) сернокислого цинка 1г + 15г танина + дистиллированной воды 100 мл;
2) насыщенный (при нагревании!) водный раствор квасцов;
3) насыщенный спиртовой раствор генцианвиолета.
Непосредственно перед окрашиванием указанные растворы смешивают в пропорции 1 : 2 : 3, смесь обязательно фильтруют, затем наливают на фиксированный препарат, подогревают в течение 2—3 минут, после чего препарат тщательно промывают водой и высушивают.
Микроскопическая картина: тела бактерий—темно-фиолетового цвета, жгутики—более нежной окраски. Обычно не во всех точках препарат одинаково хорошо и равномерно окрашивается.
Этот способ наиболее доступен для начинающих и дает вполне удовлетворительные результаты.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
1. а) Элементарные тельца (вирионы) вируса оспы (тельца Пашена) в препаратах, окрашенных по Морозову, выглядят в виде мелких точек круглой или удлиненной формы, темно-коричневого цвета.
б) Внутриклеточные включения при бешенстве (тельца Бабеша-Негри – выкристаллизовавшиеся нуклеокапсиды вируса) обнаруживаются в нервных клетках аммонова рога и в клетках Пуркинье мозжечка. В препарате, окрашенном по Туревичу, цитоплазма и ядра нервных клеток окрашенны в желто-зеленый (защитный) цвет. Тельца Негри расположены в цитоплазме рядом с ядром клетки и окрашены в малиново-красный цвет. При окраске по Манну - тельца Негри красного цвета на голубом фоне цитоплазмы.
Все рассмотренные препараты зарисовать.
| Вирионы оспы (тельца Пашена) окраска по Морозову | Тельца Бабеша-Негри при бешенстве окраска по________________ |
2. Методы заражения животных разнообразны: внутрибрюшинный, внутривенный, внутримышечный, интраназальный, заражение в мозг и другие.
Заражение в мозг (метод применяют при работе с нейротропными вирусами). Для заражения чаще используют белых мышей. Левой рукой плотно прижимают мышь к столу, большим и указательным пальцами оттягивают кожу головы назад. Туберкулиновым шприцем с предохранительной муфтой на игле прокалывают лобную кость несколько латеральнее средней линии и вводят 0,02-0,03 мл материала. Игла вводится на глубину 1,5-2 мм, при этом отчетливо ощущается "провал" в полость черепа.
При заражении новорожденных мышей (2-3-дневного возраста) их лучше брать руками в перчатках, чтобы после заражения мышата не имели постороннего запаха (пота, дезинфицирующих веществ, антибиотиков и т.д.), так как самка съедает мышат, имеющих посторонний запах. Материал вводят в количестве 0,01 мл. Вытекающую жидкость удаляют сухим стерильным ватным тампоном без дезинфицирующих веществ. После заражения мышат помещают в отдельную банку (в свое гнездо), а через 20-30 мин подсаживают к ним самку.
Больных мышат самка также съедает. Поэтому надо уловить момент извлечения зараженных животных для завершения опыта. Первые два дня просматривают мышат 1-2 раза в день, а затем чаще. Через 3-4 дня здоровый мышонок в два раза больше зараженного.
3. Кроме животных для культивирования вирусов используют куриные эмбрионы и культуры клеток различных тканей. Культуры ткани - это клетки ткани выращенные вне организма на специальной питательной. среде. Клетки ткани в искусственных условиях сохраняют присущий им обмен и восприимчивость к определенным вирусам. Для культивирования вирусов особенно пригодны клетки с быстрым ростом. По этой причине широко применяют эмбриональные ткани (фибробласты куриных эмбрионов, клетки человека и др., а также культуры тканей опухолей (клетки Неla, Нер-2 и др.).
Кулътивирование клеток может производиться в специальных флаконах (колбы-матрацы, флаконы Карреля) и в пробирках. Культура клеток для роста должна иметь какую-либо опору, например, стенку пробирки.
В выросшую культуру ткани, которая покрывает стенку сосуда в виде однослойного клеточного пласта, засевают материал, содержащий вирус. Работу производят в стерильных условиях. Для подавления роста микрофлоры вируссодержащий материал предварительно обрабатывают антибиотиками, чаще пенициллином и стрептомицином.
О наличии и размножения вируса в клетках узнают по так называемому цитопатическому эффекту: в результате размножения вируса клетки гибнут, и под микроскопом заметны дегенеративные изменения клеток. Пласты зараженных клеток отслаиваются от стенки пробирки или флакона. Так как рост клеток прекращается, pН среды мало изменяется по сравнению с контролем (клетки без вируса).
Питательной средой для культуры ткани могут быть различные растворы, состав которых приближается к составу жидкости организма (синтетическая среда 199, солевой раствор Хенкса с сывороткой, гидролизат лактальбумина с сывороткой и другие).
Получение первично-трипсинизированных клеток.
Живые клетки для однослойных культур ткани могут быть получены из эмбрионов и органов взрослых животных (напр., из почек) и человека. Для диспергирования ткани используют 0,25-0,3% раствор трипсина, который разрушает межклеточные мостики из соединительной ткани и освобождает клетки.
Метод трипсинизации тканей состоит в следующем: ткань измельчают ножницами (или другим способом) на мелкие кусочки размером 1-3 мм, промывают в буферном растворе Хенкса для удаления крови 2-3 раза, до тех пор, пока жидкость не станет почти прозрачной. Для диспергирования отмытые кусочки ткани обрабатывают раствором трипсина (добавляют 2 объема раствора трипсина) при температуре 32-37°С. Трипсинизацию проводят в течение нескольких минут (до 10 мин) при постоянном перемешивании пипеткой или в смесителе на электромагнитной мешалке. Суспензию клеток собирают в сосуд, помещенный на лед для прекращения действия фермента. К оставшейся ткани добавляют свежие порции трипсина, т.е. процесс повторяют 6-8 раз, иногда и более – до прекращения помутнения раствора трипсина.
Жидкость, содержащую клетки, фильтруют через марлю для отделения от неё комочков ткани и соединительнотканных волокон, центрифугируют при 2000 об/мин в течение 5 минут, надосадочную жидкость сливают, а клетки отмывают раствором Хенкса. Отмытые клетки добавляют к питательной среде (гидролизат лактальбумина с сывороткой, или среда 199 , или др.) в разведении 1:200.
4. С помощью камеры Горяева подсчитают количество клеток в 1 мл. Клетки считают по всей камере под малым увеличением микроскопа. Количество клеток в 1 мл вычисляют по формуле:
Количество клеток в 1 мл = 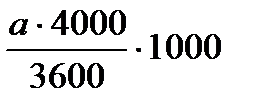
;
где а - количество клеток в камере;
3600 - количество квадратов в камере;
1/4000 мм - объем одного квадрата.
Так как в одном мл 1000 мм , то полученный результат умножают на 1000. После первого разведения (1:200) концентрация клеток достигает 600000-1300000 на 1 мл. Клетки куриных эмбрионов разводят той же средой до концентрации 400000 клеток в 1 мл.
Взвесь клеток разливают по 1 мл в пробирки, которые плотно закрывают стерильными резиновыми пробками для того, чтобы среда не выщелачивалась. Пробирки помещают в термостат при 37 ° С почти в горизонтальном положении (под углом в 5 ° ) в специальных штативах. Через 3-4 дня при микроскопии виден сплошной слой размножившихся клеток. Пробирки с хорошим ростом ткани отбирают для заражения вирусом.
5. В настоящее время имеется много стабильных штаммов клеток, пассируемых вне организма в течение многих лет. Эти культуры клеток называют перевиваемыми культурами ткани, или растущими культурами ткани. К ним относятся штаммы клеток, полученные из злокачественных опухолей и из нормальных тканей человека и животных: 1) штамм клеток Неla – клетки карциномы шейки матки человека; 2) штамм клеток Нер-2 – клетки злокачественной опухоли гортани человека; 3) штамм клеток Детройт-6 – клетки, выделенные из костного мозга человека, больного раком легких; 4) штаммы клеток А-0 и А-1 – клетки амниона человека; 5) штамм клеток ЕRК-клетки почек эмбриона кролика; 6)штамм клеток СОЦ - клетки сердца обезьяны Macacus cyn omolgus и многие другие. Эти штаммы клеток применяются только для диагностики вирусных заболеваний. Они не могут быть использованы для изготовления вакцинных вирусных препаратов, так как культуры клеток, полученные даже из нормальных тканей, в процессе длительных пересевов приобретают характер злокачественного роста.
Посмотреть под микроскопом демонстрационные препараты культур ткани и зарисовать.
| Фибробласты куриных эмбрионов окраска по Романовскому | Клетки амниона человека окраска по Романовскому |
6. Для поддержания роста клеток пересев делают через 6-7 дней. Количество клеток за это время увеличивается в 4-10 раз. При пересеве для отслаивания клеток от стекла используют 0,02% раствор Версена (двунатриевая соль этилендиаминотетраацетата – Na2ЭДТА). При добавлении его к культуре клеток он связывает кальций и магний, благодаря которым клетки прикреплены к стеклу, и клетки отслаиваются от стекла.
Предварительно из пробирки или флакона удаляют питательную среду, затем в пробирку вносят 0,5 мл раствора версена, а во флаконы-матрацы объемом 150-200 мл - 10 мл и 25 мл версена соответственно. Сосуды помещают в термостат на 20-30 мин, после чего слегка встряхивают. Взвесь вносят в пробирки, центрифугируют при 1000 об/мин 5-10 мин, раствор версена удаляют, а клетки ресуспендируют в питательной среде, Подсчитывают в камере Горяева концентрацию клеток и взвесь разводят до концентрации 200000 клеток в 1 мл. Взвесь вносят по 1-2 мл в пробирки. Пробирки закрывают резиновыми пробками, отмечают карандашом по стеклу лицевую сторону пробирок и помещают их в наклонном положении в термостат.
Подсчитать концентрацию смытых клеток с помощью камеры Горяева и сделать посев культуры клеток в пробирки.
7. Просмотреть монослой выросших клеток и заразить культуру ткани вирусом осповакцины. Техника заражения состоит в следующем. Вирус вакцины разводят синтетической средой 199 в отношении 1:3 и обрабатывают антибиотиками. Из пробирки с культурой ткани стерильной пастеровской пипеткой отсасывают питательную среду. В пробирку вносят I мл разведенного средой вируса вакцины, плотно закрывают ее резиновой пробкой и помещают в термостат в горизонтальном штативе.
8. Существует несколько методов заражения куриных эмбрионов: на хорионаллантоисную) оболочку, в аллантоисную полость, амниотическую полость, в желточный мешок. Для заражения используют эмбрионы 5-11-дневного возраста. Перед заражением эмбрионы просматривают в темной комнате при помощи овоскопа для проверки их жизнеспособности (живые эмбрионы подвижны с хорошо развитыми сосудами) и определения воздушной камеры и места расположения эмбриона. Место на столе, где производят манипуляции, покрывают салфеткой, смоченной в растворе хлорамина.
Заражение на хорионаллантоисную оболочку. Яйцо устанавливают в штативе в вертикальном положении тупым концом вверх. Скорлупу над воздушной камерой обрабатывают спиртом, йодом, повторно спиртом, обжигают, прокалывают ножницами небольшое отверстие, через которое в полость воздушного мешка вводят одну браншу ножниц и срезают скорлупу над ним. Затем анатомическим пинцетом захватывают в складку и осторожно снимают внутренний листок подскорлуповой оболочки. Под ней находится хорионаллантоисная оболочка, на которую пастеровской пипеткой наносят исследуемый материал в количестве 0,2-0,5 мл. Отверстие скорлупы закрывают стерильным стеклянным колпачком, который закрепляют на яйце расплавленным парафином. Зараженное яйцо помещают в термостат при 37 ° на 48 часов.
3аражение в аллантоисную полость. После подготовительной работы скорлупу прокалывают над воздушной камерой и через небольшое отверстие вводят иглой шприца или пастеровской пипеткой на глубину 1-1,5 см материал в объеме 0,1-0,2 мл. Отверстие заливают парафином.
Заражение в амниотическую полость. После удаления скорлупы над воздушной камерой бранши пинцета вводят в аллантоисную полость в направлении эмбриона на глубину 2-2,5 см, захватывают амниотическую оболочку, выводят ее из глубины, прокалывают иглой шприца и в амниотическую полость вводят материал в количестве 0,1 мл. Отверстие в скорлупе закрывают колпачком и парафинируют.
Заражение в желточный мешок (этим методом чаще пользуются для выделения риккетсий). Просмотреть 5-8-дневный эмбрион с помощью овоскопа, отметить границу воздушной камеры и место расположения эмбриона. Исследуемый материал вводят эмбрионам длинной иглой (4-5 см) через небольшое отверстие в скорлупе над воздушной камерой на глубину 2-3 см. При этом надо не повредить зародыш. Во время манипуляции он должен находиться ниже желточного мешка.
Ввести эмбриону на хорионаллантоисную оболочку вирус осповакцины или в аллантоисную полость вирус гриппа.
Контрольные вопросы
Чем отличаются вирусы от всех остальных живых организмов?
Что такое вирион? Что такое капсид, нуклеокапсид, пеплос (суперкапсид)?
Какой тип симметрии может иметь нуклеокапсид?
Какие признаки используются для классификации вирусов?
Почему вирусы считаются облигатными паразитами?
Какие методы используются для культивирования вирусов?
Как заражают новорожденных мышеи?
Что собой представляют тельца Негри и какими методами их окрашивают?
Что такое культура ткани?
Ткани каких органов используются для получения культур клеток?
Как получают культуру первично-трипсинизированной ткани?
Что такое перевиваемые культуры ткани?
Какие Вы знаете штаммы перевиваемых клеток?
Какие среды и солевые растворы применяют для выращивания и для обработки культур ткани?
Как подсчитывают количество клеток и с какой целью?
В каком положении ставят пробирки в термостат и сколько времени выращивают клетки до заражения их вирусом?
По каким признакам судят о размножении клеток?
Как делают пересев клеток для поддержания данного штамма в лабораторных условиях?
Как отбирают пробирки с культурой ткани для заражения вирусом?
Как выглядят растущие клетки?
Как готовят вируссодержащий материал для заражения культуры ткани?
На сколько времени ставят зараженные пробирки в термостат?
Каково строение куриного эмбриона?
Какого возраста эмбрионы используются для заражения?
Как определяет место расположения эмбриона при овоскопии?
Как обрабатывается эмбрион перед заражением?
Какие существуют метода заражения куриного эмбриона?
На сколько времени ставят зараженный эмбрион в термостат для размножения вируса?
Дата добавления: 2015-02-16 ; просмотров: 1552 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Автор работы: Пользователь скрыл имя, 29 Мая 2013 в 16:53, лабораторная работа
Цель занятия: ознакомиться с планировкой и оборудованием вирусологической лаборатории, ее документацией, правилами и техникой безопасности при работе с вирусодержащим материалом.
практикум по вирусам.doc
Керамические свечи представляют собой удлиненной формы полые цилиндры, закрытые в нижней части (свечи Шамберлена, Беркефельда, каолиновые фильтры Санкт-Петербургского керамического НИИ). Их изготовляют из каолина с различной степенью порозности.
Стеклянные фильтры готовят из пористого стекла. В последние годы довольно широкое распространение получили фильтры Шота с пластинкой №5 из сплавленных мельчайших гранул отекла.
Суспензии, содержащие вирус, перед фильтрованием необходимо освободить от грубой взвеси. Для этого их вначале центрифугируют в течение 10. 15 мин при 1500. 2000 об/мин и фильтруют через бумажный фильтр большой порозности (800 нм). Суспензия, подлежащая стерилизующему (заключительному) фильтрованию, должна быть прозрачной и лишь слегка опалесци-рующей. Жидкость, хранившуюся на холоде, перед фильтрованием рекомендуется в течение часа выдержать при комнатной температуре, а затем нужный ее объем вылить в стакан фильтровального прибора. В приемном сосуде (колбе) создают разрежение при помощи водоструйного или масляного насоса (рис.5). Фильтрат проверяют на стерильность (наличие бактерий, грибов) путем посева на МПА, МПБ, среду Сабуро.
Следует отметить, что фильтрование сопровождается адсорбцией вируса на фильтре и приводит к его значительным потерям.
Отбор крови для серологических исследований. Для серологической диагностики необходимо иметь две пробы сыворотки крови (парные сыворотки), взятые в начале и в конце болезни. Первую пробу берут как можно раньше — в инкубационный период или в начале проявления клинических симптомов болезни, вторую — во время выздоровления или через 2. 3 недели после заболевания. Брать кровь и готовить сыворотку необходимо стерильно, нельзя применять энтикоагулянты или консерванты, которые могут придать сыворотке антикомплементарность, а в реакции нейтрализации оказать инактивирующее действие на вирус, оказаться токсичными для культур клеток или просто нестерильными. Кровь в объеме 10. 15 мл берут в стерильные пробирки с резиновыми пробками, выдерживают при комнатной температуре до образования сгустка, обводят стеклянной палочкой или
Рис.5. Приемы стерилизующего фильтрования: а — фильтрование через свечу Беркефельда — снаружи внутрь с водоструйным насосом; б — схема присоединения к вакуум-насосу с тройником и зажимом Гофмана для выравнивания возможных перепадов давления: 1 — воронка Уленгута; 2 — приемник; 3 — ватный фильтр; 4 — колба Бунзена; 5 — тройник со свободным концом трубки и зажимом; 6 — водоструйный насос; в — стерилизующее фильтрование через свечу Шамберлена — изнутри наружу
другим инструментом и переносят в холодильник при 4 °С на 18. 20 ч. После максимальной ретракции сгустка сыворотку отсасывают, добавляют пенициллин и стрептомицин по 100 ЕД/мл, проводят высевы на бактериологические среды. Вместо отстаивания в холодильнике можно после обведения кровь центрифугировать.
Серологические методы вирусологической диагностики требуют исследования парных проб сывороток, поэтому необходимо правильно сохранять первые пробы, пока не будут получены вторые. Хранить сыворотки необходимо в холодильнике при 4 °С или в замороженном виде, строго соблюдая порядок нумерации проб и соответствия записей в журнале и на пробах.
В ходе самостоятельной работы студентов необходимо
1. Подготовить исследуемый материал для заражения лабораторных животных, куриных эмбрионов и культур клеток путем обработки антибиотиками.
2. Проверить полученный материал на стерильность путем высева на МПА, МПБ.
Примерный план занятия (2 ч)
1. Контрольные вопросы.
2. Объяснения преподавателя.
3. Демонстрация: а) набора посуды и инструментов;
б) приемов взятия смывов со слизистой оболочки носовой полости, конъюнктивы, прямой кишки у телят и других животных;
в) этикетирования и транспортировки взятого материала.
4. Самостоятельная работа студентов.
5. Подведение итогов занятия.
6. Задание к следующему занятию.
Методические указания Занятие можно провести следующим образом. Первый час посвятить объяснению и демонстрации приемов взятия материала от животных, находящихся в клинике института. Второй час студенты проводят работу по подготовке материала к исследованию.
На данном занятии ограничиваются только демонстрацией взятия материала от животных, так как весь процесс студенты будут отрабатывать при прохождении учебно-производственной практики.
Вопросы домашнего задания
1. Морфология и химический состав вирусов.
2. Структура вирусов.
3. Функции нуклеиновой кислоты и вирусного белка в онтогенезе вирусов.
4. Методы лабораторной диагностики вирусных инфекций.
5. Вирусоскопический метод исследования с использованием светового микроскопа.
ЗАНЯТИЕ 3. Методы лабораторной диагностики вирусных инфекций. Вирусоскопический метод исследования
Цель занятия: ознакомиться с методами лабораторной диагностики, световой микроскопии, а также техникой приготовления и способами окрашивания мазков, препаратов-отпечатков и гистосрезов для выявления вирионов и внутриклеточных включений.
Оборудование и материалы: микроскопы (соответственно количеству студентов), демонстрационные препараты с вирусами оспы, включениями Бабеша-Негри; предметные стекла, вируссо-держащий материал (например, вирус осповакцины), пастеровские пипетки, реактивы для окрашивания по методу Морозова, таблицы по теме, диапозитивы.
Краткие теоретические сведения
Методы лабораторной диагностики вирусных инфекций следующие.
1. Вирусоскопический метод исследования: а) в световом микроскопе; б) в люминесцентном микроскопе; в) в электронном микроскопе.
2. Выделение и культивирование вирусов путем заражения развивающихся куриных эмбрионов, лабораторных животных и культур клеток.
3. Серологический метод исследования (идентификация вирусов) — постановка серологических реакций (РЗГА, РН и др.).
4. Биологический метод.
\JМикроскопию в световом микроскопе проводят с целью выявления крупных вирусов-вирионов, внутриклеточных включений и изучения патологических изменений клеток, пораженных вирусами (ЦПД). Вирион — это зрелый внеклеточный вирус. Включения представляют собой вирусный материал, находящийся внутри клетки, в образовании которого участвуют и клеточные продукты. Вирионы могут быть обнаружены в мазках и препаратах-отпечатках из инфицированной ткани; включения — только в препаратах-отпечатках и гистосрезах, приготовленных из пораженных органов и тканей.
Оспа овец, свиней и коров, эктима овец, оспа-дифтерит птиц — это такие инфекции, при которых обнаружение вирионов-возбудителей приобрело диагностическое значение. Для выявления вирионов используют методы окрашивания, которые позволяют увеличить вирусную частицу в размерах и сделать ее более контрастной. В целях получения хороших результатов используют чистые обезжиренные предметные стекла. Препараты готовят из тщательно размельченного материала или путем отпечатков, стараясь сделать их как можно тоньше. При каждом вирусном заболевании учитывают, какие органы и ткани наиболее поражены и какие участки их следует исследовать, выбирают также соответствующий метод фиксации. Существует ряд методов окраски вирионов.
Окраска по Морозову применяется в процессе диагностики оспы, эктимы овец и орнитоза. Возбудителей болезни выявляют в препаратах-отпечатках, мазках из чистых суспензий. При исследовании последних на предметное стекло пастеровской пипеткой наносят небольшую каплю материала и распределяют ее тонким слоем, для окрашивания готовят три реактива.
Реактив №1 (фиксатор — жидкость Руге): 2 мл 40%-ного формальдегида (продажный формалин), 1 мл ледяной уксусной кислоты, 100 мл дистиллированной воды.
Реактив №2 (протравитель): 5 г танина, 2 мл жидкого фенола, 100 мл дистиллированной воды (если появляется осадок, раствор фильтруют).
Реактив №3 (краситель): 5 г азотнокислого серебра растворяют в 100 мл дистиллированной воды, затем осторожно по каплям добавляют раствор 25%-ного аммиака до появления легкой опалесценции. Перед употреблением разводят дистиллированной водой 1:10.
Готовые препараты высушивают на воздухе, 2. 3 мин отмывают дистиллированной водой в вертикальном положении. Затем на них наносят реактив №1, через 1 мин его сливают, мазок промывают и наносят на 1. 2 мин реактив №2, проводя препарат над пламенем спиртовки до появления паров. Далее мазок тщательно промывают дистиллированной водой и на 1. 2 мин наносят реактив №3, прогревая препарат на огне, пока он не станет темно-коричневым. После этого препарат снова тщательно промывают водой, высушивают на воздухе и микроскопируют.
На светло-коричневом фоне препарата вирионы имеют вид темно-коричневых или черных точек, расположенных одиночно, попарно или в виде скоплений (рис.6,7). Результат будет положительным только в случае массового обнаружения характерных образований.
Окраска по Маккиавелло сводится к следующему. Высушенные нефиксированные препараты окрашивают 5 мин профильтрованным 0,25% -ным раствором основного фуксина, краситель сливают, а мазок быстро (1 с) проводят через 0,5%-ный раствор лимонной кислоты, тщательно промывают водопроводной водой и окрашивают 5-10 с 1%-ным раствором метиленовой сини. Затем препарат вновь промывают, высушивают и микроскопируют. Вирионы окрашиваются в яркий рубиново-красный цвет, цитоплазма клеток — в светло-синий, ядра — в темно-синий (рис.8).
Окраска по Романовскому-Гимзе заключается в том, что
Рис.8. Скопление элементарных
телец в мазке-отпечатке зараженной белой мыши (через 48 ч). Окраска по Маккиавелло
Рис.9. Скопление элементарных телец в мазке-отпечатке мозга зараженной белой мыши (через 48 ч). Окраска по Романовскому-Гимзе
препараты фиксируют в метиловом спирте 5 мин, наносят на них раствор краски Рома-новского-Гимзы (1 мл маточного раствора на 10. 15 мл дистиллированной воды), окрашивают 30. 60 мин, краску сливают и тщательно промывают дистиллированной водой в течение 10. 15 мин. Высушенные препараты лучше провести через абсолютный спирт, толуол и заключить в бальзам.
Вирионы при этом способе окрашивания приобретают темно-фиолетовый цвет, фон препарата — голубой (рис.9).
При некоторых вирусных инфекциях диагностическим признаком является образование в клетках особых включений. Они обнаруживаются при бешенстве, оспе, гриппе свиней, чуме собак, болезни Ауески и др. Специальными методами окраски выявляются как внутрицитоплазматические, тик и внутриядерные включения. Наиболее часто они используются при Диагностике бешенства.
Окраска по Муромцеву. Препарат фиксируют метиловым спиртом, отмывают от фиксатора и окрашивают 10 мин синькой Ман-сона (в 100 мл кипящей дистиллированной веды растворяют 5-6 г химически чистой буры, добавляют 2 г метиленовой сини, охлаждают и фильтруют) в разведении 1:40. Непромытый мазок выдерживают в 10% -ном растворе танина до тех пор, пока он не
Рис.10. Внутриклеточные включения Бабеша-Негри. Окраска по Муромцеву
приобретет вместо сине-
фиолетового цвета голубой. Затем его промывают водой, высушивают фильтровальной бумагой и в течение нескольких секунд проводят через абсолютный спирт. После этого высушивают и микроскопи-руют. Включения Бабеша-Негри представляют собой фиолетовые образования различных размеров (0,2. 20 мкм) и формы на голубом фоне цитоплазмы, ядра клеток окрашиваются в синий цвет (рис.10).
Окраска по Манну. Препарат фиксируют в жидкости Буэна 2 ч и окрашивают 4 ч при 37 °С или 18 ч при комнатной температуре в растворе следующего состава: 17 мл 1%-ного раствора метиленовой сини, 23 мл 1%-ного раствора эозина, 40 мл дистиллированной воды. Раствор готовят перед употреблением. После окрашивания препарат тщательно промывают и обезвоживают в трех растворах щелочного спирта: 1) к 30 мл абсолютного спирта добавляют 30 капель 1%-ного раствора каустической соды в этом спирте, 2) к 30 мл абсолютного спирта добавляют 20 капель раствора соды, 3) к 30 мл абсолютного спирта добавляют 10 капель раствора соды. Обезвоживание прекращают, если препарат принимает светло-розовый оттенок. Такой препарат проводят через абсолютный спирт и обезвоживают в кислом спирте (30 мл абсолютного спирта и 1 капля ледяной уксусной кислоты). На фоне голубых клеток видны Рис.11. Срез мозга собаки, павшей ярко-красные включения, синие от бешенства. Тельца Бабеша- ядра и ядрышки клеток Негри. Окраска по Манну (рис.11).
Окраска по Туревичу. Препарат фиксируют в метиловом спирте. Для проведения окраски необходимо иметь следующие реактивы: железный гематоксилин Вейгерта, 1%-ный водный раствор кислого фуксина, насыщенный раствор пикриновой кислоты, разведенный пополам 96° спиртом. Для получения железного гематоксилина Вейгерта готовят два состава: 1) 1%-ный раствор гематоксилина в 96° спирте. Раствор должен созревать в течение 2. 3 недель; 2) 1,16 г хлористого железа, 98 мл дистиллированной воды и 1 мл концентрированной соляной кислоты. Перед употреблением смешивают равные количества обоих растворов. Как только смесь приобретает фиолетовый оттенок, ее наносят
Рис.12. Внутриклеточные включения Бабеша-Негри (окраска по Туревичу):
на препарат и окрашивают 1. 2 мин, промывают дистиллированной водой. Затем окрашивают 1%-ным водным раствором кислого фуксина в течение 1 мин и тщательно промывают дистиллированной водой до появления бледно-розового оттенка. После промывки дифференцируют раствором пикриновой кислоты в течение 10. 20 с до появления желтого оттенка. Препарат быстро прополаскивают в дистиллированной воде и слегка обсушивают фильтровальной бумагой, проводят через абсолютный спирт или ксилол и заключают в бальзам. Тельца Габеша-Негри — вишнево-красного цвета, ядра клеток — черные на серо-желтом фоне цитоплазмы (рис.12). Кроме указанных методов, для выявления включений можно использовать окрашивание по Романовскому-Гимзе. Включения при этом приобретают темно-фиолетовый цвет, цитоплазма — голубой.
В ходе самостоятельной работы студентов необходимо
1. Приготовить препараты-отпечатки из вируссодержащего материала и окрасить их по Морозову.
Читайте также:


