Острые респираторные вирусные инфекции в амбулаторной практике врача-педиатра

Острые респираторные вирусные инфекции (ОРВИ) – группа острых инфекционных заболеваний органов дыхания, которые различаются по этиологии (вызываются различными респираторными вирусами), но имеют сходные эпидемиологические, патогенетические и клинические характеристики.
Этиология, эпидемиология, патогенез, клиника
ОРВИ являются самыми распространенными инфекционными заболеваниями у детей. При этом наиболее частыми возбудителями ОРВИ являются риновирусы, коронавирусы, вирусы гриппа и парагриппа, респираторно-синцитиальные (PC) и аденовирусы.
Следует отметить, что этиологическая структура ОРВИ непостоянна и может меняться даже на протяжении одного эпидемического сезона. Так, если в сентябре – декабре 2012 г. основными возбудителями ОРВИ являлись вирусы парагриппа 1-го, 2-го и 3-го типов, аденовирусы и PC-вирусы, то на пике сезонного подъема заболеваемости (конец января – начало марта 2013 г.) в структуре циркулирующих вирусов стали доминировать вирусы гриппа.
При этом наиболее часто выявляли вирус гриппа A(H1N1) (14,8%), тогда как в начале эпидемического сезона его активность, также, как и активность вирусов гриппа A(H3N2) и В, была умеренной – частота их выделения не превышала 1,2-3%. В дальнейшем – в последние недели сезонного подъема заболеваемости – среди гриппозных возбудителей стал доминировать вирус гриппа В.
Основной механизм передачи инфекции при ОРВИ – аэрогенный. Инкубационный период – от 2 до 5 сут (в среднем 2-3 сут).
После проникновения вирусных возбудителей в клетки эпителия респираторного тракта происходит их репликация. Образующиеся дочерние вирионы выходят из пораженных клеток, инфицируют здоровые клетки, в которых в свою очередь начинается вирусная репликация. Эти процессы инициируют активацию иммунного ответа, что сопровождается усилением продукции и синтеза противовоспалительных цитокинов (интерлейкин-1, интерферон и др.).
В результате развивается острое катаральное воспаление слизистых верхних дыхательных путей, что клинически проявляется затрудненным носовым дыханием, болью и першением в горле, насморком, чиханием.
Одновременно с локальным распространением дочерних вирионов возможна непродолжительная виремия. При этом виремия, как правило, носит транзиторный характер и не приводит к генерализации инфекции, но при определенных условиях (недоношенность, морфофункциональная незрелость, иммунодефицитные состояния и др.) может способствовать тяжелому течению заболевания и развитию осложнений.
Развивающиеся при этом лихорадка, озноб, ухудшение аппетита, недомогание и другие общие симптомы возникают не только из-за кратковременной виремии, но и в результате системного воздействия на организм противовоспалительных цитокинов.
Следует отметить, что, несмотря на некоторые особенности клиники ОРВИ в зависимости от этиологии, в целом картина заболевания складывается из однотипных общих (лихорадка, недомогание, головная боль и др.) и местных (кашель, чихание, насморк, заложенность носа, боль в горле и др.) симптомов.
Выраженность клинических проявлений ОРВИ может быть весьма вариабельна и обусловлена целым рядом факторов. При этом тяжесть состояния ребенка может зависеть не только от вирулентности возбудителя, но и от индивидуальных и возрастных особенности организма, сопутствующих заболеваний и фоновых состояний.
Лечение ОРВИ
Основными принципами лечения ОРВИ, как и других инфекционных заболеваний, являются: адекватный уход за ребенком, правильное питание и назначение дополнительного питья, а также рациональное использование медикаментозной терапии.
Специфическим противогриппозным действием обладают ремантадин и его производные, а также более современные осельтамивир и занамивир. Производные ремантадина в последние годы используются редко, что обусловлено не только узким спектром действия (преимущественно вирусы гриппа А2), но и высоким уровнем резистентности возбудителей гриппа к препарату.
Осельтамивир и занамивир являются специфическими противогриппозными препаратами, которые избирательно ингибируют нейраминидазу всех вирусов гриппа типа А и В.
Неспецифическая этиотропная терапия ОРВИ проводится препаратами интерферона и его индукторами. Широкий спектр действия данной группы лекарственных средств обусловлен универсальным противовирусным эффектом интерферона.
Симптоматическая терапия. Цель симптоматической терапии при ОРВИ – уменьшение выраженности тех клинических проявлений заболевания, которые нарушают самочувствие ребенка и при определенных обстоятельствах могут привести к развитию осложнений. Для купирования наиболее частых симптомов ОРВИ (лихорадка, кашель, насморк) используются жаропонижающие препараты, деконгестанты, а также лекарственные средства от кашля.
Антипиретики. Лихорадка – один из общих симптомов ОРВИ. Повышение температуры тела при инфекционном воспалении является защитно-приспособительной реакцией организма. При этом перестройка процессов терморегуляции способствует активизации специфических и неспецифических иммунных реакций и направлена в конечном счете на санацию организма от инфекционных возбудителей.
Поэтому при хорошем самочувствии у исходно здоровых детей повышение температуры тела в пределах 38-39°С не требует проведения жаропонижающей терапии. При этом можно ограничиться физическими методами охлаждения.
В то же время у детей из группы риска по развитию осложнений (возраст до 2 мес., тяжелые заболевания органов дыхания, кровообращения, ЦНС, метаболические нарушения, фебрильные судороги в анамнезе) антипиретики назначают даже при невысоком подъеме температуры тела.
Так, если у исходно здорового ребенка повышение температура тела до 38,5-39°С не сопровождается нарушением самочувствия, плохим аппетитом, отказом от питья, а кожа его влажная, розовая, ладони и стопы теплые, то от назначения жаропонижающих препаратов можно воздержаться, ограничиваясь физическими методами охлаждения.
Однако если у ребенка на фоне лихорадки, независимо от степени повышения температуры тела, отмечается ухудшение состояния, имеются озноб, миалгии, плохое самочувствие, бледные и сухие кожные покровы, холодные дистальные отделы конечностей и другие проявления, антипиретики, наряду с другими способами терапии токсикоза, должны быть назначены незамедлительно.
Антипиретиками выбора у детей раннего возраста являются парацетамол и ибупрофен. Парацетамол рекомендовано использовать в дозе 10-15 мг/кг массы тела на прием, ибупрофен – 5-10 мг/кг массы тела на прием. Повторное применение препаратов возможно не ранее чем через 4-6 ч.
Повышение температуры тела при ОРВИ в течение 5 дней и более требует уточнения причин пролонгации лихорадочного периода. При этом в первую очередь необходимо исключить возможные бактериальные осложнения ОРВИ (пневмония, синусит и др.), а также обострение имеющихся у ребенка хронических инфекционно-воспалительных заболеваний (пиелонефрит, аденоидит и др.).
Назальные деконгестанты. Насморк – одно из наиболее частых клинических проявлений ОРВИ. В результате вирусного поражения слизистой носа развиваются гиперемия, отек и гиперсекреция. Это приводит к уменьшению просвета носовых ходов и затруднению носового дыхания. Для купирования насморка у детей до 12 лет разрешены только местные деконгестанты.
Среди топических деконгестантов в настоящее время наибольшее предпочтение отдают производным имидазолина (оксиметазолин, ксилометазолин и др.) и бензолметанола (фенилэфрин). Оптимальная продолжительность курсового применения деконгестантов не должна превышать 3-5 дней.
Противокашлевые, отхаркивающие и муколитические препараты. Кашель – один из частых симптомов ОРВИ – является защитным рефлексом, направленным на санацию дыхательных путей при неэффективности мукоцилиарного клиренса.
Муколитики – препараты, механизм действия которых основан на их способности разжижать густой секрет. Отхаркивающие лекарственные средства поддерживают кашлевой рефлекс и способствуют нормализации состава мокроты.
К противокашлевым препаратам относятся те лекарственные средства, которые угнетают кашлевой рефлекс. В группе противокашлевых препаратов различают центральные (угнетают кашлевой центр в продолговатом мозге) и периферические (снижают активность рецепторов периферических нервных окончаний). К противокашлевым лекарственным средствам центрального действия относят наркотические (кодеин-содержащие) и ненаркотические (бутамират (Синекод), окселадин, глауцин, декстрометорфан и др.) препараты.
Так, назначение противокашлевых препаратов при ОРВИ может быть оправданно с первых дней заболевания, когда отмечается сухой, навязчивый, частый кашель. При этом наиболее часто используют бутамират (Синекод), который хорошо известен врачам-педиатрам. Это объясняется его высокой клинической эффективностью и безопасностью, которые были доказаны при использовании у детей, начиная с 2-месячного возраста.
Синекод обладает не только противокашлевым, но и умеренным противовоспалительным действием, а также способствует умеренной бронходилатации и снижению сопротивления дыхательных путей, что определяет потенцирование терапевтического эффекта. Препарат быстро и полностью всасывается при приеме внутрь. Период полувыведения бутамирата составляет 6 ч.
Таким образом, в настоящее время в арсенале врача-педиатра имеются эффективные и безопасные лекарственные средства, позволяющие быстро купировать основные симптомы ОРВИ. При этом задачи, стоящие перед практикующим врачом при выборе лекарственных средств для лечения детей с ОРВИ, требуют не только глубоких знаний патогенеза заболевания, механизмов действия используемых препаратов и их побочных эффектов, но и обязывают в каждом конкретном случае индивидуализировать лечебную тактику.
Острые респираторные инфекции (ОРИ) — это группа острых инфекционно-воспалительных заболеваний органов дыхания, развивающихся в результате аэрогенного инфицирования различными возбудителями (респираторными вирусами, бактериями, атипичными микроорганизмам
Острые респираторные инфекции (ОРИ) — это группа острых инфекционно-воспалительных заболеваний органов дыхания, развивающихся в результате аэрогенного инфицирования различными возбудителями (респираторными вирусами, бактериями, атипичными микроорганизмами). ОРИ занимают одну из основных позиций в структуре общей заболеваемости населения России. При этом наиболее часто ОРИ отмечаются в педиатрической практике: более чем в 2,5–4 раза чаще, чем у взрослых. Установлено также, что у детей ОРИ значительно преобладают не только среди инфекционных заболеваний (почти 90%), но и в структуре впервые зарегистрированной патологии в целом (более 60%). При этом наиболее часто ОРИ отмечаются у детей, посещающих дошкольные организованные коллективы. Следует особо подчеркнуть, что у детей раннего возраста, кроме более высокого уровня заболеваемости, значительно чаще встречаются тяжелые формы ОРИ и имеется высокий риск развития серьезных осложнений. Кроме того, нельзя не отметить и существенные материальные потери, наносимые ОРИ. Так, только в период ежегодных эпидемий гриппа ущерб, наносимый экономике России в результате респираторных инфекций, составляет более 50 млрд рублей. Таким образом, повсеместное распространение, высокий уровень заболеваемости, серьезность прогноза (особенно у детей раннего возраста), а также существенная социально-экономическая составляющая ОРИ определяют необходимость разработки и внедрения в практику действенных методов профилактики и лечения данных заболеваний [4, 7, 9, 12].
В настоящее время не вызывает сомнений тот факт, что наиболее эффективным методом профилактики инфекционных заболеваний является активная специфическая иммунизация [8, 12]. Однако возможности вакцинопрофилактики респираторных инфекций существенно ограничены. Это обусловлено широким этиологическим спектром ОРИ (более 150 возбудителей), в то время как эффективные и безопасные вакцины разработаны лишь против нескольких респираторных патогенов, таких как вирус гриппа, гемофильная палочка (тип В) и пневмококк. Но, несмотря на столь ограниченный арсенал средств активной иммунизации против ОРИ, профилактический потенциал имеющихся вакцин должен быть использован максимально. Так противогриппозная вакцинация, широко проводимая в последние годы, позволила существенно уменьшить заболеваемость данной инфекцией среди привитых. При этом вводимая с 2006 г. обязательная противогриппозная иммунизация дошкольников и учеников 1–4 классов не только позволит снизить частоту гриппа среди вакцинированных, но и значительно ограничит распространение данной инфекции в организованных детских коллективах в целом [6].
Современные гриппозные вакцины являются тривакцинами, так как содержат штаммы (или их антигены) трех актуальных вирусов гриппа — А(Н1N1), A(H3N2) и В [8, 11, 12]. В России для иммунизации против гриппа у детей разрешены как живые, так и инактивированные вакцины (табл. 1). При этом живые вакцины используются только после достижения детьми 3-летнего возраста. Данный тип вакцин вводится интраназально — по 0,25 мл в каждый носовой ход, двукратно с интервалом 3–4 нед.
Среди инактивированных гриппозных вакцин различают цельновирионные, расщепленные и субъединичные. Цельновирионные вакцины содержат весь набор антигенов актуальных штаммов вируса гриппа. Иммуногенность цельновирионных вакцин высока, но из-за липидов вирусной оболочки, содержащихся в их составе, данные препараты более реактогенны. Цельновирионные гриппозные вакцины имеют существенные возрастные ограничения — их использование разрешено у детей старше 7 лет. Вакцины данного типа у детей вводятся только интраназально. При этом следует строго соблюдать рекомендованный режим дозирования — двукратное с интервалом 3–4 недели по 0,25 мл в каждый носовой ход. Следует отметить, что в последние годы цельновирионные гриппозные вакцины у детей используются редко.
Расщепленные гриппозные вакцины (сплит-вакцины) содержат поверхностные (гемагглютинин, нейраминидаза) и внутренние антигены, благодаря чему препараты характеризуются высокой иммуногенностью. При этом высокая степень очистки от реактогенных липидов определяет их хорошую переносимость. К расщепленным вакцинам относятся ваксигрип, бегривак, флюарикс. Большинство сплит-вакцин разрешены для использования у детей, начиная с 6-месячного возраста. Субъединичные гриппозные вакцины содержат только поверхностные антигены (гемагглютинин, нейраминидаза), что определяет хорошую иммуногенность и переносимость. К субъединичным вакцинам относятся гриппол, инфлювак, агриппал. Данные препараты, так же как и сплит-вакцины, разрешены для использования у детей с 6-месячного возраста. Следует отметить, что вакцинацию против гриппа необходимо проводить, строго придерживаясь международных рекомендаций по режиму дозирования. Так, иммунизация у детей первых 9 лет жизни, ранее не привитых и не болевших гриппом, должна проводиться двукратно с интервалом в 4 нед. При этом детям в возрасте от 6 мес до 3 лет 11 мес рекомендовано вводить по 0,25 мл вакцины, а начиная с 4-летнего возраста — по 0,5 мл.
Большие надежды связаны и с ожидаемым в недалеком будущем включением в календарь прививок обязательной иммунизации против гемофильной палочки типа В и вакцинации групп риска против пневмококковой инфекции. При этом доказана высокая профилактическая эффективность этих вакцин не только в отношении неосложненных респираторных форм данных инфекций, но и в отношении их инвазивных вариантов (деструктивная пневмония, гнойный менингит, бактериемия, гнойный артрит и др.) [7–9, 12]. В России зарегистрированы и разрешены для использования с 3-месячного возраста такие конъюгированные вакцины против гемофильной инфекции, как акт-ХИБ и хиберикс. Их целесообразно применять одновременно с АКДС (коклюшно-дифтерийно-столбнячная адсорбированная вакцина) и полиовакциной, начиная иммунизацию в 3-месячном возрасте. При этом показано введение трех доз вакцины с интервалом в 45 дней (вместе с АКДС и прививкой против полиомиелита). В тех случаях, когда прививки начинают во втором полугодии жизни, законченной иммунизацией считается введение двух доз (с интервалом в 45 дней). У детей в возрасте 1–5 лет для развития эффективного иммунитета достаточно введения одной дозы вакцины. Плановая вакцинация против гемофильной палочки типа В у детей старше 5 лет не проводится, так как к этому возрасту большинство пациентов уже имеют напряженный иммунитет к гемофильной палочке за счет естественной иммунизации. К сожалению, зарегистрированные в России пневмококковые вакцины (пневмо 23) являются полисахаридными и поэтому могут с достаточной степенью эффективности применяться лишь у детей старше 24 мес. При этом их использование у детей групп риска (нефротический синдром, сахарный диабет, гемато-онкологические заболевания, хронические заболевания органов дыхания и др.) характеризуется действенной профилактической эффективностью и высоким профилем безопасности [8].
Максимальное снижение заболеваемости ОРИ может быть достигнуто при сочетанном использовании вакцинации и средств неспецифической иммунопрофилактики (иммуномодуляторы). Для лечения и профилактики ОРИ в последние годы наиболее часто применяются такие иммуномодуляторы, как интерфероны, индукторы эндогенного интерферона и иммуномодуляторы бактериального происхождения. Кроме того, в комплексную систему неспецифической профилактики ОРИ входят фитоадаптогены с легким иммуномодулирующим эффектом (производные эхинации пурпурной, заманихи, корня солодки и т. д.) и поливитаминно-микроэлементные комплексы. Все реже в настоящее время используются препараты тимуса, а от введения с профилактической целью иммуноглобулинов (гамма-иммуноглобулинов) в последние годы отказались вообще.
Интерфероны. В течение нескольких десятилетий для лечения и профилактики респираторных инфекций у детей с успехом используются препараты интерферона, обладающие универсальным противовирусным эффектом. В результате воздействия интерферонов в клетках организма синтезируются ферменты, которые тормозят образование вирусных белков и разрушают вирусные рибонуклеиновые кислоты. Интерфероны также стимулируют экспрессию антигенов I и II классов главного комплекса гистосовместимости, что изменяет топографию клеточной мембраны, препятствует прикреплению вирусов к клеточной оболочке и нарушает их проникновение внутрь клеток. Кроме того, активизируя цитотоксическую активность Т-лимфоцитов, интерфероны стимулируют лизис клеток, инфицированных вирусами. Таким образом, интерфероны препятствуют вирусному инфицированию, а также подавляют репродукцию вирусов на стадии синтеза специфических белков [2, 7, 9]. Среди препаратов интерферона выделяют интерфероны природные (интерферон человеческий лейкоцитарный) и рекомбинатные (виферон, гриппферон и др.). При этом в последние годы для лечения и профилактики ОРИ все реже стали применять интерферон человеческий лейкоцитарный сухой и лейкинферон. В настоящее время предпочтение отдается рекомбинатным интерферонам (виферон, гриппферон). При этом наибольший опыт в педиатрической практике накоплен при использовании виферона — рекомбинатного интерферона α-2, обладающего также антиоксидантным эффектом за счет входящих в его состав витаминов С и Е. Наибольший терапевтический эффект от использования препаратов интерферона при лечении ОРИ достигается в тех случаях, когда этиология имеет вирусную или вирусно-бактериальную природу, а лечение начинается с первых часов заболевания [2, 7]. При этом включение данных препаратов в комплексную терапию ОРИ позволяет не только существенно уменьшить выраженность воспалительных процессов и продолжительность заболевания, но и снижает в целом риск развития осложнений.
Индукторы эндогенного интерферона. К химиотерапевтическим индукторам эндогенного интерферона относятся производные тилорона (амиксин), арбидол и циклоферон. Кроме того, эффектом усиления образования интерферона обладает анаферон — иммуномодулятор, содержащий сверхмалые дозы аффинно очищенных антител к гамма-интерферону человека. Имеются убедительные данные о профилактической и терапевтической эффективности данных лекарственных средств [2, 7, 9]. Следует отметить, что практически все представленные препараты не только индуцируют синтез эндогенного интерферона, но и обладают иммуномодулирующим эффектом (стимулируют фагоцитоз и клеточный иммунитет). При этом арбидол и амиксин оказывают также прямое ингибирующее действие на респираторные вирусы. При выборе конкретного препарата необходимо обращать внимание не только на его фармакологическую активность, но и на возрастные ограничения. Так анаферон разрешен к применению, начиная с 6-месячного возраста, арбидол может быть использован у детей старше 2 лет, в то время как амиксин и циклоферон имеют более жесткие возрастные ограничения [1, 10]. Циклоферон при этом разрешен у детей старше 4 лет, а амиксин (тилорон) — только у детей старше 7 лет. Особо следует подчеркнуть, что максимальная терапевтическая эффективность препаратов данного класса достигается в тех случаях, когда лечение начинается с первых часов заболевания.
Иммуномодуляторы бактериального происхождения в последние годы все шире используются для профилактики ОРИ, особенно у часто и длительно болеющих детей [3, 5, 7]. Терапевтическая эффективность и безопасность применяющихся у детей иммуномодуляторов бактериального происхождения подтверждена рядом контролируемых исследований. При этом различают следующие препараты: высокоочищенные бактериолизаты, мембранные фракции и рибосомально-протеогликановые комплексы. В свою очередь, среди высокоочищенных бактериолизатов выделяют препараты системного (бронхо-мунал, бронхо-ваксом) и топического действия (ирс 19, имудон). К препаратам, содержащим мембранные фракции бактериальной стенки, относится биостим, а также ликопид, в состав которого входит мурамилдипептид — синтетический аналог иммуноактивной части клеточной мембраны бактерий. Рибосомально-протеогликановые комплексы (рибомунил) содержат рибосомы определенных респираторных патогенов и мембранные факторы. В целом механизм действия всех иммуномодуляторов бактериального происхождения связан с их стимулирующим действием на фагоциты, повышением продукции интерферона и активацией естественных киллеров. Кроме того, ряд препаратов (бактериолизаты и рибосомально-протеогликановые комплексы) обладают легким вакцинирующим эффектом против тех возбудителей, антигены которых входят в их состав. При этом очень важно подчеркнуть, что благодаря этому поддерживается протекторная активность местного иммунитета (препараты потенцируют специфический иммунитет на слизистых). Учитывая тот факт, что в состав данных иммуномодуляторов входят антигены наиболее распространенных бактериальных возбудителей респираторных инфекций (пиогенный стрептококк, пневмококк, гемофильная палочка и т. д.), становится понятной их высокая профилактическая эффективность. Помимо этого, иммуномодуляторы бактериального происхождения обладают и терапевтическим эффектом, что позволяет назначать их короткими курсами во время ОРИ или при обострении хронических заболеваний ЛОР-органов. При этом отмечено, что данные препараты при одновременном использовании с антибиотиками потенцируют их антибактериальную активность. Установлено также, что иммуномодуляторы бактериального происхождения повышают иммуногенность вакцин, поэтому в последние годы, особенно у часто болеющих детей, плановую иммунизацию рекомендуют проводить на фоне приема данных препаратов [3, 7, 9].
В комплекс профилактических и терапевтических мероприятий при ОРИ может входить и назначение иммуномодуляторов растительного происхождения. Наиболее широко в последние годы в педиатрической практике стали использовать производные эхинацеи пурпурной (иммунал и др.). Эффективность препаратов эхинацеи пурпурной связывают с активацией неспецифического иммунитета. Иммунал назначают как для лечения неосложненных ОРИ (в течение 1 нед), так и для их профилактики (не более 8 нед). Иммунал (капли) назначают детям от 1 года до 4 лет — по 1 мл 3 раза в день, детям от 6 лет до 12 лет — по 1,5 мл 3 раза в день. При использовании иммунала в таблетках следует соблюдать следующий режим дозирования — детям от 4 до 6 лет — по 1 таблетке 1–2 раза в сутки, детям 6–1 2 лет — по 1 таблетке 1–3 раза в день [1, 10].
В последние годы иммуномодуляторы тимического происхождения, как природные (тималин, тактивин, тимоптин, тимактид, тимостимулин, вилозен), так и синтетические (тимоген) для профилактики и лечения ОРИ используются все реже. Это связано с тем, что корректное использование данных лекарственных средств требует предварительного иммунологического обследования и выявления убедительных данных о нарушении клеточного иммунитета. Иммуноглобулины, ранее широко используемые для профилактики и лечения ОРИ у детей, в настоящее время также применяются только по специальным показаниям. Назначение при данных состояниях иммуноглобулинов может быть оправдано лишь в тех случаях, когда заболевание приобретает тяжелое и осложненное течение, либо развивается на фоне выраженного иммунодефицитного состояния (агаммаглобулинемия, комбинированные иммунодефициты, общая вариабельная иммунная недостаточность, приобретенные гипогаммаглобулинемии на фоне нефротического синдрома, энтеропатий, хронического лимфолейкоза и др.). Предпочтение при этом должно отдаваться препаратам иммуноглобулина, которые предназначены для внутривенного введения (интраглобин, пентаглобин и др.).
Таким образом, в настоящее время в арсенале врачей-педиатров имеются высокоэффективные средства специфической и неспецифической иммунопрофилактики, рациональное использование которых позволяет не только существенно снизить заболеваемость ОРИ у детей, но и сократить риск развития тяжелых и осложненных форм заболевания.
А. Л. Заплатников, доктор медицинских наук, профессор
РМАПО, Москва
Наиболее распространенными инфекционными агентами ОРВИ являются риновирус — 14,8% случаев, вирусы гриппа определяются в 9,4%, респираторно-синцитиальный вирус — в 9,1%, аденовирус-в 5%, парагрипп-в 4,8%, коронавирус-в 2,2%, бокавирус — в 2%. Более чем в 37% случаев точно верифицировать возбудителя не представляется возможным. У 7,4% детей ОРВИ имеется сочетанный характер инфекции, при этом отмечаются вирусно-вирусные и вирусно-бактериальные ассоциации.
Все эти аспекты требуют от врачей серьезного отношения к ведению пациентов с ОРВИ и к своевременной профилактике этого заболевания. В последние годы в нашей стране активно проводится специфическая иммунопрофилактика гриппа (живыми и инактивированными гриппозными вакцинами), защищающая от этой инфекции до 80% детей и взрослых. 6 Между тем средств неспецифической профилактики гриппа и ОРВИ в арсенале педиатра явно недостаточно, хотя востребованность их высокая, как и надежных средств лечения.
Выбор эффективного и безопасного препарата для лечения ОРВИ у детей до сих пор остается дискутабельным, а устоявшиеся схемы лечения вызывают все большие сомнения. Например, традиционно используемые отечественными педиатрами индукторы интерферона в странах Европы и США применяются только при терапии серьезных заболеваний, таких как гепатит С или онкологические заболевания, то есть там, где действительно требуется прямое активное вмешательство в сложнейшие иммунологические процессы организма.
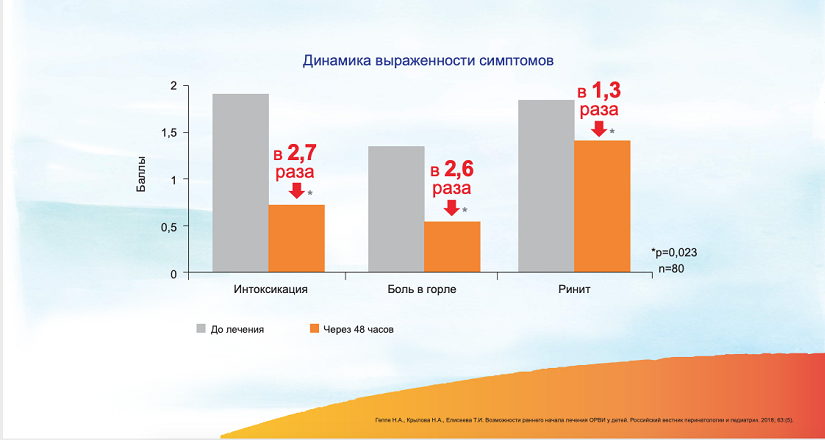
Назначение Оциллококцинума приводит к быстрому и эффективному облегчению симптомов ОРВИ уже через 48 часов. 8 Действие Оциллококцинума связано с мягким, но отчетливо выраженным воздействием на систему иммунитета. Оциллококцинум влияет на иммунную систему в целом, усиливая как гуморальный, так и клеточный иммунитет. При этом усиление иммунного ответа происходит равномерно, без смещения фокуса активности в сторону какого-то из звеньев иммунитета. 9 Важным механизмом действия Оциллококцинума является стимуляция фагоцитарной активности макрофагов и активация выработки индуцированных α-ИФН и γ-ИФН, что способствует предотвращению проникновения вирусов в клетки. 8

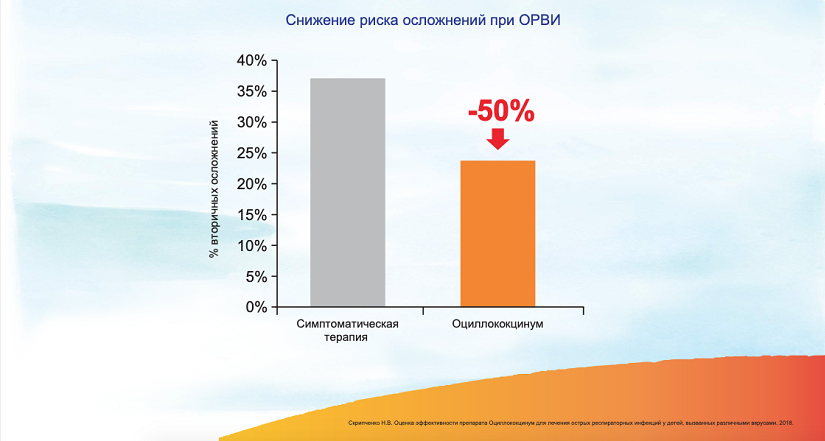
Все это обусловливает высокую эффективность препарата — при лечении Оциллококцинумом ОРВИ протекает в 2 раза легче и выздоровление происходит на 4—5 сутки. 10 При этом препарат снижает частоту развития вторичных осложнений на 50%. 11
У Оциллококцинума минимум противопоказаний и побочных действий: он не вызывает сонливости, привыкания и не взаимодействует с другими лекарствами. В отличие от большинства средств от гриппа и ОРВИ, Оциллококцинум подходит для всей семьи. Оциллококцинум не имеет возрастных ограничений и может применяться у детей с рождения, при этом его применение позволяет минимизировать назначения антибактериальных, антигистаминных, жаропонижающих и симптоматических средств. 12
А если учесть, что Оциллококцинум можно применять не только с лечебной, но и с профилактической целью (из расчета 1 доза в неделю в период распространения ОРВИ или после контакта с больным), 13— 14 становится понятно, чем обусловлен выбор Оциллококцинума педиатрами как надежного лекарственного средства для лечения и профилактики ОРВИ у детей.
Оциллококцинум имеет солидную доказательную базу эффективности и безопасности, основанную на принципах и стандартах доказательной медицины (Evidence-Based Medicine).
В метаанализе Cochrane (7 РКИ по одному из самых достоверных дизайнов — слепые, плацебо-контролируемые, рандомизированные: 3 — по профилактике, 2265 участников; 4 — по лечению, 1194 участника) отмечен клинический эффект Оциллококцинума при лечении гриппа и ОРВИ и высокий уровень безопасности [Vickers A.J, Smith C., 2006]. Ни в одном из исследований не сообщалось о каких-либо нежелательных эффектах, в т. ч. отсроченных.
Выводы этого обзора подтверждают интерес к препарату в условиях поиска оптимального решения для лечения ОРВИ и гриппа.
В заключение подчеркнем: проблема ОРВИ у детей остается актуальной не только из-за высокого уровня заболеваемости, но, по мнению многих экспертов, в связи с необходимостью пересмотра и оптимизации лечебной тактики. Следует избегать неоправданного назначения иммуномодулирующих, антибактериальных и симптоматических препаратов и искать новые подходы. Применение Оциллококцинума у детей младшей возрастной группы для профилактики и лечения ОРВИ следует признать эффективным и обоснованным.
Читайте также:


