Преднизолон при лечении аутоиммунного гепатита
Будесонид является глюкокортикостероидом 2-го поколения с высоким сродством к глюкокортикоидным рецепторам и минимальным системным действием. Он рассматривается как перспективный агент в терапии аутоиммунного гепатита, в особенности у пациентов с побочным
Budisonide is a 2nd generation glucocorticosteroid with high affinity to glucocorticoid receptors and minimum systemic effect. It is considered as a promising agent in therapy of autoimmune hepatitis, in particular, in patients with side effects for prednisolone.
Эффективное лечение аутоиммунного гепатита (АИГ), основанное на комбинации преднизолона с азатиоприном, было разработано почти полвека назад [1] и привело к существенному увеличению продолжительности жизни больных, которая в настоящее время сравнялась с популяционной [2].
В то же время не утихают дискуссии по поводу применения других, альтернативных схем терапии. Это обусловлено тем, что терапия АИГ является продолжительной: согласно недавним рекомендациям Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) она назначается на 3 года или по меньшей мере на 2 года после полной нормализации лабораторных показателей [3]. Кроме того, лечение часто является пожизненным, поскольку в достаточно небольшом проценте случаев удается достичь безмедикаментозного сохранения ремиссии. В то же время существующие режимы терапии, включающие преднизолон, приводят к большому количеству побочных эффектов, обусловленных его системным действием [3].
К сожалению, вероятно в связи с хорошей эффективностью существующей терапии, фактически не проводилось рандомизированных клинических исследований (РКИ) по применению альтернативных иммуносупрессоров при АИГ. Их действие подтверждается преимущественно описанием серий случаев и открытыми исследованиями. Исключение составляет будесонид, по применению которого существуют не только наблюдательные данные, но и результаты мультицентрового РКИ [4]. Будесонид является глюкокортикостероидом (ГКС) 2-го поколения, сродство которого к глюкокортикоидным рецепторам в 15–20 раз выше, чем у преднизолона. Кроме того, при пероральном приеме 90% его метаболизируются в печени при ее первом прохождении [4].
В проведенном M. P. Manns c соавт. в 2010 г. многоцентровом проспективном двойном слепом активно контролируемом РКИ назначение будесонида (в дозе 9 мг/сут) в комбинации с азатиоприном достоверно чаще (в 60,0% против 38,8% случаев) позволяло достичь биохимической ремиссии АИГ через 6 месяцев лечения, чем стандартная терапия преднизолоном (40 мг с последующим снижением до 10 мг) и азатиоприном. При этом системные побочные эффекты отсутствовали у 72,0% пациентов (в сравнении с 46,6% получавших преднизолон). В дальнейшем все пациенты принимали будесонид в открытом режиме. Среди пациентов, которые первоначально получали преднизолон, стероидные побочные эффекты снизились с 44,8% до 26,4% [5]. Недостатками работы M. P. Manns c соавт. является отсутствие гистологической верификации ремиссии и оценки отдаленных результатов. Но на основании полученных данных авторы сделали вывод о большей эффективности будесонида по сравнению с преднизолоном при АИГ. Этот тезис подвергался определенной критике с точки зрения эквивалентности сравниваемых доз. Существуют противоположные данные, что у части больных будесонид является менее эффективным в достижении ремиссии по сравнению с преднизолоном [6], это может быть обусловлено отсутствием возможности наращивания дозы и мальабсорбцией перорального препарата.
Однако исследование M. P. Manns c соавт. однозначно доказало следующее:
а) будесонид может использоваться при индукции ремиссии АИГ;
б) будесонид реже приводит к системным побочным эффектам, чем преднизолон;
в) пациенты, достигшие ремиссии путем назначения преднизолона, для снижения побочных эффектов ГКС могут быть переведены на терапию будесонидом с сохранением ремиссии.
Эти результаты способствовали более частому назначению будесонида при АИГ в ряде стран. Так, по данным израильского эпидемиологического исследования [7] будесонид (в качестве монотерапии или в комбинации с азатиоприном) получают 16% пациентов с установленным диагнозом АИГ. Показано, что будесонид может безопасно и эффективно применяться для индукции и поддержания ремиссии не только у взрослых, но и у детей [6].
Ограничением к применению будесонида при АИГ является стадия цирроза печени, так как в этом случае наличие портокавальных шунтов увеличивает системную концентрацию препарата, и, кроме того, растет риск тромбозов, в особенности в зоне портального кровотока [8–10].
Широкому применению будесонида при лечении АИГ препятствует ограниченное количество данных по долговременному применению препарата (возможность продолжительного поддержания ремиссии) и оптимальному варианту снижения дозы. Однако в последние годы ряд гепатологических ассоциаций выпустили рекомендации по лечению АИГ, включающие применение схем с будесонидом.
Отдельную проблему составляет лечение так называемых перекрестных (или вариантных) синдромов, наиболее распространенным из которых является комбинация АИГ и первичного билиарного цирроза (АИГ/ПБЦ).
Следует отметить, что согласно мнению части экспертов Европейской ассоциации по изучению печени [14] неконтролируемое течение ПБЦ само по себе является показанием для назначения будесонида. Этот тезис повторен в отечественных рекомендациях по лечению холестатических заболеваний, согласно которым у пациентов на доцирротических стадиях заболевания с субоптимальным биохимическим ответом на терапию урсодезоксихолевой кислотой (УДХК) предлагается использовать комбинацию ее с будесонидом (6–9 мг/день) [15]. Положительный эффект будесонида на течение ПБЦ при назначении на I-II cтадиях заболевания был показан в ряде проспективных исследований, в том числе в 3-летнем открытом РКИ H. Rautiainen с соавт. (2005) и 2-летнем двойном слепом РКИ M. Leuschner с соавт. (1999), где его назначение в сочетании с УДХК приводило к улучшению гистологической картины [16–17].
При лечении перекрестного синдрома АИГ/ПБЦ ведущие ассоциации и рабочие группы [3, 14] предлагают применять комбинацию УДХК и ГКС. Ранее обсуждалось назначение в этих случаях монотерапии УДХК, с последующим присоединением ГКС при неэффективности монотерапии [18]. Недавние рекомендации Европейской ассоциации по изучению печени подчеркивают обязательность иммуносупрессивной терапии, а при преобладании признаков АИГ рекомендуют начинать с иммуносупрессоров с последующим добавлением УДХК [3]. Проблема выработки однозначных рекомендаций по лечению АИГ/ПБЦ также связана с отсутствием клинических исследований с хорошим дизайном. В то же время применение преднизолона при ПБЦ приводит к резкому снижению минеральной плотности костной ткани, а также повышает риск развития других неблагоприятных явлений [19]. В этой ситуации предпочтительным может являться назначение будесонида.
Позволим представить собственный опыт применения будесонида при АИГ.
Ответ на терапию при АИГ оценивался как ремиссия, или неэффективное лечение, или неполный ответ [13]. Дополнительно выделялись полная (нормализация аланиновой (АЛТ) и аспаргиновой (АСТ) аминотрансфераз, а также IgG) и неполная ремиссия (снижение АСТ и АЛТ до уровня, менее чем в 2 раза превышающего верхний предел референтных значений, либо нормализация АЛТ и АСТ без полной нормализации IgG) [25]. Ответ на терапию при АИГ/ПБЦ рассматривался согласно критериям ответа на АИГ, а также парижским и барселонским критериям ответа на УДХК [26, 27].
Ретроспективный анализ выявил следующие показания к назначению будесонида:
В 17 случаях будесонид назначался для индукции ремиссии АИГ у первичных пациентов либо у пациентов, имевших рецидив заболевания на фоне отмены терапии или снижения доз ГКС. У 7 пациентов будесонид использовался для поддержания ремиссии после стандартного индукционного курса преднизолона (с достижением критериев полной либо неполной лабораторной ремиссии).
При АИГ в 5 случаях использовалась монотерапия будесонидом в дозе 9 мг (у этих пациентов имелись противопоказания к назначению азатиоприна — цитопения), а в 6 случаях назначалась комбинация будесонида 9 мг/сут и азатиоприна 50–100 мг/сут. При АИГ/ПБЦ в 9 случаях использовалось сочетание будесонида 9 мг/сут с УДХК (13–15 мг/кг/сут), а 4-м пациентам также назначался азатиоприн 50 мг/сут. Средняя продолжительность терапии на момент проведения анализа составила 20,3 ± 11,1 месяца (максимальная продолжительность — 36 месяцев). Результаты лечения представлены в табл.
У 15 пациентов (88,2% случаев) терапия будесонидом (в сочетании с азатиоприном и без него) позволила обеспечить ремиссию АИГ в течение первого года лечения. При этом достижение ремиссии наблюдалось в среднем через 8,3 ± 3,4 месяца от начала терапии. Побочных эффектов от приема будесонида в данной группе не отмечалось. В дальнейшем этим пациентам была продолжена поддерживающая терапия будесонидом с устойчивым сохранением ремиссии. У 10 пациентов при этом через год от начала лечения доза будесонида была снижена до 6 мг/сут.
Отсутствие клинико-лабораторного улучшения отмечалось у одного пациента с АИГ и одного с АИГ/ПБЦ. Была произведена замена будесонида на преднизолон в стандартной дозе, что также не привело к улучшению лабораторных показателей. У пациентки с АИГ/ПБЦ неполная лабораторная ремиссия позже была достигнута назначением метотрексата.
В результате у 4 пациентов весь период наблюдения сохранялась полная/неполная ремиссия, в том числе при дальнейшем снижении суточной дозы будесонида до 6 мг, а уровень лабораторных показателей соответствовал ранее наблюдавшемуся на терапии преднизолоном. У 3 пациентов ремиссия сохранялась при приеме будесонида в дозе 9 мг/сут, а рецидив АИГ возник после снижения до 3 мг/сут (1 пациент) и 6 мг/сут (2 пациента). Срок возникновения рецидива после изменения дозы составлял от 4 до 13 месяцев.
В настоящее время целью лечения АИГ является достижение ремиссии и последующее ее сохранение на минимальной поддерживающей дозе иммуносупрессоров [3]. Наши данные показывают высокую эффективность будесонида в индукции и поддержании ремиссии при АИГ и его вариантной форме и совпадают с результатами других авторов [4, 28–30]. При этом частота достижения ремиссии при ее индукции будесонидом соответствовала данным, приводимым для системных ГКС [3] при минимуме побочных эффектов. В случаях неэффективности будесонида в дальнейшем при лечении преднизолоном также наблюдалась гормонорезистентность.
При терапии АИГ/ПБЦ комбинацией УДХК с будесонидом (+/- азатиоприн) у всех пациентов наблюдалось улучшение лабораторного профиля, а ремиссия АИГ была достигнута в 77,8% случаев.
Будесонид был эффективен и при поддержании ремиссии, индуцированной ранее преднизолоном. Важно, что отдельные больные в нашем исследовании получали терапию будесонидом в течение 3 лет с сохранением его эффективности, что свидетельствует о возможности его длительного применения. В то же время при снижении поддерживающей дозы у 3 пациентов наблюдался рецидив заболевания. Именно вопросы снижения дозы при терапии будесонидом являются наименее разработанными и, несомненно, требуют проведения клинических исследований для выработки оптимальной тактики.
По нашему мнению, будесонид следует активно использовать в лечении АИГ и его вариантных форм у нецирротических больных без выраженных системных проявлений заболевания, особенно в группах риска развития стероидных осложнений.
Будесонид является эффективным препаратом для индукции и поддержания ремиссии при АИГ, а также он может быть успешно использован в терапии АИГ/ПБЦ.
Литература
К. Л. Райхельсон* , 1 , доктор медицинских наук, профессор
М. К. Прашнова*
Н. В. Марченко*, кандидат медицинских наук
С. Н. Мехтиев**, доктор медицинских наук, профессор
Е. Н. Зиновьева***, кандидат медицинских наук
Многим из нас приходилось слышать о такой болезни, как аутоиммунный гепатит. Что это за патология? Это хроническое заболевание, представляющее собой неразрешившееся воспалительное явление в таком важном для нашего существования органе, как печень. Установленной природы данная патология не имеет.
Что при этом происходит?
Если поставлен диагноз "аутоиммунный гепатит", что это означает? Эта серьезная патология по совершенно непонятным причинам постепенно разрушает клетки печени. Причем в этом процессе недугу помогает собственная иммунная система организма. На первой стадии болезни происходит воспаление паренхимы, то есть основной части органа. Этот процесс быстро прогрессирует и способен привести к циррозу печени.

При этом происходит отмирание клеток столь важного для нас органа - гепатоцитов. Их место тут же заполняет грубая и неэластичная соединительная ткань. В результате этого печень просто не в состоянии качественно осуществлять свои функции.
Можно встретить разные названия данного недуга. Однако наиболее часто в медицинской литературе патологию именуют так: активный хронический аутоиммунный гепатит. Это редкое заболевание, которое чаще всего встречается у девочек старше 10 лет и у женщин, не достигших тридцатилетнего возраста.
Симптомы
Клинические проявления патологии различны. Так, у четверти всех больных никаких симптомов аутоиммунного гепатита нет. И это продолжается до тех пор, пока у человека не возникнут какие-либо осложнения. В таких случаях болезнь настигает людей внезапно либо у них проявляются все симптомы вирусного гепатита или другие признаки, указывающие на поражение печени. При первом варианте развития событий человека начинает беспокоить слабость. Его биологические жидкости приобретают темный цвет. Кожные покровы, а также слизистые, желтеют, пропадает аппетит. Во втором случае возникают симптомы внепеченочного характера. Именно поэтому врачи нередко предполагают присутствие в организме различных системных заболеваний, таких как ревматоидный артрит, красная волчанка и т.д.
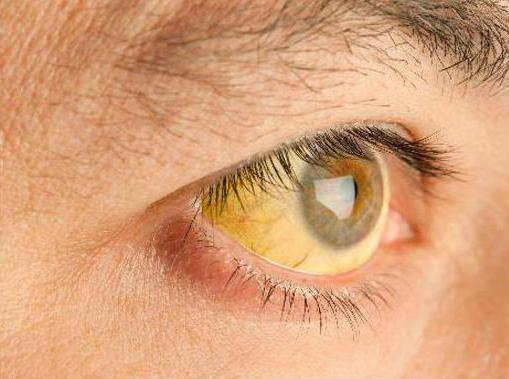
Порой у пациентов болезнь наступает внезапно, проявляется остро и протекает очень тяжело. Все это сопровождается возникновением фульминантного гепатита, который провоцирует быструю гибель большей части печеночных клеток. Это, в свою очередь, приводит к быстрому образованию токсинов, негативно воздействующих, а затем и поражающих головной мозг. Весьма сложное предстоит, если уже появился аутоиммунный гепатит (симптомы), лечение. Прогноз в таких случаях врачи дают крайне неблагоприятный для пациента.
Типы заболевания
Лечение аутоиммунного гепатита напрямую будет зависеть от его разновидности. Тот или иной тип патологии определяют по наличию в сыворотке крови определенного рода антител. При этом выделяют три вида аутоиммунного хронического гепатита:
1. При первом типе болезни выявляют белки-антитела к актину-протеину, гладкомышечным клеткам, антинуклеарным антителам.
2. Для второго типа болезни характерно наличие антител к микросомам, к клеткам почек и печени.
3. Третий тип патологии диагностируется в случаях выявления антител к веществу, которое отвечает за синтез белка, то есть к печеночному растворимому антигену.
Причины патологии
Аутоиммунный гепатит – это заболевание, при котором иммунитет человека начинает активную борьбу со своими собственными абсолютно здоровыми тканями и клетками. В чем кроются причины данного явления? На этот вопрос современная медицина ответить пока не может. Однако у ученых есть предположение, что подобный сбой в работе защитных сил организма дают различные ранее перенесенные вирусные заболевания, в частности, гепатит А, а также В и С, герпес, вирус Эпштейна-Барр.
Некоторые исследователи высказывают мнение и о том, что в развитии различных аутоиммунных заболеваний главную роль играет определенный ген. Однако стоит отметить, что болезнь у детей младше 10 лет практически никогда не выявляется.
Диагностика
Лечение аутоиммунного гепатита будет проходить намного эффективнее, если болезнь выявляется на ранней стали своего развития. Однако диагностика патологии крайне затруднительна. Как правило, подобный диагноз врачи ставят лишь при постепенном исключении наличия других заболеваний. Для этого врач осуществляет анализ жалоб пациента и анамнеза его жизни. Все это происходит в ходе беседы. При этом специалист выясняет, что беспокоит человека, и насколько долго все это продолжается.
Далее проводится физикальный осмотр, во время которого врач обследует слизистые оболочки и кожу, измеряет у пациента температуру тела, простукивает и ощупывает печень, выясняя ее болезненность и увеличение размеров. При имеющихся подозрениях на наличие патологии проводятся лабораторные исследования. Они призваны выявить уровень глобулина и активность фермента АСТ. Дается направление и на иммунологический анализ крови. Исследуют ее и на наличие вируса гепатита А, а также В и С. Врач дает направление на копрограмму. В ходе этого исследования делается проверка кала на присутствие в нем непереваренных частичек еды.

После того как выявила аутоиммунный гепатит диагностика, и лечение назначил врач, следует неукоснительно выполнять все полученные рекомендации. Только в таком случае можно говорить о благоприятных прогнозах развития болезни.
Способы устранения патологии
После того как выявлен гепатит аутоиммунный (симптомы), и лечение от этого недуга стало жизненно необходимым, врач может применить несколько методов. Они заключаются в следующем:
- в соблюдении строгой диеты;
- в медикаментозной терапии;
- в проведении хирургического вмешательства.
Рассмотрим все эти методы подробнее.
Диета
Лечение хронического аутоиммунного гепатита, находящегося в стадии обострения, проводится при строгом соблюдении постельного режима. При наступлении фазы ремиссии пациенту достаточно правильно организовать свой режим труда и отдыха, избегая при этом всяческого (эмоционального и физического) переутомления. Кроме того, важно исключить воздействие на печень различных токсических веществ, в том числе алкоголя и медикаментозных препаратов, выводимых этим органом. В период ремиссии не стоит также проводить и физиотерапевтические процедуры, оказывающие воздействие на область печени. Запрещена и бальнеотерапия.

Никаких ограничений диета не рассматривает в отношении овощей и некислых фруктов. Однако их употребление, как и всякой другой разрешенной пищи, обязательно должно находиться в разумных пределах.
Диета, рекомендованная человеку, которому проводится лечение аутоиммунного гепатита, исключает из рациона жареные блюда, жирные сорта мяса, соленые и острые закуски, щавель и шпинат, какао и крепкий кофе, алкоголь и консервы. Питание при этом должно быть обязательно дробным. Кушать важно не менее четырех раз в сутки, а лучше если прием пищи будет производиться шесть раз. Важно также соблюдать сбалансированность рациона питания, чтобы организм получал все необходимые для него вещества.
Применение лекарственных препаратов
Если требуется лечение аутоиммунного гепатита, алгоритм действий врача будет зависеть от стадии и течения патологии. Но в любом случае, помимо использования диеты, больному назначаются необходимые медикаменты. В зависимости от того, какая наблюдается у пациента с диагнозом "аутоиммунный гепатит" клиника, лечение специалистом может быть назначено с применением различных препаратов.

Использование одновременно двух препаратов угнетает развитие воспалительного процесса и дает возможность защитным силам организма самостоятельно устранить имеющиеся сбои. К сожалению, принимать эти лекарственные средства пациенты вынуждены от полугода до 4 лет. При этом врачи не дают никаких гарантий того, что курс этот окажется единственным. Многим больным приходится повторять его не один раз в течение своей жизни.
Подобный алгоритм терапии применяется и в тех случаях, когда проводится лечение аутоиммунного гепатита у детей.
Альтернативная схема терапии
По мнению исследователей, данный препарат способен стать новым стандартом клинической терапии, используемым при избавлении от аутоиммунного гепатита.
Хирургическое лечение
В тех случаях, когда применение медикаментозной терапии в течение четырех лет не улучшает состояние пациента и не нормализует его биохимические показателт крови, пациенту проводится оперативное вмешательство.
Оно представляет собой операцию по трансплантации донорского органа. Как правило, для этого берется часть печени родного по крови человека.
Народные средства
Применение средств, рецептура которых была создана знахарями на основе природных компонентов, позволяет эвакуировать желчь, устранить тошноту и явления интоксикации, а также снять болевой синдром.
Стоит иметь в виду, что если у человека обнаружен аутоиммунный гепатит, лечение народными средствами принесет лишь облегчение симптомов болезни, но избавиться от нее полностью не позволит. Подобные методы достаточно эффективны лишь при тех патологиях, которые легко поддаются лечению. Это относится к гепатиту А или к его токсическому типу.
Хорошо зарекомендовали себя в борьбе с воспалительными явлениями в печени различные травы, обладающие желчегонным эффектом. Из них готовят настои и отвары. К числу таких целебных трав относятся:
- корни и листья крапивы;
- мята и анис;
- тысячелистник;
- семена огородного укропа;
- зверобой;
- листья березы.
Из целебных трав составляются сборы, которые принимают перед приемом пищи. Приготовленным настоем из плодов шиповника заменяют чай. Пьют его через соломинку, так как это средство оказывает негативное воздействие на эмаль зубов.
Положительно влияет на состояние печени и сок различных овощей, ведь в нем содержится большое количество витаминов и полезных элементов. Для лечения гепатита в домашних условиях может быть использован сок:
- топинамбура;
- сырого картофеля;
- моркови, разведенный водой;
- сельдерея и листьев одуванчика;
- сырой свеклы, разведенный водой.
Прогноз
Выживаемость пациентов, страдающих от аутоиммунного гепатита, полностью зависит от интенсивности проходящего в печени воспалительного процесса. В легких случаях у 80 % людей она составляет более 15 лет. Однако при отсутствии полноценной терапии и при тяжелом течении недуга лишь единицам удается прожить более пяти лет.
Аутоиммунный гепатит лечится иммуносупрессантами. К ним относятся классические системные глюкокортикоидные препараты преднизон и преднизолон, современный локально действующий препарат будезонид(его эффективность пока еще изучается в клинических исследованиях). Уже на протяжении ряда лет оправдала себя комбинация азатиоприна и преднизолона, в то время как применение азатиоприна в виде монотерапии оказалось неэффективным. Резервными препаратами, применяемыми в случаях неэффективности обычно использующихся лекарственных средств, являются циклоспорин А (ЦсА), такролимус (FK506), микофенолата мофетил (ММФ) и цитостатики. В лечении больных, резистентных к терапии, или пациентов с терминальной стадией заболевания методом выбора следует считать пересадку печени. Однако обычно аутоиммунный гепатит достаточно хорошо поддается консервативной терапии.
Начальная терапия
Поскольку все иммуносупрессивные препараты обладают побочными эффектами, лечение проводится лишь у тех пациентов, у которых его целесообразность однозначно превосходит риск возникновения побочных реакций. Лечение считается абсолютно показанным лишь больным с тяжелым прогрессирующим течением заболевания, при котором отмечаются 10-кратное, по сравнению с нормой, повышение активности трансаминаз или ее 5-кратное повышение при одновременном двукратном, по сравнению с нормой, увеличении уровня гаммаглобулинов. При гистологическом исследовании в таких случаях обнаруживаются густые круглоклеточные инфильтраты в перипортальных полях, ступенчатые и/или мостовидные некрозы. Поскольку больные со сформировавшимся циррозом хорошо отвечают на проводимое лечение, оно назначается при активном воспалении. Сказанное относится и к больным с умеренно выраженными признаками декомпенсации или же после состоявшегося кровотечения из варикозно расширенных вен пищевода. Хотя целесообразность проведения лечения у больных с малоактивным и малопрогрессирующим течением аутоиммунного гепатита остается недоказанной (применительно кдальнейшему прогрессированию и ожидаемой продолжительности жизни), иммуносупрессивная терапия с применением низких доз препаратов позволяет существенно улучшить их общее самочувствие и качество жизни.
Первичная терапия аутоиммунного гепатита - назначение преднизона или преднизолона. Эффективность этих препаратов одинакова, однако преднизон до начала своего действия в печени предварительно превращается в преднизолон. Если диагноз аутоиммунного гепатита вызывал до начала терапии сомнения, то эффективность пробного назначения глюкокортикоидов подтверждает правильность его постановки.
Лечение начинается с суточной дозы 60 мг в течение 1 недели. В дальнейшем эта доза постепенно снижается (по 10 мг в неделю) до 30 мг в сутки. Последующее снижение дозы происходит более плавно (по 5 мг в неделю). Таким образом, через 6 недель лечения поддерживающая доза составляет 8-10 мг в сутки. В отдельных случаях удается снизить дозу до 5 мг в сутки (и даже менее) без возникновения рецидива. Снижение дозы должно проводиться под контролем основных лабораторных печеночных проб и корректироваться в зависимости от их показателей.
У детей начальная суточная доза должна составлять 2 мг/кг массы тела, поддерживающая - 5 мг в сутки. Дети отвечают на терапию глюкокортикоидами так же же хорошо, как и взрослые. Однако при развитии острой печеночной недостаточности глюкокортикоиды эффективны лишь при лечении взрослых, но не детей. Тогда детям показана срочная пересадка печени. Причины неодинакового ответа на глюкокортикоидную терапию остаются не ясными.
Если на фоне терапии преднизоном (преднизолоном) происходит повторное повышение уровня трансаминаз (причем когда применяемые дозы еще не достигли поддерживающих), то либо вновь возвращаются к предыдущей более высокой дозе глюкокортикоидов, либо сочетают прием глюкокортикоидов с азатиоприном в дозе 1 мг/кг массы тела. К комбинированной терапии прибегают и в тех случаях, если на фоне начальной монотерапии глюкокортикоидами рано возникают побочные эффекты лекарственных препаратов.
Комбинированная терапия преднизоном (преднизолоном) и азатиоприном может проводиться сразу же, поскольку преднизон (преднизолон) назначается в более низкой начальной дозе и риск побочных эффектов уменьшается. Указанные препараты усиливают действие друг друга. Начальная доза азатиоприна у взрослых составляет 50 мг в сутки и может быть повышена до 100 мг в сутки (1-1,5 мг/кг массы тела). Детям азатиоприн назначается по 0,5-1,0 мг/кг массы тела в сутки.
В настоящее время получены предварительные результаты применения локально действующего кортикостероидного препарата будезонида. Будезонид, назначавшийся в течение 6 недель 13 больным, способствовал достоверному снижению уровня трансаминаз и IgG. Концентрация кортизола в плазме на фоне лечения не изменялась, побочные эффекты встречались редко и были слабо выражены. Максимальные дозы будезонида составляли 6-8 мг в сутки и снижались затем до поддерживающих доз (2-6 мг в сутки). Эти результаты были подтверждены исследованиями, проведенными у 12 пациентов с аутоиммунным гепатитом, которые показали, что применение будезонида в дозе 9 мг в сутки способствует возникновению ремиссии и сопровождается низкой частотой побочных эффектов.
Поддерживающее лечение в фазе ремиссии
Если начальная терапия привела к ремиссии, то лечение больных должно быть продолжено, иначе у 80-90% пациентов в течение первого года отмечается рецидив. При поддерживающей терапии необходимо назначение как можно меньших доз, что удается добиться с помощью сочетанного применения преднизона (преднизолона) и азатиоприна. В пользу комбинированного лечения свидетельствует и более высокая эффективность данной тарапии. Так, при проведении в течение 18 месяцев комбинированной терапии ремиссия сохраняется более чем у 90% больных, при проведении монотерапии - лишь у 60%.
Поддерживающая терапия в фазе ремиссии должна продолжаться 2-4 года, хотя в наших наблюдениях встречались больные, у которых полная ремиссия достигалась спустя 5 и более лет. Регулярное контрольное обследование и лечение имевшегося исходно или индуцированного глюкокортикоидами остеопороза позволяют проводить длительную поддерживающую терапию без риска развития осложнений.
В случае сохранения ремиссии на фоне поддерживающей терапии дозу преднизона (преднизолона) можно снижать (по миллиграммам) не ранее, чем через 2 года с момента начала ее проведения. Если снижение дозы сопровождается ухудшением лабораторных печеночных проб, возвращаются к первоначальной дозе. При повторном достижении ремиссии с последующим повторным рецидивом, проводят длительное лечение меньшими дозами.
У некоторых больных длительная поддерживающая терапия преднизоном (преднизолоном) или азатиоприном в период ремиссии чревата риском развития осложнений. В таких случаях оправдана попытка проведения монотерапии тем или иным препаратом. Это целесообразно у молодых женщин детородного возраста, у больных с инсулинзависимым сахарным диабетом или выраженным остеопорозом. Если у них в течение года сохраняется ремиссия заболевания, то достаточно монотерапии азатиоприном в дозе 2 мг/кг массы тела. Учитывая, что эта доза достаточно высока, следует учитывать возможность возникновения побочных эффектов.
Читайте также:


