Противовирусный и противоопухолевый иммунитет
Исследование противоопухолевого иммунитета и устранение факторов, вызывающих его ухудшение, являются важными проблемами в современной медицине. Злокачественные новообразования занимают одно из лидирующих мест среди причин смертности и инвалидизации населения в развитых странах. В норме баланс количества делящихся и отмирающих клеток регулируется естественным образом. Если размножение клеток приобретает неконтролируемый характер, то возникают злокачественные опухоли. Механизм контроля этого процесса со стороны иммунной системы зависит от нескольких факторов, подавляющих или стимулирующих процесс избыточного деления.
Общее описание
Под иммунитетом принято понимать совокупность защитных механизмов живого организма от негативного воздействия чужеродных агентов. Чаще всего эти процессы связаны с инфекционными (бактериальными, вирусными, грибковыми, протозойными) заболеваниями. Однако существуют и другие способы защиты, одним из которых является противоопухолевый иммунитет.
В деятельности любого живого организма возникают моменты, когда ему необходимо быстрое деление клеток (травма, воспалительный процесс и другие). При развитии определенного иммунного ответа количество клеток, чувствительных к воздействию антигена (молекулы, связанной с антителом), увеличивается в несколько тысяч раз. При нормальном течении процесса после завершения данной реакции ускоренное деление клеток останавливается.
Для злокачественной опухоли характерно нарушение этого механизма. Размножение клеток продолжается постоянно и имеет независимый характер. Постепенно происходит замещение нормальных тканей в пораженном органе и прорастание опухоли в окружающие области. Перемещаясь по кровяному руслу, клетки опухоли продолжают делиться и в другой локализации, что приводит к появлению метастаз. Этот дефект непрерывного деления наследуется всеми потомками опухолевых клеток. Их мембраны изменены таким образом, что человеческий организм воспринимает объекты как чужеродные.
С другой стороны, в организме имеется способ, который может остановить этот процесс, – противоопухолевый иммунитет. В иммунологии возникновение опухолей является свидетельством того, произошли нарушения естественного защитного механизма.
История открытия
Еще в 18 веке было замечено, что у некоторых больных, перенесших инфекционные болезни, исчезали злокачественные опухоли. В конце 19 века американский хирург-онколог Вильям Коли выявил взаимосвязь между заражением гемолитических стрептококком Streptococcus pyogenes и уменьшением (а в некоторых случаях – и полным исчезновением) опухолей злокачественного характера. Им была разработана противораковая вакцина на основе этих бактерий для лечения пациентов с саркомой. В то время еще не были известны механизмы противоопухолевого иммунитета в иммунологии, поэтому его работы подвергались сильной критике, а впоследствии были забыты почти на 100 лет.
В середине XX века было открыто, что введение макромолекул липосахарида, из которых состоят оболочки клеток микробов, может приводить к отмиранию опухолей. Однако в 70-е гг. XX в. ученые установили, что этот процесс вызывает не сам липосахарид, а белковый фактор (фактор некроза опухоли, или ФНО), вырабатываемый следующими типами клеток иммунной системы при контакте с микробами:
- активированные макрофаги;
- нейтрофилы;
- Т-лимфоциты;
- тучные клетки;
- астроциты;
- NK-клетки (натуральные киллеры).
Взаимосвязь иммунитета и образования опухолей
В пользу наличия связи между состоянием иммунитета и развитием злокачественных опухолей свидетельствуют следующие факты:
- увеличенная распространенность таких новообразований у пациентов с иммунодефицитным состоянием, а также в пожилом возрасте (что связано со снижением защитных сил организма);
- выявление у больных специфических антител и Т-клеток, чувствительных к антигенам опухолей;
- возможность формирования противоопухолевого иммунитета и иммунопролиферативных заболеваний (при искусственном введении антител и подавлении иммунитета соответственно).
Защитная функция иммунитета заключается не только в уничтожении чужеродных агентов (вирусов, грибков и бактерий), но и клеток-мутантов, из которых образуются опухоли. Для них характерна антигенная специфичность, которая зависит от причины появления новообразования:
- вирусы (папилломы, лейкоза и другие);
- химические канцерогены (метилхолантрен, бензопирен, афлотоксины и другие);
- эндокринные нарушения (метаболическая иммунодепрессия);
- физические факторы окружающей среды (все виды излучений).
Естественный противоопухолевый иммунитет очень слабо влияет на уже сформировавшееся злокачественное новообразование. Это связывают со следующими факторами:
- быстрый рост опухоли, опережающий активизацию иммунных сил;
- выделение опухолевыми клетками антигенов, которые связывают соответствующие рецепторы на поверхности лимфоцитов-киллеров;
- подавление клеточного иммунитета со стороны новообразования.
Принцип действия
Механизм противоопухолевого иммунитета в медицинской науке еще мало изучен. Несмотря на то что выявлена его защитная функция, антитела могут отражать опухолевые антигены, не вызывая разрушения злокачественных клеток. В некоторых случаях иммунотерапия даже дает обратный эффект, способствуя увеличению новообразования.
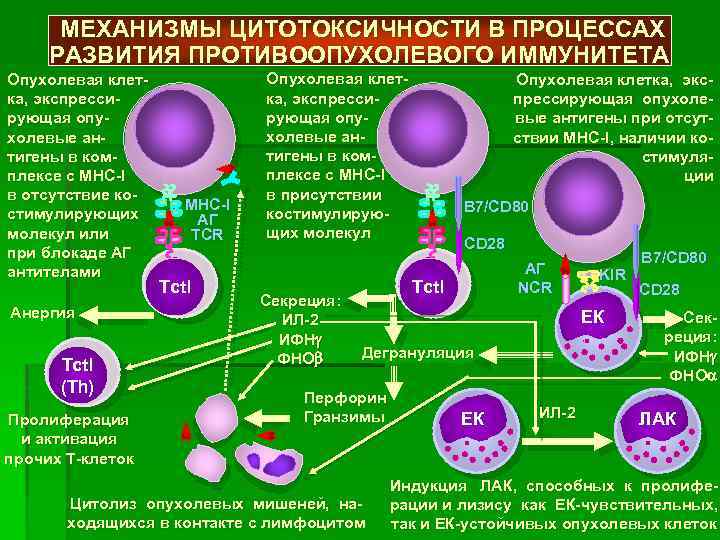
Согласно современным представлениям, ключевую роль в данном процессе играют активизированные макрофаги и клетки-киллеры. Особенностью противоопухолевого иммунитета является то, что он характеризуется сложным механизмом взаимодействия организма-хозяина и новообразования. Выделяют 4 основные группы факторов:
- Антибластомные – гуморальные и клеточные (Т-лимфоциты, ФНО, макрофаги, ЕК- и К-клетки, специфические антитела, интерфероны, интерлейкины), подавляющие развитие опухоли и разрушающие ее клетки.
- Иммунорезистентность новообразования, или его способность противостоять противоопухолевому иммунитету.
- Пробластомные: угнетающие иммунитет (вещества-супрессоры, вырабатываемые макрофагами и лимфоцитами; гормоноподобные соединения, интерлейкин-10, циркулирующие иммунные комплексы, протеины группы TGFβ, состоящие из антигенов, антител и компонентов комплемента); усиливающие иммунитет (ФНО, вырабатываемый макрофагами; гамма-интерферон, интерлейкины 2 и 6, фактор роста эндотелия; иммунодефицитные состояния).
Эффекторные механизмы
Основной функцией эффекторных механизмов противоопухолевого иммунитета является блокирование и уничтожение патогенов. Выделяют 2 группы рецепторов, избирательно связывающиеся со специфическими антигенами. На основании этого различают также 2 типа эффекторных механизмов:
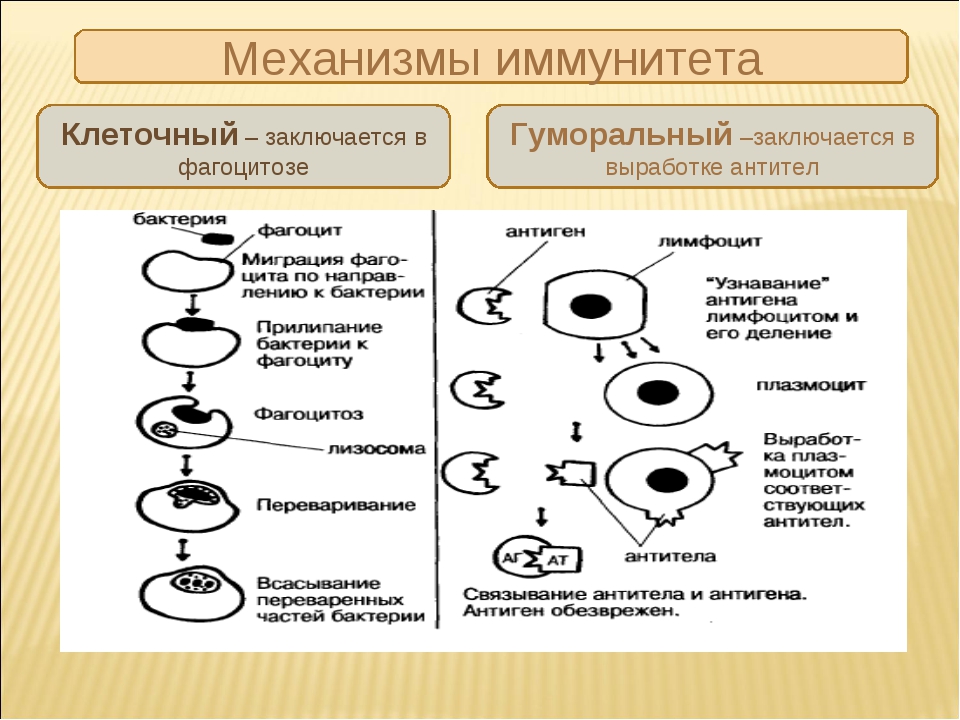
- Гуморальный, функционирующий за счет растворимых (гуморальных) факторов – антител, которые связывают и удаляют антиген.
- Клеточный (антителонезависимый), реализующийся с участием клеток иммунной системы, важнейшими из которых являются Т-лимфоциты, макрофаги, NK-клетки. Они непосредственно разрушают чужеродные, инфицированные и опухолевые клетки.
Если патологически измененная клетка избежала гибели при воздействии эффекторных механизмов, то может наступить период равновесия между ее делением и подавляющим влиянием иммунитета. При прогрессировании злокачественного процесса происходит выход опухолевой ткани из-под контроля иммунных механизмов.
Важнейшую роль в подавлении деления клеток играют 2 типа лимфоцитов, запускающих процесс некроза – Т-лимфоциты и NK-клетки, распознающие стрессорные молекулы, которые выделяет новообразование. Т-лимфоциты формируются в течение более длительного времени, а их предшественники распознают опухолевые антигены. Th1-лимфоциты запускают механизм воспаления, что приводит к активизации макрофагов. Продукты секреции последних способствуют нарушению местного кровоснабжения тканей, что также влечет гибель тканей опухоли.
Участие Т-лимфоцитов проявляется в пропитывании злокачественного новообразования лимфоидными клетками, которые разрушают его клетки путем растворения, или цитолиза. Активизация лимфоцитов происходит под действием цитокинов – белковых информационных молекул, с которыми они вместе проникают в опухоль.
Большое значение среди внутренних факторов, присущих иммунной системе организма человека, имеет также гамма-интерферон. Его функции заключаются в следующем:
- Подавление деления опухолевых клеток.
- Активизация процесса их запрограммированной гибели.
- Стимулирование выработки цитокинов, которые привлекают в новообразование Т-лимфоциты.
- Активация макрофагов и развития Т-хелперов, необходимых для укрепления противоопухолевого иммунитета.
- Подавление образования новых кровеносных сосудов, что ухудшает питание опухоли и способствует более быстрой гибели ее клеток.
Противоопухолевый иммунитет: причины его низкой эффективности
Рост злокачественных новообразований и их устойчивость к иммунитету объясняются следующими причинами:
Эти механизмы неэффективности противоопухолевого иммунитета приводят к тому, что новообразование становится мало иммуногенным и не воспринимается организмом как чужеродный элемент. В результате снижается защитная реакция. Иммунные механизмы не могут привести к отторжению уже сформировавшейся злокачественной опухоли.
Особенности
К особенностям противоопухолевого иммунитета относятся:
- Основную роль в иммунном ответе играют Т-лимфоциты, макрофаги и NK-клетки, разрушающие опухолевую ткань. Значение гуморального иммунитета значительно меньше.
- Раковые антигены распознаются или непосредственно макрофагами и дендритными клетками, отвечающими за врожденный и адаптивный иммунитет, или через Th1-хелперы.
- Взаимодействие организма и опухоли происходит по трем направлениям: естественная и приобретенная резистентность к злокачественным новообразованиям, иммунодепрессия со стороны опухоли. Совокупность этих факторов и составляет противоопухолевый иммунитет.
- Злокачественные клетки в процессе естественного отбора приобретают механизмы защиты против врожденного иммунитета. Формируется их новый фенотип, происходит эволюция новообразования.
Опухолеассоциированные антигены разделяют на 2 группы – первого типа (характерны для многих видов новообразований, имеют вирусное происхождение) и второго, очень специфичные и обнаруживаемые у всех пациентов, имеющих данный вид опухоли.
Одной из общих особенностей противовирусного и противоопухолевого иммунитета является то, что он носит как специфический характер, то есть направлен против определенных видов патогенов, так и неспецифический (уничтожает все чужеродное организму). Неспецифическими факторами служат мононуклеарные и NK-клетки, активизирующиеся под влиянием интерлейкина 2 и интерферонов, а также лимфокин-активированные киллерные клетки и цитокины.
Иммунодиагностика
В последние годы в медицине находит применение иммунодиагностика злокачественных новообразований. В ее основе лежит выявление в крови следующих белковых соединений:
- антигены, ассоциированные с опухолями;
- антитела;
- лимфоциты, восприимчивые к опухолевым антигенам.
Малоинвазивная иммунодиагностика позволяет выявить рак различных органов на ранней стадии развития опухоли по наличию специфических антигенов (в скобках указана локализация злокачественного новообразования):
- PSA (простата).
- P-53 (мочевой пузырь).
- SCC (легкие, пищевод, прямая кишка).
- СА-19-9 (поджелудочная железа).
- СА-125 (яичники).
- СА-15-3 (молочная железа).
Однако антитела к определенному антигену в крови пациентов с раком определяются нечасто (в 10 % случаев). Иммуноглобулины к опухолеассоциированных антигенов выявляют чаще – у 50 % больных. В настоящее время в медицинской научной среде ведутся поиски и других антигенов, помогающих в диагностике рака.
Иммунопрофилактика и лечение
Для повышения противоопухолевого иммунитета используют иммуномодуляторы, опосредованно активизирующие клетки иммунной системы:
- Интерлейкины 1 и 2. Эти белковые соединения относятся к группе провоспалительных цитокинов (информационных молекул) и являются биологически активными веществами, вырабатываемыми лейкоцитами. Интерлейкины – главные участники в процессе формирования иммунного ответа при внедрении патогенов в микробиологии. Противоопухолевый иммунитет активизируется за счет активного деления лимфоцитов (Т-киллеры, NK-клетки, Т-хелперы, Т-супрессоры и продуценты антител). Интерлейкин 2 также активизирует выработку фактора некроза опухолей.
- Препараты из группы интерферонов. Они стимулируют иммунный ответ путем представления Т-лимфоцитам антигенов, которые были захвачены макрофагами и дендритными клетками. Т-хелперы выделяют белковые информационные молекулы, активирующие работу других клеток иммунной системы. В результате происходит повышение противоопухолевого иммунитета. Отдельные виды интерферонов (гамма-интерферон) могут непосредственно воздействовать на макрофаги и киллеры.
- Адъюванты. Они вводятся вместе с основными иммунобиологическими медицинскими препаратами и служат для усиления ответа со стороны защитных сил организма. Чаще всего их используют для здоровых людей при вакцинации. Одной из особенностей противоопухолевого иммунитета в микробиологии, касающейся данного типа веществ, является то, что они могут концентрировать на своей поверхности антигены. Это обеспечивает более длительный эффект. Для целенаправленной доставки антигенов в органы лимфатической системы применяют липосомы – пузырьки с липидными биослоями. Наиболее распространенными веществами этой группы являются полный и неполный адъювант Фрейнда, гидроксид алюминия, коклюшная палочка, осажденная на алюминиевых квасцах; Полиоксидоний.
- Элементы клеток бактерий (иммуностимуляторы Продигиозан, Ликопид, Ромуртид и другие).
Проведенные на животных эксперименты показывают, что при введении опухолевых антигенов происходит формирование иммунологической памяти. В результате после этого отторгается трансплантируемая злокачественная опухоль. В последние годы в медицине ведутся активные разработки, которые дадут возможность создания противоопухолевой иммунной памяти путем вакцинации. Пока в этом направлении создан один тип прививок – для повышения иммунитета к вирусам папилломы человека, которые индуцируют возникновение рака шейки матки у женщин ("Гардасил" и "Церварикс" зарубежного производства).
Виды опухолей
Иммунотерапия является эффективной в отношении следующих видов опухолей:
- меланома, возникающая из меланоцитов – пигментных клеток;
- неходжкинские лимфомы, происходящие из лимфоцитов;
- рак почек, прямой кишки, яичников;
- волосатоклеточный лейкоз (поражение В-лимфоцитов, белых клеток крови);
- глиома (опухоль мозга);
- саркома мягких тканей, происхождение которой связано с эпителиальными клетками и соединительной тканью.
Между состоянием иммунной системы и возникновением и ге-незом развития злокачественных опухолей существует тесная связь. Об этом свидетельствуют следующие факты:
§ повышенная заболеваемость злокачественными новообразованиями среди лиц с первичными и вторичными иммунодефицитами;
§ повышенная частота возникновения опухолей в пожилом и старческом возрасте в связи с пониженной активностью иммунной системы;
§ наличие у больных с опухолями специфических противовирусных антител и лимфоцитов-киллеров, сенсибилизированных к опухолевым антигенам;
§ возможность экспериментального воспроизведения иммунитета к опухолям за счет введения антигенов или противоопухолевых антител, а также возникновения опухоли при искусственной подавлении иммунитета.
Иммунная система, как известно, осуществляет функцию иммунологического надзора. Она постоянно следит за появлением клеток-мутантов или мутирующих молекул, распознает их и уничтожает. В случае снижения активности иммунной системы или повышения частоты мутаций возникает возможность сохранения и размножения клеток-мутантов, т. е. образования опухолей.
Известно, что опухоли индуцируются (вызываются) вирусами, а также химическими и физическими канцерогенами и имеют свои специфические антигены. Антигены опухолей, вызываемых вирусами (саркома Рауса, вирус лейкоза и др.), имеют одинаковую специфичность, но отличаются от антигенов, вызываемых химическими (бензпирен и др.) и физическими (все виды излучений) канцерогенами. В последнем случае опухоли по антигенной специфичности строго индивидуальны, т.е. различаются по антигенности. Имеются также эмбриональные антигены, которые не встречаются в норме в постнатальном периоде, но обнаруживаются в случае возникновения опухолей (гепатомы, саркомы, карциномы).
Поскольку любые опухолевые антигены являются чужеродными для организма, они вызывают гуморальные и клеточные реакции.
Основную роль в противоопухолевом иммунитете играют Т-лимфоциты, особенно естественные киллеры (ЕК), сенсибилизированные к опухолевым антигенам. Они распознают антигенные детерминанты опухолевых клеток, прикрепляются к поверхности этих клеток, выделяют цитотоксины (видимо, ферменты), которые разрушают стенку клетки, делают ее проницаемой и доступной для действия протеолитических и других ферментов, а также фагоцитов. Клетка лизируется и поглощается фагоцитами.
Противоопухолевые антитела не всегда играют защитную роль, а иногда даже стимулируют развитие опухоли. Это, видимо, связано с тем, что специфические иммуноглобулины связывают антигенные рецепторы опухолевой клетки, тем самым препятствуя контакту Т-лимфоцитов-киллеров с клеткой. Адоптивный перенос иммунных Т-лимфоцитов в интактный организм сообщает противоопухолевый иммунитет. Пассивный перенос противоопухолевых антител иммунитета не сообщает. Однако противоопухолевый иммунитет, к сожалению, мало влияет на течение уже развившейся опухоли. Это, по-видимому, объясняется несколькими причинами:
§ связыванием антигенраспознающих рецепторов на поверхности Т-лимфоцитов-киллеров опухолевыми антигенами, выбрасываемыми в лимфу и кровь опухолевыми клетками;
§ отсутствием защитного эффекта у противоопухолевых антител;
§ иммуносупрессивным действием опухоли, выражающимся в снижении показателей клеточного иммунитета;
§ интенсивностью роста злокачественных новообразований, опережающего скорость развития иммунитета.
Однако иммунологические методы диагностики и лечения опухолей все чаще находят применение. Иммунодиагностика опухолей основана на определении в крови опухолевых антигенов и антител, а также сенсибилизированных к опухолевым антигенам лимфоцитов. Таким способом уже диагностируют опухоли печени, рак желудка, кишечника и др. Качество диагностики возрастает при использовании моноклональных антител против антигенов опухолей.
Практическое применение для лечения опухолей нашли им-муномодуляторы, стимулирующие деятельность иммунной системы: интерлейкины-2 и 1, интерфероны (а, у), разнообразные адъюванты – компоненты бактериальных клеток (БЦЖ, проди-гиозан, бластолизин, мурамилдипептид и др.).
9.13.3. Трансплантационный иммунитет
Трансплантационным иммунитетом называют иммунную реакцию организма, направленную против чужеродных тканей (трансплантата).
Знание механизмов трансплантационного иммунитета, его возникновения и течения необходимо для решения одной из важнейших проблем медицины – пересадки органов и тканей. Технически трансплантационная хирургия, которая занимается пересадкой органов и тканей, в состоянии провести практически любую операцию по пересадке почти любых органов и тканей (сердце, легкие, печень, почки, сосуды, кожа и т. д.). Однако успех операции в подавляющем большинстве случаев зависит от иммунологической совместимости тканей. Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чуждые для организма трансплантационные антигены. По специфичности тканевых антигенов все существующие виды, а также индивиды внутри вида имеют различия. Антигенная дифференцировка тканей вида и индивида закодирована в генах; она заключена в главной системе гистосов-местимости, имеющейся у человека и у всех животных. Комплекс антигенов системы гистосовместимости наиболее полно представлен в лейкоцитах крови. Поэтому эта система у человека получила название HLA (Human Leucocyte Antigens). У животных она имеет другое обозначение, связанное с видом животного.
В системе HLA человека открыто уже более 100 антигенов гистосовместимости, которые сгруппированы в несколько регионов (HLA-A, HLA-B, HLA-C, HLA-D, HLA-DR). Помимо антигенов системы HLA, у человека и животных имеются другие трансплантационные антигены. Антигены главного комплекса гистосовместимости (HLA) не только играют основную роль в трансплантационном иммунитете, но и определяют предрасположенность к тому или иному заболеванию, в том числе чувствительность к инфекционным болезням. Видимо, гены гистосовместимости сцеплены с генами, кодирующими те или иные биологические процессы.
Трансплантационные антигены имеются во многих клетках. Больше всего их в лимфоидной ткани, затем в порядке убывания следуют ткани печени и легких, кишечник, сердце, почки, желудок, мозг. Антигены HLA отсутствуют в эритроцитах и жировой ткани. Трансплантационные антигены представляют собой в основном гликопротеиды и располагаются на мембранах клеток.
В ответ на чужеродные трансплантационные антигены организм отвечает гуморальной и клеточной иммунными реакциями. Основную роль в трансплантационном иммунитете играет клеточная реакция, заключающаяся в том, что Т-лимфоциты-киллеры реципиента, сенсибилизированные антигенами донора, мигрируют в пересаженную ткань (трансплантат) и оказывают цитолитическое действие на клетки трансплантата. В результате клетка гибнет. Погибшие или поврежденные клетки трансплантата фагоцитируются макрофагами. Происходит отторжение трансплантата. Механизм иммунного отторжения трансплантата имеет две фазы. В первой фазе вокруг трансплантата и сосудов скапливаются лимфоциты, макрофаги, плазмоциты и другие клетки. Во второй фазе, когда трансплантат инфильтрирован иммунокомпетентными клетками, происходят деструкция клеток трансплантата, воспаление, тромбоз кровеносных сосудов, в результате чего нарушается питание трансплантата и он гибнет. Киллерный эффект лимфоцитов можно воспроизвести in vitro на культуре клеток. Возможен адоптивный перенос трансплантационного иммунитета, т.е. с помощью сенсибилизированных лимфоцитов. .
В трансплантационном иммунитете играют роль и антитела, образующиеся на чужеродный трансплантат (гемагглютинины, гемолизины, лейкотоксины, цитотоксины). Об этом свидетельствует возможность пассивного переноса трансплантационного иммунитета со специфической антисывороткой, содержащей антитела к антигенам трансплантата. Однако нельзя с определенностью сказать, участвуют ли антитела в процессе отторжения трансплантата или же процесс отторжения трансплантата сопровождается выработкой антител.
Основная иммунная реакция при чужеродном трансплантате называется реакцией трансплантата против хозяина (РТПХ). Она развивается в случае несовместимости антигенов комплекса гистосовместимости HLA у донора и реципиента. Эта реакция не возникает в случае совместимости антигенов комплекса HLA (например, у близнецов), и выраженность ее зависит от степени чужеродности и количества чужеродных клеток пересаживаемого органа.
Как уже было сказано, реакция отторжения трансплантата является главной причиной неудач в трансплантационной хирургии. Иммунология пока не нашла радикальных средств для преодоления тканевой несовместимости. Однако определенные успехи уже достигнуты. Используется подбор по тканевой совместимости донора и реципиента на основании определения антигенов комплекса HLA. Для подавления реакции отторжения трансплантата применяют иммунодепрессанты, которые ингиби-руют клеточное деление и дифференцировку или обладают цитостатическим действием. Наиболее эффективны циклоспорин и актиномицин D. Применяют также меркаптопурин, кортикостероиды, антилимфоцитарную сыворотку, а иногда облучение.
ИММУНИТЕТ ПРОТИВООПУХОЛЕВЫЙ (лат. immunitas освобождение, избавление от чего-либо)— комплекс реакций иммунной системы организма, направленных против опухолевой клетки, определяемых активностью иммунных лимфоцитов, макрофагов и антител.
Факторы естественного иммунитета, принимающие участие в И. п., почти не изучены. Различия в частоте возникновения у животных разного типа спонтанных опухолей или в их резистентности к индукции определенных опухолей включают, несомненно, как факторы неиммунологической природы, так и факторы противовирусного иммунитета. Экспериментально установленная резистентность определенных линий мышей и кур к размножению саркомо-лейкозных вирусов имеет неиммунол. природу. Возможно, что антитела к опухолеродным вирусам, напр, к вирусу полиомы у здоровых мышей или к вирусу Эпстайна— Барра у людей, являются факторами естественной резистентности к этим опухолям. Определенную роль в И. п., по-видимому, играет интерферон (см.), оказывающий подавляющее действие на опухолеродные вирусы и опухолевые клетки. Предполагают, что в процессе эволюции данного вида животных формируется набор генов, определяющих эффективный иммунный ответ по отношению к онкогенным вирусам, циркулирующим внутри этого вида, и к антигенам, индуцированным этими вирусами. Таким путем может создаваться различная чувствительность определенных видов животных к разным опухолеродным вирусам.
Основным условием для развития приобретенного иммунитета является наличие в составе опухолевых клеток специфических для опухоли антигенов (см.), воспринимаемых иммунологической системой организма как чужеродные. Эти антигены могут быть либо внутриклеточными, либо включенными в наружную мембрану клеток, либо продуктами жизнедеятельности клеток, попадающими затем в кровяное русло. Опухолевые антигены стимулируют образование антител (см.) и иммунных лимфоцитов, которые могут взаимодействовать с опухолевыми клетками, если соответствующий антиген находится на мембране клетки. В результате такого взаимодействия опухоль может исчезнуть, замедлить свой рост или приобрести иммунорезистентность. Конечный результат роста опухоли в условиях И. п. определяется количеством и динамикой образования антител и иммунных лимфоцитов при росте опухоли, количеством специфических опухолевых антигенов на поверхности клеток, типом опухоли, ее иммунорезистентностью и т. д.
Основным методом определения И. п. in vivo является трансплантационный тест; наличие и напряженность И. п. выявляются по увеличению минимальной онкогенной дозы опухолевых клеток при их трансплантации иммунизированным животным по сравнению с контрольными. Трансплантационный тест осуществим лишь в строго сингенной системе, т. е. когда донор опухоли и реципиенты генетически идентичны и не отличаются по антигенам тканевой совместимости.
В некоторых случаях И. п. может быть выявлен так наз. кожным тестом по реакции гиперчувствительности замедленного типа в месте введения опухолевого антигена.
Весьма широко И. п. изучается методами in vitro. Взаимодействие антител с мембраной опухолевых клеток в присутствии комплемента может давать цитотоксический эффект. Антитела, связанные с мембраной, могут выявляться также так наз. флюоресцирующими или меченными 1251 антителами против иммуноглобулинов.
И. п., обусловленный действием иммунных лимфоцитов, можно выявить в культуре опухолевых клеток при добавлении к ней лимфоцитов иммунизированного донора или пораженного опухолью организма.
Возникновение приобретенного И. п. обусловлено существованием специфических опухолевых антигенов, которые относятся к пяти основным группам. Первая группа объединяет специфические антигены вирусных опухолей, контролируемые геномом (см.) вируса. Эти антигены существенно различаются по составу и природе в разных классах онкогенных вирусов (см.) — папова-вирусов и аденовирусов, онкорнавирусов и вирусов группы герпеса. Опухолевые клетки, трансформированные папова- и аденовирусами, имеют вирусиндуцированные антигены, локализующиеся в ядре и на клеточной мембране. Некоторые из мембранных специфических опухолевых антигенов способны индуцировать сильный И. п., не позволяющий опухоли привиться на сингенных иммунизированных реципиентах и даже подавляющий возникновение опухолей у зараженных тем же вирусом животных.
В клетках, трансформированных онкорнавирусами, специфические опухолевые антигены в основном представлены структурными компонентами вируса — белками или гликопротеидами,— которые синтезируются обычно и в тех опухолях, в которых нет продукции полных вирусных частиц. Кроме структурных компонентов вируса, опухоли, индуцируемые онкорнавирусами, могут содержать не входящие в состав вирусных частиц антигены, локализующиеся на поверхности клетки. Существенной особенностью вирусиндуцированных антигенов является их идентичность во всех тех опухолях, которые вызваны одним определенным типом вируса, независимо от гистол, строения опухоли или вида животного.
Вторую группу опухолевых антигенов составляют антигены опухолей, индуцированных 'хим. канцерогенами. Антигены опухолей, вызванных одним и тем же хим. канцерогеном, у идентичных по генотипу животных и в одинаковых условиях отличаются своей иммунологической специфичностью. В некоторых случаях в вызванных канцерогенами опухолях удается обнаружить перекрестно-реагирующие антигены, однако в этих случаях они являются менее характерными и встречаются наряду с индивидуально-специфическими антигенами. Природа и механизм возникновения антигенов второй группы не изучены. Эти антигены могут индуцировать трансплантационный иммунитет, однако лишь к той опухоли, клетки к-рой использовались для иммунизации.
Третья группа антигенов объединяет специфические опухолевые антигены, являющиеся обычными изоантигенами, имеющимися у нормальных животных некоторых инбредных линий или у определенного процента особей в гетерогенной популяции. Антигены этой группы проявляют себя как специфические опухолевые в тех линиях (или особях), у которых они не синтезируются в нормальных условиях, а появляются в опухолевых клетках лишь в результате канцерогенеза. Эти антигены встречаются в вирусных, индуцированных канцерогенами, и спонтанных опухолях. Примером образования специфических опухолевых антигенов третьей группы является синтез антигена, серологически сходного с антигеном группы крови А, в опухолевых клетках пациентов с группой крови В или 0. Другим примером может служить TL (thymus— leukemiа) - антиген мышиных лейкозов, который является нормальным органоспецифическим изо антигеном тимоцитов у некоторых линий мышей, но у мышей других линий обнаруживается лишь при спонтанном или индуцированном лейкозе.
В четвертую группу антигенов входят опухолево-эмбриональные антигены. Характерная особенность этих антигенов — их присутствие в нормальных тканях на эмбриональной стадии развития или в раннем постнатальном периоде. Во взрослом организме их синтез резко снижается, но при образовании опухоли вновь возрастает. Ввиду отсутствия или очень низкого уровня опухолево-эмбриональных антигенов во взрослом организме иммунол, толерантность к ним отсутствует или легко преодолима. При появлении эмбриональных антигенов в опухолевых клетках в достаточных для иммуногенеза количествах они могут индуцировать образование антител или иммунных лимфоцитов и, следовательно, выступать в роли специфических опухолевых антигенов. Эмбриональные антигены были обнаружены в вирусных, вызванных хим. канцерогенами, и спонтанных опухолях.
Специфические опухолевые антигены, характеризующие спонтанные опухоли неизвестной этиологии, составляют самую обширную — пятую группу опухолевых антигенов. К ним в основном относятся специфические антигены опухолей человека. Эти антигены выявляются и изучаются с помощью цитотоксической реакции иммунных лимфоцитов, взятых у больного с опухолью, на клетки его собственной или аналогичной опухоли, культивируемые in vitro. Специфические опухолевые антигены, выявляемые в этих условиях, сходны или идентичны в опухолях определенного гистогенеза. Возможно, что часть антигенов этой группы относится к опухолево-эмбриональным антигенам. Спонтанные опухоли у животных вызывают лишь очень слабый И. п.
Т. о., в большинстве опухолей имеются специфические антигены того или иного типа, способные индуцировать иммунол, ответ организма. Некоторые из них могут не только вызвать иммунный ответ организма, но и существенно повысить резистентность как к индукции опухоли, так и к ее трансплантации. Особенно эффективны в этом отношении антигены первой и второй групп. Случаи спонтанного рассасывания опухоли сопровождаются сильным иммунол, ответом на специфические антигены, что также указывает на значительную роль иммунной системы в деструкции опухоли. Однако И. п. не носит абсолютного характера; при введении даже высоко-иммунным животным больших доз опухолевых клеток у большинства из них образуются опухоли, приводящие организм к гибели. Экспериментально изучены главные механизмы, позволяющие клеткам опухоли преодолевать конфликт с иммунол, системой организма. К ним относится недостаточная иммунол, компетентность взрослого организма, к-рая может быть причиной беспрепятственного роста опухолевых клеток. Искусственное подавление иммунной системы организма путем облучения, тимэктомии, действия иммунодепрессантов или антилимфоцитарной сыворотки существенно способствует появлению спонтанных опухолей (в некоторых системах), индукции опухолей с помощью онкогенных вирусов или хим. канцерогенов. Сами Онкогенные вирусы и многие хим. канцерогены также обладают иммунодепрессивным действием. С этим механизмом хорошо согласуется тот факт, что наибольший процент онкол, заболеваний приходится на пожилой возраст, когда иммунная система ослаблена, а также резкое возрастание процента новообразований у больных с врожденными дефектами иммунной системы или систематически получающих иммунодепрессанты. Обследование онкол, больных показало, что у многих из них нарушена система комплемента, ощущается недостаток Б-лимфоцитов — предшественников плазмоцитов (антителопродуцирующих клеток), а также Т-лимфоцитов — предшественников иммунных лимфоцитов, снижена активность макрофагов и других элементов ретикулоэндотелиальной системы (см. Иммунитет).
Определяющая роль в отторжении организмом опухолевых клеток принадлежит иммунным Т-лимфоцитам. Однако специфические опухолевые антигены, как правило, индуцируют как образование иммунных лимфоцитов, так и антител, и их соотношение может иметь важное значение при развитии опухоли. Антитела к антигенам клеточной мембраны, прореагировав с ними в присутствии комплемента, могут оказать цитотоксический эффект на опухолевую клетку. Антитела могут препятствовать отторжению опухоли; в этом случае они блокируют те детерминанты антигенов, против которых направлены специфические рецепторы иммунных лимфоцитов (так наз. эффект ускорения роста опухоли антителами). Эффект ускорения четко продемонстрирован для трансплантационных антигенов опухолей в аллогенной системе. Несомненно, что он может играть роль и в специфическом И. п. В роли блокирующих факторов для действия иммунных лимфоцитов могут выступать и сами опухолевые антигены, если они, являясь компонентами клеточной мембраны, циркулируют также в растворимой форме в крови. Предполагают, что растворимые опухолевые антигены, присутствуя в комплексе с соответствующими антителами, оказывают блокирующий эффект на иммунные лимфоциты, соединяясь с их специфическими рецепторами на наружной клеточной мембране. Т. о., гуморальный иммунитет к опухолевым антигенам может помогать опухоли преодолеть И. п. При других условиях антитела способны подавлять рост опухолевых клеток, как это имеет место при экспериментальных лейкозах.
Специфические опухолевые антигены спонтанных опухолей и некоторые вирусиндуцированные антигены вызывают слабый иммунол, ответ организма или не индуцируют его совсем. Слабая иммуногенность таких антигенов может быть связана с полной или частичной толерантностью к ним организма — носителя опухоли. Напр., природный канцерогенез у мышей и кур тесно связан с присутствием в их организмах онкорнавирусов лейкозно-саркоматозного комплекса и семейства вирусов рака молочных желез (у мышей). Геном этих вирусов интегрирован с геномом клеток и передается вертикальным путем, т. е. от родителей потомству через гаметы. В спонтанных или индуцированных опухолях вирусный геном присутствует в активной форме, контролируя синтез вирусиндуцированных антигенов. В нормальных тканях в эмбриональный период развития наблюдается активация некоторых вирусных генов и синтез соответствующих антигенов. Вследствие этого организм не распознает вирусиндуцированные антигены как чужеродные и становится к ним полностью или частично толерантным. При этих условиях иммунитет к специфическим антигенам не может быть достаточно напряженным и не подавляет рост опухолевых клеток. Сходная картина наблюдается при передаче вируса рака молочных желез мышей с молоком.
При наличии И. п. опухоль может стать иммуиорезистентной и не реагировать на присутствие антител или иммунных лимфоцитов. Механизмы такой резистентности весьма разнообразны. Одним из них является иммуноселекция, благодаря к-рой происходит отбор опухолевых клеток, содержащих наименьшее количество специфических антигенов, что позволяет им развиваться вопреки иммунной реакции организма. Другой механизм связан с исчезновением опухолевых антигенов клеточной мембраны после их контакта с антителами. Это явление получило название антигенной модуляции и наблюдается не со всеми мембранными антигенами.
Опухолевые антигены клеточной мембраны могут присутствовать в скрытой форме, образуя комплекс с клеточными компонентами, закрывающими антигенные детерминанты и препятствующими взаимодействию их с антителами или иммунными лимфоцитами. Т. о. создается иммунорезистентность опухолевых клеток, к-рая может быть устранена обработкой клеток in vitro нейраминидазой, трипсином и др.
Механизмы и особенности И. п. изучены гл. обр. на экспериментальных моделях, однако многие из них носят, по-видимому, общебиол. характер и могут иметь место не только у животных, но и у человека. В некоторых опухолях человека найдены специфические антигены той или иной группы; показана способность некоторых из этих антигенов индуцировать появление в организме — носителе опухоли антител и иммунных лимфоцитов; обнаружены блокирующие факторы для иммунных лимфоцитов; найдены разнообразные нарушения иммунол, компетентности у онкол, больных. При лимфоме Беркитта, возникновение к-рой тесно связано с присутствием в клетках вируса Эпстайна—Барра, принадлежащего к группе герпеса, у больных наблюдается типичный иммунол, ответ на вирусные и вирусиндуцированные антигены. Четко выраженный И. п. в этом случае, возможно, способствует успешной химиотерапии этой опухоли. Не все специфические антигены, найденные в опухолях человека, вызывают И. п.: так, обнаруженные в опухолях человека специфические для них липополисахаридные антигены не ведут к образованию антител в организме больных.
Описанные особенности И. п. позволяют наметить различные подходы к иммунотерапии опухолей. Ввиду разнообразия путей, ведущих к усилению И. п. в организме, пораженном опухолью, иммунотерапию подразделяют на четыре основных типа: активную, пассивную, адоптивную и неспецифическую.
Активная иммунотерапия направлена в основном на создание таких условий, при которых собственная иммунная система организма становится способной распознать специфические опухолевые антигены и активно бороться против опухолевых клеток. Обычные схемы активной иммунотерапии состоят из многократных инъекций ауто- или аллогенных облученных или убитых опухолевых клеток, экстракта или гомогената из них или очищенного опухолевого антигена. В экспериментальной онкологии методы активной иммунотерапии дают хорошие результаты для вирусиндуцированных опухолей и многих вызванных хим. канцерогенами опухолей. Особенно эффективны эти методы как профилактические меры, препятствующие появлению опухолей или их росту при трансплантации. В клин, онкологии еще не найдены методы активной иммунотерапии, вызывающие напряженный и стойкий иммунитет у больных к опухолевым клеткам; наблюдаемое иногда улучшение состояния больных носит временный характер.
Пассивная иммунотерапия включает способы увеличения гуморального иммунитета путем введения цитотоксических антител к опухолевым антигенам. Источником таких антител могут быть аллогенные или гетерогенные антисыворотки к специфическим опухолевым антигенам. Эффективность их применения ограничена в основном опухолями, обладающими большим количеством и высокой плотностью антигенов на клеточной мембране. Наиболее интересными в пассивной иммунотерапии представляются методы увеличения цитотоксического эффекта антител. Для этой цели очищенные иммуноглобулины, содержащие антитела к опухолевым антигенам, конъюгируются с токсичными для клеток веществами (радиоактивные изотопы, бактериальные токсины, хим. ингибиторы метаболизма и т. д.). В этом случае антитела, которые сами по себе не способны лизировать клетку, разрушают ее с помощью конъюгированных агентов. В клин, онкологии пассивная иммунотерапия практически не используется.
В клинике сравнительно часто используется неспецифическая иммунотерапия. Методы этого вида терапии многообразны; большинство из них направлено на создание условий, при которых происходит неспецифическая активация всей иммунол, системы организма. Самым распространенным является стимуляция резистентности путем инъекций убитых или аттенуированных бацилл Кальметта — Герена. Эти бациллы, обладая сильной иммуногенностью, активируют все механизмы иммунитета, но гл. обр. клеточные. Клинический эффект неспецифической иммунотерапии изучается.
Библиография: Говалло В. И. Иммунитет к трансплантатам и опухолям, Киев, 1977; Грунтенко Е. В. Иммунитет и возникновение злокачественных опухолей, Новосибирск, 1977, библиогр.; Зильбер Л. А. и Абелев Г. И. Вирусология и иммунология рака, М., 1962, библиогр.; Иммунолюминесценция в медицине, под ред. E. Н. Левиной, с. 184, М., 1977; Clinical immunobiology, ed. by F. H. Bach a. R. A. Good, N. Y.— L., 1972; Conference on immunology of carcinogenesis, Washington, 1972; D e i с h-m a n G. I. Immunological aspects of carcinogenesis by deoxyribonucleic acid tumor viruses, Advanc, cancer res., ed. by G. Klein a. S. Weinhouse, v. 12, P. 101, N. Y.—L., 1969, bibliogr.; Hell-strom K. E. a. Hellstrom I. Cellular immunity against tumor antigens, ibid., p. 167; Immunobiology of the tumor-host relationship, ed. by R. T. Smith, a. M. Landy, N. Y., 1975; Lam on E. W. The immune response to virally determined tumor associated antigens, Biochim. biophys. Acta (Amst.), v. 355, p. 149, 1974, bibliogr.; Tumor associated embryonic antigens, Copenhagen, 1974, bibliogr.
Читайте также:


