Размер вируса гриппа в нанометрах
" title="Рисунки Владимира Орехова"/>
Все сейчас говорят о вирусах: коронавирус, грипп, ВИЧ, гепатит, ВПЧ, оспа и т.д. В мире существует более тысячи видов вирусов, способных поражать различные живые клетки, да практически все виды клеток. А что же такое вирусы и с чем их едят (в прямом и переносном смысле)? Где они живут, как попадают к нам в организм, что там делают и есть ли лекарства против них? Статей и постов в интернете много, в том числе, антинаучных и дилетантских. Поэтому ТИА обратилось за информацией в Тверской медуниверситет, к профессору кафедры микробиологии и вирусологии, доктору медицинских наук, декану фармацевтического факультета Юлии Червинец.
Что такое вирус и в чём отличие от бактерий?

Название "вирус" произошло от латинского слово virus и переводится как "яд". По сути, это мельчайшие внутриклеточные микробы-паразиты, потому что живут и размножаются они только внутри хозяина - практически во всех живых организмах (бактериях, грибах, растениях, животных и человеке). Несмотря на своё "коварство", все вирусы имеют примитивное строение: одна нуклеиновая кислота (ДНК или РНК), окруженная одной или несколькими оболочками. Различают просто устроенные вирусы (безоболочечные) и сложно устроенные вирусы (оболочечные). К простым вирусам относят: вирусы полиомиелита, гепатита А, аденовирусы. Примеры сложных вирусов: гепатит В, грипп, парагрипп, корь, ВИЧ, герпес. Различаются вирусы и по форме:
- палочковидная (вирус табачной мозаики)
- пулевидная (вирус бешенства)
- сферическая (вирусы полиомиелита, ВИЧ)
- нитевидная (филовирусы)
- в виде сперматозоида (многие бактериофаги).
Размеры вирусов настолько малы (18-400 нм), что увидеть их можно только с помощью электронного микроскопа. Единицы измерения - нанометры, в отличие от бактерий (микрометры, мкм). Кстати, вирусы приблизительно в 100 раз меньше бактерий. Наиболее мелкими вирусами являются вирус полиомиелита (20 нм), гепатита А (30 нм), гепатита С (50 нм), вирус бешенства (170 нм), наиболее крупным — вирус натуральной оспы (350 нм).
От бактерий вирусы отличаются не только размерами, но и количеством генов (минимальное у вирусов от 4 до сотни, у бактерий – от 3000); нуклеиновыми кислотами (вирусы содержат только одну - ДНК или РНК, а бактерии – обе); количеством ферментов и, конечно же, самой формой жизни: вирусы размножаются только внутри живых существ, а бактерии – свободноживущие.
Интересный факт: первооткрыватель вирусов и основоположник вирусологии - русский ученый Д.И. Ивановский. В 1892 году описал необычные свойства возбудителей болезни табака (табачной мозаики), которые проходили через бактериальные фильтры и были названы "фильтрующимися частицами".
Жизненный цикл вирусов состоит из нескольких этапов:

1. Вирус прикрепляется к поверхности чувствительной клетки. Для каждого вируса есть свои чувствительные клетки, например, для гепатита – клетки печени, для гриппа – клетки дыхательных путей и т.д.
2. Проникновение вируса в клетку: либо его оболочка сливается с мембраной клетки или клетка сама его захватывает и поглощает.
3. Далее в клетке идёт процесс как бы “раздевания” вируса от всех его оболочек и активация его нуклеиновой кислоты.
4. Начинается синтез нуклеиновых кислот и белков вируса, т.е. вирус подчиняет системы клетки хозяина и заставляет их работать на своё воспроизводство.
5. Сборка вируса — многоступенчатый процесс, включающий в себя соединение всех компонентов.
6. Последний этап - выход вирусных частиц из клетки взрывным путем или почкованием. Полный цикл размножения вирусов завершается через 5-6 ч (вирус гриппа) или через несколько суток (вирус кори). Из погибающей клетки, которая длительное время может сохранять жизнеспособность, одновременно выходит большое количество вирусов. В результате пораженные вирусом клетки в основном погибают от истощения, а новые вирусы завоевывают и разрушают другие клетки. Но возможна и так называемая онкогенная трансформация клетки: тогда в организме появляется и начинает расти из мутированных клеток раковая опухоль.
Сколько вирус может жить вне организма хозяина и где?
Как правило, большинство вирусов малоустойчивы во внешней среде: они становятся инертны и погибают от многих причин, если снова не попадут в чувствительную клетку. Некоторые вирусы во внешней среде могут образовывать кристаллы, что свойственно только неживой материи.
Вирусы быстро погибают под действием солнечных лучей, ультрафиолета, стандартных веществ для дезинфекции. В воздухе помещений вирусы могут сохраняться несколько часов. При кипячении полностью инактивируются в течение нескольких минут.
Однако вирусы устойчивы к низким температурам: сохраняют свою жизнеспособность при t +4°С в течение нескольких недель, а при замораживании - в течение нескольких месяцев, а иногда и лет (особенно супернизких температурах).
Устойчивость вируса на различных поверхностях различна и зависит от температуры. На бумаге вирус разрушается за 3 часа, на банкнотах - за 4 дня, на дереве и одежде - за 2 дня, на стекле - за 4 дня, на металле и пластике - за 7 дней. Кстати, на внутреннем слое использованной маски они могут жить 7 дней, а на внешней поверхности маски – даже более недели (данные соответствуют условиям при температуре +22 °С и влажности 65 %).
Есть и исключения. Некоторые вирусы обладают значительной устойчивостью при комнатной температуре: вирус гепатита В сохраняет жизнеспособность в течение трех месяцев, гепатита А – в течение нескольких недель. ВИЧ сохраняется в высохшей крови до двух недель, в донорской крови вирус остается жизнеспособным в течение нескольких лет.
Что такое штаммы и почему вирусы мутируют?
Штамм (от нем. Stamm - "ствол,род") — чистая культура вирусов, изолированная в определённое время и в определённом месте. Один и тот же штамм не может быть выделен второй раз из того же источника в другое время. В зависимости от среды обитания – почва, вода, воздух, время года, чувствительный организм (человек, животные, птицы) - вирусы подразделяют на штаммы. Например, водный штамм, весенний, птичий, свиной и т.п. Во внешней среде геном вируса подвержен различным воздействиям, например, ультрафиолетовое облучение, солнечная радиация, химические вещества, что приводит к различного рода мутациям, т.е. изменениям в структуре нуклеиновой кислоты. В зависимости от характера мутаций вирусы могут изменять свои свойства, скажем, сменить хозяина. Так, вирус гриппа, который поражал только птиц, стал поражать и людей.
Как часто происходит в мировом научном сообществе открытие нового вируса?
Ученые каждый год открывают новые вирусы. Так, в 1972 г. открыт вирус Эбола, 1980-1989 гг. - вирусы иммунодефицита человека, гепатита Е и С, коронавирус человека впервые был выделен в 1965 году от больных ОРВИ. В Китае 2002—2003 годах была зафиксирована вспышка атипичной пневмонии или тяжелого острого респираторного синдрома (ТОРС, SARS). Заболевание было вызвано штаммом коронавируса SARS-CoV. В результате болезнь распространилась на другие страны, всего заболело 8273 человека, 775 умерло (летальность 9,6 %). И вот в 2019 году появился новый штамм коронавируса CoViD 19, который вызвал пандемию.
Так откуда берутся вирусы?
Вопрос риторический. Пока ответа у науки нет. Может быть, они были привнесены из космоса на космических телах. Ведь при низких температурах они могут сохраняться неопределенно долгое время.
Как они попадают в организм человека/животного и т.д.?
Разными путями: воздушно-капельным (корь, грипп, ветряная оспа), половым (ВИЧ, вирус простого герпеса 2 типа), через кровь (гепатит В,С, ВИЧ), через инфицированные продукты (гепатит А, Е) или через членистоногих (скажем, клещей). Различают вирусы, вызывающие инфекции с преимущественным поражением органов дыхания (респираторные), кишечника (ротавирусы), печени (вирус гепатита), иммунной (ВИЧ) или нервной системы (бешенство, энцефалит).
Как организм реагирует на вирус?

Частицы самого вируса, а также биологически активные вещества, выделяющиеся при разрушении наших клеток, могут вызвать повышение температуры тела, тошноту, рвоту, сильную слабость, головокружение вплоть до потери сознания, нарушение работы сердечно-сосудистой системы и др. На фоне нарушения функционирования различных органов и систем к вирусной инфекции может присоединиться бактериальная (стафилококки, стрептококки, кишечные бактерии) и грибковая (дрожжевые грибы), усугубив воспалительный процесс с тяжелыми последствиями вплоть до летального исхода.
Как наш организм борется?
Однако организм человека не простая мишень для атаки болезнетворных микроорганизмов, он активно борется, и в этом нам помогает иммунная система. Вырабатываются специфические, нейтрализующие данный вирус антитела, формируются клетки-"убийцы" или Т-лимфоциты, которые уничтожают как поражённые, инфицированные клетки, так и сам вирус. Но иммунной системе нужно время, чтобы вычислить "чужака", "вирусного преступника", который не просто прячется внутри наших клеток, но и старается обмануть иммунную систему. Например, новое или мутировавшее поколение вируса наша иммунная система поначалу не видит. Конечно же, со временем все вирусные клетки распознаются, но к сожалению, с потерей драгоценного времени для нашего организма.
Возможно ли повторное заражение одним и тем же вирусом?
Наше здоровье зависит напрямую от активности и лабильности иммунной системы. Если она работает со сбоями и не справляется с негативным воздействием патогенов, заболевание может перейти в хроническую форму вплоть до смертельного исхода. Поэтому повторное заражение этим же вирусом возможно. Другая причина появления рецидива заболевания - мутации вируса. Если вирус стабилен, то наша иммунная система запоминает его и, как правило, повторных случаев инфицирования не бывает. Но если вирус подвергается изменчивости, то попав в организм человека, он воспринимается уже как новый вирус.
Есть ли лекарственные препараты для лечения вируса? Что может убить вирус?
Да есть, но не против всех вирусов. Антибиотики, применяемые при лечении бактериальных инфекций, здесь совершенно не работают, т.к. они воздействуют на структуры клетки только бактерий. В случае вирусной инфекции нужны препараты, которые блокируют различные этапы размножения вируса в клетке. Таким неспецифическим веществом является интерферон, который вырабатывается клетками организма человека (кишечника, печени).
Если выработка интерферона недостаточна, то можно применить индукторы интерферона, например: ламовакс, курантил, дибазол, адаптогены растительного (элиутерококк, оралия) и животного происхождения (вытяжка из мидий). Активно действуют при респираторных вирусных заболеваниях препараты интерферона - виферон, амиксин и др. Подавляют активность вируса гриппа на ранних стадиях ремантадин, амантадин, арбидол. Герпес подавляет ацикловир (зовиракс) и т.п. Однако пока точно неизвестны препараты, подавляющие репродукцию коронавируса. К специфическому лечению от коронавируса относится введение плазмы от переболевших людей, которая содержит антитела, но этот метод находит ограниченное применение.

Зачем нужна вакцинация? Как и из чего делают вакцины?
По сути, вакцины - это препараты для создания искусственного активного иммунитета. Термин "вакцина" произошел от французского vacca – "корова". Его ввел Л. Пастер в честь Дженнера, применившего вирус коровьей оспы для иммунизации людей против натуральной оспы человека. Вакцины – это препараты, содержащие сами микроорганизмы (убитые или живые ослабленные), части микроорганизмов, а также анатоксины (токсин, лишенный своих ядовитых свойств, но сохранивший свойства активировать иммунный ответ). После введения вакцины вырабатываются специфические антитела, которые нейтрализуют, прежде всего, поверхностные рецепторы вируса, с помощью которых он проникает в клетку. Таким образом блокируется основной механизм проникновения вируса в клетку. Многие вакцины создают пожизненный иммунитет у человека, например, вакцина от гепатита В, кори, краснухи, полиомиелита, эпидемического паротита.
Сколько времени уходит на создание вакцины?
На создание вакцины уходит 1-2 года, в течение которого должны пройти многочисленные проверки на эффективность и безопасность препарата, испытания на животных, потом на людях-добровольцах, а после – наладить массовое фармацевтическое производство.
Что представляют собой тесты на вирус? Как в лабораториях выявляют положительные результаты анализов?
Диагностика вируса основана на определении структуры вируса (специфических рецепторов и нуклеиновой кислоты), а также противовирусных антител у переболевших людей. Используются различные реакции: иммуноферментный анализ (ИФА), полимеразная цепная реакция (ПЦР). Время диагностики зависит от производителя тестов - от нескольких часов до 1 суток.
Несколько примеров самых массовых с убийственных с точки зрения эпидемий вирусов в истории человечества
Вирусы гриппа постоянно циркулируют среди населения, вызывая сезонные подъемы заболевания, периодически приобретающие характер эпидемий и даже пандемий. Эпидемии гриппа наносят огромный экономический ущерб, приводят к людским потерям. Это, прежде всего, относится к вирусам типа А, который каждые 2-3 года вызывает эпидемии, а несколько раз в столетие - пандемии с числом заболевших 1-2 млрд. человек. Эпидемии, вызываемые вирусом типа В, повторяются через 3-6 лет.
Пандемии гриппа, вызванные мутированными вирусами, против которых у людей нет иммунитета, возникают 2-3 раза в 100 лет. Пандемия гриппа 1918—1919 ("испанка", штамм H1N1) унесла жизни 40-50 миллионов человек. Предполагают, что вирус "испанки" возник в результате рекомбинации генов вирусов гриппа птиц и человека. В 1957—1958 была пандемия "азиатского гриппа", вызванная штаммом H2N2; в 1968—1969 - пандемия "гонконгского гриппа" (H3N2).
С 2009 появилось новое заболевание людей и животных, вызываемое штаммами вируса гриппа А/H1N1, А/H1N2, А/H3N1, А/H3N2 и А/H2N3, известных под общим названием "вирус свиного гриппа". Он распространён среди домашних свиней, а также может циркулировать в среде людей, птиц и др. видов; этот процесс сопровождается его мутациями.

Как уберечься от вирусов? Существуют ли действенные меры профилактики и гигиены?
Выделяют специфические и неспецифические способы профилактики вирусных инфекций. Специфические заключаются в использовании вакцин, при их наличии. При их введении у человека формируется как правило пожизненный иммунитет (вакцина от кори, краснухи, эпидемического паротита, ветряной оспы, гепатита В). Существует также экстренная профилактика. Ее проводят во время эпидемического подъема заболеваемости. Для экстренной профилактики, например, гриппа применяют противовирусные химиопрепараты: ремантадин (активен только против вирусов типа А), арбидол, амиксин, оксалиновую мазь и др. Используют также интерферон, дибазол, различные индукторы интерферона (например, элеутерококк, продигиозан).
Против многих вирусных инфекций вакцин не существует. В этом случае помогает неспецифическая профилактика. Существуют ряд общих правил:
- соблюдать личную гигиену (мойте руки перед приемом пищи, после использования туалета; не трогайте грязными, немытыми руками нос, глаза, рот).
- обязательно поддерживать здоровый образ жизни с помощью сбалансированного питания, занятий физкультурой, прогулок на свежем воздухе и многое другое.
Но для каждого вируса неспецифическая профилактика своя. Если речь идет о вирусах, передающихся воздушно-капельным путем, то необходимо придерживаться следующих правил:
- надевать маски, причем на больного человека, чтобы исключить попадание в пространство крупных частиц слюны при кашле и чихании, мелкие же частицы она не задерживает;
- тщательно убирать помещения, так как вирус любит теплые и пыльные помещения, поэтому стоит уделить время влажной уборке и проветриванию;
- избегать массовых скоплений людей и воздержаться от походов в общественные места.
Если вирус передается с помощью фекально-орального механизма, например, вирус гепатита А, то необходимо соблюдать следующее:
- употреблять чистую или кипяченую воду;
- мыть фрукты, ягоды, овощи кипяченой водой:
- поливать свой сад и огород проточной водой.
Если вирус передается через кровь, например, вирус гепатита В,С, ВИЧ, то необходимы:
- дезинфекция, стерилизация медицинских изделий;
- обследование доноров крови;
- не употреблять наркотики;
- использовать индивидуальные предметы личной гигиены;
- быть осторожными с маникюром, пирсингом и татуировками, делать это только в профессиональном салоне.
Если вирус передается половым путем, например, ВИЧ, то нужно:
- исключить незащищенные половые контакты, если вы не уверены в своём партнёре;
- использовать барьерные средства контрацепции, если вы не знаете статус своего партнера.
Вирусы — это мельчайшие живые организмы, размеры которых варьируют в пределах от 20 до 300 нм; в среднем они раз в пятьдесят меньше бактерий. Их нельзя увидеть с помощью светового микроскопа, и они проходят через фильтры, не пропускающие бактерий.
Исследователи часто задаются вопросом, живые ли вирусы? Если считать живой любую структуру, обладающую генетическим материалом (ДНК или РНК) и способную к самовоспроизведению, то ответ должен быть утвердительным: да, вирусы — живые. Если же признаком живого считать наличие клеточного строения, то ответ будет отрицательным: вирусы не живые. К этому следует добавить, что вне клетки-хозяина вирусы неспособны к самовоспроизведению.
Вне клетки вирусы находятся в совершенно инертном состоянии, однако они обладают набором инструкций (генетическим кодом), необходимых для того, чтобы вновь проникнуть в клетку и, подчинив ее своим инструкциям, заставить производить много идентичных себе (вирусу) копий. Следовательно, логично предположить, что в процессе эволюции вирусы появились позже клеток.
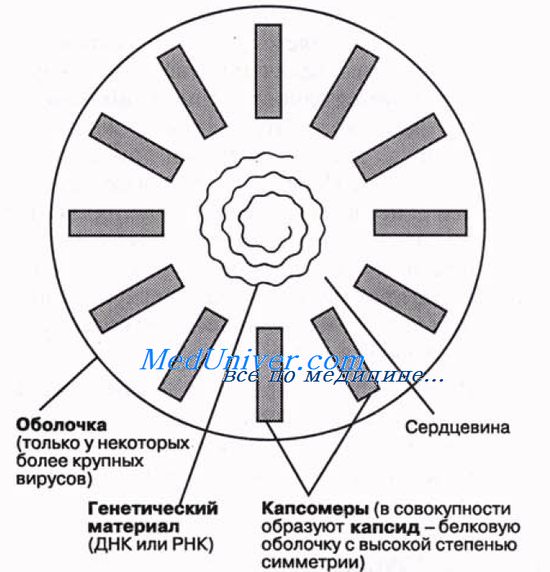
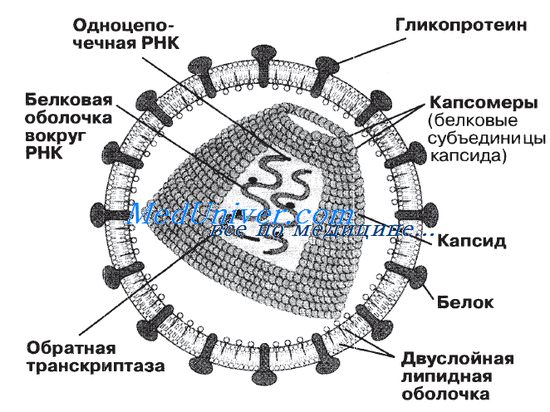
Строение вирусов очень простое. Они состоят из следующих структур:
1) сердцевины — генетического материала, представленного либо ДНК, либо РНК; ДНК или РНК может быть одноцепочечной или двухцепочечной;
2) капеида — защитной белковой оболочки, окружающей сердцевину;
3) нуклеокапсида — сложной структуры, образованной сердцевиной и капсидом;
4) оболочки — у некоторых вирусов, таких как ВИЧ и вирусы гриппа, имеется дополнительный липопротеиновый слой, происходящий из плазматической мембраны клетки-хозяина;
5) капсомеров — идентичных повторяющихся субъединиц, из которых часто бывают построены капсиды.
Общая форма капсида отличается высокой степенью симметрии, обусловливая способность вирусов к кристаллизации. Это дает возможность исследовать их как методом рентгеновской кристаллографии, так и с помощью электронной микроскопии. Как только в клетке-хозяине образуются субъединицы вируса, они сразу же могут путем самосборки объединиться в полную вирусную частицу. Упрощенная схема строения вируса показана на рисунке.
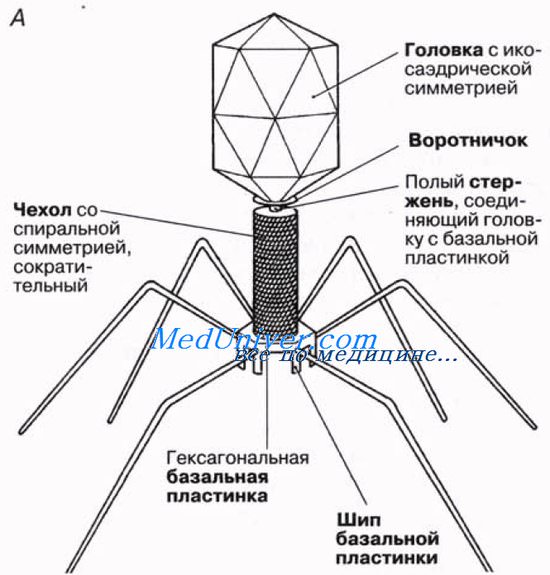
Для структуры капсида вируса характерны определенные типы симметрии, особенно полиэдрическая и спиральная. Полиэдр — это многогранник. Наиболее распространенная полиэдрическая форма у вирусов — икосаэдр, у которого имеется 20 треугольных граней, 12 углов и 30 ребер. На рисунке, А мы видим правильный икосаэдр, а на рисунке, Б — вирус герпеса, в частице которого 162 капсомера организованы в икосаэдр.
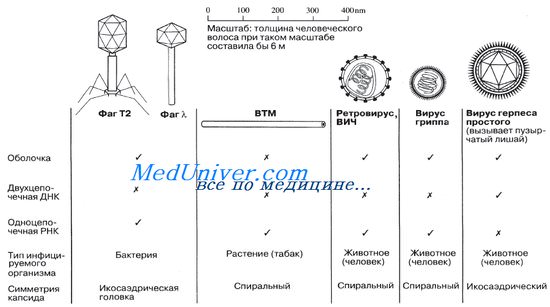
Наглядной иллюстрацией спиральной симметрии может служить показанный на рисунке, РНК-содержащий вирус табачной мозаики (ВТМ). Капсид этого вируса образован 2130 идентичными белковыми капсомерами.
ВТМ был первым вирусом, выделенным в чистом виде. При заражении этим вирусом на листьях больного растения появляются желтые крапинки — так называемая мозаика листьев (рис. 2.18, В). Вирусы распространяются очень быстро либо механически, когда больные растения или его части приходят в соприкосновение со здоровыми растениям, либо воздушным путем с дымом от сигарет, для изготовления которых были использованы зараженные листья.
Вирусы, атакующие бактерий, образуют группу, называемую бактериофагами или просто фагами. У некоторых бактериофагов имеются четко выраженная икосаэдрическая головка и хвост, обладающий спиральной симметрией). На рисунке приводятся схематические изображения некоторых вирусов, иллюстрирующие их относительные размеры и общее строение.
BJC получил финансирование исследований от MedImmune Inc. и консультирует Crucell MV. Авторы заявляют, что никаких других конкурирующих интересов не существует. Это не меняет нашу приверженность всем политикам PLoS Pathogens по обмену данными и материалами.
Задуманные и разработанные эксперименты: DKM MPF JJM. Выполнили эксперименты: DKM MPF JJM. Проанализированы данные: DKM. Написал документ: DKM MPF BJC MLG JJM. Выполненные подтверждающие эксперименты: MLG Предоставлял статистическую консультацию: BJC.
CDC рекомендует, чтобы настройки здравоохранения предоставляли пациентам с гриппом лицевые маски как средство сокращения передачи персонала и другим пациентам, а в недавнем докладе было показано, что хирургические маски могут захватывать вирус гриппа в большом аэрозоле с каплями. Тем не менее, имеются минимальные данные об утечке аэрозолей вируса гриппа, заражении выдыхаемых аэрозолей и ни о каком влиянии лицевых масок на пролиферацию вирусных аэрозолей у пациентов с сезонным гриппом.
Мелкие частицы, содержащие 8,8 (95% ДИ от 1,1 до 19), сбрасывают больше вирусных копий, чем крупные частицы. Хирургические маски уменьшали число вирусных копий в мелкой фракции в 2,8 раза (95% ДИ от 1,5 до 5,2) и в крупной фракции в 25 раз (95% ДИ от 3,5 до 180). В целом, маски продуцировали снижение вирусного аэрозоля в 3,4 раза (95% ДИ от 1,8 до 6,3). Корреляции между нозофарингеальным тампоном и номерами копий аэрозольной фракции были слабыми (r = 0,17, грубое, r = 0,29, мелкая фракция). Копия номера в выдыхаемом дыхании быстро снижалась с днем после начала болезни. Два субъекта с наивысшими номерами копий дали образцы положительной тонкой частицы культуры.
Хирургические маски, которые носят пациенты, уменьшают выброс аэрозолей. Обилие вирусных копий в аэрозолях тонкодисперсных частиц и доказательство их зараженности указывают на важную роль в передаче сезонного гриппа. Мониторинг выдыхаемых вирусных аэрозолей будет важен для проверки экспериментальных исследований передачи крови у людей.
Относительная важность прямого и косвенного контакта, большого аэрозоля с каплями и аэрозолей в качестве способов передачи гриппа неизвестна, но важна при разработке эффективных вмешательств. Хирургические лицевые маски, которые носят пациенты, рекомендуются CDC как средство снижения распространения гриппа в медицинских учреждениях. Мы стремились определить общее количество копий вирусной РНК, присутствующих в выдыхаемом воздухе и аэрозолях от кашля, независимо от того, представляют ли РНК в аэрозолях тонкодисперсных частиц инфекционный вирус, и позволяют ли хирургические лицевые маски уменьшить количество вирусов, пролитых в аэрозоли людьми, зараженными сезонными вирусами гриппа , Мы обнаружили, что общие вирусные копии, обнаруженные молекулярными методами, были в 8,8 раза более многочисленными в тонких (≤5 мкм), чем в крупных (> 5 мкм) аэрозольных частицах, и что мелкие частицы из случаев с наибольшим общим количеством вирусных копий РНК содержали инфекционные вирус. Хирургические маски уменьшили общее количество копий РНК в 3,4 раза. Эти результаты свидетельствуют о важной роли аэрозолей в передаче вируса гриппа и о том, что хирургические лицевые маски, которые носят инфицированные лица, потенциально являются эффективным средством ограничения распространения гриппа.
Передача вируса гриппа между людьми может происходить по трем направлениям: (1) прямой или косвенный контакт между инфицированным и восприимчивым человеком, обычно приводящий к загрязнению рук восприимчивого человека, за которым следует контакт с респираторной слизистой; (2) большой аэрозоль с каплями, в котором капельки дыхательной жидкости, превышающие приблизительно 100 мкм в диаметре, высвобождаются с достаточным импульсом для прямого попадания на слизистую оболочку дыхательных путей; и (3) аэрозоли, образующиеся при высвобождении меньших, содержащих вирус капель, которые могут возникать во время приливного дыхания и кашля [1], [2], которые быстро испаряются в остаточные частицы (ядра капель), которые вдыхаются и осаждаются в дыхательные пути [3] — [6]. Для каждого из этих маршрутов имеются существенные доказательства [7], [8], но их относительная значимость неизвестна [3]. В результате Институт медицины рекомендовал, чтобы медицинские работники, контактирующие с пациентами 2009-H1N1, использовали защиту от всех возможных путей заражения, включая использование подходящих респираторов N95 [3]. Через год после пандемии 2009 года не было большей ясности в отношении важности различных способов передачи [9].
Недавно Центры США по контролю и профилактике заболеваний профинансировали экспериментальное исследование передачи от человека к человеку, чтобы устранить этот важный пробел в знаниях [10]. Однако экспериментальное исследование с использованием интраназальной инокуляции для инфицирования экспериментальных доноров [11] должно будет показать, что доноры и люди с естественным заражением проливают подобные вирусные аэрозоли в отношении количества, распределения частиц по размерам и инфекционности, учитывая, что ранее эксперименты предполагали, что интраназальная инокуляция требует количественно больших доз и производит качественно более мягкое заболевание, чем инокуляция через аэрозоль [12].
В контексте гигиены труда личная защита, как правило, является последней инстанцией, после устранения источников и контроля окружающей среды [13]. Таким образом, стоит рассмотреть вопрос о том, эффективны ли хирургические лицевые маски как средство контроля источника. CDC рекомендует лицам с гриппом носить хирургические маски при контакте с чувствительными лицами [14], [15]. Тем не менее, есть только одно сообщение, в котором изучается влияние маски на сдерживание инфекционного крупнозернистого спрея во время заражения гриппом [16], а также данные о воздействии хирургической маски на выброс инфекционных вирусных аэрозолей.
В текущем исследовании пациентов, инфицированных сезонным гриппом, мы описываем количество копий вирусной РНК в двух фракциях размера аэрозоля, сообщают о культурной способности вируса в мелкодисперсной фракции и о влиянии хирургических масок.
Мы провели скрининг 89 добровольцев: 33 (37%) дали положительный результат на грипп, используя экспресс-тест (20 гриппов А и 13 гриппа В), и им было предложено предоставить образцы выдыхаемого воздуха. Также было приглашено восемь дополнительных добровольцев с отрицательными экспресс-тестами, которые сообщили о кашле и которые имели температуру ≥37,8 ° C. Всего было подтверждено, что 38 добровольцев заразились вирусом гриппа ПЦР носоглоточных образцов. Данные о выдыхаемом дыхании с хирургической маской и без нее завершены для 37 из 38 добровольцев (21 грипп A, 16 случаев гриппа B); данные для одного добровольца были исключены из-за лабораторных ошибок при обработке образцов. Один из инфицированных субъектов сообщил о получении вакцины против гриппа в текущем году. Ни один из участников не чихал во время сбора проб. В таблице 1 показаны показатели пола, симптомов и лихорадки, а также тип вируса гриппа, а в таблице 2 приведены описательные статистические данные о количестве копий возрастных и вирусных РНК в мазках и выдыхаемых аэрозольных фракциях 37 добровольцев с подтвержденной инфекцией гриппа. Номера вирусных копий в каждом из пяти экземпляров для всех 37 случаев показаны в таблице S1.
Во время измерения выдыхаемого воздуха.
Во время измерения выдыхаемого воздуха.
Мы обнаружили РНК РНК вируса гриппа в крупной фракции (частицы размером более 5 мкм), собранной у 11% (4 из 37 добровольцев) при ношении хирургических масок и от 43% (16 из 37) при отсутствии маски (относительный риск для обнаружения вируса с маской = 0,25, доверительный интервал 95% (ДИ) 0,09-0,67, тест МакНемара p = 0,003). Среднее количество вирусных копий крупной фракции (рис. 1) было ниже предела обнаружения с помощью лицевых масок и без них; 75-й процентиль снизился с 37 до уровня ниже предела с использованием хирургических масок. Используя анализ Товита, мы подсчитали, что среднее число экземпляров геометрической средней крупной фракции без маски для лица составляло 12 (95% доверительный интервал (ДИ), от 4 до 37) и что эффект лицевых масок заключался в том, чтобы получить статистически значимое сокращение в 25 раз в копии (95% ДИ от 3,5 до 180, p = 0,002) до 50 мкм), которые мы бы не обнаружили. Кроме того, ни один из наших подданных не чихал; эффективный способ получения капель из верхних дыхательных путей. Это может означать, что более мелкие капельки, которые мы обнаружили, были сгенерированы в нижних дыхательных путях и что вирусная нагрузка в этом месте не сильно коррелирует с носоглоточной нагрузкой. Альтернативно, пролитие в аэрозольные капли может приводиться в действие другими факторами хозяина (например, астмой, серьезностью симптомов и иммунным ответом), коинфекцией других агентов, вирусными факторами, влияющими на высвобождение из эпителия, или природой резидентного микробиома. Если пролитие в аэрозоль в значительной степени определяется расположением инфекции в дыхательных путях, это может иметь последствия для экспериментальных исследований передачи [11], [28]. Такие исследования должны будут отслеживать выброс аэрозолей, чтобы определить, приводит ли назальная прививка к донорам аэрозоль, который имитирует зараженную природой инфекцию, чтобы подтвердить экспериментальную конструкцию и помочь интерпретировать результаты.
Большая часть вирусной аэрозоли, которую мы наблюдали, наблюдалась в первые дни симптоматической болезни (таблица 3), что согласуется с исследованиями пролития, контролируемыми носовыми промывками [29]. Мы изучали каждого человека только один раз и по своему составу имели мало данных за день. Дальнейшие продольные исследования генерации вирусных аэрозолей необходимы для подтверждения этих результатов. Новые исследования потребуются для изучения генерации аэрозолей до и в день появления симптомов в общинной инфекции. Ограничением нашего исследования является то, что мы завербовали пациентов с определенными признаками и симптомами или которые были положительными при экспресс-тестировании или имели лихорадку, и поэтому наши данные могут быть предвзятыми к пациентам с более высокими вирусными нагрузками [21]. Тем не менее, мы по-прежнему наблюдали значительные межличностные изменения и моделирование, что случаи с более высокими вирусными нагрузками непропорционально важны в распространении гриппа [30], [31]. Дополнительные исследования также необходимы для определения того, как генерация аэрозолей коррелирует с симптомами (включая более умеренное заболевание), наличием других состояний здоровья, возрастом (мы изучали узкое распределение по возрасту) и коинфекцией других респираторных вирусов, чтобы рекомендации по инфекционному контролю могли критически оцениваться.
Мы приняли на работу добровольцев с гриппоподобной болезнью из сообщества Лоуэлл, штат Массачусетс, прежде всего среди студентов и сотрудников Массачусетского университета, начиная с 29 января и заканчивая 12 марта 2009 года. Протокол исследования был одобрен Институциональными комиссиями по обзору Университета Массачусетс Лоуэлл, больница Лоуэлла и госпиталь Мемориала святых, Лоуэлл, Массачусетс. Устное информированное согласие было получено путем предоставления каждому субъекту подробной формы информации согласия. Сбор подписанной копии формы был отменен, потому что это была бы единственная личная информация, сохраненная этим минимальным рисковым исследованием.
Волонтеры узнали об исследовании с помощью листовок и уведомлений, размещенных в кампусе, и путем направления от поставщиков медицинских услуг. Мы проводили скрининг самозванных добровольцев по телефону на гриппоподобную болезнь (ILI). Лица, которые сообщили о начале лихорадки и кашле в течение предшествующих 72 часов или были направлены поставщиком медицинских услуг, были приглашены в лабораторию для тестирования. Мы собрали носоглоточный образец с помощью флокированного тампона (501CS01, Copan Diagnostics, Murrieta, CA), и температуру брали с помощью цифрового термометра уха (модель 18-200-000, Mabis Healthcare, Waukegan, IL). Все добровольцы с температурой ≥ 37,8 ° C и кашель и добровольцы без лихорадки, которые предоставили носоглоточный образец, положительный для гриппа, методом точечной терапии (QuikVue Influenza A / B, Quidel Corp., San Diego, CA), были приглашены для выдоха образцы дыхательных путей, ответы на вопросник и предоставление второго образца носоглотки для анализа с помощью ПЦР. В анализ данных были включены только испытуемые с инфекцией гриппа, подтвержденные ПЦР.
Каждый волонтер сидел, как показано на лицевой стороне внутри входного конуса пробоотборника воздуха выдыхаемого воздуха человека в кабине, снабженной фильтром HEPA, увлажненным воздухом в течение 30 мин при ношении хирургической маски с ушной петлей. Три раза в течение 30 мин каждый испытуемый просил кашлять 10 раз. После того, как следователи сменили коллекцию, волонтер снова сел в конус, не надев хирургическую маску, еще на 30 мин с кашлем, как и раньше.
Выдыхаемые частицы собирали в течение 30 минут, в то время как испытуемый носил хирургическую маску с ушной петлей (Kimberly-Clark, Roswell, GA), а затем в течение 30 минут без маски. Субъектов просили кашлять 10 раз примерно с 10-минутными интервалами в общей сложности 30 кашля в течение каждого 30-минутного образца. Один субъект часто кашлянул, так что принудительного кашля не требовалось. Никаких субъектов не было чихать.
Сразу же после сбора поверхность имплантации тефлона удаляли и временно хранили при -20 ° C. Импакторы были очищены с помощью флокированного мазка, смоченного фосфатным буферным раствором Дульбекко с кальцием и магнием (Hyclone, Thermo Scientific, Waltham, MA) с 0,1% бычьим сывороточным альбумином (DPBS ++ BSA). Мазок был элюирован в 600 мкл DPBS ++ BSA в течение 1 минуты при встряхивании. Полученный образец хранили при -80 ° С.
Фракцию тонкодисперсных частиц, собранную в буфере DPBS ++ BSA (объем от 100 до 150 мл), поддерживали при 4 ° С и концентрировали ультрафильтрацией с использованием фильтрующих блоков Amicon Ultra 15 с молекулярной массой, отрезанной от 100 кДа (Millipore, Bedford, MA) до объема приблизительно 400 мкл. После ультрафильтрации фильтр промывали 200 мкл DPBS ++ BSA и промывочный раствор объединяли с ретентатом. Образцы хранили при -80 ° C.
Выделение РНК в Trizol-chloroform, обратной транскрипции и количественной ПЦР выполняли, как описано ранее [1], [32]. Количественную ПЦР проводили с использованием системы обнаружения Applied Biosystems Prism 7300 (Foster City, CA) для образцов грубой фракции или LightCycler 480 (Roche, Indianapolis, IN) для фракции мелких частиц. Дублированные образцы анализировали с использованием праймеров гриппа А и В, описанных van Elden et al. [33] Стандартная кривая была построена в каждом анализе с кДНК, извлеченной из запаса гриппа A (A / Пуэрто Рико / 8/1934, Advanced Biotechnologies Incorporated, Columbia, MD) с концентрацией 3,0 × 1011 частиц вируса на мл или запасы гриппа B (B / Lee / 1940, Advanced Biotechnologies Incorporated, Columbia, MD) с концентрацией 8,6 × 1010 частиц вируса на мл, как определено с помощью электронной микроскопии. Результаты выражаются как общее количество частиц вируса по стандартной кривой, округленное до ближайшего целочисленного значения. Пределы обнаружения составили 6 и 11 копий вирусной РНК на лунку qPCR для гриппа A и B соответственно. Образцы тонких частиц от всех испытуемых культивировали для инфекционного вируса на клетках MDCK. Конфлюэнтные клетки в 24-луночных планшетах (Corning, NY, USA) инокулировали 0,1 мл концентрированного образца, разбавленного 1:1 в среде OptiMEM® I (Invitrogen, Carlsbad, California). Планшеты инкубировали при 37 ° С в течение 1 ч с качанием каждые 15 мин и к каждой лунке добавляли 0,8 мл среды OptiMEM® I с 1 мкг / мл TPCK-трипсина и инкубировали в течение 72-96 часов. Клетки ежедневно проверяли на цитопатический эффект (CPE), и если ни один не был обнаружен, два слепых канала выполняли с использованием клеточного супернатанта. В каждом проходе супернатанты тестировали на вирус гриппа анализом гемагглютинации (HA) с использованием 0,5% куриных эритроцитов. Положительные образцы были подтверждены анализом полосок Flu DETECT (Synbiotics, CA, USA) и амплификацией гена гемагглютинации (HA) с помощью RT-PCR с последующим секвенированием.
Мы проанализировали влияние хирургических масок как а) логарифмический относительный риск для производства любых вирусных аэрозолей, предполагающих биномиальное распределение, с использованием обобщенных оценочных уравнений со взаимозаменяемой внутризависимой корреляцией для учета повторных мер и б) среднее геометрическое количество обнаруженных вирусных частиц в выдыхаемом дыхании qPCR и дробное сокращение числа копий с использованием регрессионного анализа Товита на номер копии журнала со случайным эффектом для учета изменчивости между индивидуумами. Анализ Товита также использовался для сравнения крупнозернистых и мелкозернистых фракций. Регрессия Тобита позволяет избежать смещения, которое может возникнуть в результате назначения образцов ниже предела обнаружения определенного значения, такого как нуль или предел, деленный на квадратный корень из 2. Использование хирургической маски было зависимой переменной. Мы также вычислили тест МакНемара для парных образцов для изучения эффекта маски и коэффициента корреляции Спирмена для изучения взаимосвязи между нагрузкой в носоглоточных мазках и аэрозольных фракциях. Статистический анализ проводился с использованием SAS (Procs GenMod, NLMixed, Lifereg, Freq, Corr и средств, версия 9.2, Cary, NC).
Количество копий и тип гриппа в пяти анализируемых образцах на одного субъекта.
Щелкните здесь для получения дополнительных данных.
Мы хотим признать обширный лабораторный вклад Приянки Чинты, без которого это не было бы завершено; Мэтью Ангел и его наставник, Дэниэл Р. Перес, доктор философии, который предоставил экспертную помощь в области вирусной культуры, средства и клетки. Мы также благодарим Ashook Chockalingam, Sara Schloth, Kesava Kalluri, Benjamin Kozak и Linda Haggerty за их время и энергию, посвященные этому проекту, и Ричарда Мартинелло за полезные комментарии к ранним черновикам рукописи.
Читайте также:


