Рецепторы клеток для вирусов
Цикл репродукции вирусов при продуктивной инфекции представляет собой специфическую последовательность событий, приводящих к образованию нового потомства вирионов. Его можно разделить на несколько стадий: адсорбция вирионов на поверхности клетки, проникновение вируса или вирусного нуклеопротеида внутрь клетки, депротеинизация генома, синтез вирусных компонентов, формирование и выход из клетки зрелых вирионов. Иногда не все стадии протекают последовательно и полностью даже при продуктивной инфекции. При заражении вирусной нуклеиновой кислотой отсутствует стадия депротеинизации. Цикл репродукции вируса может прерываться на какой-либо промежуточной стадии, и в этом случае инфекционные вирионы не образуются (абортивная инфекция).
Классическое изучение кривой роста вируса в одном цикле репродукции предполагает одновременное инфицирование клеток культуры с использованием высокой множественности заражения (М=10—100) и определение накопления вируса через определенные промежутки времени.
Прикрепление (адсорбция) вирионов к поверхности клетки - первая стадия вирусной инфекции. Для того, чтобы началась инфекция, вирионы должны быть способны прикрепляться к клетке. Безусловно, этот процесс в организме является более сложным, чем в культуре клеток.
Детальное изучение процесса адсорбции вирусов показало, что он состоит из двух быстро следующих друг за другом периодов — обратимого и необратимого. В период обратимой адсорбции вирус можно удалить с поверхности клетки при обработке версеном, хемотрипсином и другими химическими веществами. При необратимой адсорбции вирус удалить с поверхности клетки не удается.
Первичный контакт с клеткой происходит в результате случайных столкновений вирионов с поверхностью клетки. Количество стабильных прикреплений вириона к клетке во много раз меньше количества случайных столкновений.
В основе прикрепления вируса к клетке лежат два механизма — неспецифический и специфический. Первый из них определяется силами электростатического взаимодействия, возникающими между разноименно заряженными группами, расположенными на поверхности клетки и вируса. В этом процессе, прежде всего, могут участвовать положительно заряженные аминные группы вирусного белка и отрицательно заряженные группы клеточной поверхности. В пользу электростатического взаимодействия между клеткой и вирусом свидетельствуют данные о зависимости присоединения вирионов к клеткам от ионной силы раствора и его рН, наличия в среде одно- и двухвалентных катионов и присутствия отрицательно заряженных групп на поверхности клетки.
Наиболее важным механизмом прикрепления вируса является специфическое взаимодействие рецепторов вируса с комплементарными рецепторами клетки.
Прикрепление происходит за счет связи между вирионными прикрепительными белками на поверхности вирионов и рецепторами на плазматической мембране клеток.
На поверхности вирионов многих семейств вирусов (все РНК-содержащие оболочечные вирусы и аденовирусы) имеются пепломеры (выступы и шипы) длиной от 10 до 30 нм, которые принимают непосредственное участие в прикреплении вируса к клетке. Отщепление пепломеров с помощью протеолитических ферментов приводит к потере вирионами способности адсорбироваться на клетках. На поверхности вирионов, не имеющих пепломеров, находятся участки связывания с клеточной поверхностью, которые отличаются сложным строением и, вероятно, состоят из нескольких полипептидов.
Спектр чувствительности клеток к вирусам в значительной мере определяется наличием соответствующих рецепторов. Рецепторный барьер может быть преодолен при заражении инфекционной нуклеиновой кислотой.
На поверхности клетки может находиться большое количество различных видов рецепторов. Полагают, что каждая клетка может адсорбировать от десятков до нескольких тысяч вирионов. На поверхности одной клетки находится около 10000 рецепторов для полиовируса. Каждый рецептор специфичен для одного или нескольких вирусов, как родственных между собой, так и относящихся к различным таксономическим группам. Например, аденовирус типа 2 и вирус Коксаки ВЗ связываются с одними и теми же клеточными рецепторами.
У герпесвирусов прикрепительными белками могут служить гликопротеины оболочки, которые соединяются с некоторыми рецепторами клетки. Клеточным рецептором для многих ортомиксовирусов являются концевые сиаловые кислоты олигосахаридов, входящих в структуру гликопротеринов или гликолипидов, экспонированных на поверхности клетки. Рецепторами для многих риновирусов являются иммуноглобулины. У вируса ВИЧ в прикреплении первоначально участвуют молекулы СД4, расположенные на поверхности клеток, особенно макрофагов и Т-хелперных лимфоцитов. Подобные взаимодействия рецептор-лиганд свойственны другим лентивирусным инфекциям.
Рецепторы для одних вирусов имеются на клетках нескольких или многих тканей, тогда как для других вирусов они обнаружены на клетках одного вида тканей или в один из периодов онтогенеза (новорожденные или взрослые животные).
Рецепторы клеток способны к регенерации после удаления их протеолитическими ферментами.
Помимо отмеченного свойства различных вирусов присоединяться к одному типу рецептора, выявлена способность одного и того же вируса связываться с различными рецепторами. Так, аденовирусы присоединяются к рецепторам иммуноглобулинового семейства и интегринам (аvβ3 и аvβ5), вирус кори - к рецепторам CD46 и вирус Коксаки - к β2 -микроглобулинам и аvβ3 -интегринам. В процессе проникновения в клетку последнего вируса, относящегося к группе вирусов без наличия суперкапсида - "неодетым", его нуклеокапсид икосаэдрального типа претерпевает конформационные изменения. Посредством каньонов на поверхности вируса, которые образуются в результате таких преобразований, происходит его связывание с рецептором клетки, общим для аденовирусов и вируса Коксаки - CAR (Coxsackie virus-adenovirus receptor), являющимся трансмембранным протеином иммуноглобулинового семейства с двумя внеклеточными доменами молекулярной массой 46 кДа. Интересно, что некоторые штаммы вируса Коксаки В могут использовать для присоединения также рецептор CD55 (рецептор для фактора, усиливающего разрушение - decay-accelerating factor, DAF), который необходим как корецептор семейства интегринов для успешного входа этих вирусов в клетки.
Полиовирус, который также относится к "неодетым" вирусам, связывается со специфическим для него рецептором, названным полиовирусным (hPVR, CD155). Этот рецептор принадлежит к семейству рецепторов, содержащих иммуноглобулиновые внеклеточные домены и экспрессируется в четырех объединенных вариантах α, β, γ и σ. Места, посредством которых этот вирус связывается с клеточными рецепторами, находятся в каньонах нуклеокапсида. У человека, белки полиовирусного рецептора экспрессированы на многих клетках и тканях, включая тонкий кишечник, легкие, печень, сердце, нейроны и мышцы. Указывается, что чувствительность к поливирусной инфекции положительных по наличию этого рецептора мононуклеарных клеток крови может играть важную роль в инвазии вируса в центральную нервную систему. Полиовирусный рецептор также может использоваться для присоединения и других вирусов; таких как, например, вируса α герпеса. В свою очередь, разрушение рецептора либо подавление его функциональной активности приводит к нарушению или даже прекращению адсорбции вируса; что представляет интерес для исследователей, занимающихся вопросами разработки различных фармакологических препаратов.
3. Непосредственное перемещение вируса в клеточной мембране
После адгезии вируса на поверхности клетки начинается процесс перемещения его генома и сопутствующих белков через клеточную мембрану в цитоплазму. Исторически сложилось представление о двух альтернативных механизмах проникновения в клетку вирусов животных — путем виропексиса (эндоцитоза) и путем слияния вирусной и клеточной мембран. Однако оба эти механизма не исключают, а дополняют друг друга.
Виропексис представляет собой частный случай рецепторного или адсорбционного эндоцитоза. Этот процесс является обычным механизмом, благодаря которому в клетку поступают питательные и регуляторные белки, гормоны, липопротеины и другие вещества из внеклеточной жидкости. Рецепторный эндоцитоз происходит в специализированных участках плазматической мембраны, где имеются специальные ямки, покрытые со стороны цитоплазмы особым белком с большой молекулярной массой — клатрином. На дне ямки располагаются специфические рецепторы. Ямки обеспечивают быструю инвагинацию и образование покрытых клатрином внутриклеточных вакуолей. Полупериод проникновения вещества внутрь клетки по этому механизму не превышает 10 мин с момента адсорбции. Количество образующихся в одну минуту вакуолей достигает более 2000. Таким образом, рецепторный эндоцитоз представляет собой хорошо слаженный механизм, который обеспечивает быстрое проникновение в клетку чужеродных веществ.
Покрытые вакуоли сливаются с другими, более крупными цитоплазматическими вакуолями, образуя рецептосомы, содержащие рецепторы, но не содержащие клатрин, а те в свою очередь сливаются с лизосомами. Таким путем проникшие в клетку белки обычно транспортируются в лизосомы, где происходит их распад на аминокислоты; они могут и миновать лизосомы, и накапливаться в других участках клетки в недеградированной форме. Альтернативой рецепторного эндоцитоза является жидкостный эндоцитоз (пиноцитоз), когда инвагинация происходит не в специализированных участках мембраны.
Большинство вирусов животных (с суперкапсидом и без него) проникает в клетку по механизму рецепторного эндоцитоза. Эндоцитоз обеспечивает внутриклеточный транспорт вирусной частицы в составе эндоцитарной вакуоли, поскольку вакуоль может двигаться в любом направлении и сливаться с клеточными мембранами (включая ядерную мембрану), освобождая вирусную частицу в соответствующих внутриклеточных участках. Таким путем, например, ядерные вирусы попадают в ядро, а реовирусы — в лизосомы. Однако проникшие в клетку вирусные частицы находятся в составе вакуоли и отделены от цитоплазмы ее стенками. Им предстоит пройти ряд этапов, прежде чем они смогут вызвать инфекционный процесс.
Слияние вирусной и клеточной мембран.
Для того чтобы внутренний компонент вируса мог пройти через клеточную мембрану, вирус использует механизм слияния мембран. У вирусов, имеющих суперкапсид, слияние обусловлено точечным взаимодействием вирусного белка слияния с липидами клеточной мембраны, в результате которого вирусная липопротеидная оболочка интегрирует с клеточной мембраной, а внутренний компонент вируса оказывается по другую ее сторону. У вирусов, не имеющих суперкапсид, один из поверхностных белков также взаимодействует с липидами клеточных мембран, в результате чего внутренний компонент проходит через мембрану. Большинство вирусов животных выходит в цитозоль из рецептосомы.
Общая схема проникновения вирусов с суперкапсидом в клетку:
Слева — эндоцитоз и слияние в эндосоме: 1 — вирус, 2 — эндосома, 3 — ядро; справа— слияние с плазматической мембраной.
С позиций современной вирусной цитопатологии, классификация механизмов проникновения вирусов через плaзматическую мембрану пересмотрена в соответствии с открытием новых порталов для попадания питательных веществ в клетку. На данный момент выделяют пять регулируемых порталов: фагоцитоз, пиноцитоз, подразделяемый на макропиноцитоз и различные типы эндоцитоза - клатрин-опосредованный (размер образованной вакуоли
120 нм), кавеолин-опосредованный (
60 нм), кавеолин- и клатрин-независимый эндоцитоз (
90 нм). Для вирусов присущи все вышеозначенные пути проникновения, поэтому необходимо более точное описание указанных порталов.
· Фагоцитоз у млекопитающих характерен для специализированных клеток моноцитов, макрофагов и нейтрофилов - и в этот процесс вовлекаются специфические рецепторы и последующий сигнальный каскад опосредуется определенными семействами ферментов - гуанинтрифосфатаз (ГТФазы). Данные ферменты играют ключевую роль для классификации порталов питательных веществ в клетки млекопитающих. Это большая группа ферментов, которые участвуют в связывании гуанинтрифосфатов и подвергаются конформационным изменениям при гидролизе гуанинтрифосфата в гуаниндифосфат в присутствии ионов Mg 2+ . Наибольший интерес представляет семейство мономерных ГТФаз сигнальной каскадной трансдукции и движения (signal transduction cascades and motility, Ras), которые по химической структуре подразделяют на девять групп: Rho (А, В, С изоформы фермента), Rac (1, 2, 3 изоформы), Rab, Cdc42 (G25K, Cdc42Hs изоформы), RhoD, RhoG, TC10, Rnd (Rndl, RhoE/Rnd3, Rnd6) иTTF. Причем каждая группа участвует в определенных функциях клетки. Так, при фагоцитозе активируется Rhо-грyппа ГТФаз, связанная с актиновыми структурами цитоскелета, а ее инициация происходит при стимуляции рецепторов плазмалеммы. Rab-грyппа участвует в перемещении уже сформированных везикул в цитоплазме клеток. Таким образом, при фагоцитозе необходима стимуляция рецепторов клетки, после чего активируется Rhо-группа ГТФаз, приводящая в движение актиновые структуры цитоскелета.
· В сигнальный каскадный макропиноцитоз также вовлекается Rhо-группа ГТФаз, которая запускает актин-зависимое формирование выступов мембраны. В отличие от фагоцитоза выступы плазмалеммы не соединяются по принципу "молнии" с лигандами поверхности поглощенной частицы, а формируют большую эндоцитарную вакуоль. Мембрана этой вакуоли не связана с поверхностью поглощаемых частиц.
· Кавеолин-опосредованный эндоцитоз характеризуется образованием кавеол, которые формируются на специфичных участках плазмалеммы, где сконцентрированы разнообразные сигнальные молекулы, а также молекулы, ответственные за транспорт в плазмалемме клеток. Формирование этих структур связано с определенными липидными участками плазмалеммы в жидкой фазе, обогащенными холестеролом и ориентированными во внутрь мембраны сфингомиелинами и гликосфинголипидами. После интеграции белка кавеолина 1 с этим участком плазмалеммы, происходит инвагинация последней в форме небольшой фляжки, которая называется кавеолой. Кавеолин 1 - это мономер, который при стимуляции собирается в дискретный гомо-олигомер, включающий 14-16 кавеолиновых молекул. Смежные гомо-олигомеры упаковываются в пределах мембраны кавеолы, тем самым, обеспечивая структурную сеть для ее дальнейшего формирования. Причем поглощенный материал химически связан с рецепторами мембраны клетки.


Почему дети болеют меньше? Формируется ли иммунитет к коронавирусу? Главный инфекционист Минздрава Елена Малинникова ответила на вопросы, которые больше всего волнуют читателей.
— Насколько устойчив новый коронавирус во внешней среде?
— Устойчивость вируса оценивается. При передаче от человека к человеку любой вирус может приобретать активность или угасать. В принципе, по своей структуре новый коронавирус не очень устойчив, он сохраняется в окружающей среде в условиях от 7 до 7,5 PH. Если среда чуть кислее или чуть щелочнее, он не будет сохраняться. Плюс вирус прекрасно уничтожается дезсредствами. Через 10 мин его убивает ультрафиолетовое облучение. Но остается достаточно серьезная проблема в том, что вирус может хорошо сохраняться на поверхностях, если, скажем, это бумага, картон, пластик. Сколько времени он сохраняется? По разным данным, до 7-9 или 12 часов. Но это только при определенной температуре и влажности.

— Точно ли дети меньше болеют?
— Вирусы, которые вызывают ОРВИ, имеют определенную специфику. Попадая в организм человека, они не могут просто так поражать какие-то клетки. Коронавирусы, как и вирусы гриппа, поражают исключительно клетки эпителия верхних дыхательных путей, легких, кишечника, которые имеют к ним особые рецепторы. И это свойство вирус и приобрел, когда появился в человеческой популяции, преодолев межвидовой барьер.
Сейчас трудно сказать, сколько животных прошел вирус до человека. Но преодолеть межвидовой барьер вирусу очень сложно. Это долгий процесс — найти ту клеточку, куда он может прикрепиться у человека. Скорее всего, эта инфекция начала циркулировать в КНР не в декабре 2019 года. А вирус появился чуть раньше. И только в декабре китайские коллеги заявили о первом 41 больном. А с 13 января он стал циркулировать за территорией КНР.

Однако постоянно появляются новые данные о возможностях вируса. Поначалу считалось, что вирус передается только от одного человека к другому, а от него дальше, к третьему, четвертому пятому, — нет. Сейчас это тоже проверяется. Важно понимать: когда вирус находит свою популяцию, где он будет циркулировать, вирулентность, то есть токсичность, заразность его падает. Так что новый коронавирус просто занял свою нишу среди других вирусов, циркулирующих в человеческой популяции. Вообще же более 200 вирусов вызывают ОРВИ.
— Насколько эффективен карантин? Некоторые говорят, что он бесполезен.
— Наша задача — не допустить тяжелых и летальных исходов от инфекции. Для этого необходимо, чтобы люди из группы риска, которые дают такие тяжелые реакции, не имели тесного контакта с людьми, которые способны перенести инфекцию на ногах либо не болеть вообще. Задача карантина — разобщение. Это на сегодня лучшее средство профилактики. Если мы не будем распространять инфекцию в популяции, заболеваемость пойдет не по критической линии, а плавно охватит определенный контингент населения, плавно иммунизирует популяцию. Да, потом мы будем встречаться с этой инфекцией. Но будет ли вирус так активен, как его брат SARS или как MERS, которые мы периодически диагностируем, но немного? И насколько он останется активным на следующий сезон? Пока вопросы остаются.
Мы никогда не заражаемся одним вирусом. Мы заражаемся облаком разнообразных вирусов. Как они себя поведут, зависит от организма. Зависит и от того, какое количество вируса попало в организм. Рискуют больше всего пожилые люди с сердечно-сосудистыми заболеваниями и дыхательными.

— Формируется ли иммунитет к коронавирусу?
— Это называется проэпидемичивание населения. Когда появились первые выздоровевшие, стали говорить, что иммунитет после перенесенной инфекции нестоек. Сейчас мы наблюдаем циркуляцию двух вариантов вируса — S-варианта и L-варианта. Возможно, они не дают перекрестного иммунитета. Когда закончится эпидемия, вирус пройдет через человеческую популяцию, мы сможем сказать, насколько он формирует ответ иммунитета, а также уточнить показатели летальности. Сейчас смертность в среднем 3,9%, а среди пожилых достигает 20%.
В Китае эпидемия продлилась примерно сто дней. Но этот прогноз нельзя распространять на другие страны. Вообще мы не может сказать, как быстро распространяется инфекция. Те беспрецедентные меры профилактики, которые применили в КНР, не дали понимания, как эпидемия могла бы развиваться в обычных условиях. И как неожиданно инфекция стала развиваться в индустриально развитых странах. Мы не видим развития инфекции в странах, где даже, условно, хлорирование воды не практикуется. У нас в советские годы была система тотального противоэпидемического контроля. В Италии такого тотального контроля нет. Плюс туда стекается много туристических путей. Все это сыграло роль в росте заболеваемости. Но это все предварительные выводы. Многие иностранные коллеги хотят, чтобы мы поделились опытом, как мы справляемся с этой инфекцией.

— Раньше диагноз ставили после третьего теста на вирус. Сейчас говорят, что достаточно одной.
86. 1. Определение, химический состав вирусов, функции компонентов.
Функция нуклеиновой кислоты вируса: …
Функция белков вирусных частиц: …
Размножение вирусов, синтез их нуклеиновых кислот.
Где размножается вирус?
О видах вирусов
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
Как вирусная частица попадает в клетки.
Что происходит с вирусной частицей после её попадания в клетку.
86. 3. Онкогенные вирусы. См. п.87.
86. 4. ВИЧ. См. п.77 и 80.
86. 5. Прионы.
86. 1. Определение, химический состав вирусов, функции компонентов. –
Опеределение вируса.
Вирусами называют КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ С БЕЛКАМИ,
которые могут находиться во внешней среде вне клеток и
могут при попадании в организм проникать в клетки и размножаться внутри клеток.
Некоторые вирусы вдобавок к НК и белкам содержат липиды и углеводы.
Таким образом, вирусы не являются клетками, у вирусов нет органелл.
Отдельный комплекс нуклеиновых кислот с белками называется вирусной частицей или вирионом.
Функция нуклеиновой кислоты вируса:
нуклеиновые кислоты используются для синтеза белков вирусных частиц (кодируют первичную структуру белка).
Функция белков вирусных частиц:
1 – защищают НК от повреждений (НК сами по себе очень неустойчивы), образуя оболочку вокруг НК,
2 – участвуют в размножении вирусов в качестве ферментов и т.д. см. далее.
Углеводы вирусных частиц часто находятся на поверхности вирусных частиц и могут помогать вирусным частицам проникать в клетки.
Отдельная вирусная частица и вирусные частицы данного вида вирусов содержат только один вид НК – или ДНК, или РНК.
Вирусы, в вирионе которых находится ДНК, называются ДНК-овые вирусами,
а вирусы, в вирионе которых находится РНК, называются, РНК-овыми вирусами.
ДНК вируса может быть не только двухцепочечной, но и ОДНОЦЕПОЧЕЧНОЙ.
РНК вируса может быть как одноцепочечной (как в клетках), так и ДВУХЦЕПОЧЕЧНОЙ.
Размножение вирусов, синтез их нуклеиновых кислот.
Синтез нуклеиновых кислот вирусов происходит разными способами. –
1) Наряду с репликацией ДНК (см. п. 78),
2) у вирусов есть репликация РНК
3) и обратная транскрипция (см. п.80).
Какой бы ни была нуклеиновая кислота в самом вирионе,
при размножении вируса происходит синтез вирусных матричных РНК для синтеза вирусных белков (для трансляции).
Где размножается вирус?
Синтез вирусных нуклеиновых кислот и синтез вирусных белков может происходить только внутри клеток,
так как для синтезов нужны среда, рибосомы (осуществляются синтез белка), нуклеотиды и аминокислоты и т.д.
Поэтому размножаться вне клеток вирусы не могут. –
Пока вирус не проник в клетку, он не может размножаться, не может как-то влиять на обмен веществ в организме.
Поэтому наличие вируса (вирионов) в крови
не означает, что человек будет болеть болезнью, которая вызывается этим вирусом.
Он может заболеть, только если вирусные частицы проникнут в клетки,
а если они не проникнут в клетки, то человек не заболеет, хоть и будет носителем вируса.
О видах вирусов
Вирусы, содержащие разные нуклеиновые кислоты (то есть с разными последовательностями нуклеотидов) и разные белки, относят к разным видам вирусов.
Вирусные частицы с одинаковыми (или очень похожими) последовательностями нуклеотидов в НК, относятся к вирусу одного и того же вида.
Кроме того, последовательность нуклеотидов нуклеиной кислоты вируса данного вида
может меняться, то есть вирус может мутировать.
В итоге получается другой ШТАММ данного вида вируса, но сам вирус относится к тому же виду вирусов, что и до мутации.
Вирусы, которые поражают бактерии, называются БАКТЕРИОФАГАМИ.
Бактериофаги могут использоваться для внесения в клетку бактерии чужих для неё генов для синтеза клеткой белков, кодируемых этими генами,
То есть бактериофаги могут играть роль векторов – это используется генной инженерией.
В эукариотические клетки вирусы попадают не так, как в бактериальные (далее).
86. 2. (Молекулярные механизмы действия вирусов.)
Реакция иммунной системы на обнаружение вируса.
При попадании вирусной частицы в организм её должны заметить и уничтожить клетки иммунной системы
(с помощью АНТИТЕЛ – специальных белков, задача которых – распознавание антигенов)
для того чтобы вирус не успел проникнуть в клетку, размножиться в ней, убить её и заражать новые клетки.
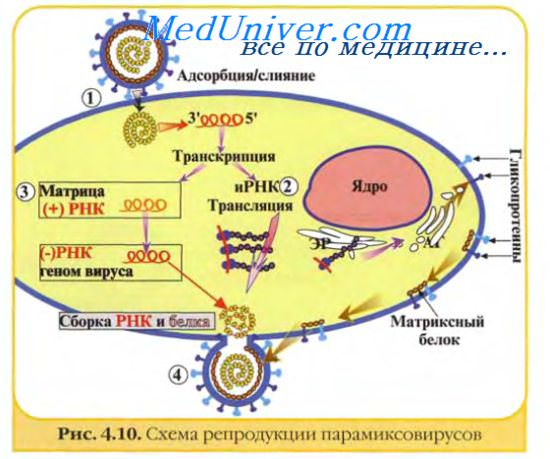
Как вирусная частица попадает в клетки.
Проникновение вирусной частицы в клетку начинается с того, что
вирус связывается с определённым белком на поверхности клетки,
который таким образом выполняет функцию РЕЦЕПТОРА клетки для этого вируса.
Роль рецептора вируса обычно играют белки, предназначенные для других целей –
например, ВИЧ использует рецепторы хемокинов.
Если рецепторы вируса отличаются от обычных так, что вирус не может с их помощью проникнуть в клетку, то вирус не приведёт к заболеванию.
Причиной отличия рецептора может быть мутация гена, который кодирует этот рецептор.
Что происходит с вирусной частицей после её попадания в клетку.
После попадания вирусной частицы внутрь клетки
вирусная нуклеиновая кислота высвобождается, после чего
могут синтезироваться новые молекулы вирусной нуклеиновой кислоты (см. п.77)
и новые молекулы вирусных белков (п.82).
После этого из молекул вирусных нуклеиновых кислот и молекул вирусных белков
могут образовываться новые вирусные частицы –
так происходит РАЗМНОЖЕНИЕ ВИРУСОВ.
Новые вирусные частицы могут покидать клетку, в которой образовались,
и поступать в новые клетки, заражая всё новые и новые клетки.
Если заражённые вирусом клетки подвергнутся АПОПТОЗУ (см. п. 79),
то распространение вирусных частиц может затормозиться.
Поэтому замедленный апоптоз способствует распространению вирусной инфекции.
Накопление вирусных частиц в клетке может приводить к РАЗРУШЕНИЮ КЛЕТКИ;
кроме того, оно нарушает нормальную жизнедеятельность клетки и организма –
всё это приводит к появлению симптомов вирусной инфекции.
Нуклеиновые кислоты некоторых вирусов (см. ВИЧ далее) могут использоваться
в качестве матриц для образования двухцепочечных ДНК (вирусных ДНК),
которые способны встраиваться в ДНК человека –
это встраивание называется интегрированием в геном,
оно относится к ПЕРЕСТРОЙКАМ генома – см. п.79.
86. 3. Онкогенные вирусы. См. п.87.
Некоторые вирусы способствуют появлению онкологических заболеваний.
Такие вирусы называются онкогенными вирусами.
Примеры онкогенных вирусов:
вирус папилломы человека способен приводит к раку матки,
вирусы гепатитов В и С приводят к раку печени.
Онкогенные вирусы относят к группе биологических мутагенов – см. п.79.
Почему некоторые вирусы могут приводить к онкологическим заболеваниям (см. п.87 и п.92, 98):
потому что онкогенные вирусы приводят к таким МУТАЦИЯМ,
которые способствуют появлению онкологических заболеваний.
Например, считается, что онкогенными являются те вирусы,
которые приводят к встраиванию вирусных ДНК в ДНК (геном) человека (интегрируется).
Потому что это встраивание может изменить тот участок ДНК,
в который встраивается вирусная ДНК (то есть привести к мутации).
В норме, до мутации, протоонкоген кодирует белки, которые стимулируют деление клеток и относятся к онкобелкам.
В норме активность онкобелков регулируется,
поэтому они стимулируют деление клетки только тогда, когда нужно –
и поэтому деление клетки (и образованных при её делении клеток) не приводит к образование опухоли.
Но после мутации протоонкогена он может измениться так, что
кодируемые им онкобелки не смогут регулироваться
и станут стимулировать деление клетки постоянно, без остановки,
что может привести к появлению опухоли,
если мутантные клетки не подвергнутся апоптозу
или не уничтожатся клетками иммунной системы.
86. 4. ВИЧ. См. п.77 и 80.
ВИЧ – это вирус иммунодефицита человека.
Размножение ВИЧ в организме человека может привести к развитию СПИДа –
Синдрома Приобретённого Иммунодефицита Человека.
ВИЧ повреждает клетки иммунной системы (Т-хелперы, макрофаги),
что приводит к дефициту иммунных клеток и снижению иммунитета (иммунодефициту).
1. После попадания ВИЧ в организм человека
ВИЧ, как и все вирусы, сначала связывается с рецепторами на поверхности клеток:
ВИЧ связывается с рецепторами хемокинов
(хемокиновыми рецепторами;
хемокины – это гормоны, относятся к цитокинам)
и СД4 рецепторами на поверхности клеток иммунной системы.
Связыванию ВИЧ с рецепторами помогают гликопротеины, расположенные на поверхности вирусной частицы ВИЧ.
Есть люди, в организме которых есть ВИЧ, но у которых не развивается СПИД –
то есть они являются носителями вируса, они могут заразить ВИЧ,
но больными они не являются.
Предполагают, что это связано с тем, что ВИЧ не может размножаться в организме этих людей,
поскольку не проникает в их клетки из-за особенностей строения рецепторов ВИЧ у этих людей:
возможно, из-за мутаций генов, кодирующих эти рецепторы.
2. В качестве нуклеиновой кислоты в ВИЧ содержится одноцепочечная РНК.
В клетках РНК вируса становится матрицей для синтеза комплементарной ей цепи ДНК
(комплементарной ДНК, кДНК),
который катализируется ферментом обратная транскриптаза
(потому что синтез ДНК на матрице РНК называется обратной транскрипцией),
который содержался в вирусной частице ВИЧ.
Затем на матрице первой цепи ДНК синтезируется вторая цепь ДНК,
в результате чего образуется двухцепочечная ДНК.
Эта вирусная ДНК способна встраиваться в ДНК человека
с помощью фермента ИНТЕГРАЗЫ, который тоже содержится в вирусной частице ВИЧ.
3. В некоторый момент вирусная ДНК, находящаяся в составе ДНК человека,
может использоваться для синтеза вирусных РНК (то есть для транскрипции – п.80).
4. Вирусные РНК могут использоваться для синтеза вирусных белков (для трансляции) с помощью рибосом самой клетки.
5. Один из ферментов ВИЧ осуществляет расщепление полипептидной цепи, синтезированной на вирусной РНК;
этот фермент называется ПРОТЕАЗОЙ.
В итоге образуются вирусные белки, в том числе уже названные протеаза, интеграза и обратная транскриптаза.
6. Объединение вирусных белков с вирусной РНК приводит
к появлению новых вирусных частиц ВИЧ,
которые могут разрушать клетки, поступать в кровь и проникать в новые клетки.
Диагностика ВИЧ
осуществляется методом ПЦР и с помощью иммуноферментного анализа.
Метод ПЦР быстрее и надёжнее.
СПИД пока считается неизлечимым заболеванием.
Но замедлить развитие СПИДа и продлить жизнь человека, инфицированного ВИЧ, можно за счёт замедления размножения ВИЧ в организме заражённого.
Размножение ВИЧ замедляется за счёт применения лекарств,
снижающих активность ферментов ВИЧ, участвующих в размножении ВИЧ (см. выше),
то есть за счёт применения ИНГИБИТОРОВ ферментов ВИЧ.
Чем раньше начинают лечение инфицированного ВИЧ – тем дольше он проживёт. Поэтому важно вовремя делать анализ на ВИЧ при наличии оснований предполагать, что человек мог заразиться ВИЧ.
При наличии ВИЧ у беременной есть шанс родить здорового ребёнка,
если вовремя сделать анализ на ВИЧ и провести лечение.
Прионами называют белки с особой структурой, которая приводит к так называемым прионовым болезням:
куру, болезни Крейцфельдта-Якобы, почесухе овец, коровьему бешенству.
У прионов есть способность
превращать молекулы нормальных белков в прионы
за счёт того, что под влиянием структуры уже имеющихся молекул прионов
структура молекул ряда других белов может измениться так,
что эти молекулы тоже становятся прионами –
нерастворимыми в воде молекулами,
под влиянием которых могут стать прионами другие молекулы белков –
то есть происходит как бы цепная реакция;
из-за этого число прионов в организме становится всё больше.
Из-за этого свойства прионы считаются инфекционными белками,
а прионовые болезни считаются заразными
(заражение происходит при попадании прионов в организм – обычно в качестве пищи).
В случае с прионами увеличение числа болезнетворных молекул
происходит не путём деления клеток
(в отличие от бактериальных и других инфекций, где бактерии размножаются делением)
и не путём синтеза нуклеиновых кислот (см. выше о размножении вирусов),
а под влиянием уже имеющихся молекул прионов.
Прионы могут оказаться в организме не только в результате заражения
(не только при съедении пищи, содержащей прионы),
но и в результате мутаций генов некоторых белков.
Из-за своей структуры прионы не уничтожаются и не теряют свои вредные свойства при сколь угодно долгой варке, поэтому варка не является способом сделать пищу безопасной и свободной от прионов. Единственный способ исключить возможность заражения прионами при эпидемиях коровьего бешенства – это не употреблять в пищу мясо, тушёнку, консервы, желатин и т.д.А единственный способ уничтожить прионы - только сжечь. Прионы устойчивы и к действию других факторов, которые разрушают структуру обычных белков, то есть прионы устойчивы к денатурации под действием излучений, ультразвука и т.д.
Читайте также:


