Ротавирусы классификация характеристика микробиология
11 геномных сегментов ротавирусов кодируют 13 белков, 2 из которых образуются в результате посттрансляционного расщепления.
Данные по характеристике белковой композиции ротавирусов основном получены на модели ротавирусов животных, в частности обезьян, крупного рогатого скота и свиней, которые адаптированы к культуре клеток и накапливаются в высоких титрах.
В вирионах ротавирусов обнаружено шесть полипептидов (VP1, VP2, VP3, VP4, VP6 и VP7) с молекулярной массой от 37 до 125 кД, один из которых (VP7) гликозилирован.
Два белка VP4 (90 кД) и VP7 (36-38 кД) являются компонентами наружного капсида и не обнаруживаются в однокапсидных частицах. Другие белки образуют внутренний капсид или ассоциированы с сердцевиной вируса. Мажорным белком вириона является полипептид внутреннего капсида VP6 (42 кД). Три белка VP1, VP2 и VP3 входят в состав сердцевины.
Полипептиды наружного капсида ротавирусов представляют особый интерес, поскольку играют основную роль в возникновении инфекционного процесса и развитии иммунитета. Они ответственны за осуществление ранних этапов взаимодействия вирионов с чувствительными клетками - адсорбцию и проникновение, с ними связывают вирулентность ротавирусов. Эти же белки (VP7 и VP4) вызывают образование специфических вируснейтрализующих антител. Они ответственны за иммуногенность ротавирусов. Вирусоподобные частицы ротавирусов, содержащие основные иммуногенные белки, могут служить своеобразными компонентными вакцинами.
Белок VP7 является основным протективным антигеном ротавирусов, ответственным за образование ВН-антител. С помощью моноклональных антител (МАТ) в его составе обнаружен большой домен нейтрализации, включающий несколько перекрывающихся эпитопов. Гликозилирование VP7 - необходимое условие для взаимодействия с клетками-мишенями и проявления инфекционности.
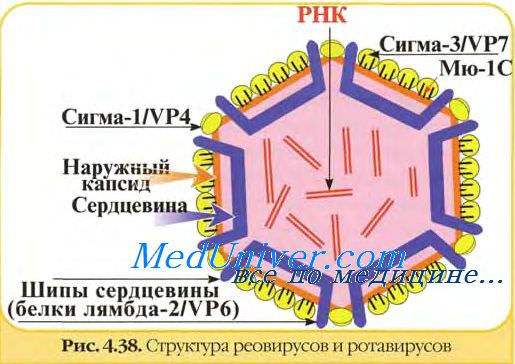
Другим важным белком наружного капсида является VP4. Он ответственен за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на уровне организма, к тому же является вирусным гемагглютинином и, по-видимому, осуществляет некоторые функции, что и гемагглютинин вируса гриппа, то есть является вирусным белком, обеспечивающим проникновение вируса в клетку. Гемагглютинирующий и нейтрализующий домены находятся в N-концевой половине VP4 ротавируса.
В отличие от гемагглютинина орто- и парамиксовирусов, гемагглютинин ротавирусов не является гликопротеином, хотя в первичной структуре этого белка обнаружены потенциальные сайты гликозирования. В результате протеолиза от полипептида VP4 отщепляется фрагмент — VP8, в котором обнаружено пять нейтрализующих эпитопов.
Нейтрализующие моноклональные антитела к VP7 и VP4 сообщали протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса. Способность VP4 и VP7 к независимой и гетеротипической индукции синтеза протективных антител может иметь важное значение при конструировании современных ротавирусных вакцин.
Сравнительное изучение антигенных свойств ротавирусов различными методами показало наличие у них общих групповых антигенов. Групповое сходство определяется антигенной общностью внутреннего капсида, а антигенная специфичность связана с белками наружного капсида. Ротавирусы разделяют на группы, субгруппы и серотипы. Белки наружного капсида содержат типоспецифические антигенные детерминанты, а внутреннего — группоспецифические и субгруппоспецифические антигенные детерминанты. Групповая принадлежность определяется антигенной общностью белка VP6, субгрупповая — его антигенными различиями. Гликопротеин VP7 (главный белок нейтрализации) является типоспецифическим антигеном ротавирусов и определяет их серотиповую принадлежность. Серотиповая специфичность отличается высокой консервативностью. Критерием антигенного различия вирусов принята 20-кратная или большая разность титров вируса в РН с гомологичными и гетерологичными антителами.
Исходя из наличия общего группоспецифического антигена (VP6), все ротавирусы, независимо от вида естественного хозяина, разделены на шесть антигенных групп: А, В, С, D, Е и F. Наиболее многочисленна группа А, представители которой играют существенную роль в патологии человека и животных.
Большинство ротавирусов человека и животных относят к группе А, включающей так называемые типичные ротавирусы. Ротавирусы других групп называют атипичными, или параротавирусами. Они изучены недостаточно, поскольку, за небольшим исключением, их пока не удалось размножить in vitro. Каждая группа ротавирусов на основании типоспецифических антигенов делится на серотипы. Так, ротавирусы группы А разделены на 11 серотипов, получивших название G-серотипы.
В другие антигенные группы также входят ротавирусы, поражающие различных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно различаться между собой в антигенном отношении, что представляют различные антигенные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выделенные от различных видов животных, часто имеют более тесную антигенную связь, чем штаммы различных серотипов, выделенные от одного вида животных.
В группу В входят ротавирусы человека, крупного и мелкого рогатого скота, в группу С — человека и свиней, группы Е и F — свиней, группу D — птиц. В настоящее время различают не менее четырех серотипов ротавируса человека. Известно о существовании не менее трех серотипов ротавирусов группы А свиней. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В, С, Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов крупного рогатого скота и других животных. В перекрестной реакции нейтрализации тесное антигенное родство выявлено между ротавирусами обезьян и свиней, а также между ними и ротавирусами крупного рогатого скота. Гомология первичной структуры VP7 различных серотипов достигает 71—85%. Различная степень антигенного родства по VP4 обнаружена между ротавирусами, выделенными от свиней, человека, обезьян и собак. Штамм (АН-1), выделенный от человека, характеризовался высокой гомологией с ротавирусом, выделенным от кошек (FRV-1). От крупного рогатого скота с диареей выделен ротавирус, геномная РНК которого была аналогична ротавирусу птиц. Ротавирусы человека и свиней имели высокую степень гомологии нуклеотидных последовательностей и, возможно, могли иметь общего предка.
Ротавирусы обезьян, свиней и кроликов легко инфицировали телят в экспериментальных условиях. Ротавирус человека вызывал летальную инфекцию у новорожденных поросят при оральном заражении. Существуют ротавирусы, обладающие двойной субгрупповой специфичностью. Такая уникальная способность обнаружена, например, у ротавируса лошадей (штамм FI-14), который взаимодействовал с антителами первой и второй субгрупп. Известен штамм ротавируса свиней с двойной серотипоспецифичностью (G3 и G5). Природа антигенного полиморфизма у ротавирусов пока не выяснена. Приведенные выше данные свидетельствуют о возможности пересечения ротавирусами видовых барьеров и их миграции между различными классами и видами млекопитающих в естественных условиях.
В последнее время у кур, свиней и человека были обнаружены атипичные ротавирусы, не имеющие группоспецифического антигена, несмотря на типичную для ротавирусов морфологию. Они были названы параротавирусами. Атипичные штаммы были обнаружены в 5% случаев при ротавирусных инфекциях у свиней и в 1% — ротавирусных диареях у крупного рогатого скота. При изучении с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и типичных ротавирусов. Параротавирусы свиней, в отличие от ротавирусов, вызывают образование синцития из энтероцитов в тонком кишечнике. Хемопротеин в тонком отделе кишечника удаляет наружный капсид ортореовирусов и ротавирусов и повышает их эффективность.
Колтивирусы и аквареовирусы по структуре и свойствам практически не отличаются от свойств, присущих семейству.
Название рода связано со своеобразием морфологии вирионов (лат. rota - колесо).
Возбудитель был обнаружен впервые в 1973 г. в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки детей с острым гастроэнтеритом.

Культивирование и репродукция. Ротавирусы человека в отличие от ротавирусов животных плохо адаптируются к культуре клеток. Однако их культивируют в роллерных культурах первичных и перевиваемых почечных клеток зеленых мартышек. ЦПД характеризуется уплотнением и округлением клеток, объединением их в конгломераты, соединенные между собой тяжами. Процесс репродукции ротавирусов протекает так же, как и у других реовирусов.
Антигены. По антигенному составу ротавирусы человека и животных очень близки между собой. Их перекрестные антигенные связи позволяют использовать ротавирус телят (Небраски) и обезьян в качестве антигена для серологической диагностики ротавирусной инфекции, а также для получения диагностических сывороток. По антигенным свойствам ротавирусы разделены на 3 подгруппы и 4 серотипа. Перекрестные антигенные связи между ротавирусами, рео-вирусами и орбивирусами не обнаружены. Гликопротеин наружного капсида ротавирусов определяет их гемагглютинирующие свойства и типовую антигенную специфичность.
Патогенез. Ротавирусы являются возбудителями гастроэнтеритов новорожденных и детей более старшего возраста. У взрослых наблюдаются легкие формы заболевания. Первичная репродукция вируса происходит в цитоплазме энтероцитов тонкой кишки. При этом микроворсинки щеточной каймы клеток укорачиваются, становятся неровными или полностью исчезают. Нарушается процесс всасывания простых Сахаров. Воспалительные явления усиливают перистальтику кишечника, что способствует развитию диарейного синдрома и появлению рвоты.
Иммунитет. В организме больных вначале появляются антитела класса IgM, которые через 2-3 недели сменяются IgG. Существенное значение в местном иммунитете принадлежит секреторным иммуноглобулинам IgA. Вируснейтрализующие антитела класса IgG способны проходить через плаценту. Они играют определенную роль в создании пассивного иммунитета в первые 6 мес. после рождения ребенка. Комплементсвязывающие антитела быстро исчезают после перенесения заболевания, вируснейтрализующие сохраняются десятилетиями.
Эпидемиология. Источником заражения являются больные с острой и бессимптомной формами инфекции, а также вирусоносители. Механизм заражения фекально-оральный. Наиболее опасны больные в первые 3-5 дней заболевания, когда в фекальных массах накапливается максимальное количество вируса. Через 7-8 дней после начала заболевания выделение вируса прекращается. Ротавирусы обладают сравнительно высокой устойчивостью к физическим и химическим факторам внешней среды. Ротавирусы вызывают в 40-60% случаев острый гастроэнтерит у детей в возрасте от 1 года до 6 лет, а также внутрибольничные вспышки гастроэнтерита в палатах для новорожденных. Реже заболевание регистрируется у подростков 10-12 лет. По данным ВОЗ, во всем мире от ротавирусного гастроэнтерита ежегодно погибают от 1 до 3 млн. детей.
Профилактика проводится в ряде стран путем иммунизации детей инактивированной вакциной.
Лабораторная диагностика. Проводится путем выявления вируса в фекальных массах больных в 1-ю неделю заболевания, с од- ной стороны, и регистрации нарастания титра антител в парных сыворотках от больных - с другой. Ротавирусы обнаруживаются в фекальных массах в 100% случаев в первые дни заболевания с помощью иммунной электронной микроскопии. Вирусный антиген в фекалиях выявляют иммуноферментным и радиоиммунным методами, в реакции иммунофлюоресценции, а также с помощью нуклеиновых зондов. Вирусы могут быть выделены в культурах клеток в первые дни болезни. Серологическую диагностику проводят в реакциях нейтрализации вируса в культуре клеток, РСК, а также в РТГА с эритроцитами человека группы 0. В качестве диагностикума используют ротавирусы обезьян или телят.

Учебник предназначен для студентов, аспирантов и преподавателей высших медицинских учебных заведений, университетов, микробиологов всех специальностей и практических врачей.
5-е издание, исправленное и дополненное
Книга: Медицинская микробиология, иммунология и вирусология
Ротавирусы
Ротавирус человека впервые обнаружил в 1973 г. Р. Бишоп с соавторами при электронно-микроскопическом исследовании энтероцитов двенадцатиперстной кишки у больных гастроэнтеритом детей и в их испражнениях с помощью метода иммунной электронной микроскопии (были использованы сыворотки реконвалесцентов с заведомо известными антителами), а в опытах на добровольцах была доказана их этиологическая роль.
В 1978 г. Международный комитет по таксономии вирусов выделил ротавирусы человека и животных (у которых они также были обнаружены) в самостоятельный род Rotavirus семейства Reoviridae. Родовое название происходит от латинского слова rota – колесо, так как форма вириона сходна с колесом. Это обусловлено тем, что вирион имеет сферическую форму, а его геном окружен нуклеокапсидом, состоящим из двух слоев: внутренний слой плотно окружает сердцевину, имеет форму икосаэдра и соприкасается с тонким наружным слоем капсида, в результате образуется структура, напоминающая колесо: втулка, спицы и ободок (рис. 87).
В выделениях больного обычно встречаются однокапсидные (60 – 65 нм) и двухкапсидные вирионы (70 – 75 нм). Инфекционными являются полные двухкапсидные вирионы.
Геном вириона представлен двунитевой фрагментированной РНК (11 фрагментов); в сердцевине кроме геномной РНК располагается вирионная РНК-полимераза. Суперкапсид отсутствует. В составе вириона имеется 8 белков (VP1 – VP8). Особенно важным является VP3-белок наружного капсида. Он отвечает за проникновение вируса в клетку и его вирулентность. Кроме того, он обладает гемагглютинирующим свойством. По белкам VP3 и VP7 ротавирусы делят на 4 сероварианта.
Ротавирусы человека и животных по групповым антигенам подразделяются на 6 серогрупп: A, B, C, D, E, F. Их представители не имеют антигенного родства и различаются по электрофоретическим свойствам геномной РНК. Для каждой серогруппы характерен свой профиль миграции фрагментов, состоящий из 4 классов. Идентифицированы:
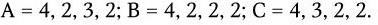
С помощью электрофореза выявляют и дифференцируют вирусы различных серогрупп.
Особенностью ротавирусов человека является то, что они плохо размножаются в лабораторных условиях, и поэтому требуется длительное время для адаптации их к росту в культурах клеток.
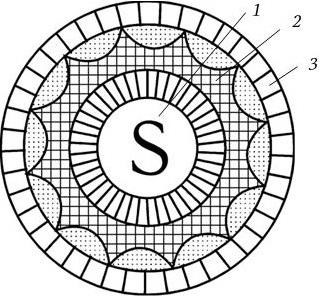
Рис. 87. Схема строения ротавирусного вириона (по А. Г. Букринской, 1986):
1 – сердцевина, содержащая вирионную РНК; 2 – внутренний капсид; 3 – наружный капсид
Эпидемиология. Источник заражения – человек. Болеют главным образом дети в возрасте до 4 лет. Ротавирусы ежегодно вызывают более 130 млн случаев заболевания диареей, в результате чего ежегодно умирает до 600 тыс. человек.
Патогенез и клиника. Вирус размножается в эпителиальных клетках двенадцатиперстной кишки, вызывая различные повреждения. Инкубационный период варьирует от 1 до 7 дней, но обычно менее 2 сут. При типичной ротавирусной инфекции основным ранним симптомом является рвота, которая возникает раньше, чем понос, и продолжается от 2 до 6 дней. Отмечается небольшое повышение температуры. Понос проявляется в виде частых позывов, стул жидкий или полужидкий, частота позывов до 20 раз в день. Дегидратация наблюдается у 83 % больных. Длительность болезни варьирует от 4 до 7 дней, выделение вируса продолжается до 10 дней. Рвота достигает максимума в первые 2 дня болезни, понос длится дольше.
Лечение ротавирусной диареи преследует три главные цели:
1) прекращение дегидратации;
2) восстановление и поддержание нормального водно-солевого обмена;
3) обеспечение нормального питания.
Ротавирусная диарея успешно излечивается путем регидратации с помощью орального солевого раствора (NaCl – 3,5 г; NaHCO3 – 2,5 г; KCl – 1,5 г; глюкоза – 20,0 г на 1 литр воды).
Методы диагностики ротавирусных диарей. 1. Обнаружение вируса в испражнениях с помощью электронной и иммунной электронной микроскопии, иммуноферментного анализа в твердофазном варианте, встречного иммуноэлектрофореза, иммунодиффузионной преципитации в агаре, РСК, реакции коагглютинации, клонированных РНК-зондов. 2. Специфические антитела выявляют с помощью различных серологических реакций, в том числе с помощью иммуноферментного метода, РСК, реакции нейтрализации и иммунофлуоресценции.
В нашей стране для диагностики ротавирусной инфекции предложены следующие методы: а) РПГА с применением антительного ротавирусного диагностикума; б) реакция коагглютинации; в) тест-системы для обнаружения антигена с помощью ИФМ.
Эти методы предназначены для быстрого обнаружения ротавирусов в испражнениях больного. Для обнаружения специфических антител к ротавирусам используют реакцию торможения непрямой (пассивной) гемагглютинации.
В США создана высокоэффективная вакцина против ротавирусной инфекции.
Название рода связано со своеобразием морфологии вирионов (лат. rota - колесо).
Возбудитель был обнаружен впервые в 1973 г. в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки детей с острым гастроэнтеритом.

Культивирование и репродукция. Ротавирусы человека в отличие от ротавирусов животных плохо адаптируются к культуре клеток. Однако их культивируют в роллерных культурах первичных и перевиваемых почечных клеток зеленых мартышек. ЦПД характеризуется уплотнением и округлением клеток, объединением их в конгломераты, соединенные между собой тяжами. Процесс репродукции ротавирусов протекает так же, как и у других реовирусов.
Антигены. По антигенному составу ротавирусы человека и животных очень близки между собой. Их перекрестные антигенные связи позволяют использовать ротавирус телят (Небраски) и обезьян в качестве антигена для серологической диагностики ротавирусной инфекции, а также для получения диагностических сывороток. По антигенным свойствам ротавирусы разделены на 3 подгруппы и 4 серотипа. Перекрестные антигенные связи между ротавирусами, рео-вирусами и орбивирусами не обнаружены. Гликопротеин наружного капсида ротавирусов определяет их гемагглютинирующие свойства и типовую антигенную специфичность.
Патогенез. Ротавирусы являются возбудителями гастроэнтеритов новорожденных и детей более старшего возраста. У взрослых наблюдаются легкие формы заболевания. Первичная репродукция вируса происходит в цитоплазме энтероцитов тонкой кишки. При этом микроворсинки щеточной каймы клеток укорачиваются, становятся неровными или полностью исчезают. Нарушается процесс всасывания простых Сахаров. Воспалительные явления усиливают перистальтику кишечника, что способствует развитию диарейного синдрома и появлению рвоты.
Иммунитет. В организме больных вначале появляются антитела класса IgM, которые через 2-3 недели сменяются IgG. Существенное значение в местном иммунитете принадлежит секреторным иммуноглобулинам IgA. Вируснейтрализующие антитела класса IgG способны проходить через плаценту. Они играют определенную роль в создании пассивного иммунитета в первые 6 мес. после рождения ребенка. Комплементсвязывающие антитела быстро исчезают после перенесения заболевания, вируснейтрализующие сохраняются десятилетиями.
Эпидемиология. Источником заражения являются больные с острой и бессимптомной формами инфекции, а также вирусоносители. Механизм заражения фекально-оральный. Наиболее опасны больные в первые 3-5 дней заболевания, когда в фекальных массах накапливается максимальное количество вируса. Через 7-8 дней после начала заболевания выделение вируса прекращается. Ротавирусы обладают сравнительно высокой устойчивостью к физическим и химическим факторам внешней среды. Ротавирусы вызывают в 40-60% случаев острый гастроэнтерит у детей в возрасте от 1 года до 6 лет, а также внутрибольничные вспышки гастроэнтерита в палатах для новорожденных. Реже заболевание регистрируется у подростков 10-12 лет. По данным ВОЗ, во всем мире от ротавирусного гастроэнтерита ежегодно погибают от 1 до 3 млн. детей.
Профилактика проводится в ряде стран путем иммунизации детей инактивированной вакциной.
Лабораторная диагностика. Проводится путем выявления вируса в фекальных массах больных в 1-ю неделю заболевания, с од- ной стороны, и регистрации нарастания титра антител в парных сыворотках от больных - с другой. Ротавирусы обнаруживаются в фекальных массах в 100% случаев в первые дни заболевания с помощью иммунной электронной микроскопии. Вирусный антиген в фекалиях выявляют иммуноферментным и радиоиммунным методами, в реакции иммунофлюоресценции, а также с помощью нуклеиновых зондов. Вирусы могут быть выделены в культурах клеток в первые дни болезни. Серологическую диагностику проводят в реакциях нейтрализации вируса в культуре клеток, РСК, а также в РТГА с эритроцитами человека группы 0. В качестве диагностикума используют ротавирусы обезьян или телят.
РОТАВИРУСЫ (Rotavirus, ед. ч.; лат. rota колесо + вирусы) — род вирусов семейства Reoviridae, вызывающих острые гастроэнтериты человека и животных.
Название Rotavirus предложено в 1974 г. Флюэттом (Т. H. Flevvett) и сотр. Международный комитет по таксономии вирусов принял его сначала для наименования группы в семействе Reoviridae, а в 1978 г. выделил Р. человека и животных в самостоятельный род этого семейства.
Первым среди Р. обнаружен и исследован возбудитель диареи белых мышей [Крафт (L. М. Kraft), 1957], названный вирусом EDIM (epizootic diarrhea of infant mice). В 1958 г. из материала ректального тампона от здоровой обезьяны Cercopithecus aethiops pygerythrus выделен сходный вирус — SA11. После установления в 1969 г. вирусной природы диареи телят ее возбудитель — вирус NCDV (Nebraska calf diarrhea virus) адаптирован к культуре ткани и изучен с помощью электронного микроскопа. Близким к этим вирусам по антигенной структуре и морфологии частиц оказался агент О, выделенный из воды, использованной для промывания кишок домашнего скота на бойне. В дальнейшем обнаружена и исследована обширная группа Р. — возбудителей диарей поросят, жеребят, ягнят, щенят, кроликов и оленей.
В 1973 г. австралийские исследователи Бишоп (R. F. Bishop) и сотр. при электронно-микроскопическом исследовании кусочков двенадцатиперстной кишки, взятых путем биопсии у детей, больных гастроэнтеритом, обнаружили в эпителиальных клетках слизистой оболочки вирусные частицы (вирионы) диаметром ок. 67 нм; после выздоровления вирус не был найден. Аналогичные частицы были обнаружены в фекалиях больных детей. Применение иммуноэлектронной микроскопии с использованием сывороток крови больных гастроэнтеритом в остром и реконвалесцентном периодах позволило не только обнаружить вирионы в фекалиях, но и установить их этиологическую роль (см. Электронная микроскопия).


Вирионы Р. имеют сферическую форму. Сердцевина вириона окружена двойным капсидом (оболочкой). Мощный внутренний к апсид имеет структуру икосадельтаэдра с триангуляционным числом Т-13, построен из 12 пентамеров и 120 гексамеров, состоящих из 780 структурных единиц. Внешний капсид на негативно контрастированных препаратах выглядит тонким ободком с плохо различимой субъединичной структурой. В фекальных и культуральных препаратах одновременно обнаруживаются и однокапсидные вирионы Р. диаметром 60—65 нм, и двухкапсидные вирионы диам. 70—75 нм: и те, и другие могут быть полными и лишенными сердцевины (рис. 1). Инфекционными являются полные двухкапсидные вирионы. Размножение Р. происходит в цитоплазме клеток. Ранние стадии морфогенеза связаны с цитоплазматическими включениями. Формирующиеся в их периферических участках вирионы Р. перемещаются, отпочковываясь от мембраны эндоплазматической ретикулума (рис. 2).
Геном Р. представлен двунитчатой РНК, в к-рой выявлено 11 сегментов. Электрофорез (см.) в полиакриламидном геле позволяет обнаружить различия в структуре РНК ротавирусов человека и отдельных видов животных. В составе вириона Р. обнаружено 8 — 10 структурных полипептидов. Р. устойчивы к действию растворителей жиров и кислой среды (pH 3,0).
Изученные Р. — возбудитель гастроэнтерита человека, вирусы EDIM, NCDV, SA11 и агент О — обладают общим групповым антигеном, входящим в состав внутреннего капсида. Видовая антигенная специфичность Р. определяется антигеном внешнего капсида; для Р. человека установлено существование двух антигенных типов. В составе вирионов Р. телят (NCDV), вируса обезьян (SA11) и Р. человека обнаружены гемагглютииины.
Р. животных при экспериментальном заражении активно размножаются в кишечнике и выделяются с фекалиями, к-рые используют как источник вируса или вирусного антигена при лабораторных и диагностических исследованиях. Отдельные Р. животных хорошо размножаются в культурах ткани (NGDV, SA11, агент О и др.). Р. человека трудно адаптировать к организму какого-либо вида лабораторных животных. Вызвать диарею перораль-ным заражением фекалиями, содержащими Р. человека, удалось у обезьян и у новорожденных живот-ных-гнотобионтов (поросят, ягнят и телят). Первичное инфицирование клетки Р. человека достигается с трудом, а последующее размножение вируса сопровождается появлением неполных вирионов, лишенных наружного капсида и не способных к репродукции. Размножение Р. человека в культурах клеток приматов было осуществлено при помощи комбинированного воздействия физических и химических факторов (обработка трипсином и центрифугирование) на клетку в начальной фазе инфекции Р. Активное размножение Р. человека в клетках приматов происходит только при большой концентрации полных двухкапсидных вирионов в исходном материале.
Носителями и источниками Р. различных видов являются человек и животные. У заболевших людей Р. обнаруживается в фекалиях одновременно с появлением симптомов диареи, выделение вирионов достигает максимума на 3—5-й день болезни. В 1 г фекалий содержится до 109—1010, а иногда до 1011 вирионов. Выделение Р. обычно длится 7—8 дней, редко затягивается до 2—3 недель. Р. могут выделяться с фекалиями и при бессимптомной инфекции. Через верхние дыхательные пути Р. не выделяется, однако существует возможность их вторичного инфицирования и распыления вируса воздушно-капельным путем. Достоверные случаи заражения человека Р. от животных неизвестны.
Р. является причиной возникновения значительного количества случаев острого гастроэнтерита преимущественно у детей во многих странах различных географических регионов: по расчетам Стейнхоффа (М. С. Steinhoff, 1978) в экономически развитых странах не менее 50% всех случаев острого детского гастроэнтерита вызывается Р. Заболевания в СССР гастроэнтеритом, вызванным Р., зарегистрированы в ряде районов европейской части, Закавказья, Урала и Сибири среди детей ясельного и школьного возраста и среди взрослых (см. Ротавирусный гастроэнтерит).
Лабораторная диагностика включает обнаружение Р. или его антигенов в фекалиях больных и специфических антител в сыворотке крови переболевших (см. Вирусологические исследования).
Библиография: Дроздов С. Г. и др. Ротавирус человека в культуре клеток, выделение и пассирование, Вопр. виру-сол., № 4, с. 389, 1979; Дроздове. Г. и др. Ротавирусный гастроэнтерит, М., 1982; Флеветт Т. X. Острый небактериальный инфекционный гастроэнтерит, Исследование по сравнительной вирусологии, в кн.: Последние достижения в области клин, вирусол., под ред. А. П. Уотер-сона, пер. с англ., с. 185, М., 1980; Holmes I. Н. Viral gastroenteritis, Progr. med. Virol., v. 25, p. 1, 1979, bibliogr.; Me Nulty M. S. Rotaviruses, J. gen. Virol., v. 40, p. 1, 1978, bibliogr.; Steinhoff M. G. Rotavirus, J. Pedi-at., v. 96, p. 611, 1980, bibliogr.
Описание и строение ротавируса
Ротавирусная инфекция представляет собой инфекционное заболевание, вызванное вирусами из семейства реовирусов (Reoviridae). Впервые вирус был обнаружен в 1973 г. в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки детей с острым гастроэнтеритом (рис. 1.).
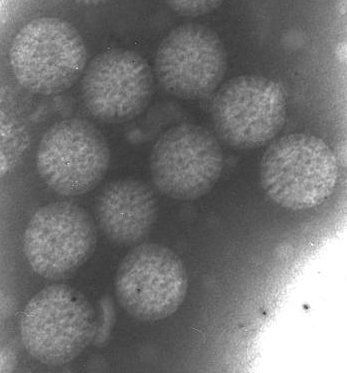
Рис. 1. Фотография вирионов ротавируса с электронного микроскопа.
Острый гастроэнтерит является одним из самых распространенных заболеваний человека и характеризуется наиболее высоким уровнем заболеваемости и смертности среди детей и пожилых людей. В развивающихся странах гастроэнтерит является распространенной причиной смертности детей в возрасте до 5 лет и может быть вызван широким спектром возбудителей. Несмотря на то, что в развитых странах смертность от диареи встречается реже, указанное заболевание зачастую приводит к госпитализации или к вызову врача. Значительная доля заболеваний гастроэнтеритом среди детей приходится на долю вирусов, принадлежащих к четырем различным семьям: ротавирусы, калицивирусы, астровирусы и аденовирусы. Другие вирусы, такие как торовирусы, пикобирнавирусы, пикорнавирусы (вирус Айчи) и энтеровирус 22, также могут приводить к развитию заболевания. Вирусный гастроэнтерит имеет две эпидемиологические модели: диарея (эндемическое заболевание у детей) и вспышки заболеваний среди людей всех возрастов. Возбудителями вирусной диареи у детей являются ротавирусы группы А, кишечные аденовирусы, астровирусы и калицивирусы; при этом заболевание возникает у всех детей в первые несколько лет жизни по всему миру, независимо от уровня гигиены, качества воды или пищи, а также типа поведения. Все указанные инфекционные заболевания за исключением, пожалуй, калицивирусных инфекций, приводят к формированию у пациента иммунитета от повторного заражения тяжелой болезнью.
В геноме ротавируса, основу которого составляет двухцепочечная фрагментированная РНК, 11 фрагментов, кодирующие 13 белков: 7 структурных (VP — вирусные протеины) и 6 неструктурных белков (NSP).
Вирион имеет четыре основных структурных белка (VP2, VP4, VP6 и VP7), образующих трехслойный капсид (рис.2). VP2 формирует ядро вируса и связывает вирусный геном. VP4 располагается на поверхности вирусной частицы в виде шипа, связывается с рецепторами на поверхности клеток и управляет внедрением вируса в клетку, определяет вирулентность вируса. Данных полипептид модифицируется в кишечнике трипсином до VP5 и VP8. VP6 формирует толщу капсида и используется для определения вида ротавируса. Структурный гликопротеин VP7 участвует вместе с VP4 в формировании иммунитета к инфекции.
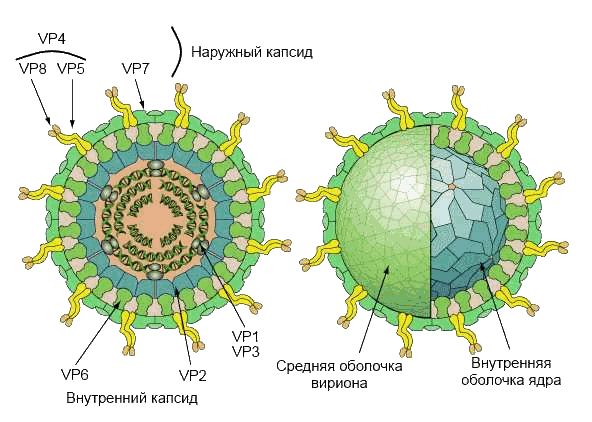
Рис. 2. Структура вириона. Полипептиды VP4 и VP7 формируют наружный капсид вириона; VP2 формирует оболочку ядра, VP6 — среднюю оболочку, вместе образуют внутренний капсид. VP1 и VP3 располагаются в вершинах ядра вирусной частицы.
Диагностика ротавируса
Инкубационный период ротавирусной инфекции составляет около 2 суток. Симптомы заболевания проявляются в течение 3-8 дней в виде рвоты и водянистой диареи, часто сопровождающейся лихорадкой и болями в животе. Как и все вирусы, некоторые разновидности ротавирусной инфекции, в особенности поражающие взрослых, протекают бессимптомно либо проявляются незначительными симптомами. Для ротавирусной инфекции характерен фекально-оральный механизм передачи.
Антитела к ротавирусу компании Биалекса
В качестве иммуногена компания Биалекса использует очищенный бычий ротавирус, при этом моноклональное антитело RV3 специфично к группе А ротавирусов млекопитающих. Антитело кросс-реактивно к ротавирусу обезьяны (SA-11), ротавирусу свиньи (РР), ротавирусу мышей и ротавирусу человека. В рамках Вестерн-блоттинга антитела реагируют с основным антигеном внутреннего капсида VP6, а также могут использоваться при проведении иммуноферментного анализа и иммуногистохимии.
Читайте также:


