Ртга для диагностики вирусов
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Студент должен знать:
-морфологию, экологию, физиологию вирусов, методы их изучения;
-основы эпидемиологии вирусных инфекций (типы инфекций);
-основы химиотерапии и химиопрофилактики вирусной инфекции;
-факторы иммунитета при вирусных инфекциях.
Студент должен уметь:
-проводить профилактику вирусных инфекций;
-составлять алгоритмы действия в условиях эпидемии.
Вопросы для фронтального обсуждения:
1.Дайте понятие вирусам. Охарактеризуйте особенности строения и жизни вирусной частицы.
2.Какими факторами осуществляется защита организма человека от вируса.
3.Назовите группу и механизм действия препаратов на вирусы. Приведите примеры препаратов.
4.Назовите типы инфекции, вызываемые вирусами.
5. Назовите представителей кишечных, кровяных, респираторных вирусных инфекций, инфекций кожных покровов и слизистых.
7.Назовите, как называются мероприятия, ликвидирующие эпидемический процесс.
Самостоятельная работа студентов:
Запишите определения методов исследования вирусных инфекций.
Зарисйте в атлас внутриклеточные включения при натуральной оспе (тельца Гварниери), при бешенстве (тельца Бабеша-Негри).
3.Составьте план противоэпидемических мероприятий на вирусную инфекцию (инфекцию определяет преподаватель).
Краткие теоретические положения
Введение
Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий.
Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных.
Методы диагностики вирусных инфекций
Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки.
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв;
– при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы);
– при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа);
– при экзантемных инфекциях – смывы (корь, краснуха);
– при арбовирусных инфекциях – кровь, спинномозговая жидкость.
1.Быстрые (экспресс-методы) — прямое обнаружение вируса или его компонентов (антигенов, НК), включений непосредственно в клиническом материале.
А. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. При данном методе можно определить тип НК, размеры вириона, форму вириона, а также выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях.


II. Вирусологический метод основан на:
культивировании вирусов в чувствительных биологических системах (клеточных культурах, курином эмбрионе, организмах лабораторных животных),их индикации по цитопатогенному действию на биологическую систему (рис.1), идентификации по ингибиции действия вирусов соответствующими противовирусными антителами (рис.2).

Рис. 1. Цитопатическое действие вирусов на клетку: А-нормальный рост, Б-ЦПД вирусов на клетку

Рис.2 Ингибиция вируса антителами
Вирусологическое исследование - это "золотой стандарт" вирусологии и должно проводится в специализированной вирусологической лаборатории. В настоящее время оно используется практически только в условиях возникновения эпидемической вспышки того или иного вирусного инфекционного заболевания.
III. Серологический метод — определение противовирусных антител (оптимально — IgM) и/или определение динамики нарастания их титров за определенный период заболевания в парных сыворотках. Диагностически значимым считают нарастание титра антител в 4 и более раз.
Метод парных сывороток:осуществляем сбор венозной крови в количестве 10 мл в начале болезни и в конце, приготавливаем сыворотку, определяем количество антител в первой и второй сыворотке.
При этом четырехкратное нарастание титра антител во второй сыворотке в большинстве случаев служит показателем протекающей или свежеперенесенной инфекции. При исследовании одной сыворотки, взятой в острой стадии болезни, диагностическое значение имеет обнаружение антител класса Ig М, свидетельствующее об острой инфекции.
Современные методы диагностики:
1.ПЦР-выявляют персистирующие вирусы по НК, находящиеся в клиническом материале, с трудом обнаруживаемые или не обнаруживаемые другими методами.
2.Радиоизотопный иммунный анализ (РИА)-метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
3.Иммуноферментный анализ (ИФА) – Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
4.Реакция иммунофлюоресценции (РИФ) – Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
5.Другие методы диагностики –
РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии.
РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов.
Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции.
РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более.
РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови.
Все серологичные реакции используются с двоякой целью:
1) для выявления антител в сыворотке больного с помощью стандартных антигенов-диагностикумов – для серологической диагностики инфекционной болезни;
2) для определения неизвестных антигенов (бактерий, грибов, вирусов) за известными стандартными сыворотками-антителами – для серологической идентификации возбудителей.
РТГА: Принцип РТГА состоит в том, что в пробирке (лунке) смешивают равные объемы сыворотки крови и вируса и после экспозиции (30—40 мин) добавляют эритроциты соответствующего вида животного.
Выбор эритроцитов зависит от вируса, используемого в РТГА. Так, для вирусов гриппа используют эритроциты кур, для ПГ-3 КРС — эритроциты морской свинки. Обычно используют 0,5—1%-ную взвесь эритроцитов
Эритроциты являются индикатором наличия вируса в смеси. Агглютинация эритроцитов указывает на наличие вируса в смеси, а отсутствие гемагглютинации — на его отсутствие, так как антитела полностью нейтрализовали гемагглютинирующую активность вируса.
РБН: В РБН берут или двукратно возрастающие разведения исследуемых сывороток и постоянную дозу вируса, или одно (постоянное) разведение сывороток и 10-кратно возрастающие разведения препарата вируса. Реакция (РБН) применяется для определения вируснейтрализующей активности сывороток и носоглоточных смывов. Она высокочувствительна и штаммоспецифична, требует значительных затрат времени. Принцип метода основан на способности специфических антител сывороток крови или секрета дыхательных путей соединяться с соответствующим по антигенной структуре вирусом гриппа.
РНГА: В РНГА выявляют антитела сыворотки крови с помощью антигенного эритроцитарного диагностикума, который представляет собой эритроциты с адсорбированными на них антигенами. Эритроциты (или частицы латекса) с адсорбированными на них антигенами взаимодействуют с соответствующими антителами сыворотки крови, что вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. При отрицательной реакции эритроциты оседают в виде пуговки.
РСК: заключается в том, что при соответствии друг другу антигенов и антител они образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), те происходит связывание комплемента комплексом антиген - антитело. Если же комплекс антиген - антитело не образуется, то комплемент остается свободным. PCK проводят в две фазы 1-я фаза - инкубация смеси, содержащей антиген + антитело + комплемент, 2-я фаза (индикаторная) - выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним.
ПЦР- диагностика вирусных инфекций - экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе).
В основе метода ПЦР лежит многократное удвоение определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатываются количества ДНК. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
Кроме простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК), и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, введения мутаций, выделения новых генов. Также, этим методом проводят диагностику вирусных инфекций, таких как гепатиты, ВИЧ и др. Методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т. д.).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
реакция торможения гемагглютинации (РТГА)
В основе РГА лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов. В качестве исследуемого материала при гемагглютинации используют аллантоисную, амниотическую жидкость, суспензию хорионаллантоисных оболочек куринных эмбрионов, взвеси и экстракты из культур или органов животных, зараженных вирусами, нативный инфекционный материал. РГА не является серологической, поскольку происходит без участия иммунной сыворотки и используется для выбора рабочего разведения антигена для постановки РТГА или наличия антигена (вируса) в исследуемом материале (например, при гриппе). В реакции используются эритроциты животных, птиц, человека I (0) группы крови.
Для постановки ориентировочной РГА на предметное стекло наносят каплю 5% взвеси эритроцитов и каплю испытуемого материала, тщательно смешивают. При положительном результате через 1-2 минуты макроскопически наблюдают появление хлопьевидной агглютинации эритроцитов.
Для постановки РГА в развернутом ряду в лунках полистероловых планшетов готовят двукратно возрастающие разведения исследуемого материала на физиологическом растворе в объёме 0,5 мл. Во все пробирки вносят по 0,5 мл 0,25 - 1% взвеси эритроцитов. Результаты учитывают после полного оседания эритроцитов в контроле (эритроциты + физиологический раствор). Реакцию учитывают по характеру осадка эритроцитов. В положительных случаях степень агглютинации отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеившихся эритроцитов, покрывающей дно пробирки (зонтик), реакцию с просветами в пленке отмечают тремя плюсами, наличие пленки с фестончатыми кружевными краями из склеившихся эритроцитов обозначают двумя плюсами, хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов соответствует одному плюсу. Резко очерченный осадок эритроцитов, неотличимый от контроля показывает отсутствие агглютинации. За титр принимают предельное разведение исследуемого материала, вызвавшее агглютинацию эритроцитов на два плюса.
При положительном результате РГА исследование продолжают, определяя тип выделенного вируса с помощью реакции торможения гемагглютинации типоспецифическими сыворотками.
РТГА основана на свойстве антисыворотки подавлять вирусную гемагглютинацию, так как нейтрализованный специфичными антителами вирус утрачивает способность агглютинировать эритроциты. При ориентировочном типировании вирусов используют капельный метод на стекле. Для окончательного установления типовой принадлежности выделенного вируса и титрования антител в сыворотках ставят развернутую РТГА в пробирках или в лунках. С этой целью готовят двухкратные разведения сывороток на физиологическом растворе и разливают по 0,25 мл. К разведениям сыворотки прибавляют по одной капле материала, содержащего вирус и по одной капле 1% взвеси эритроцитов.
При использовании РТГА для определения типа вируса, используют типоспецифические сыворотки, которые добавляют к равному объему рабочего разведения антигена. Типовую принадлежность выделенного вируса устанавливают по специфической иммунной сыворотке, показавшей наивысший титр антител к этому вирусу.
РГА и РТГА широко применяется для диагностики вирусных инфекций (клещевой энцефалит, грипп и др.) с целью обнаружения специфических антител и для идентификации многих вирусов по их антигенам.
Реакция иммунофлуоресценции (РИФ)
РИФ основана на соединении антигенов бактерий, риккетсий и вирусов со специфическими антителами, меченными флюоресцирующими красителями (флуоресцеинизотиоцианат, родамин, В-изотицианит, лиссатинродамин В-200, сульфохлорид и др.), имеющими реакционно-способные группы (сульфохлорид, изотиоцианит и др.). Эти группы соединяются со свободными аминогруппами молекул антител, которые не теряют при обработке флуорохромом специфического сродства к соответствующему антигену. Образовавшиеся комплексы АГ–АТ становятся хорошо видимыми, ярко светящимися структурами под люминесцентным микроскопом (рис. 48). С помощью РИФ можно обнаруживать небольшие количества бактериальных и вирусных антигенов. Метод РИФ используют в двух вариантах: прямой и непрямой метод.
Прямой метод основан на непосредственном соединении антигена с меченым антителом. Непрямой метод – на поэтапном выявлении комплекса АГ–АТ с помощью флуоресцентных красителей. Первый этап заключается в образовании иммунных комплексов определенного антигена со специфическими антителами. Второй этап – в выявлении этого комплекса путем обработки его меченым антигаммаглобулином.
Преимущество РИФ – простота, высокая чувствительность, скорость получения результата. РИФ применяется как метод ранней экспресс-диагностики гриппа, дизентерии, малярии, чумы, туляремии, сифилиса и др. Для проведения такого исследования используется люминесцентный микроскоп.

|
Радиоиммунологический анализ (РИА)
РИА – один из самых чувствительных методов иммунодиагностики. Его применяют для выявления антигена вируса гепатита В, у больных вирусным гепатитом. Для этого к исследуемой сыворотке добавляют референс-сыворотку (сыворотку, содержащую антитела к вирусу гепатита В). Смесь инкубируют 1-2 сут при температуре 40 0 С, затем добавляют референс-антиген (антиген, меченный изотопом 125 J) и продолжают инкубацию еще 24 часа. К образовавшемуся комплексу антиген-антитело добавляют преципитирующие антииммуноглобулины против белков референс-сыворотки, что приводит к образованию преципитата (рис. 49). Результат учитывают по наличию и числу импульсов в преципитате, зарегистрированных счетчиком. При наличии в исследуемой сыворотке антигена, связавшегося со специфическими антителами, последние не вступают в связь с меченным антигеном и, поэтому, он не обнаруживается в преципитате. Таким образом, в основу РИА положен принцип конкурентного взаимодействия определяемого антигена и известного количества меченного антигена с активными центрами антител.

|
Иммуноферментный метод (ИФА)
Метод используется для выявления антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, b-галактозой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат и хромоген.Субстрат расщепляется ферментом, а его продукты деградации вызывают химическую модификацию хромогена. При этом хромоген меняет свой цвет – интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител (рис. 50).
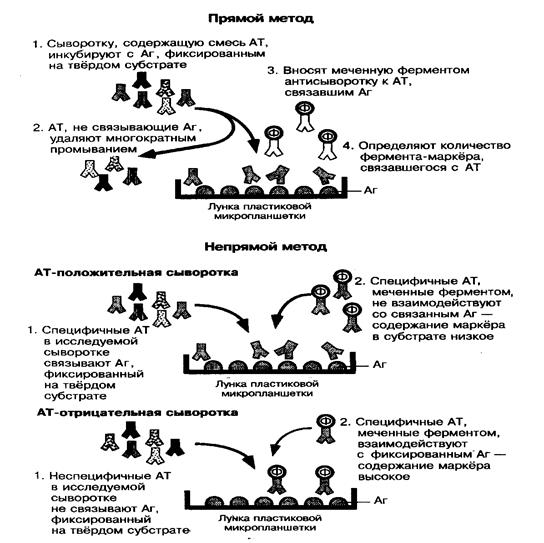
|
Наиболее распространен твердофазный ИФА, при котором один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе. В качестве твердого носителя используются микропанели из полистирола. При определении антител в лунки с сорбированным антигеном последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена.
Твердофазный носитель можно сенсибилизировать не только антигеном, но и антителом. Тогда в лунки с сорбированными антителами вносят искомый антиген, добавляют иммунную сыворотку против антигена, меченную ферментом, а за тем – смесь растворов субстрата для фермента и хромогена.
ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями.
ОРВИ часто вызывают представители 3-х семейств РНК-содержащих вирусов – парамиксовирусы (респираторно-синцитиальный вирус, метапневмовирус человека, вирусы парагриппа 1–4), коронавирусы (229E, OC43, NL63, HKUI) и пикорнавирусы (риновирусы) и 2-х семейств ДНК-содержащих вирусов – аденовирусы (виды B, C, E), парвовирусы (бокавирус человека). Все вышеперечисленные вирусы, за исключением бокавируса человека, вызывают заболевания верхних и нижних дыхательных путей у всех возрастных групп, но наиболее тяжело протекают ОРВИ, вызванные респираторно-синцитиальным вирусом, метапневмовирусом, вирусами парагриппа и коронавирусами, у детей в возрасте до 5 лет, пожилых и у лиц с иммунодефицитом. Респираторно-синцитиальный вирус (РС-вирус) в отдельные годы вызывает до 40% всех ОРВИ. С РС-вирусом связывают формирование хронических бронхитов и бронхиальной астмы у 30% детей, перенесших бронхиолит в течение первых 6-ти месяцев жизни. Метапневмовирусная инфекция сходна по клинической картине с РС-вирусной инфекцией. Доля вирусов парагриппа в этиологической структуре ОРВИ составляет от 9 до 30%. Среди детей с заболеваниями нижних дыхательных путей, госпитализированных в стационары, инфицированные вирусами парагриппа в среднем составляют около 12%, что ставит вирусы парагриппа на второе место после РС-вируса по частоте госпитализации и тяжести заболевания. Аденовирусы часто вызывают вспышки в детских дошкольных учреждения, домах ребенка, домах престарелых, воинских частях. Инфекция, вызванная коронавирусами, тяжелее протекает у детей первого года жизни преимущественно в форме крупа. Самым распространенным возбудителем ОРВИ среди взрослого населения и детей всех возрастных групп является риновирусы, вызывающие воспаление слизистой верхних дыхательных путей с ринореей и кашлем; в качестве осложнения нередко развивается трахеит. В 2005 г. был описан бокавирус человека, который обнаруживается в назофарингеальных мазках и мокроте у детей, страдающих ОРЗ верхних или нижних дыхательных путей со среднегодовой частотой 1,5–19,0%, а также в фекалиях детей с гастроэнтеритами с частотой 1–2%. Помимо этого, бокавирусы часто обнаруживаются в составе сочетанной инфекции с другими вобудителями ОРЗ. Основной восприимчивой группой являются дети до 3 лет. У взрослых отмечают случаи заболевания бокавирусной инфекцией, ассоциированные, как правило, с пневмонией на фоне иммунодефицита. У лиц со сниженной активностью иммунной системы, ОРЗ могут вызывать также энтеровирусы, вирусы герпеса, цитомегаловирус.
Показания к обследованию. Наличие у пациента остро возникшего заболевания с локальными симптомами поражения верхних или нижних дыхательных путей при наличии обще-интоксикационного синдрома.
Материал для исследований
- Мазки из носоглотки – культуральное исследование, обнаружение АГ;
- мазки со слизистой носоглотки и ротоглотки – выявление РНК/ДНК вирусов (поражение верхних дыхательных путей);
- мокрота, плевральная жидкость, аспираты из зева, БАЛ – выявление РНК/ДНК вирусов (поражение нижних дыхательных путей);
- сыворотка крови – обнаружение АТ.
Этиологическая лабораторная диагностика ОРВИ включает выделение вируса в культуре клеток, выявление РНК/ДНК возбудителей и их АГ, обнаружение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики. Выделение в культуре клеток возможно для респираторно-синцитиального вируса, вирусов парагриппа 1–3 типов, метапневмовируса человека и аденовирусов. Для рутинной диагностики метод не используется.
Для обнаружения АГ респираторно-синцитиального вируса, вирусов парагриппа 1–3 и аденовирусов используют ИХА и РИФ (МФА), последний отличается субъективностью при интерпретации результатов анализа. Аналитические характеристики наборов для РИФ и ИХА широко варьируют: при их использовании в период эпидемий могут быть выявлены не все случаи инфицирования (недостаточная диагностическая чувствительность по сравнению с культуральными методами и ПЦР), в межэпидемический период могут быть получены ложноположительные результаты (низкая специфичность).
При выявлении специфических АТ оценивают нарастание их титра в динамике в пробах крови, полученных с интервалом в 2 недели (парные сыворотки). Для обнаружения АТ к вирусам используют различные методы: к респираторно-синцитиальному вирусу – РН, РСК, РНГА, ИФА; вирусам парагриппа 1–4 – РТГА, РСК, ИФА; аденовирусам – ИФА; риновирусам – РСК; исследования носят ретроспективный характер. По сравнению с РСК метод ИФА отличается большей чувствительностью.
Показания к применению различных лабораторных исследований. Для быстрой этиологической диагностики ОРВИ используется выявление НК вирусов методом ПЦР. Выявление АТ применяют для определения уровня коллективного гуморального иммунитета, ретроспективной диагностики и ретроспективного анализа природы эпидемических вспышек ОРВИ. Обнаружение АГ целесообразно использовать только для массового скрининга в эпидемиологических целях.
Особенности интерпретации результатов лабораторных исследований. Возможность сочетанного инфицирования несколькими возбудителями ОРЗ может осложнять течение болезни, поэтому необходимо проведение исследований полного спектра возбудителей. Несоблюдение техники получения клинического материала для исследования может снизить информативность исследования вплоть до получения отрицательного результата. При выявлении АТ пробы крови для исследования берут в начале заболевания и повторно через 10–14 дней, диагностическим считается нарастание титра АТ не менее чем в 4 раза в повторно взятой пробе. В связи с недостаточной чувствительностью тестов для выявления АГ методами РИФ и ИХА получение отрицательных результатов при их использовании не исключает возможного инфицирования.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Читайте также:


