Штаммы вируса клещевого энцефалита
Среди переносчиков инфекционных заболеваний человека клещи занимают второе место после комаров: на сегодня выявлено не менее трех вирусных, 22 бактериальные и несколько протозойных инфекций, которые переносятся иксодовыми клещами. Ситуация зачастую осложняется тем, что при укусах клещи способны передавать человеку одновременно разные виды бактерий, вирусов и простейших, вызывая смешанные инфекции, часто протекающие в более тяжелых формах. Дополнительный риск заражения возникает из-за возможной циркуляции патогенов в сельскохозяйственных и домашних животных (например, инфекционные агенты могут сохраняться в молочных продуктах), а также при переливаниях крови и трансплантации органов. Наиболее опасными среди инфекций, переносимых клещами, считаются клещевой энцефалит, иксодовый клещевой боррелиоз, эрлихиоз, риккетсиоз и бабезиоз. Для России наиболее социально значимыми инфекционными агентами являются боррелии и конечно же вирус клещевого энцефалита, о котором пойдет речь ниже.
Таежная инфекция
В 30-х гг. XX в. шло интенсивное освоение Дальнего Востока: строились дороги, вырубались леса, из-за напряженных отношений с Японией в тайге дислоцировались крупные военные части. Врачи, работавшие в то время в Приморском крае, стали регулярно сообщать о неизвестной тяжелой болезни, поражающей как местных жителей, так и военных. Заболевание, считавшееся новой разновидностью тяжелого гриппа, сопровождалось резким повышением температуры и часто приводило к параличам и даже гибели заболевших.
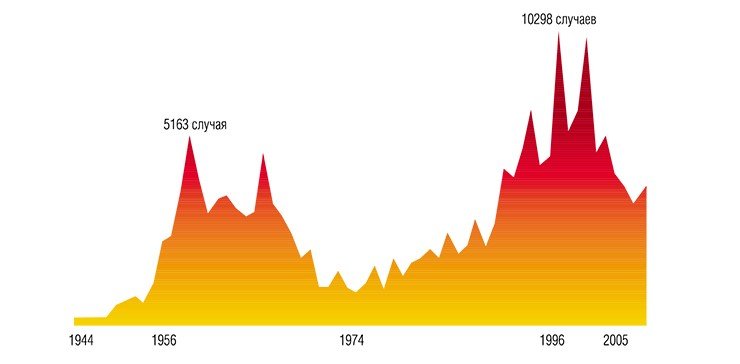
Правильно диагностировать неизвестную болезнь удалось лишь в 1935 г. местному врачу А. Г. Панову. Заболевание оказалось воспалением мозга, т. е. энцефалитом, похожим по симптомам на описанный ранее японский энцефалит. В 1936 г. врачи дальневосточной пастеровской станции пытались выделить возбудителя заболевания, вводя мышам в мозг эмульсию мозга людей, погибших от энцефалита. Но, несмотря на то, что у мышей появлялись признаки заболевания, исследования не увенчались успехом.
В январе 1937 г. военные медики обратились в Наркомздрав СССР, где и было принято решение об организации на Дальний Восток научной экспедиции под руководством Л. А. Зильбера. В тяжелых полевых условиях была развернута настоящая вирусологическая лаборатория. Ученые свою задачу выполнили: патоген, вызывающий тяжелые заболевания центральной нервной системы, был успешно выделен и описан. Кроме того, была четко установлена определяющая роль иксодовых клещей в передаче инфекционного агента. Выяснилось, что источником заражения клещей служили дикие позвоночные животные, на основе чего были разработаны рекомендации по необходимым профилактическим мерам.
К сожалению, это поистине блестящее открытие, ставшее важной вехой в истории вирусологии, не обошлось без жертв среди самих участников научной экспедиции. Так, М. П. Чумаков – будущий академик и создатель Института по изучению полиомиелита – перенес тяжелейшую форму инфекции, перешедшую у него в хроническую пожизненную форму; последствием заболевания у В. Д. Соловьева стала шестимесячная слепота.
Опасный сосед
Что на сегодня известно о вирусе клещевого энцефалита (ВКЭ)? Вирус относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), включающему более 70 вирусов животных и человека, в том числе такие опасные, как вирус желтой лихорадки, японского энцефалита, вирус лихорадки Денге и вирус гепатита C.

Лев Александрович ЗИЛЬБЕР (1894—1966) – один из основоположников медицинской науки в СССР. С его именем связаны фундаментальные исследования изменчивости у бактерий и природы иммунитета, организация первых в стране вирусологических центров, создание и экспериментальная разработка вирусо-генетической теории происхождения опухолей, а также совершенно нового направления – иммунологии рака.
За работу по выявлению возбудителя и переносчика весенне-летнего энцефалита в 1937 г. был награжден премией Наркомздрава СССР, но в том же году арестован по ложному обвинению, что экспедиция, которую возглавлял Зильбер, тайно распространяла японский энцефалит на Дальнем Востоке, и освобожден лишь через полтора года. В короткий промежуток времени между освобождением и новым арестом работал над монографией об эпидемических энцефалитах, подготовил несколько статей.
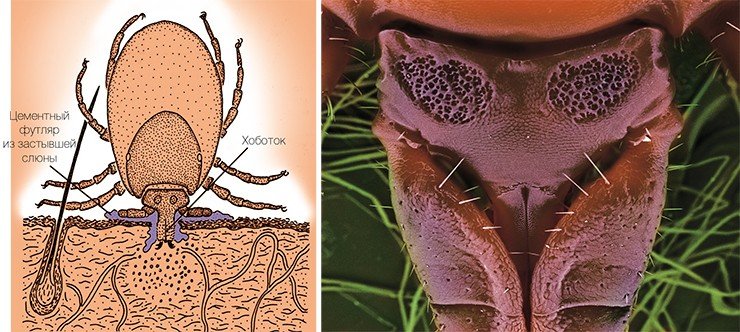
Основным природным резервуаром ВКЭ служат мелкие млекопитающие (полевки, мыши, насекомоядные). Вирус способен заражать животных и размножаться в их организме, однако заболевание протекает у них зачастую без видимого вреда для здоровья. Переносчиками вируса являются клещи, питающиеся кровью лесных зверьков, – европейский лесной клещ, таежный, луговой клещи, а также ряд других, более редко встречающихся видов. ВКЭ может размножаться и в их организме. Точно не известно, был ли вирус первоначально связан только с клещами, или только с позвоночными животными, но в процессе эволюции он приспособился к существованию в организмах как тех, так и других.
В настоящее время вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия ареал ВКЭ неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. Так, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для обитания мелких млекопитающих и связанных с ними клещей.
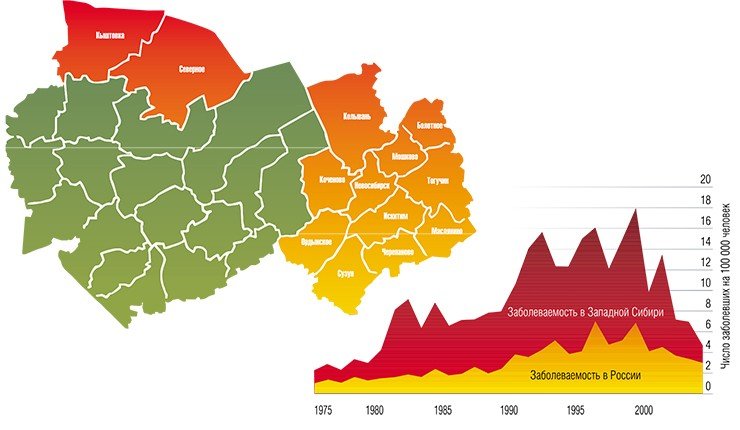
Кроме того, все большее число людей предпочитает проводить свободное время на природе, отдыхая или работая на приусадебных участках. В той же Новосибирской области около 75% населения проживает на территории, условия которой благоприятны для жизни клещей, здесь же сосредоточена и основная масса летних оздоровительных учреждений, зон массового отдыха, садово-дачных участков.
В Институте химической биологии и фундаментальной медицины были исследованы 95 штаммов вируса клещевого энцефалита из коллекции Института систематики и экологии животных СО РАН, выделенных от взрослых особей таежного клеща, собранных с растительности в восточной части Новосибирской области в 1980—2001 гг.
Анализ нуклеотидных последовательностей фрагмента гена Е, кодирующего белок оболочки вируса, показал, что все штаммы соответствуют сибирскому генетическому типу.
С другой стороны, в крови людей, госпитализированных с подозрением на клещевые инфекции, в совместных исследованиях с новосибирскими медиками были обнаружены изоляты ВКЭ, относящиеся к дальневосточному генетическому типу.
Ранее считалось, что этот тип вызывает только тяжелые формы заболевания, тогда как сибирский – преимущественно хронические. Наши исследования, подтвержденные данными других авторов, показали, что вирус дальневосточного генетического типа способен вызывать различные формы клещевого энцефалита, начиная от самых тяжелых и заканчивая стертыми, никак не проявляющимися.
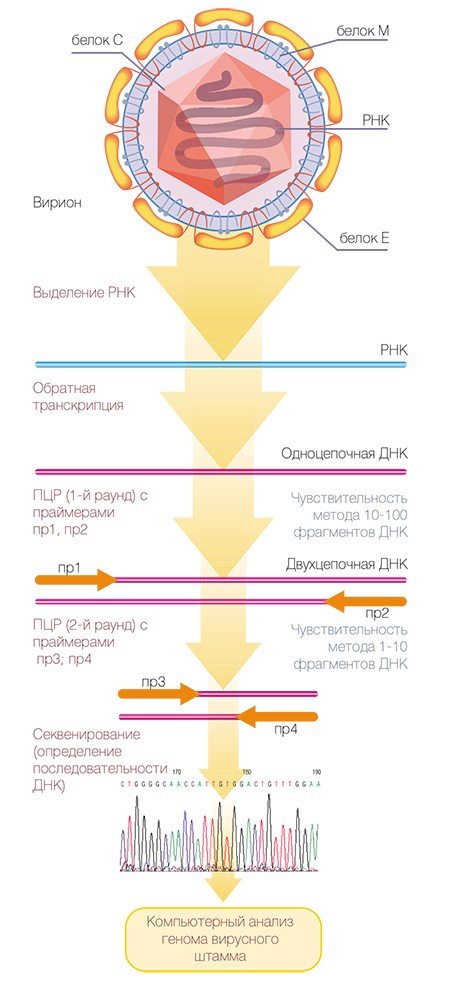
Геном вируса клещевого энцефалита был расшифрован в 1989—1990 гг. практически одновременно в нашей стране (в том числе и в Институте химической биологии и фундаментальной медицины СО РАН (Pletnev et al., 1990)) и за рубежом (Mandl et al., 1989). На сегодня выделено три генетических типа вируса, различающихся по своим свойствам: дальневосточный, сибирский и западноевропейский. Такая привязка генетического типа к географическому местоположению достаточно условна, поскольку в одном регионе могут встречаться штаммы, относящиеся к разным типам.
Для вируса клещевого энцефалита, как и для большинства других вирусных инфекций, не существует высокоспецифических методов лечения – в этом заключается его опасность. Лечение всех вирусных заболеваний направлено в основном на стимуляцию иммунитета и устранение внешних симптомов заболевания, а дальше организм должен сам справляться с инфекцией. ВКЭ опасен еще и тем, что способен вызывать хронические формы заболевания, а его последствиями могут быть параличи и инвалидность. Поэтому важнейшим делом в исследовании этого инфекционного агента является разработка методов диагностики и профилактики заболевания.
Диагностика и профилактика
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител, специфических защитных белков, или наличие самого агента. Однако чувствительность этих методов не слишком высока, к тому же существует вероятность ошибки из-за возможных перекрестных реакций с другими патогенами. Кроме того, с их помощью невозможно получить подробную характеристику самого возбудителя (например, определить его генетический тип).
Молекулярно-генетические методы, направленные на специфическое распознавание генетического материала вируса, обладают более высокой чувствительностью. Особенно это относится к методу полимеразной цепной реакции** (ПЦР), благодаря которой можно размножить, а потом идентифицировать ничтожное количество наследственного материала вируса, что позволяет провести диагностику в течение первых дней после заражения. Однако при некоторых обстоятельствах достоинства могут переходить в недостатки: генодиагностика ВКЭ молекулярно-генетическими методами благодаря высокой чувствительности может также приводить к ошибкам, обусловленным многочисленными новыми мутациями вирусных геномов, а кроме того, предъявляет высокие требования к чистоте экспериментов.

Живые вакцины
Живые вакцины – способ стимуляции иммунитета введением в организм ослабленных вирусов, открытый еще в 1796 г. английским врачом Э. Дженнером. С тех пор была получена живая вакцина против вируса желтой лихорадки, отличающаяся от высокопатогенных штаммов многочисленными заменами нуклеотидов в геноме; продолжаются поиски ослабленных штаммов флавивирусов Денге, Западного Нила и Лангат для разработки на их основе живых вакцин.
Были предприняты попытки создания живой вакцины и против вируса клещевого энцефалита. В 1957 г. в качестве такой живой вакцины было решено использовать ослабленный штамм флавивируса Лангат, вызывающий в организме выработку антител, подобных антителам к ВКЭ. Однако выяснилось, что при внутримозговом введении этот штамм сам становится патогенным и вызывает энцефалиты и атрофию участков мозга без внешних клинических проявлений. В дальнейшем были обнаружены ослабленные штаммы самого ВКЭ, но, к сожалению, все они оказались генетически нестабильными.
Вот трагический пример использования живых вакцин против ВКЭ. В 1969 г. от больного, у которого после укуса клеща в течение 4 лет не было клинических проявлений заболевания, но в крови сохранялись высокие титры антител, был выделен ослабленный штамм вируса клещевого энцефалита. Лабораторные исследования выявили его низкую нейровирулентность, после чего были проведены клинические испытания на добровольцах, давшие положительные результаты. В конечном счете ослабленным штаммом ВКЭ было иммунизировано около 650 тыс. человек. Однако 35 вакцинированных получили тяжелые осложнения в виде менингитов и менингоэнцефалитов, причем у 22 из них тяжелые последствия заболевания остались на всю жизнь, а один человек умер. Использование этого штамма в качестве живой вакцины было прекращено (Timofeev, Karganova, 2003).
ДНК-копии
С помощью подобных манипуляций были созданы живые химерные вакцины, содержащие, например, часть генов вируса желтой лихорадки и часть генов других флавивирусов. При этом в функционально важные участки их геномов были введены точечные мутации, вызывающие ослабление патогенности (Pletnev et al., 2006).
Тем не менее в настоящее время применение ослабленных живых вакцин, в том числе и против ВКЭ, ограничено, поскольку существует вероятность превращения ослабленных штаммов в высокопатогенные штаммы дикого типа. Это происходит потому, что в клетке-хозяине отсутствуют системы коррекции мутаций, которые могут возникнуть в вирусной РНК. Гарантией безопасности таких вакцин могла бы служить утрата больших фрагментов вирусных геномов, однако это приводит к значительному снижению жизнеспособности самих вирусов-мутантов.
Нужно отметить, что исследования флавивирусов, как и многих других патогенов, осложняются их высокой инфекционностью, следствием которой являются строгие требования безопасности, а также дороговизной самих вирусных препаратов. И в этом смысле использование неинфекционных ДНК-копий генома ВКЭ является очень перспективным направлением.
В ИХБФМ был получен ряд генно-инженерных ДНК, содержащих в том числе и полноразмерную ДНК-копию генома вируса клещевого энцефалита (Dobrikova et al., 1996). Конструирование подобных стабильных ДНК-копий вирусных геномов открывает широкие возможности для исследования хода размножения вируса в клетках, изучения функций отдельных вирусных белков и их комплексов.
Иммунизация генами
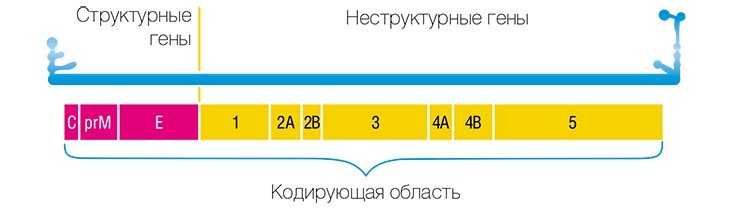
В 1993 г. появился новый подход к профилактике инфекционных заболеваний – генная иммунизация, основанная на прямом введении в организм генно-инженерной ДНК, рекомбинантных плазмид (векторов-переносчиков), содержащих не весь геном, но отдельные гены возбудителя заболевания.
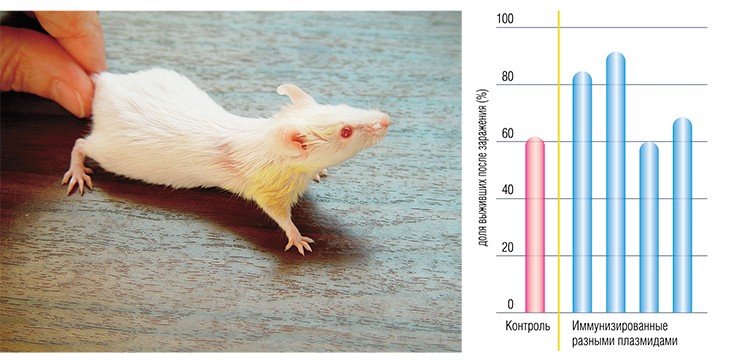
Учеными из ИХБФМ были сконструированы четыре таких плазмиды, содержащие различные гены одного из штаммов вируса клещевого энцефалита. Для оценки эффекта генной иммунизации привитых мышей заражали летальными дозами того же штамма ВКЭ. В результате оказалось, что некоторые плазмиды обладают определенным защитным эффектом.
В качестве вакцин против вирусных заболеваний ученые предполагают использовать генно-инженерные плазмиды, в которые встроены отдельные гены вирусов
Чтобы изучить возможные нежелательные эффекты этих вакцин, плазмиды вводили в различные клеточные культуры. В результате выяснилось, что при увеличении времени культивирования клеток до нескольких месяцев наблюдалась существенная модификация плазмид и встраивание их в хозяйский геном.
Таким образом, несмотря на положительные результаты генной вакцинации, вопрос о применении ДНК-вакцин в настоящее время остается открытым, поскольку препятствием к их использованию также является проблема безопасности. Возможно, преодолеть это препятствие удастся созданием РНК-вакцин с аналогичным принципом действия, для которых не существует риска интеграции в ДНК-геном хозяйской клетки. Но это уже задачи будущих исследований.
Возможно ли полностью избавиться от ВКЭ, например, уничтожив его основных переносчиков, иксодовых клещей? В свое время такая попытка была сделана с использованием печально известного ДДТ, но последствия массовой обработки лесов сильнейшим ядом были поистине ужасающими.
Синонимы: весенне-летний, таежный, русский, дальневосточный; Encephalitis ocarina.
Клещевой энцефалит — природно-очаговая трансмиссивная (передающаяся клещами) вирусная инфекция, характеризующаяся преимущественным поражением центральной нервной системы. Заболевание отличается полиморфизмом клинических проявлений и тяжестью течения (от легких стертых форм до тяжелых прогредиентных).
Первое клиническое описание болезни дали в 1936—1940 гг. отечественные ученые А. Г. Панов, А. Н. Шаповал, М. Б. Кроль, И. С. Глазунов. Возбудитель клещевого энцефалита — фильтрующийся вирус — был также открыт отечественными учеными Л.А.Зильбером, Е.Н.Левковичем, А. К. Шубладзе, М. П. Чумаковым, В. Д. Соловьевым, А. Д. Шеболдаевой в 1937 г.
В настоящее время клещевой энцефалит регистрируется в Сибири, на Дальнем Востоке, на Урале, в Беларуси, а также в центральных областях России.
Этиология. Вирус клещевого энцефалита (КЭ) относится к семейству Flaviviridae, роду Flavivirus (от лат. flavus - желтый). Выделяют три разновидности возбудителя — дальневосточный подвид, центрально-европейский подвид и возбудитель двухволнового менингоэнцефалита. Вирионы вируса клещевого энцефалита имеют сферическую форму с диаметром 40—50 им. Внутренним компонентом является нуклеокапсид. Он окружен наружной липопротеидной оболочкой, в которую погружены шипы, состоящие из гликопротеида, обладающего гемагглютинирующими свойствами. Нуклеокапсид содержит однонитчатую РНК. Вирус длительное время сохраняется при низких температурах (оптимальный режим минус 60°С и ниже), хорошо переносит лиофилизацию, в высушенном состоянии сохраняется много лет, но быстро инактивируется при комнатной температуре. Кипячение инактивирует его через 2 мин, а в горячем молоке при 60°С вирус погибает через 20 мин. Инактивирующим действием обладают также формалин, фенол, спирт и другие дезинфицирующие вещества, ультрафиолетовое излучение.
Эпидемиология. Клещевой энцефалит относится к группе природно-очаговых болезней человека. Основным резервуаром и переносчиком вируса в природе являются иксодовые клещи — Ixodes persulcatus, Ixodes ricinus с трансовариальной передачей. Дополнительным резервуаром вируса являются грызуны (заяц, еж, бурундук, полевая мышь), птицы (дрозд, щегол, чечетка, зяблик), хищники (волк). Для заболевания характерна строгая весенне-летняя сезонность заболевания. Динамика заболеваемости находится в тесной связи с видовым составом клещей и наибольшей их активностью. Чаще болеют лица в возрасте 20—40 лет. Основным путем инфицирования человека является трансмиссивная передача через укусы клещей. Возможна также передача инфекции алиментарным путем при употреблении в пищу сырого молока коз и коров, а также при раздавливании клеща в момент его удаления с тела человека и, наконец, воздушно-капельным путем при нарушении условий работы в лабораториях. При алиментарном заражении обращает на себя внимание наличие семейно-групповых случаев болезни.
Патогенез. Инфекционный процесс развивается вследствие внедрения нейротропного вируса и взаимодействия его с организмом человека. Эти взаимоотношения определяются путем внедрения, свойствами и дозой возбудителя, а также резистентностью и реактивностью макроорганизма. Вирус клещевого энцефалита проникает в организм человека в естественных условиях через кожу при присасывании клеща или через сырое молоко домашних животных.
После присасывания клеща вирус распространяется гематогенно и быстро проникает в мозг, фиксируясь здесь клетками. Параллельно с накоплением вируса развиваются воспалительные изменения сосудов и оболочек мозга. Соответствие места укуса клеща последующей локализации сегментарных расстройств указывает на возможность лимфогенного пути проникновения вируса в центральную нервную систему (ЦНС). В отдельных случаях преобладает тот или иной путь, что отражается в клинических особенностях клещевого энцефалита. Возникновение менингеальных и менингоэнцефалических синдромов соответствует гематогенному, а полиомиелитических и радикулоневритических — лимфогенному пути распространения вируса. Инвазия нервной системы возможна также и невральным путем посредством центростремительного распространения вируса через обонятельный тракт. Редкость поражения нижних конечностей при клещевом энцефалите не соответствует частоте присасывания клещей в кожных областях, иннервируемых поясничными и крестцовыми сегментами спинного мозга, что указывает на известную тропность вируса к клеткам шейных сегментов и их аналогов в бульбарных отделах продолговатого мозга.
Вирусемия при клещевом энцефалите имеет двухволновый характер: кратковременная первичная вирусемия, а затем повторная (в конце инкубационного периода), совпадающая по времени с размножением вируса во внутренних органах и появлением его в ЦНС.
Возможно длительное вирусоносительство, которое может быть различным по своим проявлениям и последствиям: латентная инфекция (вирус интегрирован с клеткой или существует в дефектной форме), персистентная инфекция (вирус репродуцируется, но не вызывает клинических проявлений), хроническая инфекция (вирус репродуцируется и вызывает клинические проявления с рецидивирующим, прогрессирующим или регрессирующим течением), медленная инфекция (вирус репродуцируется после длительного инкубационного периода, вызывает клинические проявления с неуклонным прогрессированием, приводящим к смерти).
Симптомы и течение. Выделяют следующие клинические формы болезни:
Независимо от клинической формы у больных наблюдаются общие инфекционные проявления болезни, характеризующиеся лихорадкой и другими признаками синдрома общей инфекционной интоксикации. Инкубационный период клещевого энцефалита длится в среднем 7—14 сут с колебаниями от одних суток до 30 дней. У ряда больных началу заболевания предшествует продромальный период, длящийся 1—2 дня и проявляющийся слабостью, недомоганием, разбитостью; иногда отмечаются легкие боли в области мышц шеи и плечевого пояса, боли в поясничной области в виде ломоты и чувства онемения, головная боль.
Лабораторным подтверждением диагноза служит нарастание титра антител, выявляемое с помощью РСК, РТГА, РПГА, РДНА и реакции нейтрализации. Диагностическим является нарастание титра антител в 4 раза.
Перспективным методом является выделение вируса на культуре ткани. Вирус и его антигены обнаруживаются в первые 7 дней болезни. В последнее время апробирован и хорошо зарекомендовал себя иммуноферментный метод (ИФА) диагностики клещевого энцефалита. С помощью ИФА выявляют антитела к вирусу клещевого энцефалита раньше и в более высоких разведениях сывороток, чем в РТГА и РСК, а также чаще определяют изменение напряженности специфического иммунитета, необходимое для подтверждения клинического диагноза.
Лечение больных клещевым энцефалитом проводят по общим принципам независимо от проводимых ранее профилактических прививок или применения с профилактической целью специфического гамма-глобулина.
Профилактика и мероприятия в очаге. Уничтожение и предотвращение укусов клещей. В течение первых суток после присасывания клеща — экстренная профилактика: донорский иммуноглобулин (титр 1:80 и выше) внутримышечно в дозе 1,5 мл детям до 12 лет, 2 мл — от 12 до 16 лет, 3 мл — лицам в возрасте 16 лет и старше. Для специфической профилактики применяют инактивированную культуральную сорбированную жидкую вакцину.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Леонова Галина Николаевна, Крылова Н.В., Павленко Е.В., Беликов С.И., Кондратьев И.Г.
Показано, что на Дальнем Востоке России разные формы клещевого энцефалита вызывают штаммы вируса только дальневосточного субтипа. Определены иммунопатогенетические особенности разных форм инфекции от инаппарантной до очаговых с летальным исходом. Охарактеризованы штаммы вируса клещевого энцефалита по нейровирулентности и нейроинвазивности.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Леонова Галина Николаевна, Крылова Н.В., Павленко Е.В., Беликов С.И., Кондратьев И.Г.
THE VALUE OF THE FAR EASTERN TICK-BORNE ENCEPHALITIS VIRUS STRAINS OF INFECTIOUS DISEASES
It is shown that in the Russian Far East different forms of tick-borne encephalitis virus strains cause only the Far Eastern subtype. Are defined features of immunopathogenicity of different forms of inapparent infection to focal forms with a lethal outcome. Characterized strains of tick-borne encephalitis virus in neurovirulence and neuroinvazivnosti.
ЗНиСО ЯНВАРЬ №1 (226)
ЗНАЧЕНИЕ ДАЛЬНЕВОСТОЧНЫХ ШТАММОВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА В ИНФЕКЦИОННОЙ ПАТОЛОГИИ
Т.Н. Леонова1, Н.В. Крылова1, Е.В. Павленко1, С.И. Беликов2, И. Г. Кондратьев2
THE VALUE OF THE FAR EASTERN TICK-BORNE ENCEPHALITIS VIRUS STRAINS OF INFECTIOUS DISEASES
G.N.. Leonova, N.V. Krylova, E.V. Pavlenko, S.I. Belikov, I.G. Kondratyev
'Научно-исследовательский институт эпидемиологии и микробиологии СО РАМН, 2Лимнологический институт СО РАН
Показано, что на Дальнем Востоке России разные формы клещевого энцефалита вызывают штаммы вируса только дальневосточного субтипа. Определены иммунопатогенетические особенности разных форм инфекции от инаппарантной до очаговых с летальным исходом. Охарактеризованы штаммы вируса клещевого энцефалита по нейровирулентности и нейроинвазивности. Ключевые слова: вирус клещевого энцефалита, биологическая вариабельность, иммунопатогенез. It is shown that in the Russian Far East different forms of tick-borne encephalitis virus strains cause only the Far Eastern subtype. Are defined features of immunopathogenicity of different forms of inapparent infection to focal forms with a lethal outcome. Characterized strains of tick-borne encephalitis virus in neurovirulence and neuroinvazivnosti.
Keyword: tick-borne encephalitis. immunopathogenicity, neurovirulence, strains of virus.
Вирус клещевого энцефалита (ВКЭ) впервые был открыт в 1937 г. Л.А. Зильбером на территории Дальнего Востока. В настоящее время эта нейроинфекция известна на Евразийском континенте от островов Тихоокеанского бассейна (Япония, Сахалин) до берегов Атлантического океана и имеет выраженную географическую неоднородность по эпидемической напряженно -сти и по тяжести клинического течения инфекции. На территории Приморского края в разные годы удельный вес лихорадочной формы клещевого энцефалита (КЭ) колебался от 20 до 50 %, менингеальной — до 20 % и очаговых форм — от 30 до 60 %.
Наши исследования были направлены на изучение биологической и молекулярной характеристики штаммов ВКЭ, попавших в организм человека при укусе клеща, а также выявление особенностей влияния их на иммунную систему пациента.
Для решения этих вопросов мы применили авторские способы экспресс-диагностики КЭ и изоляции вируса из крови лиц после укуса клеща. Выявление антигена ВКЭ в крови проводили с помощью иммуноферментного анализа (ИФА). За этот период обследовано несколько тысяч лиц с жалобами на укус клеща, а также больных КЭ. Установили, что в 70 % случаев происходила быстрая элиминация вирусного антигена из крови лиц, которые фактически оставались абсолютно здоровыми. У 30 % лиц регистрировали различные формы манифестного течения инфекции. Патологию при КЭ следует рассматривать с позиций единого механизма, лежащего в основе защитного и повреждающего действий имму-номорфологических реакций. Это обусловливает широкий диапазон проявлений инфекционного процесса — от инаппарантных и апаралитических форм до тяжелых очаговых форм острого КЭ с летальными исходами, а иногда с хронически-прогредиентным течением заболевания.
Представил интерес изучить начальный этап (на 2—4-е сутки после укуса клеща) иммунопа-тогенеза инфекции у лиц, в крови которых был выявлен антиген вируса КЭ, но эти люди не заболели. Повторное обследование их на наличие антигена проводили через месяц и при необходимости — через 6 и более месяцев.
При изучении гуморальных факторов иммунитета у таких лиц было отмечено, что в указанные сроки исследования не только клинические проявления заболевания, но и вирусспецифи-ческие антитела класса ^М к антигену ВКЭ не были зарегистрированы.
На ранней стадии инфицирования вирусом КЭ важно было определить иммунологические маркеры, характеризующие либо быструю элиминацию вируса из организма, либо его длительную персистенцию. При иммунофенотипи-ровании субпопуляций лимфоцитов на ранней стадии инфицирования ВКЭ отличительным признаком в группе лиц с кратковременной антигенемией являлось повышение относительного количества естественных киллеров ^К-клеток), Т-лимфоцитов-киллеров ^КТ-клеток) и активированных Т-лимфоцитов (CD3+CD25+, CD3+CD95+) по сравнению с показателями у здоровых доноров.
В то же время у лиц с длительной персистен-цией вируса на начальном этапе инфицирования ВКЭ выявляли сниженный уровень NKT-клеток и активированных Т-лимфоцитов, что можно считать прогностически неблагоприятным признаком. Кроме того, при анализе содержания про- и противовоспалительных цитокинов на ранней стадии инфицирования ВКЭ в крови этих пациентов не выявлена стимуляция продукции провоспалительных цитокинов (^-ф, 1КК-а). И только уровень TNF-а был выше в 1,6 раза, по сравнению с таковым у здоровых доноров, а концентрация №N-7 находилась на уровне контрольных значений. Эти данные, ка-
сающиеся неактивной продукции ^-ф, IFN-a и №N-7, помогают понять причину задержки элиминации вируса у пациентов с длительной анти-генемией.
Следующим этапом наших исследований было выявление особенностей иммунопатогене-за манифестных форм КЭ. Обследовано 50 пациентов в возрасте от 18 до 55 лет, которые были разделены на 3 группы: 1-я группа — 28 пациентов с лихорадочной формой КЭ; 2-я группа — 16 пациентов с благоприятным исходом при очаговых формах КЭ; 3-я группа — 6 пациентов с летальным исходом при очаговых формах КЭ.
Установлено, что при лихорадочной форме КЭ изменения параметров клеточного иммунитета носили компенсаторный характер: снижение количества CD3+- и CD4+-клеток сопровождалось увеличением количества NK-клеток и усилением экспрессии активационных антигенов (CD25+, CD95+). У пациентов данной группы отмечался умеренный характер активации системы комплемента и системного цитокинового ответа ТЫ-типа. Результаты этих исследований показали, что иммунологическая реактивность при лихорадочной форме КЭ соответствует общеизвестным иммунологическим закономерностям и может рассматриваться как адекватный иммунный ответ на вирусную инфекцию.
При очаговых формах КЭ развивается параллельно как противовирусный, так и иммунопатологический ответ. Их суммарное действие влияет на течение и исход инфекции. У пациентов с благоприятным исходом при очаговых формах КЭ в начальной стадии заболевания наблюдался глубокий дефицит Т-клеточного звена иммунитета. Несмотря на активацию гуморального звена иммунной системы, у этих пациентов отмечалась диспропорция содержания подклассов IgG. Низкие концентрации одного или нескольких подклассов IgG служат индикаторами дисфункции Т- и В-клеток, и могут возникнуть в результате нарушения продукции цитокинов. Известно, что дефект в продукции 1Г№-у замедляет переключение синтеза антител с ^М на IgG1 и IgG3. У пациентов этой группы в остром периоде отмечалось повышение уровня противовоспалительных цитокинов, что, с одной стороны, свидетельствует о своевременной активации противовоспалительных механизмов защиты, а с другой стороны, характеризует недостаточность клеточного иммунного ответа на фоне низких значений ТЫ-цитокинов.
Особого внимания заслуживает группа пациентов с летальным исходом при очаговых формах КЭ. Изменения показателей клеточного иммунитета у них характеризовались дефицитом содержания зрелых Т-лимфоцитов (CD3+) на фоне повышения количества незрелых активированных Т- и В-лимфоцитов. Отмечалась также депрессия киллерных механизмов цитотоксической активности (снижение количества CD8+-, NK-, NKT-клеток). В гуморальном звене иммунитета выявлена гиперактивация системы комплемента, в
цитокиновом — ранняя гиперпродукция про- и противовоспалительных цитокинов.
Таким образом, у пациентов этой группы наблюдалась дисфункция различных звеньев иммунной системы активационного типа как системного воспалительного избыточного ответа, характерного для острой фазы инфекционного процесса. Но неадекватность ответа в острой фазе является серьезной предпосылкой к формированию в патогенезе общей иммуно-депрессии, указывающей на тяжелое течение и неблагоприятный прогноз заболевания.
Разнообразие типов иммунного ответа у пациентов с разными формами КЭ обусловлено исходным уровнем иммунокомпетентности организма пациента, дозой антигена вируса, а также степенью вирулентности возбудителя.
В этой связи наши научные поиски были направлены на изоляцию и изучение характеристики вирусной популяции, попавшей в организм человека после укуса клеща и вызвавшей ту или иную форму инфекции. Получена полногеномная характеристика 36 штаммов ВКЭ, изолированных от больных с очаговыми формами в 11 случаях (30,5 %), лихорадочной — в 4 (11,1 %) и в 21 случае (58,3 %) — от лиц с инаппарантной формой инфекции. Показано, что все изученные штаммы принадлежали только к дальневосточному субтипу ВКЭ. На филогенетическом древе они расположились в двух крупных кластерах. Штаммы 1-го кластера заняли близкие позиции к штамму ОБЫша, 2-го кластера — к штамму Со-фьин. В кластере 1 доминировали штаммы, вызвавшие инаппарантную форму КЭ (82 %), здесь же по 9 % пришлось на штаммы с лихорадочной и очаговыми формами инфекции. Второй кластер в большинстве случаев состоял из штаммов, вызвавших манифестные формы. Из них 9 штаммов из группы очаговых форм и 2 — лихорадочной, здесь же расположились 3 штамма, вызвавших инаппарантную форму инфекции. Основная доля инаппарантных штаммов была изолирована на юге Приморского края. Штаммы ВКЭ, которые вызвали очаговые формы с летальным исходом, изолированы в отдаленных таежных районах среднего Сихотэ-Алиня.
Известно, что вирулентность возбудителей инфекционных болезней является одним из наиболее важных биологических свойств микроорганизма. Ведущим патогенетическим маркером, позволяющим дифференцировать штаммы ВКЭ, является, по нашему мнению, уровень периферической активности изолятов, отражающий способность возбудителя проникать в мозг. Причем, при периферической инокуляции вируса проявляется важный компонент нейровирулент-ности — нейроинвазивность.
На модели белых мышей разного возраста дана характеристика нейровирулентности и ней-роинвазивности штаммов ВКЭ, принадлежащих к разным группам. Показано, что вирусная активность всех штаммов для белых мышей при внутримозговом (в/м) заражении чаще имела
ЗНиСО ЯНВАРЬ №1 (226)
высокий уровень (7,7—11,0 ^ LD50/мл), что указывало на выраженную их вирулентность. При подкожном (п/к) заражении титр вируса у инап-парантных штаммов был ниже и колебался от 3,7 до 7,7 ^ LD50/мл. Все изученные штаммы ВКЭ проявили достаточно высокую инфекционную активность. Средняя продолжительность жизни (СПЖ) при в/м заражении мышей весом 18—20 г штаммами, вызвавшими очаговые формы, варьировала от 4,6 до 10,0 дней и в среднем составила 6,1 ± 0,5, а при п/к заражении — 8,9 ± 1,7. Для штаммов, вызвавших инаппарантное течение инфекции при в/м заражении белых мышей, СПЖ составила 14,4 ± 3,2, а при п/к заражении мышей для некоторых штаммов СПЖ резко увеличивалась до 28 дней, в среднем она составила (20,3 ± 3,9) дней. Штаммы, вызвавшие манифестные формы инфекции, как правило, более активно проявляли нейровирулентные и нейро-инвазивные свойства.
Проведено изучение гемагглютинирующей активности (ГА) штаммов при значениях рН 5,4; 6,2 и 6,8. Штаммы, вызвавшие очаговые формы увеличивали ГА активность от рН 5,4 к рН 6,8. Инаппарантные штаммы наоборот имели наибольшую активность при рН 5,4 и наименьшую — при рН 6,8.
Таким образом, показано, что на Дальнем Востоке России инфекционный процесс при КЭ с разной степенью тяжести вызывают штаммы только дальневосточного субтипа ВКЭ, которые вариабельны по параметрам как биоло-
гической (иммунопатогенетической, физико-химической, вирулентности), так и молекулярно-генетической характеристики.
Работа выполнена при поддержке гранта МНТЦ № 4006.
1. Ерман Б.А. Патологическая анатомия современного клещевого энцефалита на Урале. Екатеринбург:1999. 80 с.
3. Леонова Г.Н., Беликов С.И., Павленко Е.В., Кулакова Н.В., Крылова Н.В. Биологическая и молекулярно-генетическая характеристика дальневосточной популяции вируса клещевого энцефалита и ее патогенетическое значение //Вопр. вирусологии. 2007. № 6. С. 13—17.
4. Онищенко Г.Г., Федоров Ю.М., Пакскина Н.Д. Организация надзора за клещевым вирусным энцефалитом и меры по его профилактике в Российской Федерации //Вопр. вирусол. 2007. № 5. С. 8—10.
5. Офицеров В.И. Подклассы иммуноглобулина G: возможности использования в диагностической практике. Кольцово, 2005. 35 с.
Леонова Галина Николаевна, тел.: 8-924-2396480
Contact information: Leonova Galina, phone: 8-924-2396480
Читайте также:


