Синтез днк на матрице и-рнк у вирусов
ДНК-зависимая РНК-полимераза может осуществлять транскрипцию ДНК нормальных клеток и ДНК-вирусов. Как же осуществляется синтез РНК у тех вирусов, которые в геноме вместо ДНК содержат РНК? Оказывается, в этих случаях вирусная РНК индуцирует образование в клетках хозяина (например, у Е. coli) РНК-зависимой РНК-полимеразы, которая участвует в репликации вирусной РНК (отсюда второе название фермента – РНК-репликаза). Фермент также используется нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. Этот синтез должен пройти через стадию образования репликативной формы. Следовательно, на I стадии РНК-репликаза на матрице РНК-вируса специфически строит комплементарную, с противоположной полярностью цепь РНК. Последняя на II стадии служит матрицей для синтеза РНК, совершенно однотипной исходной вирусной РНК. Обе стадии катализируются одним и тем же ферментом, хотя в каждой из них участвуют различные белковые факторы. Следует особо подчеркнуть, что, поскольку РНК-репликаза имеет отношение только к вирусам, очевидно, на этом основании могут быть разработаны эффективные антивирусные лекарственные препараты.
Синтез РНК из нуклеозиддифосфатов. М. Грюнберг-Манаго и С. Очоа в 1955 г. в клетках Е. coli открыли особый фермент – полинуклеотид-фос-форилазу. Этот фермент наделен способностью синтезировать in vitro полимерную молекулу РНК из однотипных или разных рибонуклеозид-дифосфатов (НДФ). Реакция, являющаяся обратимой, протекает по уравнению:
Рибонуклеозидтрифосфаты и дезоксирибонуклеозидтрифосфаты не являются субстратами фермента. Фермент не нуждается в матрице, однако для синтеза необходима затравочная цепь РНК (НМФ)n со свободной 3'-гидроксильной группой, к которой присоединяются остатки моно-нуклеотидов. Образовавшаяся полимерная молекула РНК не имеет заданной специфической последовательности мононуклеотидов, но содержит 3'–>5' фосфодиэфирные связи, легко разрываемые рибонуклеазой. Относительно биологической роли этого фермента у бактерий предполагают, что он катализирует, скорее всего, обратную реакцию – расщепление мРНК с образованием нуклеозиддифосфатов.
Полученные в лаборатории С.С. Дебова данные свидетельствуют о более широком распространении полирибонуклеотид-фосфорилазы в живых организмах, чем это признавалось ранее. Фермент открыт также в клетках животных. Кроме того, получены экспериментальные доказательства синтетической функции полинуклеотид-фосфорилазы. Вполне правомерно допущение, что этот фермент может принимать участие в синтезе коротких полирибонуклеотидов в клетках эукариот в норме и в некоторых экстремальных условиях. Кроме того, в лабораторных условиях фермент может найти применение для синтеза РНК-праймеров, используемых далее при синтезе ДНК.
Проблемы генетической инженерии. Генетическая инженерия, по определению А.А. Баева, представляет собой систему экспериментальных приемов, позволяющих создавать в лаборатории (в пробирке) искусственные биологические структуры. В качестве инструментов для генно-инженерных операций применяются созданные самой природой ферменты: одни из них рассекают молекулу ДНК в строго определенных участках (рестриктазы), другие, напротив, сшивают разрозненные участки в единое целое (лигазы). Конечной целью генетической инженерии является получение организмов (животных и растений) с новыми наследственными свойствами с помощью лабораторных приемов. Для достижения этой пока еще отдаленной цели необходимо проведение огромной работы на уровне отдельного гена или генов. Ген, представленный определенным участком ДНК и соответствующий определенному белку, можно или выделить из другого организма, или синтезировать химическим либо биологическим путем. Впервые в 1969 г. из Е. coli был выделен участок ДНК с геном, ответственным за синтез фермента, катализирующего усвоение молочного сахара (лактозы),– так называемый лактозный оперон. Химический синтез гена аланиновой тРНК впервые осуществил Хар Гобинд Корана в 1970 г. Состоящий из 72 нуклеотидов, этот ген, однако, лишен функциональной активности, так как в клетках тРНК синтезируется не в готовом виде, а в форме предшественника. Эти данные послужили для Кораны основой для синтеза гена-предшественника тирозиновой тРНК (из 126 нуклеоти-дов), хотя сама тирозиновая тРНК состоит из 85 нуклеотидов. Ввиду громоздкости, а также недостаточной эффективности химического синтеза в последние годы все большее место занимают биологические методы синтеза генов при помощи обратной транскриптазы (ревертазы). Для этого необходимо иметь мРНК, с помощью которой можно воспроизвести соответствующий ген. Синтезированы ДНК-копии на мРНК, кодирующие синтез белка глобина (человека, кролика, мыши, голубя, утки), иммуноглобулина, белка хрусталика глаза и др. Однако на этом пути синтеза генов встречаются большие трудности, связанные с выделением из огромного разнообразия клеточных мРНК, нужной для синтеза гена.
Следующий этап генетической инженерии – перенос генов в клетку – осуществляется тремя способами: трансформацией (перенос генов посредством выделенной из клеток и освобожденной от примесей ДНК), трансдукцией (перенос генов посредством вирусов) и гибридизацией клеток, полученных из разных организмов (высших животных, микроорганизмов и др.) (рис. 13.7, 13.8). Заключительный этап этих экспериментов сводится к адаптации введенного гена в организме хозяина, но он почти не зависит от искусства экспериментатора.
Исследования в области генетической инженерии могут служить основой для решения практических задач здравоохранения и сельского хозяйства. Полученные в лаборатории искусственные гены, помимо широкого использования в микробиологической и фармацевтической промышленности для приготовления кормового белка и лекарственных препаратов (инсулин, интерферон, гормон роста, гормоны щитовидной железы, стимуляторы иммунитета и др.), возможно, смогут применяться при лечении многих наследственных заболеваний (их насчитывается около 5000), генетический дефект которых точно известен пока только для небольшого числа (не более 50) болезней.
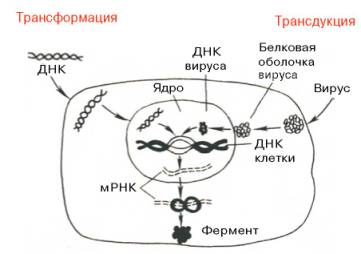
Рис. 13.7. Схематическое изображение двух способов введения генов в клетку – трансформации и трансдукции (по А. А. Баеву).
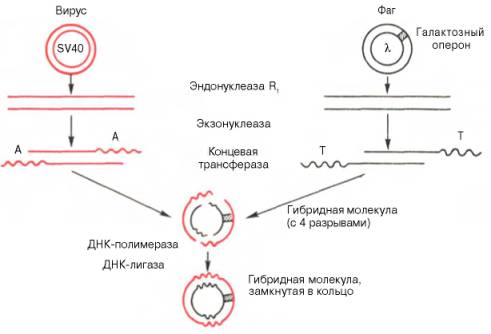
Рис. 13.8. Получение гибридной молекулы, содержащей одновременно ДНК вируса SV40, ДНК фага λ, и галактозный оперон (схема по А.А. Баеву).
Под действием эндонуклеазы R1Е. coli кольцевые ДНК разрываются в одной точке, в результате образуются линейные нити. Под действием другого фермента - экзонуклеазы (из фага) укорачиваются нити ДНК с противоположных концов. Далее при помощи фермента концевой трансферазы наращиваются нити ДНК, причем у одной ДНК новые концы состоят из адениловых (А), у другой - из тимидиловых (Т) остатков. При смешивании молекул концевые остатки А и Т образуют комплементарные пары, замыкая линейные молекулы в кольца. Вначале эти кольца содержат 4 разрыва, которые затем закрываются при участии еще одного фермента - ДНК-лигазы.
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив НЕ НУЖНО зубрить.
См. сначала п.70, 73 и 74, 77, 79, можно 78 и 76.
РНК – это цепь из (рибо)нуклеотидов.
Точнее – это полимер из нуклеотидных остатков в качестве мономеров.
Функции РНК:
набор разных РНК позволяет синтезировать белки, закодированные в ДНК.
Кроме этого, есть регуляторные РНК.
80. 1. Транскрипция, ее отличия от репликации. п.70, 73, 77 и 78.
Синтез РНК на матрице РНК тоже бывает, он называется репликацией РНК (см. п.77) и обнаружен только у вирусов.
Синтез РНК похож на синтез ДНК при репликации, но есть и отличия:
1. Матрица.
При репликации в качестве матриц используются обе цепи ДНК полностью
(кроме концов ДНК – см. теломеры в п.78),
При транскрипции в качестве матрицы используется тоже ДНК,
но не вся, а только участок одной из цепей дуплекса –
это транскрибируемый участок ДНК, использующийся в качестве матрицы при транскрипции, называется гЕном.
2. Субстраты.
ДНК синтезируется из дезоксирибонуклеотидов (дАТФ, дГТФ, дТТФ, дЦТК),
а РНК – из рибонуклеотидов (из АТФ, ГТФ, УТФ и ЦТФ).
3. Основной фермент
синтеза ДНК (присоединяющий новые нуклеотиды) – ДНК-полимераза (см. п.78),
а основной фермент синтеза РНК (транскрипции) – РНК-полимераза.
4. Праймер:
При синтезе РНК не нужно образовывать праймер (РНК-затравку),
а при синтезе ДНК (при репликации) нужно образовывать праймер (затравку из РНК).
Чтобы ДНК стала матрицей при транскрипции,
перед транскрипцией цепи ДНК должны отделиться друг от друга
(не по всей длине ДНК, а только в том участке, где происходит транскрипция).
После разделения цепей дуплекса одна из цепей дуплекса используется в качестве матрицы при синтезе РНК (при транскрипции).
Начало синтеза РНК (транскрипции) называется ИНИЦИАЦИЕЙ транскрипции.
К определённому нуклеотиду ДНК присоединяется первый нуклеотид РНК
(тот из четырёх рибонуклеотидов, который комплементарен этому нуклеотиду ДНК-матрицы;
связывание нуклеотидов происходит через азотистые основания, водородными связями – см. п.78 и 77),
то есть к азотистому основанию нуклеотида матрицы
водородными связями присоединяется комплементарное основанию
азотистое основание нуклеотида РНК.
Затем ко второму нуклеотиду матрицы так же присоединяется
второй нуклеотид РНК (комплементарный второму нуклеотиду матрицы).
После этого два фосфата от второго нуклеотида отщепляются,
а за счёт выделяющийся при этом энергии
второй рибонуклеотид присоединяется к первому рибонуклеотиду будущей РНК фосфодиэфирной связью (ФДЭ):
к атому кислорода первого нуклеотида в его 3’ положении
присоединяется атом фосфора второго нуклеотида в его 5’ положении.
Из-за такого образования ФДЭ получается, что в начале РНК свободен 5’ конец,
а в конце РНК свободен 3’ конец,
а направление синтеза РНК получается от 5’ конца к 3’ концу.
(Свободен в том смысле, что не образовал ФДЭ-связи).
При этом синтезируемая РНК антипараллельна ДНК-матрице,
с которой связана водородными связями.
Из-за антипараллельности комплементарных нуклеиновых кислот
ДНК-матрица при транскрипции считывается в направлении от 3’ конца к 5’ концу.
После этого к третьему нуклеотиду матрицы
присоединяется водородными связями комплементарный ему третий нуклеотид РНК,
затем этот третий рибонуклеотид соединяется фосфодиэфирной связью
со вторым рибонуклеотидом будущей РНК и т.д.
Процесс присоединения новых рибонуклеотидов и удлинения РНК
называется элонгацией (продолжением) транскрипции
и продолжается до тех пор, пока в ДНК не встретятся специальные последовательности нуклеотидов –
при их появлении синтез РНК прекращается –
(это прекращение синтеза РНК называется терминацией транскрипции –
так же как прекращение синтеза ППЦ при трансляции
называется терминацией трансляции – см. п.82).
Основной фермент транскрипции(синтеза РНК):
Присоединение новых рибонуклеотидов при синтезе РНК при транскрипции катализируется ферментом РНК-полимеразой.
При начале транскрипции РНК-полимераза соединяется с участком ДНК,
который содержит много аденина и тимина
и поэтому называется ТАТА-участком или ТАТА-боксом.
Синтезированная при транскрипции РНК называется ПЕРВИЧНЫМ ТРАНСКРИПТОМ
или про-РНК, поскольку ещё не является зрелой формой РНК,
а является только предшественницей зрелой РНК.
Для превращения про-РНК в зрелую РНК нужен процессинг про-РНК:
80. 2. Процессинг про-РНК. См. п.76.
Синтезированные при транскрипции РНК (про-РНК)
подвергаются дополнительным видоизменениям,
после которых приобретают способность выполнять свои функции.
Эти процессы называются созреванием про-РНК
или ПРОЦЕССИНГОМ про-РНК.
ПРОЦЕССИНГ про-РНК – это превращение первичного транскрипта
(РНК, полученной при транскрипции)
в молекулу зрелой РНК (мРНК, тРНК, рРНК, малые РНК).
Один из процессов процессинга про-РНК заключается в том, что
некоторые участки про-РНК удаляются,
а остальные участки про-РНК соединяются между собой
(соединяются концы, образующиеся после удаления участков) фосфодиэфирными связями.
Осуществляется сплайсинг
специальными комплексами, состоящими из белков и малых ядерных РНК,
которые называются СПЛАЙСО/СОМАМИ.
При этом малые РНК осуществляют функцию катализаторов, то есть являются РИБОЗИМАМИ.
Другой процесс, в котором участвуют рибозимы – это синтез белков п.82:
рибозимом является рибосомальная РНК,
которая участвует в образовании пептидной связи между аминоацилами
при транспептидации во время элонгации трансляции.
Сплайсинг должен протекать очень точно:
при удалении участка, которые всего на один нуклеотид короче или длиннее,
чем нужно,
получится в итоге РНК с совсем другими ТРИПЛЕТАМИ (см. 82),
на которой будет синтезироваться совсем другая ППЦ вместо нужной.
Поэтому нарушения сплайсинга
могут быть причиной нарушений синтеза данного белка,
и приводит к протеинопатиям (см. п. 57 и 79),
даже если нет мутаций в гене, при нормальном гене.
Примеры болезней, в развитии которых есть нарушение сплайсинга:
1) некоторые талассемии (нарушения синтезе глобиновых цепей гемоглобина),
2) системная красная волчанка.
Из одной и той же про-РНК при сплайсинге могут удаляться разные участки.
То есть разные участки про-РНК могут считаться интронами.
(Разные, но строго определённые).
Это явление называется АЛЬТЕРНАТИВНЫМ СПЛАЙСИНГОМ.
Из-за наличия альтернативного сплайсинга
из одной и той же молекулы про-РНК
после сплайсинга могут получиться совершенно разные зрелые мРНК,
то есть с разными последовательностями нуклеотидов, с разными кодонами – п.82.
И при трансляции этих разных мРНК получаются разные ППЦ и разные белки.
По этой причине при 20 000 генов человека у него около 100 000 белков.
По этой же причине ген кодирует не одну ППЦ, а несколько.
80. 3. Обратная транскрипция. См. п.79, 86.
РНК может использоваться не только для синтеза белка (п.82),
но может стать и матрицей для синтеза ДНК.
Процесс синтеза ДНК на матрице РНК называется ОБРАТНОЙ ТРАНСКРИПЦИЕЙ
(потому что про обычной транскрипции РНК синтезируется на матрице ДНК).
Фермент, катализирующий процесс обратной транскрипции,
называется ОБРАТНОЙ ТРАНСКРИПТАЗОЙ или РНК-зависимой ДНК-полимеразой.
Сначала на цепочке РНК синтезируется комплементарная ей цепочка дезоксинуклеотидов (то есть ДНК).
После этого уже эта цепочка ДНК становится матрицей для синтеза второй цепочки ДНК.
Синтез обеих цепочек катализируется обратной транскриптазой,
хотя синтез второй цепочки ДНК на матрице ДНК не является обратной транскрипцией.
В итоге образуется двухцепочечная молекула ДНК,
которая является КОПИЕЙ ГЕНА
(того участка ДНК, который был матрицей при синтезе РНК).
Интеграция в генОм.
Копии генов, полученных благодаря обратной транскрипции,
могут встраиваться в хромосомы.
Процесс встраивания копий генов в хромосомы называется интеграцией в генОм.
При интеграции в хромосому копии гена
может произойти повреждение ДНК – изменение генов или регуляторных участков ДНК (п.81).
Поэтому интеграция в геном является потенциально мутагенным процессом – см. п.79.
Интеграция в геном относится к так называемым ПЕРЕСТРОЙКАМ генома.
И формально не считается разновидностью мутаций.
Как и все перестройки, интеграция в геном может привести: к превращению проонкогена в онкоген и антионкогена в неактивный антионкоген – п.87.
В геном могут встраиваться (интегрироваться) не только копии собственных генов,
но и вирусные ДНК, в том числе ДНК, полученные на матрице вирусной РНК – см. п.86.
Для амплификации нужны:
1) транобычная скрипция гена для получения РНК, которая станет матрицей,
2) обратная транскрипция этой РНК
(синтез на РНК первой цепи ДНК,
затем синтез на первой цепи ДНК – второй цепи ДНК),
3) интеграция в геном полученной двухцепочечной ДНК (копии гена).
Зачем нужны копии генов и процесс копирования?
Для ускорения синтеза белка и увеличения числа молекул белка:
Считается, что амплификация помогает быстрее синтезировать некоторые белки во время эмбриогенеза.
БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ
Биосинтез нуклеиновых кислот протекает только при наличии всех четырех видов дезоксирибонуклеозидтрифосфатов (синтез ДНК) или рибонуклеозидтрифосфатов (синтез РНК). Биосинтез идет при каталитическом воздействии ферментов - ДНК- или РНК-полимераз. Необходимо наличие затравки в виде готового полинуклеотида, который играет роль матрицы. Это обеспечивает биосинтез нуклеиновых кислот со строго заданной последовательностью нуклеотидных остатков в молекуле.
БИОСИНТЕЗ ДНК (РЕПЛИКАЦИЯ)
Общая схема биосинтеза ДНК (А. Корнберг, 1958): двойная спираль ДНК раскручивается, цепи расходятся. Одинарные цепи ДНК служат матрицей для синтеза новых цепей. В результате получаются две двухцепочечные молекулы ДНК, идентичные исходной молекуле. Последовательность нуклеотидов новых цепей определяется правилом комплементарности оснований и последовательностью нуклеотидов имеющейся цепи. Синтез ДНК называется репликацей.
Гомологическая репликация – бесконечное повторение процесса удвоения числа молекул путем прямого копирования их структуры. Такой способ удвоения молекул ДНК называется полуконсервативным. Консервативный механизм – вновь синтезируемая нуклеотидная цепь образуется прямо на двойной спирали ДНК, без ее раскручивания.
За выдающийся вклад в решение проблем биосинтеза ДНК и РНК
А. Корнберг и С. Очоа были удостоены Нобелевской премии в 1959 г.
Ферменты биосинтеза ДНК. Прокариоты.
Хеликаза – раскручивает двойную спираль ДНК в репликационной вилке.
РНК-полимераза (праймаза) катализирует синтез олигорибонуклеотида (от 10 до 60 нуклеотидов), т. е. праймера, с которого начинается синтез ДНК.
Праймасома - комплекс, включающий около 20 полипептидов. Участвует в формировании специфической вторичной структуры ДНК, подходящей для узнавания праймазой.
ДНК-полимераза I катализирует отщепление затравочного праймера, удаление ошибочно присоединенных нуклеотидных остатков и заполнение образующихся пробелов (ДНК-полимеразная активность). ДНК-полимераза I в качестве матрицы использует одноцепочечные участки.
ДНК-полимераза II достраиваете поврежденные участки в молекуле ДНК, т. е. осуществляет репарациюДНК.
ДНК-полимераза III катализирует синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации. В качестве матрицы использует двухцепочечные ДНК, в которых есть короткие одноцепочечные последовательности (отличие от ДНК-полимеразы I, которая использует в качестве матрицы одноцепочечные участки).
ДНК-лигаза соединяет две цепи ДНК или замыкает два конца одной цепи в процессе репликации либо репарации.
Топоизомеразы создают или уничтожают суперспирализацию путем сшивания образующихся разрывов или разрезания ДНК.
ДНК-полимеразы эукариот – α, β, γ, d, ε.
В репликации ДНК участвуют два главных типа полимераз - α и d. ДНК-полимераза d катализирует синтез ведущей цепи ДНК, а ДНК-полимераза-α - отстающей цепи ДНК, являясь составной частью праймасомы. Ни одна из ДНК-полимераз эукариот, в отличие от прокариот, не обладает нуклеазной активностью.
ДНК-полимераза γ реплицирует митохондриальную ДНК.
ДНК-полимераза ε в ряде случаев заменяет ДНК-полимеразу d.
ДНК-лигаза устраняет разрывы в одной из цепей ДНК, замыкает линейную молекулы ДНК в кольцевую структуру.
Белковые факторы, необходимые для биосинтеза ДНК.
ДНК-связывающий белок.Ослабляет взаимодействие цепей в молекуле ДНК. Активирует ДНК-полимеразы II и III.
ДНК-раскручивающий белокобладает нуклеазной активностью. Разрывает связь одной из цепей ДНК, что обеспечивает раскручивание ее молекулы.
ДНК-закручивающий белок вызывает суперспирализацию ДНК.
Всего в репликации ДНК участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК-репликазную систему,называемую реплисомой.
Этапы биосинтеза ДНК
Инициация. К одноцепочечному фрагменту ДНК в момент распаривания биспиральной структуры присоединяются ДНК-связывающий белок, ДНК-раскручивающий белок, ДНК-полимеразный комплекс, праймаза и праймосома.Формируется репликативная вилка.
На материнской цепи ДНК при участии праймазысоздается затравочный олигонуклеотид – праймер.Затем при посредстве ДНК-полимеразы III на материнской цепи ДНК синтезируется дочерняя цепь.
Элонгация.Процесс полимеризации идет только в направлении 5' ® 3'.Обе цепи реплицируются одновременно. Их синтез идет в противоположных направлениях. Синтез ведущей цепи ДНК осуществляется непрерывно.
Отстающая цепь образуется в направлении, обратном движению репликативной вилки. Синтез происходит фрагментарно. Эти фрагменты получили название фрагментов Оказаки (в честь японского биохимика, впервые предложившего схему биосинтеза ДНК, в которой были преодолены трудности, связанные с антипараллельностью цепей ДНК в ее биспиральной молекуле. Длина фрагментов Оказаки – 150-200 тысяч нуклеотидов у эукариот и 1000-2000 – у бактерий).
Элонгация завершается отделением праймеров и замещением свободных мест комплементарными дезоксирибонуклеотидами под действием ДНК-полимеразы I. Отдельные фрагменты ДНК объединяются при помощи ДНК-лигаз.
Точность репликацииДНК – одна ошибка на 10 10 реакций. Допущенная ошибка может быть исправлена в ходе репарационных процессов.
Репликация начинается в участках ДНК, имеющих определенную нуклеотидную последовательность и называемых ориджинами. Ориджины расположены примерно через 100 000 нм. Участок ДНК между соседними ориджинами называют репликоном.Каждый репликон реплицируется двумя репликативными комплексами, движущимися навстречу друг другу. Один репликон реплицируется за 2 ч. И столько же времени потребуется для репликации молекулы ДНК любой длины. Фактически репликация генома человека in vivo продолжается 6-8 ч. Если бы молекула ДНК реплицировалась одним репликативным комплексом, то потребовалось бы 10 дней.
Терминация.Прекращение репликации ДНК программируется особой нуклеотидной последовательностью.
Синтез ДНК на матрице РНК
Выдающимся достижением является открытие в составе онковирусов (вирус Раушера и саркомы Рауса) фермента обратной транскриптазы, или ревертазы (РНК-зависимая ДНК-полимераза), катализирующего биосинтез молекулы ДНК на матрице РНК. Ревертаза нуждается в праймере, роль которого может играть тРНК.
На I этапе фермент ревертаза синтезирует на матрице вирусной РНК комплементарную цепь ДНК. Образуется так называемая гибридная молекула.
II этап - разрушение исходной вирусной РНК.
На IIIэтапе на матрице цепи ДНК комплементарно синтезируются новые цепи ДНК.
Ревертаза нашла применение в молекулярной биологии для синтеза генов и фрагментов генов и в генетической инженерии, для расшифровки первичной структуры РНК и белков.
БИОСИНТЕЗ РНК
Биосинтез РНК - транскрипция,т.е. переписывания информации с ДНК-матрицы.Биосинтез РНК осуществляется на ДНК при посредстве РНК-полимераз.
У эукариототкрыты три разные РНК-полимеразы. РНК-полимераза I катализирует синтез рибосомных РНК, РНК-полимераза II - матричной РНК, РНК-полимераза III - транспортных РНК, а также ряда низкомолекулярных РНК со специфической функцией. Вместе с ферментом в единый транскрипционный комплекс объединены множество регуляторных белков (факторы транскрипции).
Все виды РНК синтезируются на ядерной ДНК в качестве матрицы.
Синтез мРНК.Одновременно на молекуле ДНК могут синтезироваться много молекул РНК. Ген эукариот наряду с кодирующими последовательностями (экзоны) содержит также некодирующие (интроны). РНК-полимераза катализирует транскрипцию как экзонов, так и интронов с образованием первичного транскрипта (РНК-предшественника). Наряду с информативными зонами они содержат неинформативные участки. В дальнейшем в ядре происходит процессинг,или созревание РНК.
Освоение синтеза ДНК по матрице РНК: проект Ревертаза в действии
В 1973 г. на Международном симпозиуме по генетике и селекции промышленных микроорганизмов, проходившем в Армении, а также на Симпозиуме по структуре и функциям нуклеиновых кислот и нуклеопротеидов (Москва) было рассказано о ферментативном синтезе участка гена белка глобина (белок красных кровяных телец) голубя.
В 1973 г. на Международном симпозиуме по генетике и селекции промышленных микроорганизмов, проходившем в Армении, а также на Симпозиуме по структуре и функциям нуклеиновых кислот и нуклеопротеидов (Москва) было рассказано о ферментативном синтезе участка гена белка глобина (белок красных кровяных телец) голубя.
Синтез был выполнен группой ученых — доктором биологических наук Л. Л. Киселевым, кандидатом биологических наук Л. Ю. Фроловой и академиком В. А. Энгельгардтом (Институт молекулярной биологии АН СССР) совместно с доктором биологических наук К. Г. Газаряном и В. 3. Тарантулом (Институт атомной энергии им. И. В. Курчатова).
Чтобы понять суть этой работы, необходимо вернуться к 1970 г., когда американские исследователи X. Темин и Д. Балтимор обнаружили в составе олухолеродных вирусов, содержащих РНК (рибонуклеиновую кислоту) в качестве своего генетического материала, необычный фермент, получивший затем название обратная транскриптаза (ревертаза). Фермент оказался способен вести синтез ДНК (дезоксирибонуклеиновой кислоты), используя молекулы РНК как матрицу. Следует напомнить, что обычный синтез в клетках идет в противоположном направлении, а именно: молекулы РНК образуются на молекулах ДНК как на матрицах. Поскольку обычный процесс изображают схемой ДНК ® РНК, то обратный процесс, катализируемый ревертазой, обозначают схемой РНК ® ДНК и называют обратной транскрипцией (обратным переписыванием).
Процесс обратной транскрипции, открытый у опухолеродных вирусов интересен прежде всего исследователям природы превращения нормальных клеток в раковые. Сейчас стало ясно, что вирусогенетическая теория возникновения рака, сформулированная много лет назад выдающимся советским ученым Л. А. Зильбером, приложима не только к ДНК-содержащим (это было доказано еще в 1967—1969 гг.), а и к РНК-содержащим опу-холеродным вирусам. При обратной транскрипции РНКовая форма вируса превращается в ДНКовую, а затем последняя выступает в интимный контакт с наследственным материалом (ДНК) клетки. Особенно важно изучить значение обратной транскрипции при таких заболеваниях, как лейкозы человека и сельскохозяйственных животных, которые, по всей видимости, вызываются РНК-содержащими опухолеродными вирусами.
Еще одна важная сторона открытия фермента обратной транскрипции состоит в том, что стало возможным получать ДНКовые копии РНК в пробирке, вне организма. Этим в 1972 г. воспользовались три лаборатории в США, где удалось получить дополнительные (комплементарные) ДНК, пользуясь РНК как матрицей. В опытах использовались информационные (матричные) РНК (мРНК), в которых зашифрована последовательность аминокислот, входящих в состав белка глобина у кролика или человека В живых клетках эти мРНК синтезируются на генах (ДНК), кодирующих структуру глобинов, и представляют собой дополнительную копию этих генов. Когда при обратной транскрипции матрицей служат мРНК, то образуется ДНК, аналогичная той, которая при обычном синтезе по пути ДНК - РНК служит матрицей этой мРНК. Иными словами, с помощью ре-вертазы в экспериментальных условиях можно получать участки определенных генов, что представляет большой теоретический и практический интерес.
Именно благодаря проекту участникам заключительной работы по ферментативному синтезу ДНК, о которых упоминалось вначале, удалось выполнить его в очень сжатые сроки, и наша страна также вошла в числе тех стран (США, Англия, Швейцария, Голландия и др.) где успешно освоен синтез генетического материала вне клеток путем обратной транскрипции. Помимо большого выигрыша во времени, благодаря проекту достигнута и значительная экономия средств (работы по обратной транскрипции нуждаются в весьма дорогостоящих реактивах и оборудовании).
Наука и человечество. 1975. Сборник - М.: Знание, 1974.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
ДНК-зависимая РНК-полимераза может осуществлять транскрипцию ДНК нормальных клеток и ДНК-вирусов. Как же осуществляется синтез РНК у тех вирусов, которые в геноме вместо ДНК содержат РНК? Оказывается, в этих случаях вирусная РНК индуцирует образование в клетках хозяина (например, у Е. coli) РНК-зависимой РНК-полимеразы, которая участвует в репликации вирусной РНК (отсюда второе название фермента — РНК-репликаза). Фермент также использует нук-
леозидтрифосфаты для синтеза одноцепочечной вирусной РНК. Этот синтез должен пройти через стадию образования репликативной формы. Следовательно, на первой стадии РНК-репликаза на матрице РНК-вируса специфически строит комплементарную, с противоположной полярностью цепь РНК. Последняя на второй стадии служит матрицей для синтеза РНК, совершенно однотипной исходной вирусной РНК; обе стадии катализируются одним и тем же ферментом, хотя в каждой из них участвуют различные белковые факторы. Следует особо подчеркнуть, что, поскольку РНК-репликаза имеет отношение только к вирусам, очевидно, на этом основании могут быть разработаны эффективные антивирусные лекарственные препараты.
Синтез РНК из нуклеозиддифосфатов.М. Грюнберг-Манаго и С. Очоа в 1955 г. в клетках Е. coli открыли особый фермент — полинуклеотид-фосфорилазу, — наделенный способностью синтеза полимерной молекулы РНК из однотипных или разных рибонуклеозиддифосфатов. Рибонуклеозидтрифосфаты и дезоксирибонуклеозидтри-фосфаты не являются субстратами фермента. Фермент не нуждается в матрице, однако для синтеза необходима затравочная цепь РНК со свободной З'-гидроксиль-ной группой, к которой присоединяются остатки мононуклеотидов. Образовавшаяся полимерная молекула РНК не имеет заданной специфической последовательности мононуклеотидов, но содержит У -* 5' фосфодиэфирные связи, легко разрываемые рибонуклеазой. Относительно биологический роли этого фермента у бактерий можно предположить его каталитическое фосфоролитическое действие на короткоживущие мРНК.
Полученные в последние годы в лаборатории С. С. Дебова данные свидетельствуют о более широком распространении полирибонуклеотид-фосфорилазы в живых организмах, чем это признавалось ранее. Фермент открыт также в клетках животных. Кроме того, получены экспериментальные доказательства синтетической функции полинуклеотид-фосфорилазы. Вполне правомерно допущение, что этот фермент может принимать участие в синтезе коротких полирибонуклеотидов в клетках эука-риот в норме и при некоторых экстремальных условиях.
Проблемы генетической инженерии.Целью генетической инженерии является получение организмов (животных и растений) с новыми наследственными свойствами с помощью чисто лабораторных приемов. Для достижения этой пока еще отдаленной цели необходимо ввести в организм соответствующий ген или гены. Ген, представленный определенным участком ДНК и соответствующий определенному белку, можно или выделить из другого организма, или синтезировать химическим или биологическим путем. Впервые в 1969 г. из Е. coli был выделен участок ДНК с геном, ответственным за синтез фермента, катализирующего усвоение молочного сахара (лактозы), — так называемый лактозный оперон. Химический синтез гена аланиновой тРНК впервые осуществил Хар Гобинд Корана в 1970 г. Состоящий из 72 нуклеотидов, этот ген, однако, был лишен функциональной активности, так как в клетках тРНК синтезируется не в готовом виде, а в форме предшественника. Эти данные послужили для Кораны основой для синтеза уже гена предшественника тирозиновой тРНК (из 126 нуклеотидов), хотя сама тирозиновая тРНК состоит из 85 нуклеотидов. Ввиду громоздкости, а также недостаточной эффективности химического синтеза в последние годы все большее место занимают биологические методы синтеза генов при помощи обратной транскриптазы (ревертазы). Для этого необходимо иметь мРНК, с помощью которой можно воспроизвести соответствующий ген. С 1972 г. этим путем синтезированы ДНК-копии на мРНК, кодирующие синтез белка глобина (человека, кролика, мыши, голубя, утки), иммуноглобулина и белка хрусталика глаза. Однако на этом пути синтеза генов встречаются большие трудности, связанные с выделением из огромного разнообразия клеточных мРНК нужной для синтеза гена.
Следующий этап генетической инженерии — перенос генов в клетку — осуществляется тремя способами: трансформацией (перенос генов посредством выделенной из клеток и освобожденной от примесей ДНК), трансдукцией (перенос генов посредством вирусов) или гибридизацией клеток, полученных из разных орга-
низмов (высших животных, микроорганизмов и др.) (рис. 12.6 и 12.7). Заключительный этап этих экспериментов сводится к адаптации введенного гена в организме хозяина и почти не зависит от искусства экспериментатора.
Исследования в области генетической инженерии могут служить основой для решения практических задач здравоохранения и сельского хозяйства. Полученные в лаборатории гены, помимо широкого использования в микробиологической промышленности для приготовления лекарственных препаратов белковой природы (гормонов, ферментов и др.), возможно, смогут применяться при лечении многих наследственных заболеваний (их насчитывается более 2000), генетический дефект которых точно известен пока только для небольшого числа (не более 50) болезней. Первые попытки применения лактозного оперона при галактозе-мии (наследственном заболевании, связанном с непереносимостью галактозы из-за отсутствия фермента гек-созо-1 -фосфатуридилилтрансферазы; см. главу 9) вселяют надежду на реальные практические возможности генетической инженерии, хотя вполне обоснованы тревога и опасения, связанные с вмешательством человека в сферу тончайших биологических процессов наследственного аппарата целостного организма. В последние годы, после бурного периода расцвета в генетической инженерии, наблюдается некоторый спад, обусловленный недостаточностью знаний о структуре и функционировании генома клеток эукариот. Переход от исследований на клетках прокариот к исследованиям на клетках эукариот встретил ряд технических трудностей из-за мо-заичности структуры генов ДНК последних. В частности, открытие экзонов и интронов в геноме ДНК, открытие явления сплайсинга (формирование зрелой матричной РНК) указывают на необходимость соблюдения высочайшей точности процедуры вырезания необходимого гена
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


