Стволовые клетки и вирусы
Пол Нопфлер (Paul S. Knoepfler) – профессор кафедры клеточной биологии и анатомии человека Центра генома и Комплексного онкологического центра при Калифорнийском университете. В своем блоге он комментирует последние новости об эффективности стволовых клеток против коронавирусной инфекции.
Количество зарегистрированных клинических исследований стволовых клеток для лечения COVID-19, вызванного коронавирусом SARS-CoV-2, продолжает расти, особенно в Китае.

Часть рисунка из препринта, в котором заявлено о стволовых клетках, улучшивших исход заболевания COVID-19. Состояние легких на рентгенограмме сначала ухудшалось (более зернистый инфильтрат в воздушных пространствах) по мере прогрессирования заболевания, а затем улучшалось после инфузий стволовых клеток.
В течение последних двух недель я пытался выделить немного времени, чтобы изучить эти исследования более подробно, но не смог вникнуть достаточно глубоко, потому что был очень занят другими вещами.
То, что я до сих пор прочитал в описаниях исследований о COVID-19 и стволовых клетках, не убедило меня в том, что стволовые клетки могут быть полезны для лечения COVD-19. Обоснования этого подхода мне показались шаткими.
Могу ли я быть категорически неправ?
Сомневаюсь. За последние несколько дней китайские исследователи опубликовали ознакомительные фрагменты двух статей, в которых утверждается, что мезенхимальные стволовые клетки (МСК) успешно применяли для лечения пациентов с коронавирусной инфекцией, и эту информацию подхватили СМИ.
Вот два ключевых пункта под заголовком новостной статьи, которые также отражают оптимистичные взгляды:
Я откопал два препринта, которые стали основой статьи Чена:
Я не могу ничего с собой поделать и скептически отношусь к этим отчетам после их изучения.
Надеюсь, я ошибаюсь, но все это (особенно новостная статья) дало мне какое-то мрачное дежавю из прошлого о клиниках стволовых клеток и личностях, утверждающих, что они могут снова заставить ходить парализованного человека.
Конечно, в реальности это всего лишь короткие сообщения о клинических случаях, и их следует интерпретировать с большой осторожностью, поскольку нельзя исключать самопроизвольное выздоровление, именно так проводятся быстрые клинические исследования во время вспышки.
Вы согласны? Что вы думаете на этот счет?
В конце статьи Чена у нас есть слова одного из исследователей:
«По словам д-ра Ли Хунхуи, который участвует в аналогичных испытаниях в центральной больнице Лоуди в центральной части провинции Хунань, инъекции стволовых клеток могут дать значительные результаты в течение трех дней.
Посмотрим, к чему приведет применение стволовых клеток против коронавируса. Я считаю, что мы не увидим клинического подтверждения недоказанных заявлений, например, о здоровье легких в целом или чего-то подобного.
Таково мнение Пола Нопфлера.
Читать статьи по темам:
Читать также:
Эффективный метод получения иПСК без применения вирусов и генов
Новый метод позволяет превращать соматические клетки кожи как в индуцированные плюрипотентные стволовые клетки, так и в соматические клетки других типов без вмешательства в генетический материал.
Аденовирусы перепрограммируют соматические клетки в плюрипотентные
Аденовирусное перепрограммирование клеток намного менее эффективно, чем при использовании ретровирусов. Но при этом ни в одном случае не появилось опухолевых образований, а геномы получившихся плюрипотентных клеток не имеют вирусных вставок.
Вакцина от коронавируса найдена?!
К сожалению, все прототипы вакцин от SARS-CoV-2, созданные на сегодняшний день – это разработки на нулевой стадии доклинических испытаний.
Еще одна опасность ожирения
Мыши помогли понять механизмы, с помощью которых заражение вирусом тучных людей делает его опаснее для них самих и окружающих.
Интервью члена международной группы по разработке вакцины от китайского вируса – так ли он страшен и могли ли его запустить специально.
Подождите лет двадцать
В ближайшие десятилетия рак шейки матки может полностью исчезнуть в развитых странах. Первыми в их числе, вероятно, станут США.
Электронное СМИ зарегистрировано 12.03.2009
Свидетельство о регистрации Эл № ФС 77-35618
Несколько дней назад появилась информация, что 48-летняя Анастасия Заворотнюк попала в реанимацию одной из столичных клиник с диагнозом рак мозга последней стадии. И практически сразу в СМИ начали обсуждать процедуру омоложения стволовыми клетками, которой актриса якобы воспользовалась – именно это, по мнению многих специалистов, могло стать катализатором болезни.
Так что такое стволовые клетки? Чем они могут быть полезны, а главное – в каких случаях и почему могут стать смертельным врагом? Раскладываем все по полочкам.
Фото: Москва 24/Юлия Иванко
Существует такая технология, как реверс-инжениринг. За этим серьезным термином кроется технология изучения и постепенной разборки какого-либо устройства, чтобы понять принцип его работы и, возможно, скопировать. Именно так создавалось огромное количество самой разной техники в Советском Союзе: за границей покупался образец, его разбирали "до винтика", проводили тщательные измерения, а затем делали собственную нелицензионную копию. Так выпускали все что угодно – от детских игрушек до военной техники.
Если воспользоваться реверс-инженирингом для изучения любого человеческого организма (разумеется, без разборки) и "отмотать" его историю к самому началу, выяснится, что исходным "зернышком" была одна-единственная клетка – зигота. Весь гигантский объем информации о количестве конечностей, способе размножения, размерах мозга, цвете волос и глаз содержался в крохотном комочке протоплазмы, разглядеть который невооруженным глазом невозможно. Зигота – это самая первая клетка, которая не имеет никакой специализации. Ее называют недифференцированной, или стволовой клеткой. Некоторое время спустя она разделится пополам, образуя две новые стволовые, каждая из которых также разделится и так далее, пока не наступит этап специализации: какие-то из них станут нервными клетками, какие-то начнут образовывать кости, а какие-то – внутренние органы.
Во взрослом организме стволовые клетки также есть, они используются в качестве "ремонтного материала", но с возрастом их становится все меньше и меньше. Если у новорожденного на каждые 10 тысяч обычных клеток приходится одна стволовая, то у взрослого – одна на миллион, а к старости – раз в сто меньше.
Все эти исходные данные рано или поздно должны были привести исследователей к простой мысли: чтобы "ремонтировать" взрослый организм, необходимо добавлять в него стволовые клетки. Потратив десятилетия на опыты и эксперименты, современная медицина научилась их трансплантировать для лечения самых разных болезней.
Идеальными считаются эмбриональные стволовые клетки – те самые, из которых со временем должен вырасти полноценный Homo Sapiens. Их главное достоинство в том, что такие клетки не вырабатывают антигены тканевой совместимости – это значит, что организм, в который их пересадят, не станет их отторгать. Эмбриональные стволовые клетки почти наверняка приживутся в организме любого реципиента.
Правда, это справедливо только в том случае, если иммунная система организма в полном порядке. Например, опыты на животных показывают, что в противном случае стволовые клетки хоть и не отторгаются, но развиваются совсем не так, как положено, образуя сложные опухоли.

Фото: Москва 24/Лидия Широнина
При этом сейчас также тестируется применение стволовых клеток для восстановления каких-либо поврежденных органов. "Вне организма они используются для того, чтобы получить специализированные клетки. Например, если нам надо восстановить хрящ, то можно использовать стволовые из кости, из них сделать хрящ и после этого трансплантировать человеку", – отметил Киселев.
Однако при нарушении требований проведения операции действия могут привести к негативным последствиям. "Если "продукт" будет с бактериями, то это может привести к сепсису. На самом деле на сегодняшний момент, поскольку все началось недавно (использование стволовых клеток), оно еще не очень отработано и эффективно", – подчеркнул он.
Киселев добавил, что в косметологии не используют стволовые клетки для так называемого "омолаживания". При процедурах используют обычные клетки кожи лица, чтобы уменьшить морщинки. "Процедура приводит к временному устранению некоторых морщин, куда это вкалывается. Но это не омоложение – моложе человек не становится – а просто как грим, только его накладывают не снаружи, а под кожу", – сказал он.
Вообще исследователи предпочитают говорить об использовании стволовых клеток с максимальной осторожностью. На первый взгляд все выглядит крайне позитивно, но если углубиться в тему, можно обнаружить, что все вовсе не так радужно. Дело в том, что недифференцированные клетки, попав в организм взрослого человека, провоцируют бурное развитие не только здоровых клеток, но и тех, в развитии которых есть какая-либо патология. А чем старше пациент, тем их больше в его организме.
Да, чаще всего они выращены in vitro, но все равно – после изъятия определенного количества клеток зародыш умирает. Впрочем, это положение вещей имеет все шансы измениться: несколько лет назад японские ученые обнаружили, что практически любую зрелую клетку человеческого организма можно "индуцировать", то есть сделать ее стволовой. В этом случае также отпадает вероятность отторжения, так как клетки для пациента берутся у него же самого. Однако и эта технология до сих пор находится в условно-экспериментальной стадии.
Махсон также добавил, что использование стволовых клеток в косметологии, вероятно, неподкрепленная реклама. "Вреда, скорее всего, не будет, но чтобы было омоложение – я сомневаюсь", – заключил онколог.
И все же мы верим в то, что медицина стволовых клеток сможет сделать жизнь человечества лучше. Рано или поздно технологии взаимодействия с ними разовьются до такого уровня, что их применение станет абсолютно безопасным. А пока этого не произошло, мы сможем получать от исследований и разработок "глобальные бонусы" в виде, например, восстановления вымирающих видов животных.
Все-таки люди – раса разумная и осторожная.
- 2041
- 1,7
- 0
- 7

Стволовые клетки взрослого организма
Стволовые клетки (СК) находятся в организме в строго определенных местах, которые, благодаря окружающим клеткам и внеклеточному матриксу [1], обеспечивают правильное функционирование стволовых клеток. Такие места называются клеточной нишей [2]. В костном мозге есть два типа СК: кроветворные, способные дифференцироваться во все клетки крови, и мезенхимные (МСК), дающие начало костной, хрящевой и жировой тканям и составляющие важную часть стромы кроветворения (ниши кроветворной СК), но ни при каких обстоятельствах не способные дифференцироваться в клетки крови.
Ниже в иерархии стоят олигопотентные клетки-предшественницы — родоначальницы только нескольких линий клеток крови, таких как общие миелоидные предшественники (дающие моноциты, мегакариоциты, эритроциты) и общие лимфоидные предшественники (дающие В-, Т- и НК-клетки ).
Еще более низкую ступень в иерархии занимает отдел уни- и бипотентных клеток-предшественниц, способных дифференцироваться только в одном или двух направлениях.
Большой медицинский потенциал сподвиг Бигильдеева А.Е. с соавторами досконально изучить этот тип клеток при помощи генетического штрихкодирования клеточных популяций [6]. При извлечении МСК из костного мозга [7] в каждую клетку вносят метку — небольшой уникальный фрагмент ДНК, который встраивается в геном клетки и потому будет находиться в геномах всех ее потомков. Анализ этих меток после роста в чашке Петри позволяет определить, потомки каких клеток размножились сильнее, а каких — не оставили потомков.
Оказалось, что популяция МСК гетерогенна и представлена множеством клеточных клонов (потомков одной исходной клетки), различающихся по способности к делению и дифференцировке. При многократном пересеве культуры ее клональный состав значительно меняется из-за ухода потомков клеток, не способных к долгому размножению. МСК с высокой способностью к размножению чаще выявляются на ранних этапах культивирования вне организма, и в поликлональной популяции МСК содержится лишь небольшое количество таких клеток. В связи с этим в подходах регенеративной медицины, требующих активного размножения клеток, рекомендуется применять МСК ранних пассажей (то есть те, что жили в чашке Петри недолго). Благодаря подобным исследованиям становится ясно, что хранить в замороженном виде МСК в больших количествах невозможно: для этого придется их долго культивировать, и они могут утратить требуемые стволовые свойства. Тут можно обратиться к более ранним стволовым клеткам, каких во взрослом организме уже не остается.
Эмбриональные стволовые клетки
Некоторые стволовые клетки функционируют не просто в особом месте организма, но и в строго определенное время. Тотипотентностью — способностью дифференцироваться во все клетки организма и экстраэмбриональные ткани — обладает только зигота, но уже после нескольких делений это свойство утрачивается навсегда. На стадии бластоцисты происходит первая специализация клеток эмбриона: выделяются клетки трофобласта (наружный слой, который затем образует экстраэмбриональные ткани) и клетки внутренней клеточной массы, из которых разовьется весь организм (рис. 1). Последние при культивировании в чашке Петри называются эмбриональными стволовыми клетками (ЭСК). Впервые удалось вывести этот тип клеток в культуру в 1981 году [8]. Добавляя в культуральную среду определенные белки — факторы роста, — удается долго поддерживать ЭСК в недифференцированном плюрипотентном состоянии. ЭСК активно размножаются, сохраняя при этом свои свойства, что позволяет получать большое количество клеток для исследовательских задач и для применения в медицине.
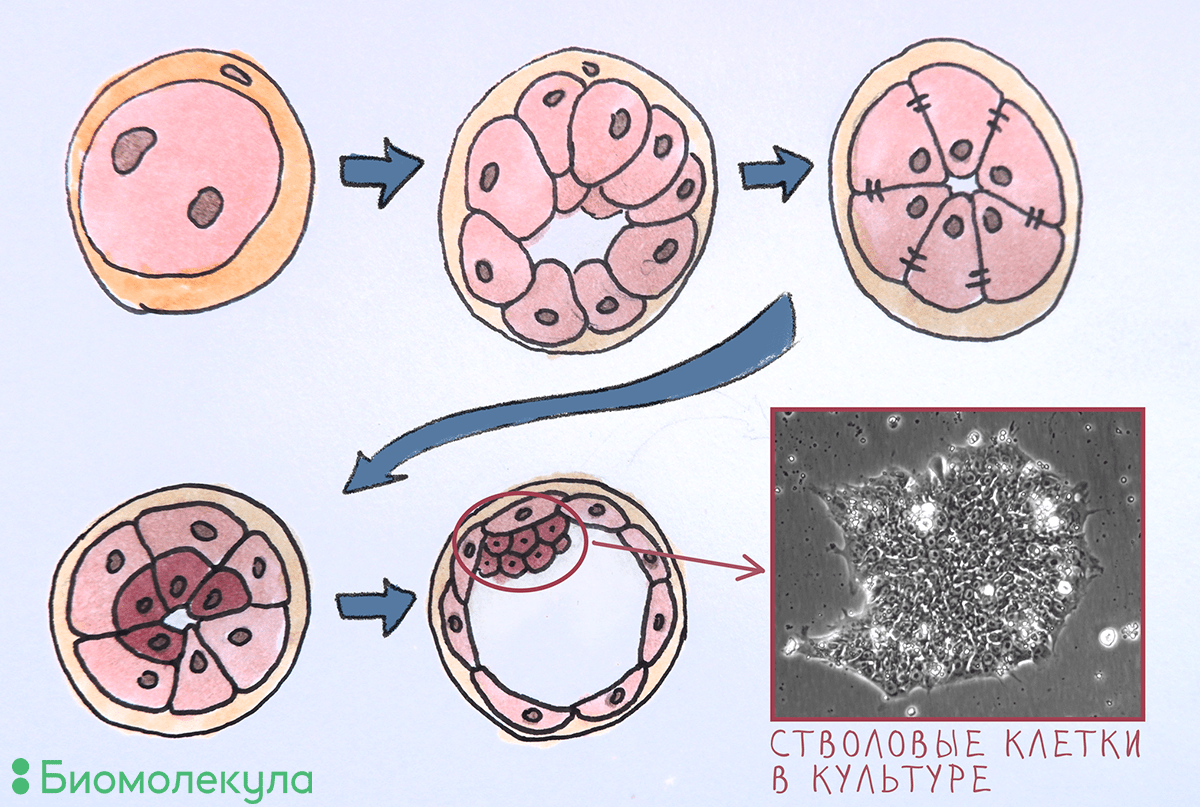
Рисунок 1. Первые пять дней развития эмбриона человека. 1 — Оплодотворение; 2 — деление (дочерние клетки называются бластомерами); 3 — компактизация (образование плотных контактов между бластомерами); 4 — дифференцировка на внутренний и внешний слои; 5 — образование полости (бластоцеля), внешнего слоя клеток (трофобласта) и внутренней клеточной массы, которую можно извлечь для культивирования в чашке Петри и получить таким образом ЭСК (фото автора статьи).
Существуют разные протоколы перепрограммирования — как со вставкой ДНК прямо в геном клетки (подходят только для исследовательских целей), так и не оставляющие следов в геноме (подходят и для медицинского применения ИПСК). Получение ИПСК с помощью доставки репрограммирующих факторов в вирусных векторах (например, лентивирусных, относящихся к тому же семейству вирусов, что и ВИЧ), которые встраиваются в геном клетки, широко распространено в лабораторной практике ввиду высокой эффективности, методологической простоты и дешевизны.
С одной стороны, проблема решается прочно укоренившейся в мире практикой клинических исследований, доказывающих эффективность и оправданность применения разрабатываемых лекарств на людях . С другой стороны, заметно помочь в разработке препаратов могут модели заболеваний на основе ИПСК, несущих связанные с развитием той или иной болезни мутации, из клеточного материала пациентов с установленным диагнозом. ИПСК представляют собой практически бесконечный источник клеточного материала и могут превращаться в любой тип клеток взрослого организма, в том числе в предшественников нейронов, зрелые нейроны и кардиомиоциты. Разработка таких моделей наследственных заболеваний позволит изучать функции продуктов мутантных генов в клетке и механизмы развития патологии. Дифференцированные производные ИПСК можно использовать для скрининга новых лекарственных препаратов (рис. 2).
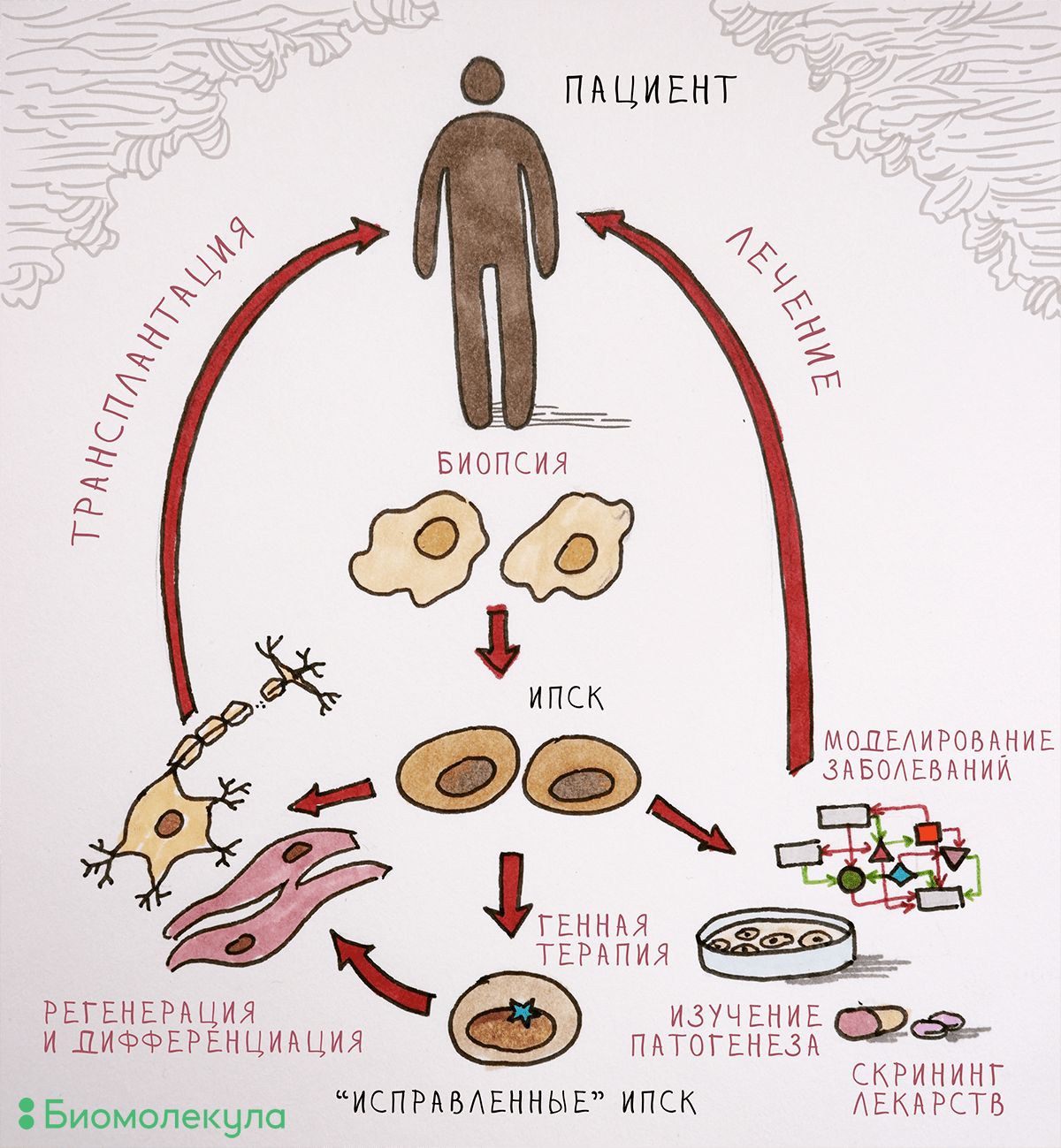
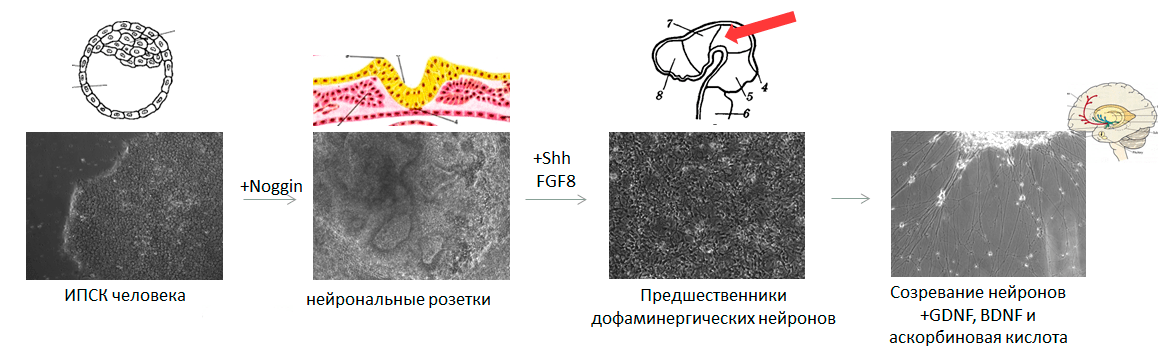
Для создания модели заболевания на основе ИПСК необходимо превратить их в тот тип клеток, который повреждается при изучаемой патологии. Наиболее востребованы модели нейродегенеративных и кардиологических заболеваний, ведь в этих случаях поврежденные ткани напрямую не доступны исследователям. Для запуска дифференцировки в нужную сторону необходимо воспроизвести в чашке Петри те же условия, с которыми клетка сталкивается в организме. Рассмотрим, как можно получить клетки нервной системы — нейроны, производящие дофамин (а именно они погибают при болезни Паркинсона [14], [15]).
Тут мы должны слегка углубиться в эмбриологию, ведь нужно будет имитировать все изменения в окружении клетки, происходящие от стадии бластоцисты до формирования головного мозга. Придется учитывать и механические воздействия на клетку, и своевременное появление определенных белков — факторов дифференцировки, — и их концентрацию, и состав солей в окружающей клетку среде, и особенности поверхности, к которой клетка прикреплена.
Перед запуском ИПСК в дифференцировку важно убедиться, что клетки растут в оптимальной плотности: они должны занимать почти всю площадь чашки Петри. Это необходимо, чтобы на старте превращения клетки давили друг на друга ровно так, как это происходит на первом этапе формирования нервной системы эмбриона — при развитии нервной трубки. Клетки, которые находятся на дне нервной бороздки, испытывают давление из-за активного размножения соседних клеток и изгибания самой бороздки в трубку, а клетки, расположенные сверху, наоборот, испытывают растяжение и превращаются в нервный гребень. Из нервного гребня впоследствии развивается множество типов клеток, в том числе и волосяные луковицы, а из клеток, находящихся на дне нервной бороздки, образуется центральная нервная система (рис. 3).

Рисунок 3. Последовательные стадии развития нервной системы (ранние этапы). Первоначально будущие клетки нервной системы изменяют форму и характерным образом располагаются друг относительно друга — получается нервная пластинка. Затем она изгибается, превращаясь в нервную бороздку, где на клетки действуют механические силы. Наконец, нервная бороздка замыкается в нервную трубку. Красные стрелки показывают механические силы, действующие на клетки. Нейрональные розетки — аналог нервной трубки в чашке Петри. Увеличение 100× (фото автора статьи).
Поскольку при нейродегенеративных заболеваниях, в том числе и при болезни Паркинсона, гибнут именно зрелые нейроны у взрослых людей, а не их размножающиеся предшественники, для моделирования болезни правильно брать как раз зрелые нейроны, чтобы с большей достоверностью повторить развитие патологических процессов. С другой стороны, можно изучать особенности дифференцировки нейронов и выяснять, что и как на эту дифференцировку влияет. Аналогичные подходы можно применить при получении кардиомиоцитов — клеток сердца, изучать которые прямо в организме тоже непросто.
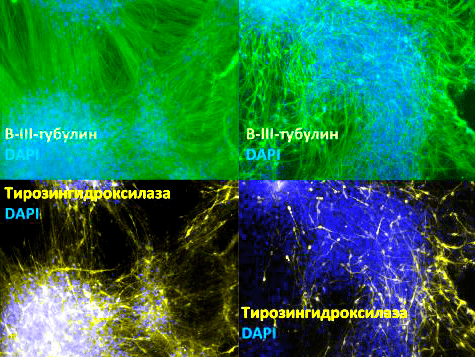
Рисунок 5. Зрелые нейроны, полученные путем дифференцировки из клеток-предшественниц. Различные структуры нейронов флуоресцентно окрашены: бета-III-тубулин (присутствует во всех типах нейронов; окрашен зелёным), тирозингидроксилаза (фермент, участвующий в синтезе дофамина; характерен для нейронов, выделяющих дофамин; окрашен желто-зеленым), ядра клеток (окрашены синим). Увеличение 100×.
фотография из диссертации автора статьи [18]
Получение ИПСК от пациента и их последующая направленная дифференцировка в кардиомиоциты открывают новые возможности для изучения патогенеза наследственных сердечно-сосудистых заболеваний, в частности гипертрофической кардиомиопатии, от которой до сих пор не разработано эффективного лечения. При этом заболевании утолщаются стенки левого желудочка и межжелудочковой перегородки, развиваются сердечная недостаточность и аритмия, возрастает риск внезапной сердечной смерти. Гипертрофическая кардиомиопатия — одна из самых распространенных сердечно-сосудистых патологий: 1 случай на 500 человек. Елена Дементьева с коллегами создала модель этого заболевания на основе пациентспецифичных ИПСК [19]. Исследовав геном пациента с гипертрофической кардиомиопатией, коллектив обнаружил мутацию R326Q в гене MYBPC3, кодирующем миозин-связывающий белок С. Этот белок расположен в саркомере и играет важную роль в сокращении кардиомиоцита. ИПСК пациента и здорового донора (в качестве контроля) превратили в клетки сердца, которые воспроизводили такие признаки гипертрофической кардиомиопатии, как нарушение динамики потоков ионов кальция и их повышенное внутриклеточное содержание.
Таким образом, описанная клеточная модель для изучения гипертрофической кардиомиопатии представляет собой кардиомиоциты, полученные в результате направленной дифференцировки ИПСК пациента с этой болезнью.
3D-дифференцировка: миниорганы в пробирке
Исследования последних лет, связанные с созданием 3D-органоидов (Еремеев А.В. с соавторами [20]) из ЭСК или ИПСК, существенно облегчили исследования в области моделирования органогенеза человека in vitro и стали мощным инструментом для исследования механизмов развития патологий сложных органов, равно как и разработки новых подходов к их терапии. В последние годы были созданы многоклеточные органоиды мозга человека [21], толстой кишки [22], почек, сетчатки, печени. Разумеется, пока 3D-модели многоклеточных органов на основе 2D-культур имеют свои ограничения и лишь условно имитируют их сложную архитектонику [23], [24].
Применение плюрипотентных стволовых клеток в медицине
Для решения проблем, выявленных в предыдущей серии трансплантаций, запустили TRANSEURO — клиническое исследование в Европе, в ходе которого в 2014–2016 годах 11 пациентам трансплантировали предшественников нейронов, вырабатывающих дофамин. Однако из-за источника клеток — эмбрионов человека — возникли как этические, так и чисто технические трудности, связанные с получением фетального материала и невозможностью его стандартизации для клинического применения. Из-за сбоев в поставке ткани для трансплантации из 90 запланированных операций по подсадке таких клеток осуществили только 20, и на данный момент проект остановлен. Для того чтобы обойти эти сложности, активно разрабатывают эффективные методы дифференцировки ЭСК и ИПСК для дальнейшего их применения в клинической практике.
В качестве альтернативы Киотский университет запустил проект Stock, нацеленный на создание банка разных линий ИПСК, типированных по иммунологическим параметрам совместимости (как это делается при пересадке органов). Было подсчитано, что 50 линий ИПСК, специально отобранных по этому принципу, позволят охватить 73% населения Японии. Но не стόит забывать, что развитию иммунного ответа могут способствовать и клетки врожденной иммунной системы, такие как макрофаги и естественные киллеры.
Клеточная терапия с использованием стволовых клеток различного происхождения набирает обороты в мировой практике. Такой подход клеточной терапии, как пересадка костного мозга, уже давно прижился в клинической практике. Терапия МСК не всегда дает хорошие результаты. Однако в случае реэпителизации поврежденных кожных покровов (например, при синдроме диабетической стопы) эффективность применения МСК уже показана в клинических исследованиях [28].
В клинику готовы войти и производные плюрипотентных стволовых клеток (ЭСК и ИПСК). Полученные из ЭСК олигодендроциты [29] и клетки поджелудочной железы [30], производящие инсулин, находятся на финальных этапах клинических испытаний. В случае олигодендроцитов был заявлен 15-летний срок наблюдения за пациентами после подсадки клеток в спинной мозг. Этот срок еще не истек, но негативных последствий для пациентов до сих пор не обнаружено. Начались клинические исследования клеточных продуктов для терапии таких сложных и тяжелых заболеваний, как дистрофия сетчатки и болезнь Паркинсона [31]. Многие исследования направлены на то, чтобы уменьшить или полностью исключить иммуносупрессию при пересадке дифференцированных производных ЭСК и ИПСК. Благодаря стволовым клеткам перед нами открывается огромное поле возможностей, но впереди еще большее поле научной работы.

Сейчас стволовые клетки в России разрешено применять для лечения некоторых заболеваний. Запрет на их использование был снят в 2010 году. Однако до сих пор нет достаточных оснований для того, чтобы признать введение стволовых клеток абсолютно безопасным. Ученые Курчатовского института провели исследование на животных и выяснили, что стволовые клетки могут стимулировать развитие опухоли, а после облучения трансформироваться в опухолевые клетки и вызывать рак.
Использование стволовых клеток (СК) для восстановления организма на сегодняшний день является актуальным направлением в лечении некоторых заболеваний. Однако полный спектр побочных действий СК пока не изучен, а некоторые из них могут представлять реальную угрозу здоровью. В частности, биологи из Курчатовского института выяснили, что стволовые клетки способны провоцировать рост опухолей.

Чтобы выяснить это, ученые провели следующий ряд экспериментов. Одной группе лабораторных мышей исследователи привили опухоль молочной железы. Другой группе ввели подкожно смесь опухолевых клеток и предварительно облученных в малых и сублетальных дозах стволовых клеток жировой ткани. Для третьей группы использовали смесь опухолевых клеток и необлученных СК жировой ткани. Четвертой группе ввели просто необлученные стволовые клетки из жировой ткани. Через неделю исследователи начали анализировать динамику появления и роста опухолей.
У первых трех групп подопытных животных опухоли начали расти. Спустя всего месяц после начала эксперимента у грызунов из второй и третьей группы опухоли были уже в 5-10 раз больше, чем у подопытных из первой группы. А у мышей из последней группы не произошло образования спонтанных опухолей даже через полгода после начала эксперимента.
— Дело в том, что при культивировании (процесс, в котором клетки выращиваются в питательной среде при контролируемых условиях — "Известия") стволовые клетки выделяют в питательную среду широкий спектр биологически активных молекул, оказывающих различные эффекты на окружающие ткани, - пояснила начальник отдела клеточной биологии, иммунологии и молекулярной медицины НИЦ "Курчатовский институт" Алла Родина. - Среди таких молекул есть факторы роста, стимулирующие деление находящихся рядом клеток.
Поэтому, по заключению Аллы Родиной, введение стволовых клеток пациенту возможно только после полного исключения присутствия у него новообразований.
Однако стволовые клетки могут стать опасными и во время лечения – при облучении опухолей. Чтобы понять, какие из клеток наиболее подвержены мутации и какие дозы представляют особую опасность, исследователи из Курчатовского института изучили действие излучения на стволовые клетки лабораторных животных. Ученые исследовали действие гамма-излучения и нейтронов, именно они используются в медицине для лечения злокачественных опухолей.
В этой серии экспериментов биологи облучали стволовые клетки, взятые из жировой ткани, костного и головного мозга лабораторных мышей. Потом анализировали уровень образования двунитевых разрывов ДНК. Принципиально было изучить именно двунитевые разрывы, так как однонитевые способны быстро и правильно восстановиться, то есть воспроизвести изначальную структуру цепочки. Появление же двунитевых — с большой вероятностью приводит к появлению мутаций.
Оказалось, что количество двунитевых разрывов под действием нейтронного излучения в дозе 0.5 Гр было в два раза выше, чем под действием гамма-квантов. Впрочем, известно, что нейтронное облучение в целом более повреждающее, так как эти частицы тяжелые и выделяют больше энергии при прохождении через ткани организма. С повышением дозы обоих видов излучения количество разрывов ДНК возрастало.
Отличалась между собой и реакция различных типов стволовых клеток на одинаковые дозы одного и того же вида облучения. Согласно экспериментам, скорость восстановления двунитевых разрывов ДНК стволовых клеток костного мозга ниже, чем стволовых клеток жировой ткани и головного мозга, как сообщает младший научный сотрудник лаборатории клеточной биологии и молекулярной медицины Курчатовского института Юлия Семочкина. По словам эксперта, окончательные выводы делать рано, тем более что опыты проводились с использованием стволовых клеток экспериментальных животных, а не человека. Но полученные результаты позволили заключить, что стволовые клетки костного мозга медленнее восстанавливаются после облучения, и в них больше вероятность возникновения онкогенных мутаций.
— Безусловно, исследования безопасности применения стволовых клеток для терапии различных заболеваний — очень актуальное направление, — отметил руководитель лаборатории генных и клеточных технологий института фундаментальной медицины и биологии КФУ Альберт Ризванов. — В то же время, данные, получаемые учеными всего мира, по злокачественной трансформации стволовых клеток, культивируемых вне организма, зачастую противоречивы. Одни группы исследователей сообщают о мутации клеток в опухолевые, другие — о том, что никакая онкологическая трансформация им не грозит.
Но в любом случае очень важно понимать фундаментальные процессы, которые происходят при воздействии радиации на стволовые клетки, считает эксперт. И поэтому исследования коллег из Курчатовского института имеют значение как для фундаментальной науки, так и для практического здравоохранения.
Читайте также:


