У каких вирусов есть нейраминидаза
19 декабря 2017
- 1633
- 1,4
- 0
- 1
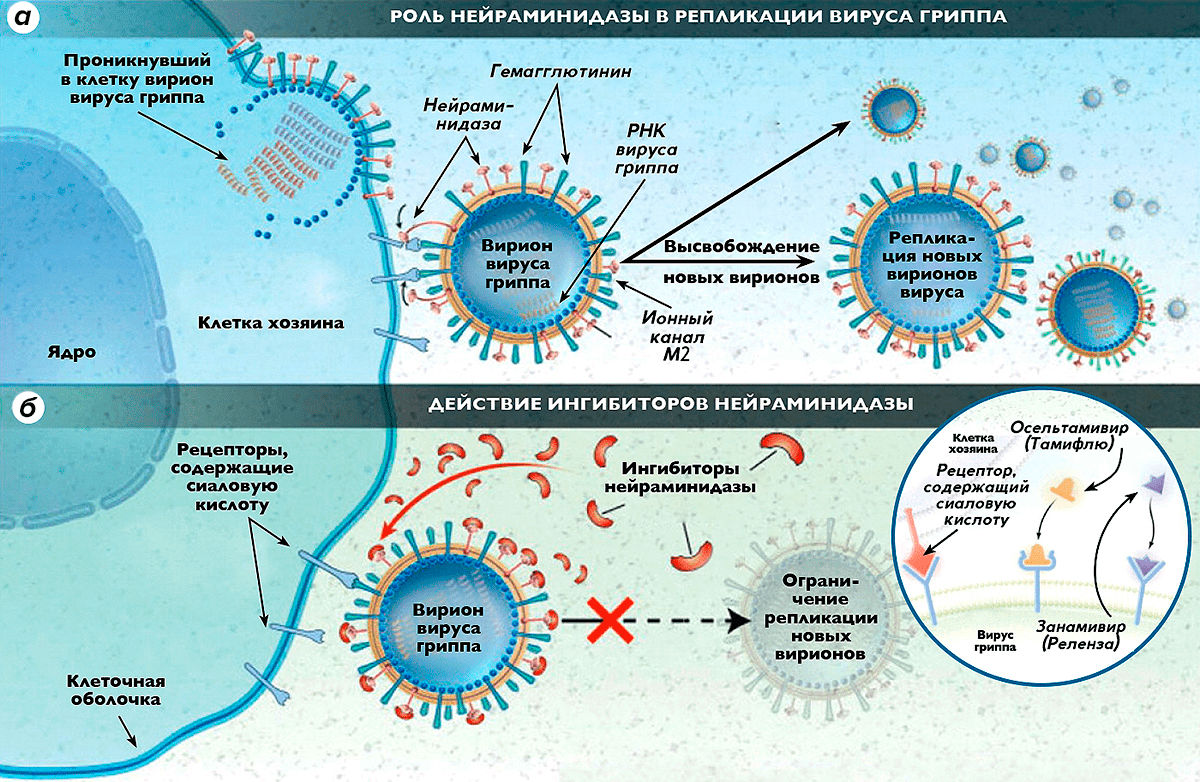
Рисунок 1. Роль нейраминидазы в репликации вируса гриппа и действие ингибиторов нейраминидазы. а — В наружной липидной оболочке вириона вируса гриппа типа А имеются 3 основных белка (гемагглютинин, нейраминидаза и ионный канал М2), играющих основную роль в инфекционном процессе. Шипчики гемагглютинина объединяются с рецепторами восприимчивой клетки хозяина, связываясь с сиаловой кислотой, входящей в состав этих рецепторов. Нейраминидаза отщепляет концевые группы клеточных рецепторов, содержащих сиаловую кислоту, в результате чего клетка теряет способность распознавать антиген, и вирус проникает внутрь нее. Далее в клетке хозяина происходит сборка новых вирионов вируса, которые при помощи нейраминидазы выходят из поврежденной клетки, разносясь с кровотоком и заражая новые клетки. б — Ингибиторы нейраминидазы нарушают способность вирусов гриппа проникать в здоровые клетки, блокируют действие нейраминидазы внутри клетки хозяина, делая невозможным высвобождение из нее новых поколений вирионов вируса гриппа и, соответственно, препятствуя заражению новых клеток.
Каковы альтернативы?
Эффективно? Нет?
До сих пор ингибиторы нейраминидазы принято считать препаратами с недоказанной эффективностью, обладающими к тому же выраженными побочными эффектами, и многие адепты доказательной медицины уверены в их полной бесполезности. Доказательством этой точки зрения обычно служат выводы метаанализа независимой исследовательской организации Cochrane (бывшая The Cochrane Collaboration). Однако — и это самое странное — именно они окончательно запутывают дело.
Эксперты из Cochrane анализировали ингибиторы нейраминидазы несколько раз (рис. 2), и до 2009 года их отчеты практически ничем не отличались от официальных выводов и информации Roche. Однако в 2009 году грянул гром: японский педиатр Кейдзи Хаяси усомнился в качестве их данных и провел собственное расследование.
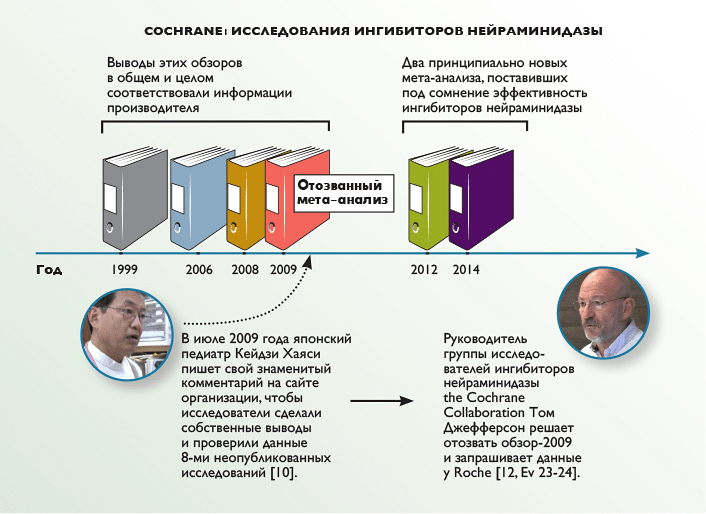
Рисунок 2. Cochrane: исследования ингибиторов нейраминидазы.
Тогда, в 2009 году, пообещав детально разобраться в ситуации, руководитель исследовательской группы ингибиторов нейраминидазы Cochrane — эпидемиолог Том Джефферсон поднял опубликованные материалы и с удивлением обнаружил, что оригиналы данных придется искать в архивах производителя. Тогда он обратился к Roche с просьбой предоставить необходимые материалы. Концерн долго артачился и даже предлагал Джефферсону подписать соглашение о неразглашении (тот, естественно, отказался), но в конце концов уступил и выслал семь небольших документов.
Таких как IL-6, IL-10, IFN-γ, TNF-α, MIP-1α и −1β, MCP-1.
И еще кое-что про пониженные титры антител. Не удивительно, что в конечном итоге этот феномен сказывается на риске дальнейшего повторного заражения: Том Джефферсон и его коллеги отмечают, что снижение титров защитных антител у пациентов из групп лечения согласуется с данными испытаний на животных, показавших, что по сравнению с группой контроля, применение препарата у подопытных мышей привело к выделению недостаточного уровня секреторного иммуноглобулина IgA (а также подавлению индукции IgA-образующих клеток) на слизистой носа, но при этом не оказало значительного влияния на системный IgG-ответ [22]. А это может означать, что существует риск повторного заражения пациента, у которого вследствие терапии осельтамивиром выработался недостаточный иммунный ответ слизистой оболочки (IgA) [22]. Однако эти данные не указывают на отсутствие лечебного эффекта. Что же касается риска повторного заражения, то он может быть естественным процессом вследствие низкого уровня выработанных защитных антител.
В общем, чтобы подтвердить негативное действие ингибиторов нейраминидазы на иммунный ответ, необходимо хотя бы изучить различие количества антител при разной концентрации вируса, а также понять, спустя какое время после момента заражения регистрировалось это различие, и как параллельно снижалась вирусная нагрузка (рис. 3 и 4). В целом, снижение указанных параметров по сравнению с группой контроля может быть как следствием иммуносупрессивного действия препаратов, так и результатом быстрого подавления репликации вируса, не позволяющего развиться полноценному иммунному ответу.
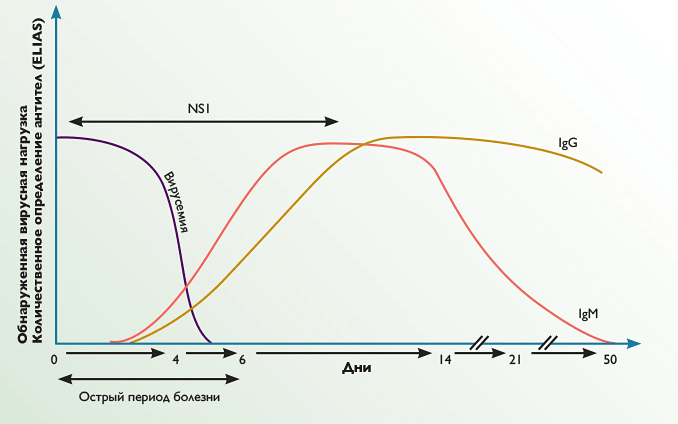
Рисунок 3. Временнáя кривая накопления антител.
| нейраминидазы | |
|---|---|
 |
| Доступные белковые структуры: | |
|---|---|
| Pfam | сооружения |
| PDB | RCSB PDB ; PDBe ; PDBj |
| PDBsum | краткое описание структуры |

Вирусные нейраминидазы являются одним из видов нейраминидазы обнаружили на поверхности вируса гриппа , который позволяет вирус быть выпущены из клетки - хозяина. Нейраминидазы являются ферменты , которые расщепляют сиаловой кислоты группы из гликопротеинов и которые необходимы для репликации вируса гриппа.
Когда вирус гриппа размножается, он прикрепляется к внутренней поверхности клетки с помощью гемагглютинина , молекула находится на поверхности вируса , который связывается с группами сиаловой кислоты. Сиаловых кислот встречаются на различных гликопротеинов на поверхности клетки - хозяина, и вирус использует эти группы для связывания клетки - хозяина. Для того , чтобы вирус будет выпущено из клетки, нейраминидазы должны ферментативно расщеплять группы сиаловых кислот из принимающих гликопротеинов . Поскольку расщепление сиаловых групп является составной частью репликации вируса гриппа, блокируя функцию нейраминидазы с ингибиторами нейраминидазы является эффективным способом для лечения гриппа.
содержание
функция
Фермент помогает вирусам быть освобождены после того, как многообещающие из плазматической мембраны клетки - хозяина. Вирус гриппа мембраны содержат два гликопротеинов : гемагглютинина и нейраминидазы. В то время как гемагглютинин на поверхности вириона необходим для инфекции, его присутствие ингибирует высвобождение частицы после почкования. Вирусные нейраминидазы расщепляет терминал нейраминовой кислоты (также называемой сиаловой кислоты ) остатки из гликанов структур на поверхности инфицированной клетки. Это способствует высвобождению потомства вирусов и распространения вируса от клетки - хозяина неинфицированных окружающих клеток. Нейраминидазы также отщепляют остатки сиаловых кислот от вирусных белков, предотвращая агрегацию вирусов.
Ингибиторы
Нейраминидазы была ориентирована в структуре на основе программ дизайна ингибиторов фермента , которые привели к производству двух препаратов, занамивир (Relenza) и озельтамивира (Тамифлю). Введение ингибиторов нейраминидазы является лечением , которое ограничивает тяжесть и распространение вирусных инфекций. Ингибиторы нейраминидазы полезны для борьбы с гриппом инфекции: занамивир , вводят путем ингаляции; озельтамивир , вводят перорально; и под исследования перамивир вводят парентерально, то есть путем внутривенной или внутримышечной инъекции.
27 февраля 2005 года 14-летний вьетнамец девочка была документирована, перевозил в H5N1 вируса гриппа штамма , который был бы устойчив к препарату озельтамивиру . Препарат используется для лечения пациентов , которые заболели гриппом. Тем не менее, вьетнамская девочка , которая получила профилактическую дозу (75 мг один раз в день) было установлено, что не реагируют на лекарства. В растущих опасений глобальной пандемии птичьего гриппа, ученые стали искать причину устойчивости к Тамифлю лекарства. Причиной была определена , чтобы быть гистидина на тирозин ( аминокислота ) замещение в положении 274 в его нейраминидазы белка.
Как штаммы гриппа постоянно мутирует, то очень важно, чтобы ученые быстро и эффективно определить правильный нейраминидазы подтипа, который отвечает за лекарственной устойчивости с целью разработки лекарств, которые будут бороться специфические штаммы гриппа.
Новый класс ингибиторов нейраминидазы , которые ковалентно прикрепляются к ферменту показал активность в отношении лекарственной устойчивости вируса в пробирке .
специфичность
В идеальных условиях, вирус гриппа нейраминидазы (NA) должны действовать по тому же типу рецептора вирус гемагглютинина (HA) , связывается, явление , которое не всегда бывает. Это не совсем понятно , каким образом вирус удается функционировать , когда нет близкое соответствие между спецификой НС и ГА.
Экзо- и эндо-
Нейраминидазы ферменты могут иметь эндо- или экзо- глюкозидазу активности, и классифицируются как EC 3.2.1.29 (эндо-нейраминидаза) и EC 3.2.1.18 (экзо-нейраминидазы). В общем, млекопитающих остатки сиаловых кислот находятся в концевых положениях (невосстанавливающий концевые) в сложных гликанах, и так вирусные нейраминидазах - которые являются экзо- гликозидазы ферментов - использовать эти концевые остатки , как их субстраты.
На пороге сезона гриппа многие задумываются о прививках. Основной компонент противогриппозных вакцин – гемагглютинин. Специалисты Ростеха, главного поставщика таких препаратов в России, рассказали, что это за вещество, откуда оно берется и как помогает нашему иммунитету справиться с возбудителем.
В результате ежегодных эпидемий по всему миру гриппом заражаются 5 миллионов человек, из них до 500 тысяч погибают. В первую очередь в опасности дети и пожилые люди.
Орудие преступления и главная мишень для иммунной системы
Вирус гриппа – шар диаметром 100 нанометров (хотя встречаются и похожие на нити длиной 300 нанометров и больше). Внутри него спрятан генетический материал в виде РНК – рибонуклеиновой кислоты. Именно она, проникая в клетку, превращает ее в фабрику по производству новых вирусных частиц.
Если для вируса гемагглютинин и нейраминидаза – важные инструменты, то для организма человека это чужеродные частицы, антигены. Иммунитет умеет их распознавать с помощью антител, в результате чего развивается реакция, направленная на борьбу с инфекцией. Антитела против гемагглютинина не дают вирусу инфицировать клетки, а против нейраминидазы – выходить из клеток новым вирусным частицам. Причем, самым сильным антигеном является гемагглютинин. Именно он привлекает наиболее пристальное внимание иммунной системы. И это его свойство лежит в основе работы противогриппозных вакцин.
В 2009 году весь мир паниковал из-за эпидемии свиного гриппа, вызванной новым штаммом H1N1. Эти буквы как раз обозначают гемагглютинин (H) и нейраминидазу (N). Цифры рядом с ними указывают на подтипы этих веществ. Ученым известно 16 антигенных подтипов гемагглютинина (H1–16) и 9 подтипов нейраминидазы (N1–9). Они характерны для вируса гриппа A – он является самым распространенным и может инфицировать не только людей, но и животных.
Довольно часто встречается инфекция, вызванная вирусом гриппа B – она протекает немного легче и распространяется только среди людей. Однако, как и вирус гриппа A, он может вызывать серьезные осложнения. Все современные вакцины направлены против этих двух возбудителей. Есть еще вирус гриппа C – им тоже заражаются только люди, он встречается редко и вызывает легкие симптомы. Если говорить о вирусе A, то у людей чаще всего встречаются антигенные подтипы H1–3 и N1–2.
Как гемагглютинин применяют в вакцинах?
В зависимости от того, насколько сильно разрушен вирус, противогриппозные вакцины делятся на три вида. Цельновирионные – содержат целые инактивированные вирусы; расщепленные (сплит-вакцины) – содержат отдельные фрагменты вирусов, а субъединичные – поверхностные и внутренние антигены вируса.
Побочные эффекты после введения вакцины возможны, но они бывают очень редко. У некоторых людей повышается температура, возникает легкое недомогание и боли в мышцах. Иногда болит место укола. Это происходит из-за того, что иммунная система реагирует на антигены и вызывает воспалительный процесс. Обычно симптомы сохраняются один день, потом проходят.
Историческая справка
В XIX веке ученые активно пытались понять причину гриппа. Основными подозреваемыми были бактерии, но иногда высказывались и более экзотические теории о том, что болезнь вызывает пороховой дым, загрязнение воздуха, курение некачественных сигар. Только во время эпидемии 1918–1919 годов появились подозрения, что виновниками являются некие вирусы. Впервые они были выделены из носовой слизи больных людей (вирус гриппа A) в 1932 году английскими учеными Уилсоном Смитом, Кристофером Эндрюсом и Патриком Лейдлоу.
В 1936 году удалось получить нейтрализованные антитела, и начались испытания вакцины. Поначалу она защищала только от вируса A. Во время испытаний в 1942–1945 годах ученые обнаружили вирус B, и была создана двухвалентная вакцина (против двух возбудителей).
Большой вклад в развитие противогриппозных вакцин внесли советские ученые. Выдающийся русский вирусолог Анатолий Александрович Смородинцев, основавший Научно-исследовательский институт, который сейчас носит его имя, впервые в мире создал живую аттенуированную (ослабленную, — NS) вакцину против гриппа. Результаты его работы с соавторами были опубликованы в 1937 году в журнале American Journal of the Medical Sciences. Анатолий Александрович активно занимался вопросами комплексной профилактики гриппа, разработки живых ассоциированных вакцин, коллективного иммунитета к гриппу.
Во время очередной пандемии в 1978 году была создана трехвалентная вакцина против двух штаммов A и одного B. Наконец, в 2012 году появились четырехвалентные вакцины, которые и рекомендуется использовать сегодня.
Как производят вакцины против гриппа?
Есть разные технологии. Чаще всего, для того чтобы получить гемагглютинин, вирусы выращивают на куриных эмбрионах. В первую очередь важно понимать, от каких штаммов вируса нужна защита в текущем сезоне. Эксперты из Всемирной организации здравоохранения (ВОЗ) дважды в год проводят обзор мировой эпидемиологической ситуации и выпускают соответствующие рекомендации. Производители вакцин получают нужные штаммы из лабораторий ВОЗ.
Готовую вакцину нельзя сразу отправлять в больницы. Ее нужно протестировать с помощью реагентов, полученных из лаборатории ВОЗ. Обычно процесс занимает две недели. Сотрудники лаборатории проверяют, содержится ли в вакцине нужное количество антигена, нет ли посторонних примесей, насколько она безопасна, стерильна и так далее. Когда проверка окончена, препарат можно разливать по одноразовым шприцам. Каждый шприц повторно проверяют, чтобы убедиться, что он не поврежден, и в нем находится необходимая доза.
Опасны ли вакцины против гриппа для людей, у которых аллергия на яйца?
Даже после очень тщательной очистки в противогриппозной вакцине остается минимальное количество яичного белка. Теоретически это опасно для аллергиков, но на практике все не так однозначно. Еще в 1976 году в Америке было проведено крупное исследование, которое показало, что на 48 миллионов введенных доз вакцины описано 11 случаев тяжелой аллергической реакции – анафилаксии. Но ни один пациент не погиб. При этом, до прививки ни один из этих 11 людей не сказал, что у него есть аллергия на яйца.
По последним данным, анафилактические реакции на противогриппозные вакцины встречаются в одном случае на миллион. Если в препарате содержится не более 0,12 мкг/мл яичного белка, это считается безопасным даже для аллергиков. И все же людей, у которых были анафилактические реакции на куриные яйца, рекомендуется прививать в стационаре, где за их состоянием может наблюдать врач.
Производство гемагглютинина для противогриппозных вакцин – процесс сложный. Для него требуется высокотехнологичное оборудование. Производитель должен соблюсти массу требований и обеспечить тщательный контроль. Ситуация осложняется еще и тем, что во время пандемии может потребоваться очень много доз в короткие сроки.
Зачем прививаться каждый год?
Осельтамивир и занамивир были складированы во многих странах для лечения и профилактики сезонного и пандемического гриппа, [чтобы использовать] до того как вакцина против гриппа, соответствующая циркулирующему вирусу, станет доступной. Осельтамивир классифицируется Всемирной организацией здравоохранения как основное (жизненно-важное) лекарственное средство.
Какие подходы к этому обзору использовались
Мы обновили и объединили наши обзоры по противовирусным средствам занамивир и осельтамивир при гриппе у взрослых и детей на основании отчетов производителей в регуляторные органы (отчеты о клинических исследованиях) и комментариев регуляторов. Мы назвали эти комментарии и отчеты "регуляторная информация'. Отчеты о клинических исследованиях не опубликованы, это обширные документы с очень подробными деталями испытаний, которые сформировали базу для маркетингового одобрения. Они включают в себя протоколы, методы и результаты. Отчеты о клинических исследованиях до сих пор были конфиденциальными, их видели только производители и регуляторы.
Почему мы предприняли этот подход
В предыдущих версиях этого обзора мы выявили неразрешенные несоответствия в данных, представленных в опубликованных отчетах по клиническим испытаниям, и существенную предвзятость публикаций (публикационное смещение). Исходя из этого, мы решили не использовать данные из журнальных статей, а включили документы, созданные во время процессов лицензирования (маркетингового одобрения). Мы получили доступ к таким данным из Великобритании, США, Европейского лекарственного агентства (EMA), от японских регуляторов и к отчетам по клиническим исследованиям от производителей (после затяжной кампании в средствах массовой информации). Это позволило нам проверить информацию из рандомизированных плацебо-контролируемых клинических испытаний на взрослых и детях с подтвержденным или предполагаемым контактом с естественно встречающимся гриппом.
Исходя из наших оценок регуляторных документов (более 160 000 страниц), мы пришли к выводу, что были существенные проблемы с дизайном, проведением, отчетностью и доступностью информации во многих из этих клинических испытаний.
Мы использовали в этом обзоре данные из 46 клинических испытаний (20 по осельтамивиру и 26 исследований по занамивиру). Мы определили проблемы в дизайне многих исследований, которые мы включили, и которые отразились на нашей уверенности в их результатах. Мы обнаружили, что оба лекарства сокращали продолжительность симптомов гриппоподобного заболевания (неподтвержденный грипп или "грипп") менее, чем на один день. Осельтамивир, на основании данных от всех людей, включенных в клинические испытания по лечению осельтамивиром, не влиял на число госпитализаций. Клинические испытания по занамивиру этот исход не регистрировали. Сообщения о влиянии на пневмонии и другие осложнения гриппа, такие как бронхит, инфекции среднего уха (средний отит) и синуситы, были не надёжны, как показали истории болезни по документам клинического испытания. Некоторые формы показали ограничения (проблемы) диагностических критериев пневмонии. Регуляторные комментарии отметили проблемы с недостающими дневниками наблюдения у участников. У детей с астмой не было ясного влияния на время до первого облегчения симптомов.
Клинические испытания по профилактике (заболевания) показали, что осельтамивир и занамивир снижали риск симптоматического гриппа у отдельных лиц и в семье. Не было доказательств влияния на бессимптомный грипп или на не грипп, на гриппоподобные заболевания, но проблемы в проведении испытаний препятствуют любому определённому заключению.
Применение осельтамивира было связано с тошнотой, рвотой, головными болями, почечными и психиатрическими событиями; последние три случались, когда его [осельтамивир] применяли для профилактики гриппа. Его [осельтамивира] действие на сердце остается неясным: он может уменьшать симптомы со стороны сердца, но может и вызывать серьезные проблемы сердечного ритма. В клинических испытаниях занамивира у взрослых не было повышенного риска по сообщённым неблагоприятным событиям. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные.
Соответствие другим результатам
Отсутствие качественных доказательств, демонстрирующих влияние на осложнения [гриппа], согласуется с осторожными выводами по обоим лекарствам, сделанными Администрацией по контролю за лекарствами и пищевыми продуктами США (FDA). FDA разрешила заявления только по эффективности обоих лекарств в профилактике и лечении симптомов гриппа, но не по другим эффектам (в том числе прерывание распространения вируса от человека к человеку или профилактика пневмонии). FDA описала эффективность обоих препаратов в целом, как "скромную".
Механизм развития благоприятных эффектов
Эти результаты позволяют предположить, что низкий иммунный ответ с низким уровнем прововоспалительных цитокинов, вызванный действием осельтамивира карбоксилата, может уменьшать симптомы гриппа, не связанные с подавлением размножения (репликации) вируса гриппа. Потенциальный гипотермический или жаропонижающий эффект осельтамивира как депрессанта центральной нервной систем, также может вносить вклад в очевидное сокращение симптомов пораженного организма. Заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими данными, к которым мы имели доступ.
Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.
В структуре острых респираторных вирусных инфекций (ОРВИ) грипп занимает ведущее место по показателям тяжелых форм клинического течения, госпитализации, развития осложнений и летальности в период как эпидемий, так и пандемий [1–3].
С появлением и быстрым распространением в 2009 г. нового вируса гриппа A(H1N1)pdm09 изменилась структура циркулирующих штаммов, а также их долевое участие в последующих эпидемических сезонах [4, 5]. В странах Северного полушария в сезонах 2009–2010, 2010–2011, 2012–2013 и 2015–2016 гг. доминировал вирус гриппа A(H1N1)pdm09. Следует отметить, что вирус гриппа A(H1N1)pdm09 низкочувствителен к препаратам адамантанового ряда (римантадину и амантадину). Вирус гриппа A(H3N2) не циркулировал только в сезоне 2009–2010 гг. и проявлял максимальную активность в сезонах 2011–2012 и 2014–2015 гг. Вирус гриппа B наблюдался в период всех семи сезонов и значительную долю в структуре циркулирующих вирусов гриппа занимал в сезонах 2014–2015 и 2015–2016 гг.
Деятельность экспертов Всемирной организации здравоохранения (ВОЗ) предполагает, в частности, мониторинг чувствительности циркулирующих штаммов к применяемым на практике препаратам, оценку их эффективности в лечении и профилактике, а также разработку и внедрение новых форм. Названные направления имеют значение для диверсификации запасов антивирусных препаратов во избежание появления резистентных к ним штаммов и закрепления последних в популяции циркулирующих вирусов гриппа.
В настоящее время ингибиторы нейраминидазы являются референтными и рекомендованы ВОЗ для лечения и профилактики гриппозной инфекции, обусловленной сезонными вирусами гриппа и новым вирусом гриппа с пандемическим потенциалом. Ингибиторы нейраминидазы эффективны также в отношении высокопатогенных вирусов гриппа птиц A(H5N1), A(H7N9) и A(H5N6), случаи инфицирования которыми в последнее время зарегистрированы среди людей [6, 7].
Разработка данной группы препаратов относится к целевым достижениям ученых, которые использовали современные данные о структуре и свойствах одного из поверхностных белков вируса гриппа – нейраминидазы, выполняющей роль и антигена, и фермента [8]. Препараты с антинейраминидазной активностью имитируют структуру натуральных субстратов каталитического сайта нейраминидазы, привлекая вирус к большему взаимодействию. Это не позволяет нейраминидазе действовать в роли фермента для высвобождения из конгломерата на поверхности клетки-хозяина новых поколений вируса, в результате чего предотвращается их распространение на восприимчивые клетки.
Первые официальные сообщения о новых препаратах с антинейраминидазной активностью появились в 1993 г. (занамивир) и 1997 г. (осельтамивир). Практическое применение препаратов началось в 1999 г. При этом осельтамивир быстро завоевал позиции препарата выбора в лечении гриппозной инфекции в период эпидемий и создании резерва на случай пандемии [6]. Причиной тому в определенной степени послужила высокая частота резистентных к римантадину и амантадину штаммов высокопатогенного вируса гриппа птиц A(H5N1), инфицировавших людей в период 2003–2004 гг. С появлением в 2007 г. резистентных к осельтамивиру штаммов вируса гриппа A(H1N1) эксперты ВОЗ изменили рекомендации в отношении подготовки к пандемии, дополнив перечень используемых препаратов занамивиром.
В России с 2001 г. осельтамивир (Тамифлю®) разрешен для лечения детей с одного года, для профилактики гриппа – с 12 лет. В 2005 г. показания к применению были расширены и препарат рекомендовали для лечения и профилактики детей с одного года. В 2007 г. разрешили применение занамивира (Реленза®) у детей с пяти лет и взрослых без ограничения возраста.
К настоящему моменту накоплен огромный практический опыт использования осельтамивира и занамивира в лечении и профилактике гриппозной инфекции как в России, так и за рубежом. Кроме того, в ряде клинических исследований подтверждена высокая эффективность данных препаратов [9, 10]. В частности, C.J. Heneghan и соавт. опубликовали систематический обзор и метаанализ данных об эффективности антинейраминидазных препаратов, в том числе в отношении показателей смертности и риска развития побочных реакций [11].
Показано, что осельтамивир сокращает длительность клинических симптомов у взрослых на 16,8 часа (95%-ный доверительный интервал (ДИ) 8,4–25,1), занамивир – на 14,4 часа (ДИ 9,6–19,2). Оба препарата продемонстрировали эффективность при лечении пневмонии (разность рисков (РР) 1,0%; ДИ 0,2–1,5 и РР 0,3%; ДИ 0,1–0,4 соответственно). Профилактическое применение препаратов повышало риск возникновения тошноты у 3,7% взрослых, рвоты – у 4,6% взрослых и 5,3% детей. Профилактика осельтамивиром и занамивиром снижала риск развития клинических симптомов гриппозной инфекции у отдельных лиц (РР 3,1%; ДИ 1,8–3,9 и РР 1,98%; ДИ 1,0–2,5 соответственно) и в семьях (РР 13,6%; ДИ 9,5–15,5 и РР 14,8%; ДИ 12,2–16,6 соответственно). Во время и после лечения осельтамивиром имели место психические расстройства (РР 1,06%; ДИ 0,07–2,8) и во время лечения головные боли (РР 3,2%; ДИ 0,9–5,8). Результаты 30 исследований показали зависимость частоты летальных исходов от времени начала приема препарата и снижение риска летальных исходов у пациентов, инфицированных пандемическим вирусом гриппа A(H1N1)pdm09. Авторы также указали, что, решая вопрос об использовании осельтамивира и занамивира, следует обосновывать необходимость их назначения и учитывать потенциальный риск развития побочных эффектов.
S.G. Muthuri и соавт. провели метаанализ исследований эффективности ингибиторов нейраминидазы у пациентов с пневмониями, этиологически связанными с вирусом гриппа A(H1N1)pdm09 [12]. Авторы проанализировали индивидуальные данные 20 634 пациентов, у которых был диагностирован грипп, вызванный вирусом A(H1N1)pdm09 (лабораторно подтвержден у 20 021 пациента, клинически – у 613). Рентгенологическое подтверждение пневмонии было также обязательным критерием включения пациентов в анализ. Исследователи установили, что раннее назначение антинейраминидазных препаратов не снижало риск развития вирусной пневмонии, но достоверно сокращало частоту случаев подключения больных к искусственной вентиляции легких и летальных исходов.
Препараты с антинейраминидазной активностью являются препаратами выбора при лечении гриппозной инфекции у беременных. A.B. Beau и соавт. оценивали безопасность осельтамивира у 337 беременных и 674 небеременных женщин с гриппозной инфекцией. Достоверных различий по таким показателям, как самопроизвольный аборт (относительный риск (ОР) 1,52; 95% ДИ 0,80–2,91), преждевременные роды (ОР 0,64; 95% ДИ 0,31–1,27) и патология плода (ОР 0,62; 95% ДИ 0,23–1,54), не выявлено [17].
Одним из направлений в разработке новых противогриппозных препаратов является изучение эффективности инъекционных форм, в частности занамивира и перамивира. Такие формы имеют особое значение для пациентов, испытывающих затруднения (желудочный стаз, мальабсорбция, наличие рвоты, бронхоспазм) при использовании пероральных или ингаляционных форм.
Перамивир – противогриппозный препарат, избирательно ингибирующий нейраминидазу вирусов гриппа человека, а также потенциально активный в отношении нейраминидазы высокопатогенного вируса гриппа птиц A(H5N1). Химическая структура перамивира позволяет взаимодействовать с нейраминидазой вируса гриппа с большим сродством, чем осельтамивир. В лабораторных исследованиях у перамивира регистрировались меньшие значения ингибирующих концентраций по сравнению с другими ингибиторами нейраминидазы [18–20].
Результаты изучения эффективности перамивира в плацебоконтролируемых исследованиях у взрослых, как входящих, так и не входящих в группы риска, продемонстрировали, что введение препарата в дозах 300/600 мг/сут в течение одного – пяти дней значительно сокращает длительность клинических симптомов по сравнению с группой контроля. Средняя продолжительность клинических симптомов составила 68,6 часа (90% ДИ 30,0–82,7), у принимавших 300 мг/сут – 114,4 часа (90% ДИ 40,2–253,3), у получавших 600 мг/сут – 42,3 часа (90% ДИ 30,0–82,7). Побочные реакции зарегистрированы у 33,3% пациентов. Какие-либо серьезные клинические симптомы отсутствовали. При измерении концентрации препарата в крови не выявлено признаков его накопления и задержки выведения.
T. Hikita и соавт. изучали эффективность перамивира у 223 детей в возрасте до 18 лет. Средняя продолжительность лихорадки составила один день. Этот показатель существенно отличался от аналогичного показателя в группе сравнения – два дня на фоне применения занамивира (p = 0,02420). Побочных реакций не зарегистрировано, что позволило рекомендовать перамивир для использования в педиатрической практике [21]. Убедительные данные о безопасности препарата, в том числе у беременных и госпитализированных пациентов с тяжелыми формами гриппа, получавших постоянную заместительную почечную терапию и экстракорпоральную мембранную оксигенацию, позволили начать его практическое применение в Японии в 2010 г. (Rapicta), а затем в США и Южной Корее [22].
Ланинамивир (R-125489, или CS-8958) – одна из последних удачных разработок японских ученых, занимающихся поиском новых препаратов с антинейраминидазной активностью. Ланинамивир в отличие от представленных в настоящем обзоре препаратов обладает продолжительным действием: его однократное интраназальное введение на курс лечения подтверждено результатами клинических исследований в 2008–2009 гг. [23–25]. Эффективность ланинамивира сравнима с таковой других препаратов с антинейраминидазной активностью. Однако одним из его преимуществ является снижение риска инфицирования контактирующих лиц при прерывании или недостаточности курса других препаратов на фоне длительно протекающей инфекции, особенно вызванной вирусом гриппа A(H1N1)pdm09. Ланинамивир (инавир), в настоящее время производимый компанией Daiichi Sankyo Co., Ltd (Tokyo), в Японии разрешен для лечения с 2010 г., для профилактики – с 2012 г.
В 2014–2015 гг. частота штаммов вирусов гриппа с пониженной чувствительностью к препаратам с антинейраминидазной активностью была низкой – 1,9%, в 2015–2016 гг. – около 1,0%. Большинство штаммов были выделены у больных, получавших курс лечения осельтамивиром, или пациентов с иммунодепрессивными состояниями [28, 29].
Таким образом, учитывая низкую частоту штаммов с пониженной чувствительностью к препаратам с антинейраминидазной активностью, можно утверждать, что они остаются препаратами выбора в лечении и профилактике гриппозной инфекции. К практическому применению рекомендованы новые препараты, а также их формы. В 2016 г. в России зарегистрирован отечественный препарат с антинейраминидазной активностью – Номидес, активным веществом которого является осельтамивир.
Читайте также:


