Вакцина против гриппа из растений
C приходом сезона простуд и гриппа снова приходится вооружаться вакцинами, однако в Северной Америке их продолжают делать из куриных яиц. В Канаде пытаются разработать новые уникальные вакцины против гриппа, используя растение табака.
"Одно маленькое растение позволит изготовить 50 доз вакцины, - говорит Энди Шелдон (Andy Sheldon), руководитель канадской фармакологической компании Medicago, которая занимается разработкой новых вакцин. – Если взять для сравнения яйца, которые раньше использовались для производства вакцин против гриппа, то из одного яйца можно получить всего 2 дозы".
Большинство вакцин против гриппа делается из яиц, причем используются для этого живые эмбрионы куриц. У этой технологии есть свои ограничения. Например, при появлении новых вирусов, сложно что-либо изменить в этой технологии. В 2009 году эпидемия свиного гриппа прошла второй волной еще до того, как вакцина была готова.
Компания Medicago получила американские гранты. Она является одной из нескольких компаний, которые ищут более эффективные способы замены яиц для производства вакцин. На растения стали обращать внимание в качестве альтернативы еще в начале 1990-х годов. В настоящее время тестируется несколько растений, включая томаты.

Академические попытки разработать альтернативы были приостановлены из-за серьезных нормативных требований при производстве вакцин. Обычная вакцина против гриппа должна пройти клинические тесты перед тем, как ее одобрят, на которые требуется 5-6 месяцев. Некоторые компании, в том числе биотехнологическая компания Icon Genetics из Германии, обратили внимание на вид табака Nicotiana benthamiana. Medicago также стала использовать этот вид растения.
Medicago начала с того, что стала выращивать табак в своих оранжереях. Примерно через 5 недель растения поместили в раствор, содержащий безопасные для человека бактерии, которые находятся в почве. Этот раствор заставлял растения вырабатывать большие объемы белка. Растение оставалось в растворе в течение 5 дней.

Листья табака начинали сворачиваться и проходили через стандартные фармакологические стадии, образуя чистую вакцину против гриппа. Похожие на вирусы частицы выглядели и вели себя точно так же, как настоящие, заставляя реагировать иммунную систему, однако у них не было ДНК, чтобы воспроизводиться.
Более того, компания сообщила, что вакцина будет относительно недорогой. Для производства традиционных вакцин против гриппа на основе яиц требуется от 350 до 400 долларов за 40-50 миллионов доз. Оборудование и предприятие по выращиванию клеток оцениваются в 1 миллиард, однако производственный объект компании Medicago обошелся в общей сложности в 36 миллионов долларов, сообщил Шелдон.
Компания финансируется Агентством передовых оборонных исследовательских проектов (DARPA). Исследования являются частью программы Министерства обороны США с целью разработать вакцины как можно быстрее в случае очередной эпидемии. Гранты DARPA также получили и другие компании. В 2008 году производитель сигарет, компания Phillip Morris, также стал вкладывать средства для развития проектов Medicago.

Во время эпидемии свиного гриппа в 2009 году как только Medicago получила генетическую последовательность, она смогла всего за 19 дней разработать продукт в пробирке, который был чистым на 95 процентов. Прошлой весной Medicago выпустила 10 миллионов доз вакцины против свиного гриппа всего за 1 месяц.
Компания также разрабатывает ингредиент для вакцин, который предназначен для стимуляции и лучшей работы иммунитета.
Medicago уже завершила первую фазу клинических исследований в США для разработки вакцины против сезонного гриппа. Новые вакцины на основе табака смогут поступить на рынок не раньше, чем через 4-5 лет. Пока что придется пользоваться птичьими вакцинами. Компания уже прошла все нормативные требования для того, чтобы начать вторую фазу испытаний в Канаде.
Практически каждый человек хотя бы раз в жизни болел гриппом. Грипп — это тяжелое инфекционное заболевание, которое отличается резкой интоксикацией, умеренными катаральными явлениями, с поражением трахеи и крупных бронхов. Возбудителем гриппа является вирус, который размножается в слизистой оболочке дыхательных путей.
Причины высокой заболеваемости ОРВИ и гриппом:
Подъем заболеваемости гриппом начинается в холодное время года. С одной стороны, этому способствует высокая устойчивость вируса гриппа к действию низких температур. С другой стороны, переохлаждение снижает защитные свойства организма человека.
Источником инфекции является больной человек. Путь распространения — воздушно-капельный. Это объясняет столь быстрое распространение вируса в пределах помещения, в организованных коллективах.
Молниеносный грипп
Первичная вирусная пневмония является самой тяжелой формой гриппа. Эта форма наиболее характерна для пандемий и поражает людей независимо от их возраста и состояния здоровья.
Типичный грипп
Острое респираторное инфекционное заболевание с внезапным началом после инкубационного периода длительностью 1-2 дня, сопровождающееся повышением температуры тела, слабостью и другими симптомами интоксикации, а также поражением дыхательных путей.
Период заразности длится 3 дня с момента появления клинических симптомов (описана длительность до 5 дней).
Наиболее важным симптомом является повышение температуры тела. Температура быстро поднимается до 40-41°С, параллельно развитию других общих симптомов. Фебрильный период длится обычно 3 дня, иногда 4-8 дней, Восстановление проходит быстро, однако в течение нескольких дней может сохраняться слабость и астения, у некоторых больных могут развиться серьезные осложнения.
Осложнения
Наиболее частым проявлением суперинфекции при гриппе является вторичная бактериальная пневмония. Именно от нее погибают большинство детей младшего возраста, пожилых людей и больных с хроническими заболеваниями.
Пневмония развивается спустя 4-14 дней после исчезновения симптомов гриппа. Вирусная инфекция защитную систему легких. Это создает условия для размножения таких микроорганизмов, как Streptococcus pneumoniae, Staphylococcus aureus и другой бактериальной флоры.
Кроме пневмонии встречаются и другие респираторные осложнения: круп (ларинготрахеобронхит), средний отит и др. (синусит, ринит).
Грипп также может спровоцировать обострение хронических заболеваний легких (астма, бронхит); декомпенсацию сердечно-сосудистых заболеваний (миокардит, перикардит), почечной недостаточности или эндокринных расстройств (сахарный диабет).
Вакцинация против гриппа рекомендуется для всех лиц от 6 месяцев и старше, входящих в группы риска по возрасту или состоянию здоровья. Вакцинация необходима также сотрудникам здравоохранения и членам семей, контактирующим с пациентами групп риска. Кроме этого, вакцинация показана всем людям, желающим снизить вероятность заболевания гриппом.
Группы риска по осложнениям вследствие гриппа: люди преклонного возраста, страдающие хроническими соматическими заболеваниями, часто болеющие ОРЗ, дети дошкольного возраста.
Группы высокого риска заражения: медицинский персонал, работники сферы обслуживания, транспорта, учебных заведений, воинские контингенты, школьники и пр.
Группы высокого риска передачи вируса гриппа: медицинский и другой персонал лечебных учреждений, включая скорую и неотложную помощь; персонал учреждений длительного ухода, контактирующий с пациентами; лица, ухаживающие за пациентами из групп высокого риска, включая членов семьи.
Профилактика гриппа – ежегодная вакцинация.
Нужно ли прививаться ежегодно?
Противогриппозный иммунитет, который выработался в прошлом году, не спасет от гриппа в этом. Из-за непрерывной изменчивости вирусов гриппа каждую осень появляется совершенно новый грипп, от которого не помогают и прошлогодние прививки. Поэтому, каждый год надо делать новые прививки. Если прививаться прошлогодними вакцинами, то эффективность вакцинации уменьшается до 20-40%, вместо 70-90%.
Для ежегодного проведения вакцинации есть несколько причин:
- Изменчивость вируса (появление новых подтипов или ежегодный антигенный дрейф). В связи с этим штаммовый состав вакцин меняется ежегодно.
- Длительность иммунитета (циркуляция антител), вызываемого как вакцинацией, так и естественной инфекцией, составляет около года (особенно у пожилых).
Эффективность вакцинации в профилактике осложнений и смертности.
Снижение на 48-75% частоты госпитализаций по поводу гриппа и пневмонии.
У детей в возрасте 6-30 мес: 69%-ная эффективность предотвращения острого среднего отита (ОСО).
У детей с патологией: среди детей с астмой эффективность профилактики приступа составляет 67,5%.
Лучшим средством противостояния гриппу является его профилактика. Она включает:
изоляция больных, использование средств индивидуальной защиты (марлевые маски на лицо) эффективны, но, на самом деле трудно жестко соблюдать этот режим;
прививки от гриппа — вакцинация (каждый год вакцины от гриппа выпускаются с учетом ожидаемого штамма вируса) — очень высокий уровень надежности профилактики;
Вакцинация населения является наиболее эффективным, надёжным и доступным средством профилактики гриппа; при этом значительно снижается уровень заболеваемости, риск развития тяжёлых осложнений, преобладают лёгкие формы течения заболевания. Все отечественные вакцины адаптированы к предстоящему сезону.
Оптимальным временем для проведения вакцинации против гриппа является осенний период — с сентября по ноябрь. Это объясняется рядом соображений: эпидемии гриппа приходятся, как правило, на период между ноябрем и мартом; время выработки антител занимает около 2-4-х недель; высокий титр антител, вызванный прививкой, держится несколько месяцев и начинает падать спустя 6 месяцев после вакцинации. Поэтому слишком заблаговременная вакцинация не рекомендуется (титр антител может упасть к моменту начала эпидемии). Если по каким-то причинам вакцинация не была сделана вовремя, то ее можно сделать и после начала эпидемии гриппа. Широко распространено ошибочное мнение, что после начала эпидемии вакцинация противопоказана. Это имеет отношение к живым противогриппозным вакцинам. Инактивированные вакцины рекомендуются к применению на протяжении всей эпидемии. Однако, если прививка была сделана тогда, когда человек был уже инфицирован вирусом гриппа (но клинические проявления еще не начались), то вакцина может оказаться неэффективной. Иммунитет, развивающийся вследствие вакцинации против гриппа, сохраняется от 6 до 12 месяцев, хотя защитные титры антител обнаруживаются в течение более длительного времени. В целом, можно считать, что человек, вакцинированный инактивированным вирусом гриппа, сохраняет иммунитет к гриппу до 12 месяцев.
А вакцинация, как самый эффективный способ вакцинопрофилактики, позволяет значительно снизить риск заболевания гриппом, и все вытекающие из него последствия.
Аннотация научной статьи по агробиотехнологии, автор научной работы — Кондакова О.А., Трифонова Е.А., Архипенко М.В., Никитин Н.А., Карпова О.В.
Птичий грипп инфекционная вирусная болезнь, поражающая разные виды пернатых, включая домашнюю птицу (кур, индюков, уток и гусей). Вакцинация остается ключевой стратегией в предотвращении эпизоотий и эпидемий птичьего гриппа. При этом на сегодняшний день актуальная задача заключается в разработке и внедрении быстрых, безопасных и высокопроизводительных методов при производстве вакцин против гриппа. Применение рекомбинантных антигенных детерминант в вакцинных препаратах рассматривается как перспективный подход для создания универсальных, безопасных и эффективных вакцин . Одно из решений проблемы низкой иммуногенности вакцинных белков использование вирусов растений и вирусоподобных частиц в качестве платформы для презентации антигенов и усиления иммунного ответа. Ранее нами было показано, что при нагревании палочковидного вируса табачной мозаики происходит образование частиц сферической формы (СЧ), обладающих уникальными адсорбционными и иммуностимулирующими свойствами. В представляемой работе разработана вакцина против вируса гриппа А птиц (штамм H5N1), созданная посредством сборки in vitro комплексов, включающих антигенные детерминанты вируса на поверхности СЧ. Методом непрямой иммуннофлуоресцентной микроскопии показана антигенная активность рекомбинантных вирусных белков гемагглютинина НА и внеклеточного домена матриксного белка М2 (М2е), адсорбированных на СЧ. Полученные комплексы СЧ-HA-М2е (СЧ-HA62/284-М2е) оказались высокоиммуногенными. При иммунизации лабораторных животных подтверждено образование специфических антител к обеим антигенным детерминантам вируса гриппа А птиц. Адсорбция НА и М2е на СЧ позволила в 10 раз увеличить выработку антител к антигенам в крови иммунизированных животных. Преимущество использованного подхода при создании вакцинных препаратов высокая эффективность, основанная на стабильности и адъювантной активности сферических частиц , безопасность и низкая себестоимость использования вирусов растений . Получение ветеринарных вакцин на основе структурно модифицированных вирусов растений позволяет создать отечественные маркерные ветеринарные вакцины для оздоровления популяции птицы в агропромышленных комплексах. Полученная вакцина может рассматриваться в качестве кандидатной рекомбинантной вакцины против вируса гриппа птиц.
Похожие темы научных работ по агробиотехнологии , автор научной работы — Кондакова О.А., Трифонова Е.А., Архипенко М.В., Никитин Н.А., Карпова О.В.
DEVELOPMENT OF AVIAN INFLUENZA VACCINE ON THE BASIS OF STRUCTURALLY MODIFIED PLANT VIRUS
Avian influenza is an infectious viral disease that affects various species of birds, including poultry (chicken, turkeys, ducks and geese). Vaccination is a key strategy in the prevention of epizootics and epidemics of influenza. Now, the actual problem is the development of rapid, safe and effective methods for the production of avian flu vaccines . The using of recombinant flu antigen is a promising approach for creating universal, safe and effective poultry flu vaccines . To increasing of low immunogenicity of recombinant antigens plant viruses and virus-like particles can be applied. We have previously shown that spherical particles (SPs) with unique adsorption property and immunostimulating activity. Here we design the candidate vaccine against the avian flu virus (H5N1). The complexes containing the antigenic determinants of the avian flu virus hemagglutinin (HA) and the extracellular domain of the M2 matrix protein (M2e) presented on the surface of SPs were developed. By indirect immunofluorescence microscopy the specific antigenic activity of recombinant proteins adsorbed on the SPs surface were demonstrated. The SPs-HA-M2e (SPs-HA62/284-М2е) complexes were highly immunogenic. The candidate vaccine induced a strong humoral immune response to both antigenic determinants of avian flu A virus. HA and M2e adsorption on the SPs allowed a 10-fold increase in the production of blood antibodies to antigens in immunized animals. The advantage of this approach for the vaccine development is high efficiency based on the stability and adjuvant activity of SPs, safety and low cost of using plant viruses . Obtaining veterinary vaccines based on structurally modified plant viruses allows the creation of marker veterinary vaccines . Development and creation of marker vaccines is extremely important for the recovery of the poultry population in agro-industrial complexes. The proposed vaccine can be considered as a candidate recombinant vaccine against avian influenza virus .
СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОЛОГИЯ, 2017, том 52, № 4, с. 731-738
УДК 636.5:619:615.371:[573.6.086.83+577.21 doi: 10.15389/agrobiology.2017.4.731rus
РАЗРАБОТКА ВАКЦИНЫ ПРОТИВ ПТИЧЬЕГО ГРИППА НА ОСНОВЕ СТРУКТУРНО МОДИФИЦИРОВАННЫХ ВИРУСОВ РАСТЕНИЙ*
О.А. КОНДАКОВА, Е.А. ТРИФОНОВА, М.В. АРХИПЕНКО, Н.А. НИКИТИН, О.В. КАРПОВА, И.Г. АТАБЕКОВ
Птичий грипп — инфекционная вирусная болезнь, поражающая разные виды пернатых, включая домашнюю птицу (кур, индюков, уток и гусей). Вакцинация остается ключевой стратегией в предотвращении эпизоотий и эпидемий птичьего гриппа. При этом на сегодняшний день актуальная задача заключается в разработке и внедрении быстрых, безопасных и высокопроизводительных методов при производстве вакцин против гриппа. Применение рекомбинантных антигенных детерминант в вакцинных препаратах рассматривается как перспективный подход для создания универсальных, безопасных и эффективных вакцин. Одно из решений проблемы низкой им-муногенности вакцинных белков — использование вирусов растений и вирусоподобных частиц в качестве платформы для презентации антигенов и усиления иммунного ответа. Ранее нами было показано, что при нагревании палочковидного вируса табачной мозаики происходит образование частиц сферической формы (СЧ), обладающих уникальными адсорбционными и иммуностимулирующими свойствами. В представляемой работе разработана вакцина против вируса гриппа А птиц (штамм H5N1), созданная посредством сборки in vitro комплексов, включающих антигенные детерминанты вируса на поверхности СЧ. Методом непрямой иммуннофлуоресцентной микроскопии показана антигенная активность рекомбинантных вирусных белков — гемагглютинина НА и внеклеточного домена матриксного белка М2 (М2е), адсорбированных на СЧ. Полученные комплексы СЧ— ИЛ-М2е (СЧ—ИЛ62/284-М2е) оказались высокоиммуногенными. При иммунизации лабораторных животных подтверждено образование специфических антител к обеим антигенным детерминантам вируса гриппа А птиц. Адсорбция НА и М2е на СЧ позволила в 10 раз увеличить выработку антител к антигенам в крови иммунизированных животных. Преимущество использованного подхода при создании вакцинных препаратов — высокая эффективность, основанная на стабильности и адъювантной активности сферических частиц, безопасность и низкая себестоимость использования вирусов растений. Получение ветеринарных вакцин на основе структурно модифицированных вирусов растений позволяет создать отечественные маркерные ветеринарные вакцины для оздоровления популяции птицы в агропромышленных комплексах. Полученная вакцина может рассматриваться в качестве кандидатной рекомбинантной вакцины против вируса гриппа птиц.
Ключевые слова: вирусы растений, вакцины, сферические частицы, вирус гриппа А, ре-комбинантные белки.
Грипп относится к наиболее заразным и быстро распространяющимся инфекционным заболеваниям (1). Его возбудители — РНК-содер-жащие вирусы семейства Orthomyxoviridae. Хотя природным резервуаром вируса гриппа А служат дикие птицы, эти вирусы могут заражать также домашнюю птицу и несколько видов млекопитающих, включая человека. Эпизоотии, этиологический связанные с вирусом гриппа А, наносят заметный ущерб сельскому хозяйству. В настоящее время борьба с гриппом птиц предполагает введение карантинов, а также забой инфицированных и контактировавших с ними особей, что приводит к значительным экономическим потерям. Из всех вирусов гриппа, циркулирующих среди птиц, наибольшую опасность для человека представляет штамм H5N1 в связи с большим числом случаев заражения людей при контакте с инфицированными птицами и самым высоким процентом смертельных исходов (2).
Наиболее эффективным способом профилактики эпидемий и пан-зоотий гриппа считается вакцинация. Для получения современных лицензированных вакцин против вирусов гриппа используют куриные эмбрионы, и производство таких вакцин для каждого штамма занимает до 6-9 мес, что в случае появления нового пандемического штамма может иметь не-
предсказуемые последствия. Кроме того, применение традиционных методов ограничено высокой вирулентностью штамма H5N1 для цыплят, куриных эмбрионов и потенциальной опасностью для человека.
Конструирование рекомбинантных белков рассматривается как альтернативный подход для создания универсальных, безопасных и эффективных вакцин против вируса птичьего гриппа (3). Однако в ряде работ сообщается, что наиболее перспективные для включения в вакцину вирусные белки (поверхностный белок гемагглютинин HA, который служит основной мишенью для нейтрализующих антител, и консервативный матрикс-ный белок М2) имеют низкую иммуногенность и не могут стимулировать эффективный иммунный ответ (4-7). Одно из решений проблемы — использование вирусов растений (8-10) и вирусоподобных частиц на их основе для презентации эпитопов протективных антигенов и усиления иммунного ответа (11-15).
Ранее мы показали, что при нагревании спирального вириона вируса табачной мозаики (ВТМ) до 94 °С происходит структурная перестройка вирусного белка и формируются сферические частицы (СЧ) контролируемого размера. Такие СЧ биодеградируемы, не содержат РНК и обладают высокой стабильностью. Кроме того, СЧ безопасны для человека, так как растения и животные не имеют общих патогенов (16-19). В то же время СЧ — эффективные иммуностимуляторы (11).
В настоящем исследовании для создания ветеринарной кандидат-ной вакцины использованы уникальные, не имеющие аналогов частицы — СЧ. Впервые получены комплексы СЧ—HA62/284-М2е, содержащие сферические частицы, образованные при термической перестройке ВТМ, и адсорбированные на их поверхности рекомбинантные антигены HA62/284 и М2е вируса гриппа А, и продемонстрировано сохранение антигенной специфичности рекомбинантных белков. Такие комплексы оказались высо-коиммуногенными: при иммунизации лабораторных животных показана выработка специфических антител к обеим антигенным детерминантам вируса гриппа А птиц.
Цель представляемой работы заключалась в разработке рекомби-нантной кандидатной вакцины нового поколения против вируса птичьего гриппа, полученной посредством сборки in vitro комплексов, включающих иммуногенные эпитопы белков НА и М2 вируса гриппа А на поверхности сферических частиц на основе вириона вируса табачной мозаики.
Методика. Вирионы ВТМ (штамм U1) выделяли из инфицированных растений Nicotiana tabacum L. сорта Samsun, как описано ранее (20). СЧ получали из очищенного препарата ВТМ (5 мг/мл) при 94 °С согласно протоколу (18).
НА62/284-М2е получали in vitro при инкубации белков HA62/284, M2e и СЧ в массовом соотношении 5:5:100 при 25 °С в течение 20 мин.
Иммуногенность комплексов СЧ—HA62/284-М2е изучали на самках лабораторных беспородных белых мышей в возрасте 6-8 нед массой 15-18 г, разделенных на 4 группы по 5 животных в каждой. Мышей внутрибрюшин-но иммунизировали PBS (натрий-фосфатный буфер, phosphate-buffered saline; отрицательный контроль, I группа), свободными рекомбинантными белками HA62/284 и М2е (II группа), белками в смеси с адъювантом Фрейнда (III группа), комплексами СЧ—HA62/284-М2е (IV группа). Доза на одну инъекцию составляла 5 мкг HA62/284, 5 мкг М2е, 100 мкг СЧ; объем смеси, инъецируемой животному, — 0,2 мл. Всего провели 3 иммунизации с 2-недельным интервалом. Кровь для анализа брали через 1 нед после последней иммунизации.
Результаты. Для создания кандидатной вакцины из очищенного препарата ВТМ посредством термической денатурации при 94 °С были получены частицы сферической формы. Для контроля их характеристик использовали просвечивающую электронную микроскопию (рис. 1). Размер полученных СЧ составил 612±41 нм.
А __Б Рис. 1. Электронные микро-
i.e. Ид 9 J IB* * фотографии сферических ча-
•¡В а стиц, полученных при терми-
Ч? ï**® Да ческой денатурации вируса та-
JÏ , К** J ^^^^^^^^^^^^^ бачной мозаики. Просвечива-
25 сентября 2019
- 31294
- 26,0
- 32
- 5



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Мутации и вариации
Известно три разновидности вируса гриппа, опасных для человека:
- тип А (Alphainfluenzavirus) — наиболее подвержен мутациям и является постоянной головной болью Всемирной организации здравоохранения (ВОЗ);
- тип В (Betainfluenzavirus) — более стабилен, но все же может видоизменяться;
- тип С (Gammainfluenzavirus) — наиболее стабилен, поэтому к нему вырабатывается длительный иммунитет. Эпидемичных вспышек не дает, чаще всего приводит к нетяжелому заболеванию у детей.
Если бы все типы вируса гриппа были похожи на тип С, больших проблем с ними не было. Однако тип А постоянно мутирует, поэтому довольно часто появляются его новые вариации (штаммы), с которыми наша иммунная система еще не знакома [2]. Из-за этой изменчивости классификация вирусов гриппа достаточно сложная: внутри каждого типа существуют подтипы (в случае с типом В — линии), в которые объединяют штаммы вируса. Причем, штаммы подтипов могут быть как родственными (то есть эволюционно недалеко ушедшими друг от друга), так и непохожими.
Причем в случае с беременными женщинами риск касается не только будущей мамы, но и ее ребенка: грипп во время беременности более чем в 7 раз повышает риск госпитализации, а также может привести к преждевременным родам (около 30% случаев), мертворождению и малому весу при рождении [2], [6]. Поэтому во многих странах мира (США, Великобритания, Австралия, Италия) беременным рекомендована вакцинация против гриппа. Делают это по двум причинам:
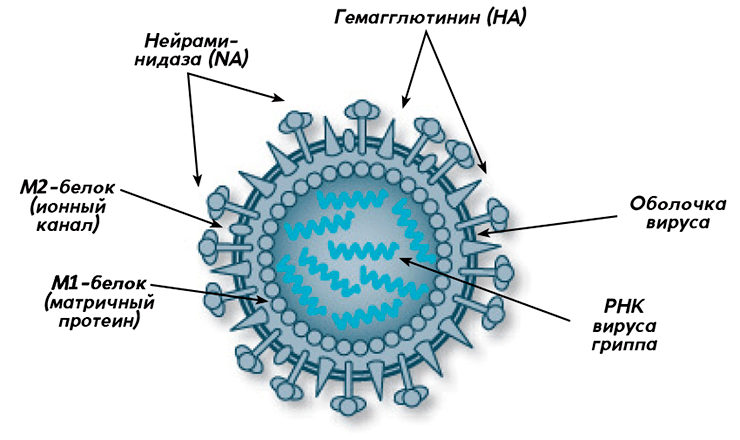
Рисунок 1. Строение вируса гриппа (типы А и В)
Когда лучше сделать прививку?
Вакцинация против гриппа — это ежегодная прививка , которая защищает от трех или четырех наиболее распространенных в данной местности штаммов вируса. Это значит, что каждый год на основании рекомендаций ВОЗ и региональной ситуации национальные комитеты по контролю над гриппом составляют рекомендации антигенного состава будущей вакцины [15], [16]. Однако чаще всего эти рекомендации совпадают с рекомендациями ВОЗ, которые публикуются отдельно для северного и южного полушарий.
Большинству людей прививают одну дозу вакцины, однако детям от шести месяцев до двух лет (и до девяти лет в случае их первой вакцинации [17]) рекомендованы две дозы с минимальным интервалом в один месяц. Исследования показывают, что в этом случае эффективность вакцинации увеличивается [18], [2].
Состав противогриппозных вакцин все время меняется: например, в сезоне 2019–2020 были заменены оба штамма вируса типа А, и в итоге в четырехкомпонентную вакцину вошли:
- A/Brisbane/02/2018 (H1N1);
- A/Kansas/14/2017 (H3N2);
- B/Colorado/06/2017 (линия B/Victoria/2/87);
- B/Phuket/3073/2013 (линия B/Yamagata/16/88).
В трехкомпонентную вакцину, соответственно, рекомендовано включить первые три штамма вируса [16]. Однако бывает и так, что каждый год в составе вакцин повторяется название одного из штаммов. Значит ли это, что постоянно прививают одно и то же? Нет, даже в этом случае штаммы могут существенно различаться, в том числе и по генам, не входящим в классификацию.
Как долго длится иммунитет после вакцинации и имеет ли он пролонгированный эффект на будущий год? К сожалению, эффективность прививок против гриппа недолговечна. Она зависит от времени, прошедшего с момента прививки и штамма вируса: в среднем, считается, что защита снижается примерно на 7% в месяц для H3N2 и штаммов линии В и на 6–11% — для H1N1 [17]. Конечно, скорость и степень снижения могут различаться, но эффективной защиты, скорее всего, хватает на год [11].
Как выбирают штаммы и почему четыре лучше трех?
В течение всего года специалисты NICs анализируют циркулирующие штаммы вирусов на основании лабораторных анализов пациентов с респираторными заболеваниями, выделяют из общей массы пробы с вирусом гриппа и выбирают подходящих кандидатов для дальнейшего изучения в одном из пяти центров ВОЗ (WHO CCs) [19]. Отбор идет по принципу типичности вируса для данного региона и новизне, которую определяют по его реакции с антителами из набора ВОЗ. Дальнейшая работа осуществляется уже в центрах ВОЗ, где штаммы культивируют, анализируют, сравнивают между собой, составляют карты антигенности, строят математические модели и в итоге на основании всех этих данных выбирают претендентов в состав вакцины [19]. Как происходит этот процесс и сколько времени занимает каждая стадия, показано на рисунке 2.
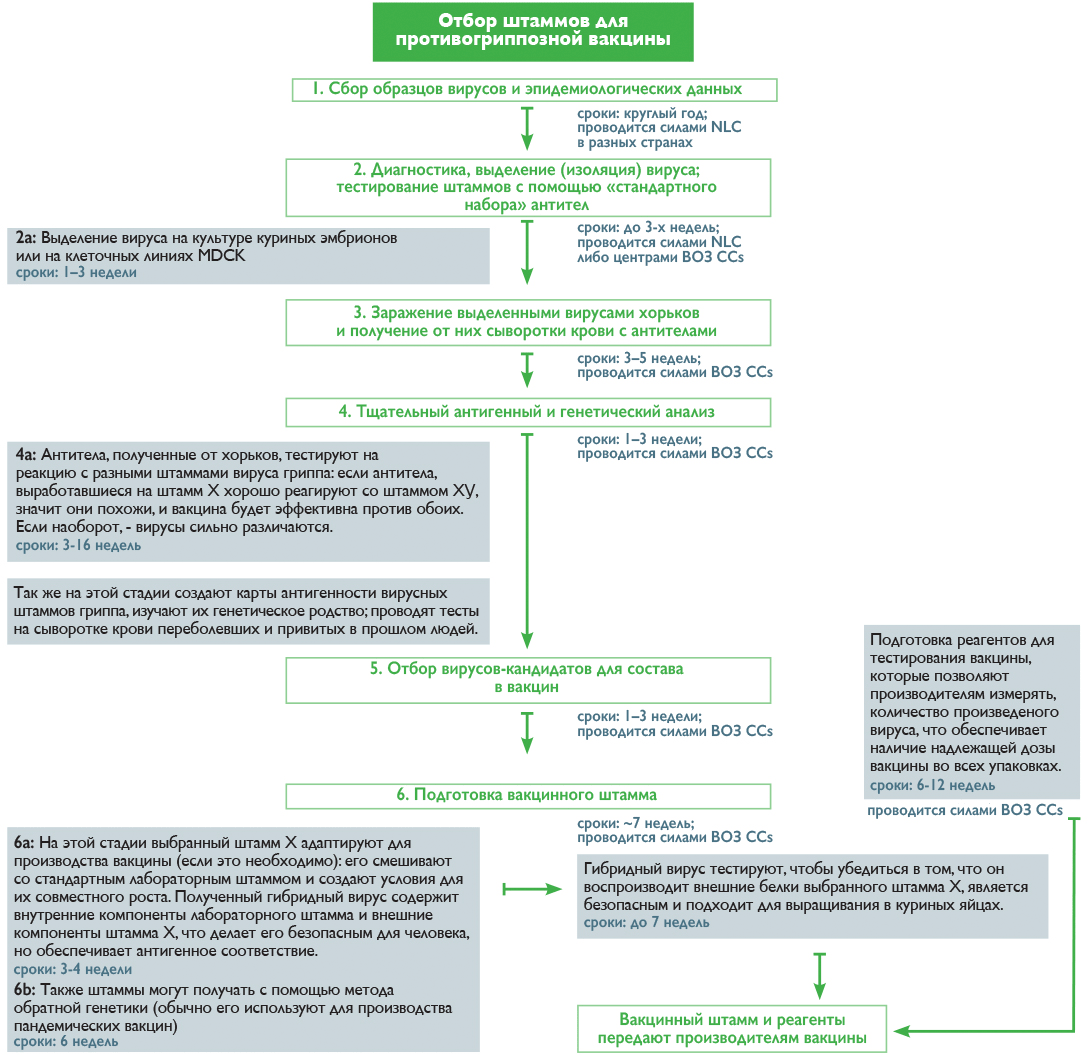
Рисунок 2. Процесс отбора штаммов для противогриппозной вакцины
И наконец, дважды в год проходят Сезонные совещания ВОЗ, посвященные составам противогриппозных вакцин (Seasonal influenza vaccine composition meeting), на которых объявляют рекомендации для будущего сезона: в феврале — для северного полушария, в сентябре — для южного. Как только составы обнародованы, и производители получают вакцинные штаммы, запускается процесс производства, на который уходит около полугода (видео 1). Однако ошибки в планировании могут задержать весь цикл, что скажется на количестве произведенной вакцины или на сроках ее поставки.
Видео 1. Производство противогриппозных вакцин
Почему все-таки четырехкомпонентная вакцина лучше трехкомпонентной, если циркулирующих штаммов гораздо больше? Все дело в линии В, вирусы которой обычно циркулируют вместе, но в разных пропорциях [3], поэтому в случае с вакцинами, состоящими из трех компонентов, штамм линии В всегда является компромиссным вариантом. Экспертам ВОЗ приходится выбирать большее из двух зол, но так как невозможно точно предсказать ситуацию, которая будет наблюдаться через восемь месяцев, периодически случаются ошибки, сказывающиеся на эффективности вакцины. Например, в сезоне 2017–2018 она оказалась ниже ожидаемой, так как ВОЗ прогадала со штаммом вируса типа В, предположив, что доминировать будет линия Victoria, а оказалось — Yamagata [20]. Кроме того, уже не первый год наблюдается низкая эффективность вакцины в отношении штамма H3N2. Точная причина неизвестна, но существует несколько предположений:
- Адаптация штамма во время производства может приводить к некоторым изменениям (антигенному несоответствию), и иммунитет развивается уже к новому штамму, который отличается от циркулирующего.
- Циркулирующие штаммы подтипа H3N2 меняются быстрее, чем другие — им хватает полугода (то есть времени, прошедшего с момента объявления рекомендаций ВОЗ), чтобы измениться и стать менее похожим на вакцинный штамм.
- Стандартной дозы, содержащейся в вакцине, может быть недостаточно для эффективной защиты [18], [21].
Какой должна быть идеальная вакцина?
Вакцины против гриппа бывают живыми (интраназальные вакцины, применяются редко) и инактивированными. Современные инактивированные делятся на нескольких категорий:
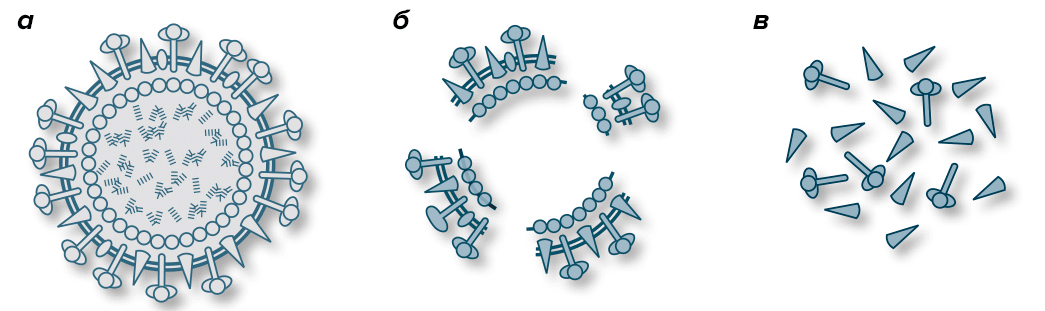
Рисунок 3. Виды антигенов инактивированных вакцин. а — Инактивированный вирусный вирион в цельновирионной вакцине. б — Расщепленный инактивированный вирион в сплит-вакцине. в — Частички антигена в субъединичной вакцине.
Все вышеперечисленные вакцины являются вакцинами против сезонного гриппа .
В отдельную группу выделяют препандемические и пандемические вакцины. Их производят в случае возникновения угрозы пандемии. Препандемические (зоонозные) состоят из штамма зарождающегося вируса животного происхождения, который, по мнению экспертов, обладает пандемическим потенциалом, пандемические — из штамма, вызвавшего пандемию (такие вакцины появляются на волне заболеваемости) [15].
Однако выбрать штаммы для состава — лишь полдела. Главное, чтобы вакцина была эффективной. Для этого существуют определенные критерии.
Во-вторых, существуют требования к титрам антител после вакцинации (в том числе и для вакцин с адъювантами), которые указаны в таблице 1.
| Показатель | Люди от 18 до 60 лет | Люди старше 60 лет |
|---|---|---|
| 1. Кратность нарастания среднего геометрического титра антител после вакцинации (GMT increase) | 2,5 раза | 2 раза |
| 2. Уровень сероконверсии * (процент привитых с нарастанием титра антител минимум в четыре раза по сравнению с исходым) | 40% | 30% |
| 3. Уровень серопротекции (число лиц с защитным титром) ** | 70% | 60% |
| * — В тестах, измеряющих ингибирование гемагглютинина (HI), сероконверсия соответствует отрицательной сыворотке до вакцинации (HI | ||
Для сезонных вакцин необязательно соблюдение всех трех условий; соответствие всем требованиям необходимо только для пандемических [24]. Мало того, сейчас титр HI ≥ 1:40 уже не считается надежным фактором для определения эффективности защиты (50–70% против клинических симптомов гриппа), так как уровни защиты могут варьировать в зависимости от индивидуальных характеристик, групп населения, возрастных групп и даже от типа вакцины [25].
В-третьих, есть отдельные требования к вакцинам, содержащим адъюванты:
- Совместимость адъюванта с антигенными компонентами вакцины.
- Доказательство последовательной связи адъюванта с вакцинными антигенами во время производства и в течение срока годности.
- Данные о влиянии адъюванта на эффективность вакцины.
- Биохимическая чистота адъюванта [23].
Если все это суммировать, то идеальная вакцина должна быть безопасной (низкореактогенной ), содержать 15 мкг гемагглютинина на дозу, вызывать определенные уровни титров антител у привитых в зависимости от их возраста (при этом количество эффективно привитых должно быть не менее 70% среди взрослого населения до 60 лет). Если же вакцина содержит адъювант, он должен быть безопасным, связанным с антигенами и вызывать иммунный ответ в соответствии со строгими стандартами.
Что касается безопасности, то благодаря широкому использованию сплит- и субъединичных вакцин, прививки против гриппа демонстрируют низкую реактогенность. В основном наблюдаются местные реакции (у 10–64 привитых из 100) и повышение температуры (чаще всего у детей: 12 из 100 привитых) [26].
В противопоказаниях к вакцинам против гриппа указано, что их нельзя прививать людям, у которых есть аллергические реакции на любой из компонентов, в том числе и на белок куриного яйца [27]. Однако в международной практике людей с аллергией на куриный белок совершенно спокойно прививают как против гриппа, так и против кори, краснухи и паротита, хотя вирусы для этих вакцин выращивают с использованием куриных эмбрионов. Вакцинации аллергиков дали зеленый свет после серии исследований [28–30], в которых изучали реактогенность у людей с аллергическими реакциями на куриный белок: в итоге эти вакцины признали безопасными, и теперь прививают даже людям с анафилактической реакцией на куриный белок (единственное, таких пациентов нельзя прививать в аптеках или школах, как это делают в некоторых странах — только в медицинских центрах, где есть противошоковые медикаменты).
Во время производства вакцины клеточную культуру подвергают сериям центрифугирований и ультрафильтраций, которые позволяют отделить вирусные частицы от остальных белков. Конечно, эта технология не идеальна, но даже если в препарат вдруг что-то и попадает, то лишь следовые количества овальбумина — основного белка куриного яйца: ≤ 1 мкг на 0,5 мл дозы инактивированной и 0,24 мкг на 0,2 мл дозы живой вакцины [31]. Поэтому основным противопоказанием для вакцинации против гриппа являются только тяжелые реакции на введение этих вакцин в прошлом (реакция на предыдущую дозу и аллергия на куриный белок не всегда связаны между собой: человек мог отреагировать на другой компонент, например, на неомицин) [27], [31].
Чем же прививаться?
Это вопрос, который волнует многих. В России прививают следующими вакцинами:
Муки выбора
Но, честно говоря, таких исследований единицы, поэтому выводы приходится делать по косвенным данным — официальной статистике заболеваемости гриппом в зависимости от количества привитых в нашей стране (рис. 4).
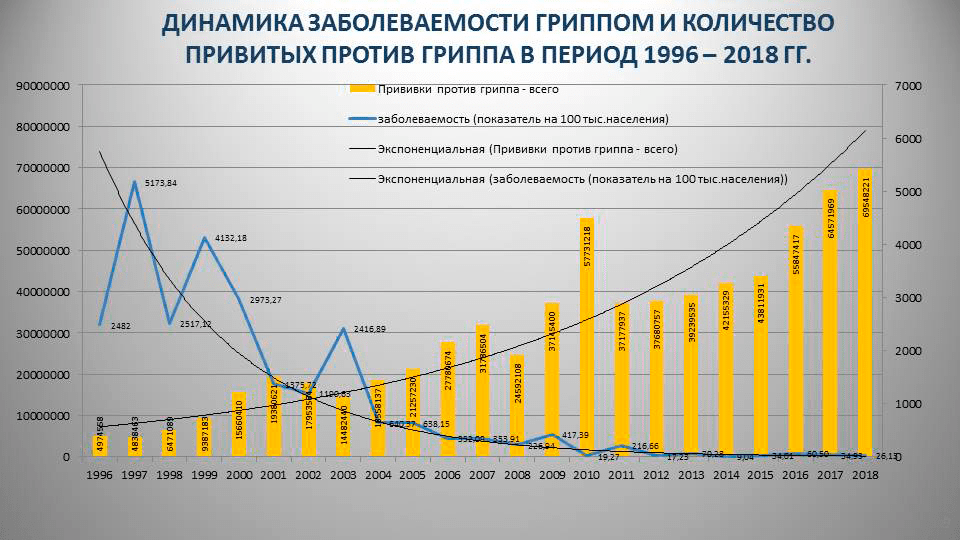
Рисунок 4. Заболеваемость гриппом и количество привитых против гриппа в России за 1996–2018 годы
Автор благодарит врача-биофизика Кирилла Скрипкина за помощь в подготовке материала.
Читайте также:


