Вакцинные штаммы вируса бешенства
При лицензировании новых живых вакцин для животных во многих странах (ЕС, США, Япония) их проверяют на отсутствие горизонтальной передачи вакцинного штамма. Проверку проводят на естественно восприимчивых животных (10 вакцинированных и 10 контактных). При совместном содержании в течение 2—4 недель о наличии или отсутствии горизонтальной передачи судят по результатам тщательного лабораторного обследования этих животных. Однако при отрицательном результате таких исследований не исключается принципиальная возможность контактной передачи вакцинного штамма при массовой вакцинации в условиях влияния множества эндогенных и экзогенных факторов.
Редкие случаи такой передачи некоторых вакцинных штаммов известны, но они не ведут к повышению вирулентности вакцинного вируса и не сопровождаются снижением эффективности вакцинации. Исключением из этого правила является живая вакцина против полиомиелита. Вакцинный штамм Сэбина полиовируса типа 1 и 3 в редких случаях оказался способным вновь обрести нейровирулент-ность и вызывать заболевание у вакцинированных или у контактировавших с ними людей. Однако это происходит с исключительно низкой частотой (около одного случая на 106—107 иммунизации) и в общем не влияет на выраженную эпидемиологическую эффективность данного препарата.
Выяснена генетическая основа этого довольно редкого повышения вирулентности полиовирусных вакцинных штаммов при репликации в кишечнике привитых.
Другое исключение состоит в том, что некоторые аттенуированные вакцинные штаммы могут довольно легко передаваться горизонтальным путем, не вызывая при этом нежелательных последствий. Однако из-за их высокой эффективности приходится мириться с циркуляцией вакцинного вируса в популяции. Таким примером могут служить некоторые вакцинные штаммы вируса ньюкаслской болезни, которые бессимптомно иммунизируют кур, находящихся в контакте с привитыми в полевых условиях. Способность некоторых аттенуированных штаммов выделяться из организма вакцинированных животных и иммунизировать контактирующих индивидуумов данной популяции считалась положительным явлением, так как облегчала формирование группового иммунитета. Вероятно, данное положение может быть приемлемым только в случае применения нереверсибельных вакцин.
Другая потенциальная опасность живых вакцин состоит в том, что вакцинные штаммы могут длительно персистировать в организме привитых. Например, известны случаи, когда вирус краснухи выделяли из лимфоцитов лиц с артритами через 6 лет после иммунизации. Известны также случаи длительной персистенции (19 мес) вакцинного штамма вируса ветряной оспы в организме привитых детей с последующей реактивацией и восстановлением вирулентности. Однако, в общем, вероятность такой ситуации очень низкая, а широкое применение живой вакцины против кори устраняет редкое, но длительное носительство полевого вируса кори.
Живые вакцины, применяемые в ветеринарии, должны использоваться только для тех видов животных, для которых они предназначены. Например, живая вакцина против чумы собак может вызывать летальную инфекцию у некоторых видов пушных зверей. Живая вакцина против болезни Ауески безопасна для свиней, но высоко вирулентна для пушных зверей.
Противоположным явлением недостаточной аттенуации является чрезмерная аттенуация вируса, при которой могут утрачиваться полезные свойства аттенуированных штаммов и практический смысл их получения. Чрезмерная аттенуация вируса кори при длительном пассировании в различных культурах клеток могла быть возможной причиной ослабления иммуногенной активности вакцины Эдмонстон-Загреб и Ленинград-16. Однако такого не произошло в опытах с вирусом осповакцины. После продолжительной персистентной инфекции выделены аттенуированные для мышей мутанты, имеющие большую делению размером 8 МД на левом конце генома и изменение нуклеотидной последовательности в другой части генома, что сопровождалось значительным изменением структуры белков оболочки (14 и 21 кД) и нуклеоида (39 кД).
Несмотря на такие изменения, аттенуированные мутанты сохраняли иммуногенность и защищали мышей от заражения летальными дозами вирулентного штамма вируса. Таким образом, глубокая аттенуация вируса осповакцины сохранялась в процессе персистенции и, несмотря на значительные изменения генома и поверхностных белков, не сопровождалась потерей иммуногенных свойств. Создается впечатление, что вирус осповакцины является исключением из правил.
Во избежание потери полезных свойств при изготовлении живых вакцин используют вакцинные штаммы только в том диапазоне пассажей, который определен для каждого из них в предварительных опытах и является гарантией безвредности и активности вакцины (обычно в течение не более 20 пассажей от матричной расплодки вируса).
Теоретически одновременное введение двух или более живых вакцин может вызывать снижение иммунного ответа за счет гетерологической интерференции вакцинных штаммов вирусов. На практике оказалось, что это зависит от конкретных вакцин. Так, одновременное применение комбинированной вакцины против кори, краснухи и паротита безопасно и эффективно. Аналогичный результат получен при одновременной иммунизации кур против болезни Марека, ларинготрахеита, ньюкаслской болезни и оспы. Однако пероральная вакцина против полиомиелита и вакцина против ротавирусной инфекции не сочеталась между собой. Также не рекомендуется использовать комбинацию живых вакцин против инфекционного бронхита, ларинготрахеита и ньюкаслской болезни.
Вероятно, все зависит от места репликации вакцинных вирусов в организме. Если места репликации вакцинных штаммов совпадают, значит будет гетероинтерференция, и такие вакцины нельзя применять одновременно.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Лосич Милана Анатольевна, Зайкова О.Н., Непоклонова И.В., Гребенникова Т.В., Верховский О.А.
В статье представлена молекулярная и биологическая характеристика вакцинного вируса бешенства штамм ERA-CB 20M , полученного российским рабиологом, доктором медицинский наук С.В. Грибенча путём адаптации и клонирования штамма ERA и SAD в перевиваемой культуре клеток BHK-21 С13. Установлен спектр наиболее чувствительных к вирусу бешенства штамм ERA-CB 20M линий клеток, количественно определён уровень гликопротеина. Получена информация о первичной структуре фрагментов генома штамма ERA-CB 20M (гены N и G) и проведён филогенетический анализ. Методами молекулярного анализа установлено, что данный штамм попадает в группу вакцинных штаммов SAD1. При сравнении с референсным штаммом SAD1 выявлено 10% нуклеотидных отличий во фрагменте гена N и 15% во фрагменте гена G.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Лосич Милана Анатольевна, Зайкова О.Н., Непоклонова И.В., Гребенникова Т.В., Верховский О.А.
MOLECULAR AND BIOLOGICAL CHARACTERISTICS OF VACCINARY ERA-CB 20M OF RABIES VIRUS
The molecular and biological characteristics of the vaccine against rabies virus strain ERA-CB 20M obtained by the Russian rabiologist, doctor of medical sciences S.V. Gribencha by adapting and cloning the strain ERA and SAD in a transplantable BHK-21 C13 cell culture are presented. The spectrum of the most sensitive strain of rabies ERA-CB 20M cell lines was determined and the level of glycoprotein was quantitatively determined. Primary nucleotide sequences of fragments of the genome of the strain ERA-CB 20M (genes N and G) were obtained and phylogenetic analysis was carried out. Molecular analysis showed that this strain belongs to the group of vaccine strains SAD1. When compared with the reference strain SAD1, 10% of the nucleotide differences were revealed in the gene fragment N; 15%, in the gene fragment G.
Лосич М.А.1'2, Зайкова О.Н.1'2, Непоклонова И.В.2, Гребенникова Т.В.13, Верховский О.А.2, Одноворов А.И.3, Алипер Т.Н.1'2
молекулярно-биологическая характеристика вакцинного
ШТАММА ERA-cB 20M ВИРУСА БЕШЕНСТВА
В статье представлена молекулярная и биологическая характеристика вакцинного вируса бешенства штамм ERA-CB 20M, полученного российским рабиологом, доктором медицинский наук С.В. Грибенча путём адаптации и клонирования штамма ERA и SAD в перевиваемой культуре клеток BHK-21 с1з. Установлен спектр наиболее чувствительных к вирусу бешенства штамм ERA-CB 20M линий клеток, количественно определён уровень гликопротеина. Получена информация о первичной структуре фрагментов генома штамма ERA-CB 20M (гены N и G) и проведён филогенетический анализ. Методами молекулярного анализа установлено, что данный штамм попадает в группу вакцинных штаммов SAD1. При сравнении с рефе-ренсным штаммом SAD1 выявлено 10% нуклеотидных отличий во фрагменте гена N и 15% - во фрагменте гена G.
К л ю ч е в ы е с л о в а: бешенство; штамм ERA-CB 20M; секвенирование; гликопротеин вируса бешенства; титр вируса.
Losich M.A.12, Zaykova O.N.12, Nepoklonova I.V.2, Grebennikova T.V.13, Verkhovsky O.A.2,
Odnovorov A.I.3, Aliper T.I12 MOLECULAR AND BIOLOGICAL CHARACTERISTICS OF VACCINARY ERA-CB 20M
OF RABIES VIRUS
2Diagnostic and Prevention Research Institute for Human and Animal Diseases, Moscow, 123098, Russian Federation; 3Peoples' Friendship University of Russia, Moscow, 117198, Russian Federation
The molecular and biological characteristics of the vaccine against rabies virus strain ERA-CB 20M obtained by the Russian rabiologist, doctor of medical sciences S.V. Gribencha by adapting and cloning the strain ERA and SAD in a transplantable BHK-21 C13 cell culture are presented. The spectrum of the most sensitive strain of rabies ERA-CB 20M cell lines was determined and the level of glycoprotein was quantitatively determined. Primary nucleotide sequences of fragments of the genome of the strain ERA-CB 20M (genes N and G) were obtained and phylogenetic analysis was carried out. Molecular analysis showed that this strain belongs to the group of vaccine strains SAD1. When compared with the reference strain SAD1, 10% of the nucleotide differences were revealed in the gene fragment N; 15%, in the gene fragment G.
K e y w o r d s: rabies; .strain ERA-CB 20M; .sequencing; rabies virus glycoprotein; virus titer.
Acknowledgments.The publication was prepared with the support of the RUDN University Program 5-100. Conflict of interest. The authors declare no conflict of interest.
Received 22 December 2017 Accepted 06 March 2018
Бешенство - это острое нейроинфекционное заболевание, возбудитель которого - вирус бешенства (ВБ) -передаётся со слюной больного животного через укус или при ослюнении повреждённых участков кожи. Вирус бешенства относится к порядку Mononegavirales, семейству Rhabdoviridae, роду Lyssavirus, и единственный из известных представителей царства Virae поражает всех теплокровных животных, в том числе человека, в глобальном масштабе с летальностью 100% [1].
На сегодняшний день род Lyssavirus насчитывает 14 видов: вирус бешенства (ВБ, G1), Lagos bat lyssavirus (G2), Mokola lyssavirus (G3), Duvenhage lyssavirus (G4), European bat lyssavirus-1 (EBLV-1, G5), European bat lyssavirus-2 (EBLV-2, G6), Australian bat lyssavirus (G7), Aravan lyssavirus (G8), Khujand lyssavirus (G9), Irkut lyssavirus (G10), West Caucasian bat lyssavirus (G11), Shimoni bat lyssavirus (G12), Bokeloh bat lyssavirus (G13), Ikoma lyssavirus (G14), 1 неклассифицированный Lleida bat lyssavirus. Установлено, что 7 генотипов встречались у людей (Rabies, European, Irkut, Duvenhage, Australian, Mokola) [2].
По форме вирион ВБ пулеобразный, имеет длину в среднем 180 нм, диаметр - 75 нм и состоит из несегмен-тированного генома, представленного одной молекулой спиралеобразно скрученной негативной РНК и пятью структурными белками: нуклеопротеином (N), фосфо-протеином (P), матричным белком (М), гликопротеином (G) и РНК-зависимой РНК полимеразой или большим белком (L-large protein). Именно гликопротеин, образуя поверхностные пепломеры, участвует в проникновении вируса в клетку (прикрепление к клеточным рецепторам, слияние мембран и эндоцитоз), индуцирует образование вируснейтрализующих антител и клеточно-опосредованного иммунного ответа. Гликопротеин гликозилирован по N-связям, а также отвечает за гемаг-глютинирующую активность и определяет серотип вируса [3, 4].
В Российской Федерации и в мире проблема бешенства остаётся актуальной. За последние годы стабильно высокий уровень распространения рабической инфекции наблюдался в Центральном и Приволжском федеральных округах. Наибольшее число неблагополучных пунктов в 2016 г. зарегистрировано в Московской области (274). Всего за 2016 г. выявлен 2151 случай бешенства животных на территории РФ, большая часть заболевших - дикие и домашние плотоядные [5, 6].
На сегодняшний день нет гарантированного 100% лечения бешенства, и основным методом борьбы с распространением инфекции является вакцинопрофилак-тика. В настоящее время совершенно очевидно, что без углублённого знания природы возбудителя, включая детальное изучение молекулярной организации генома, невозможно создание высокоэффективных средств специфической профилактики.
ВБ штамм ERA-CB 20M был получен д-ром мед. наук, рабиологом Сергеем Васильевичем Грибенча из штамма ERA и SAD. Культуру клеток заражали вирусом ERA в дозах 50, 250, 1250, 6250 и 31250 LD50, затем через 5, 7, 10 и 13 дней определяли титр вируса в вируссодержащей жидкости путём внутримозгового заражения мышей, а также концентрацию гликопротеина методом твердофазного ИФА. В результате проведённых пассажей удалось получить популяцию вируса с относительно стабильной
высокой экспрессией гликопротеина от 500 до 2400 нг/ мл. Выделенный биологический вариант прошёл 20 последовательных пассажей в культуре клеток ВНК-21 и получил новое обозначение - ERA-CB 20M (С - селекция, В - вариант, 20 - 20 последовательных пассажей, M - Москва) [7, 8].
В работе исследованы молекулярные и биологические свойства вакцинного штамма ERA-CB 20M ВБ.
Материал и методы
Филогенетический анализ фрагментов генома штамма ERA-CB 20M
problems of virology. 2018; 63(5)
Олигонуклеотиды (праймеры) для ОТ-ПЦР и секвенирования фрагмента гена G ВБ
CTGCATTTCATCAAAGTCAA AGCGGTGTCTTCTACCTACT TCTACAACAAGGTGCTCAAT GGAGGACTATTGAACCCA
секвенирования с использованием автоматического сек-венатора Applied Biosystems 3130 Genetic Analyzer.
Определение спектра наиболее чувствительной линии клеток для получения вакцинного ВБ штамм ERA-CB 20М
Наиболее интенсивная репродукция ВБ штамм ERA-CB 20М была определена при заражении линии клеток ПС на уровне 3—4-го сбора (пула), и титр вируса соста-
Таблица 2 Штаммы ВБ, используемые для сравнения [11]
SAD1 variant 1 SAD1 variant 2 CVS-11 RV-97
SAD Bern (Sanafox) SAD Bern (Lysvulpen) SAD B19 (Fuchsoral) SAD P5/88 (Rabifox) ERA
SAD Vnukovo isolate 9503TCH
EF206717 EF206718 GQ918139 EF542830 EF206720 EF206708 EF206709 EF206715 EF206707 GU992319 JN234414 JN234418 JN234424
BSR BHK-21 BHK-Щ BHK-ф Vero Линии клеток
■ 1-й сбор □ 2-й сбор □ 3-й сбор ■ 4-й сбор □ 5-й сбор
Рис. 1. Зависимость репродукции вакцинного ВБ штамм ERA-CB 20М от линии клеток.
вил 7,5 ± 0,15 lg ТЦД 50/мл, а также линии клеток BSR на уровне 1—2-го сбора (пула) (титр вируса 6,5 ± 0,26 lg ТЦД 50/мл) и третьей линии клеток ВНК-21-13С -на уровне 3-го сбора (пула), где титр вируса составил 6,0 ± 0,15 lg ТЦД 50/мл (рис. 1).
Исходя из полученных данных был сделан вывод о том, что перевиваемые линии клеток ПС, BSR и ВНК-21-13С являются наиболее чувствительными к ВБ штамм ERA-CB 20М, в культуральной жидкости которых происходит максимальное накопление вируса.
Количественное определение гликопротеина ВБ
Поскольку G-белок является основным иммуногеном вакцинного ВБ, следующим этапом исследований было количественное определение гликопротеина при культивировании вакцинного ВБ методом ИФА (Институт полиомиелита им. Чумакова, Москва) на следующих линиях клеток: ВНК-О, BHK-Ф, BHK-21 BSR, ПС (рис. 2).
Количественный анализ уровня экспрессии G-белка в линиях клеток, заражённых ВБ штамм ERA-СВ 20М, показал, что наиболее высокий уровень гликопротеина наблюдается в следующих клеточных линиях: BSR (в количестве 285 нг/мл, 1-й пассаж, 1-й сбор), затем ВНК-21 (275 нг/мл, 1-й пассаж,1-й сбор), ВНК-О (270 нг/мл, 1-й пассаж, 1-й сбор).
Филогенетический анализ нуклеотидных последовательностей фрагментов генома штамма ERA-CB 20М ВБ
Проведён филогенетический анализ вакцинного ВБ штамм ERA-CB 20М. Определены нуклеотидные последовательности фрагментов генов, кодирующих нуклео- и гликопротеин. Полученные данные о первичных последовательностях генома исследуемого штамма сравнивали с данными о первичной последовательности генома штамма Щёлково-51, а также с последовательностями других вакцинных штаммов ВБ из базы данных NCBI.
Было выполнено множественное выравнивание полученных фрагментов генов N и G по наиболее старому из доступных сиквенсов штаммов вируса бешенства -SAD1, зарегистрированному в двух вариантах. Во фрагменте гена, кодирующего N-белок, были обнаружены в основном однонуклеотидные замены (61-я позиция). Также обнаружены двунуклеотидные и трёхнуклеотид-ные замены. При этом выявлено всего 11 аминокислот-
Ученые атакуют пока неизлечимую вирусную инфекцию бешенства с двух сторон. Молекулярные биологии создают ДНК-вакцину против вируса бешенства. Зоологи массово вакцинируют диких животных — природных носителей вируса путем массового разбрасывания приманки с вакциной в местах их обитания.
Летальность при заражении вирусом бешенства у человека — 100%. Единственный способ спасения — своевременная вакцинация. Сейчас ведутся работы по созданию ДНК-вакцин от бешенства как для человека, так и для животных. Животных тоже надо лечить, потому что человек всего лишь промежуточный и случайный хозяин вируса при его циркуляции в природе, а без ликвидации природных очагов вируса борьба с бешенством будет бесконечной.
134 года назад впервые пациенту, укушенному бешеной собакой, была введена вакцина на основе препарата мозга зараженного кролика. Это был большой риск для уже знаменитого ученого Луи Пастера, опыты на животных были в самом разгаре, и гарантировать исход вакцинации человека не мог никто. Ясно было только одно — без лечения укушенный ребенок умрет. Вакцина сработала, это стало выдающимся событием в медицинской науке. Пастер был удостоен беспрецедентных почестей, стал членом академий, кавалером более 200 орденов разных стран мира, в его институте проходили вакцинацию тысячи пациентов ежегодно.
Сложно поверить, но и спустя столько лет человечество все еще находится под угрозой страшного заболевания. Несмотря на ежегодную вакцинацию более 15 миллионов человек, потенциальную угрозу этот вирус несет для 3,3 млрд человек в 100 странах мира. 99% случаев заболевания связаны с укусами больных собак, но источником заражения могут быть и другие плотоядные (кошки, ежи и др.), в некоторых регионах мира переносчиком заболевания могут стать летучие мыши.
Для человека нет спасения, если уже появились симптомы заболевания. По оценкам Всемирной организации здравоохранения (ВОЗ), из-за отсутствия лечения ежегодно от бешенства погибает до 60 тыс. человек, 40% из них — дети в возрасте от 5 до 15 лет.
Вирус бешенства относится к роду Lyssavirus семейства Rhabdoviridae. Помимо вируса бешенства другие 11 представителей этого рода тоже вызывают прогрессирующий энцефалит. Можно считать бешенство энцефалитом, вызываемым лиссавирусами, а вирус бешенства — основным вирусным видом этого рода.
Заражение обычно происходит через повреждение кожи после царапины или укуса зараженным животным. Вирус содержится в его слюне. В зависимости от удаленности места укуса от основных нервных окончаний, от количества попавшего в рану вируса период скрытого развития заболевания занимает от недели до года, в среднем три месяца, особенно опасны укусы в область головы и шеи.
Вирус распространяется по нервной системе, организм не вырабатывает к нему антитела, и заражение невозможно диагностировать на ранней стадии. Разработаны эффективные способы определения вируса только на стадии клинических его проявлений и при посмертном обследовании.
Но бешенство отличается от многих других инфекций тем, что вакцинация оказывается эффективной после заражения: вирус распространяется по организму скрытно, неуклонно, но очень медленно.
До сих пор миллионы людей получают вакцину этого типа. Она опасна своими побочными эффектами, поскольку кроме вируса бешенства содержит остатки тканей животного, что может вызвать аллергическую реакцию. Но такая вакцина проста в производстве и относительно дешева. ВОЗ рекомендует в ближайшее время отказаться от вакцин этого типа и перейти на работу с вакцинами, полученными из культуры тканей.
В 1956 году было предложено выращивание вируса в тканях эмбриона утки, а к концу 1960-х годов развитие методов культивирования тканей позволило размножать вирус в биореакторе, что значительно повысило чистоту препарата и снизило побочные эффекты.
Сейчас на рынке предлагаются препараты на основе разных штаммов вируса, полученные в разных культурах клеток. Главное условие: все они должны отвечать стандартам по иммуногенной активности: не менее 2,5 международных единиц в разовой дозе для внутримышечного введения.
Бешенство в России
В России за медицинской помощью после нападения животных обращаются от 250 тыс. до 450 тыс. человек в год. Все группы риска проходят постэкспозиционную (профилактическую) вакцинацию, причем в связи с опасностью заболевания без ограничения для детей, беременных женщин и людей с иммунодефицитом.
Несмотря на это, в России с начала этого века регистрируется от четырех до 22 смертей от бешенства в год. Потребность России в антирабической вакцине оценивается в 1,5 млн доз, срок хранения таких препаратов составляет до трех лет при температуре от +2°С до +8°С в защищенном от солнечного света месте.
Все это делает актуальным поиск вариантов вакцин нового типа — более дешевых (цена дозы в $45 в некоторых регионах мира оказывается для многих недоступной), более стабильных и менее капризных к условиям хранения (не везде можно обеспечить температурный режим хранения), более иммуногенных при меньшем количестве побочных эффектов.

ДНК-вакцины интересны тем, что в их составе можно комбинировать белки разных представителей рода лиссавирусов, их проще хранить, дешевле производить. ДНК-вакцины уже проходят испытания в животноводстве.
Но в случае ДНК-вакцин для человека существенным ограничением для их внедрения становится смертельный характер заболевания.
Но даже при полном охвате групп риска постэкспозиционной вакцинацией проблема бешенства не будет решена до конца. В природе останутся ее зоонозные очаги, и придется постоянно ждать, не произойдет ли там какой-нибудь мутации вируса, против которой даже самые продвинутые ДНК-вакцины окажутся бессильными. Требуется вакцинация диких животных — носителей вируса, желательно поголовная. Основные целевые виды вакцинируемых животных: лисица, енотовидная собака, песец, корсак, шакал.
Ее проводят с помощью специальных кормовых добавок или кормовых брикетов с дозой вакцины, которые распространяются в дикой природе или в зонах, граничащих с поселениями, на неблагополучных и угрожаемых по бешенству территориях. При поедании приманки животное раскусывает блистер с вакциной, вирус контактирует со слизистой оболочкой ротовой полости и глотки в области окологлоточного лимфоидного кольца, проникает в организм и, проходя ограниченное количество циклов репродукции, инициирует иммунный ответ к вирусу бешенства через 21 сутки.
Методика не нова. В странах Западной Европы она применятся с конца 1970-х годов. Пионером была Швейцария, где в 1978 году была применена массовая оральная вакцинация лис, после того как ученые в опытах продемонстрировали, что орально введенный аттенуированный штамм вируса бешенства SAD может защищать лис от заболевания. Через пять лет после первого испытания в Швейцарии по этому пути пошла Германия, где использовали вакцину SADD 19, производную от швейцарского вакцинного штамма. Еще через три года к вакцинации диких животных присоединилась Франция.
В начале 1990-х здесь на площади 120 тыс. кв. км было разбросано 4,4 млн приманок. После этого заболевание бешенством не отмечалось здесь ни среди людей, ни среди животных. Фактически был создан грандиозный иммунологический барьер от Ла-Манша до швейцарской границы. Частота бешенства снизилась на 99,7%, заболевание во Франции практически исчезло.
У нас такие же меры принимались еще при Советском Союзе, но при огромной территории нашей страны разделить ее сплошными иммунологическими барьерами и зачистить потом территории внутри них невозможно.
Была избрана другая стратегия — выявление зоонозных очагов вируса бешенства и иммунизация животных в них приманками с вакцинами, в том числе с применением авиации для разбрасывания приманок с вакцинными блистерами. Образно говоря, в отличие от стран ЕС, в России ковровые бомбардировки вакцинированными приманками невозможны, тут требуется прицельное бомбометание.
Вакцинированные брикеты разбрасываются с самолетов малой авиации из расчета 20–30 брикетов на 1 кв. км. Считается, что систематическое применение такого метода вакцинации позволяет в течение шести лет перевести территорию в разряд благополучных по бешенству. После реформы системы управления в ветеринарии в начале 2000-х годов, когда полномочия по борьбе с бешенством переданы на региональный уровень, занимаются этим ветеринарные службы регионов.
В 2018 году природные очаги бешенства обнаруживались на большей части территории России (за исключением 14 регионов). Лидерами по числу случаев заболевания животных стали Московская, Белгородская, Саратовская области, правда, эпидемиологический порог не был достигнут.
По данным Россельхознадзора, в 2019 году о раскладке брикетов с оральной вакциной от бешенства (в том числе с применением малой авиации) сообщили ветеринарные службы Московской области, Удмуртии, Бурятии, Татарстана, Кировской области, Ненецкого автономного округа и др.
Работы много. Но если она продолжится, а на смену традиционным антирабическим вакцинам придут более эффективные ДНК-вакцины, можно достичь цели, и бешенство в нашей стране перейдет в разряд экзотических болезней.
Алексей Дейкин, кандидат биологических наук, Институт биологии гена РАН
08 октября 2018
- 3720
- 3,1
- 0
- 4
Даже домашние животные могут быть переносчиками бешенства

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Стоит начать с истории
Первые упоминания о болезни от укуса собак, весьма напоминающей бешенство, встречаются на клинописных глиняных табличках Древней Месопотамии в третьем тысячелетии до н.э. [1].
Древнегреческий философ Демокрит описал бешенство собак в V веке до н.э., то же сделал и Аристотель, однако он считал, что человек бешенством не болеет. Корнелий Цельс, древнеримский ученый, в I веке н.э. все же заметил аналогичное заболевание у людей и назвал его водобоязнью [2].
Начиная с XIII века у нас появляются сведения о крупных эпизоотиях бешенства на территории Европы. Вероятно, они вспыхивали и на других континентах, так как это заболевание в современном мире распространено практически повсеместно.
Эпизоотия — эпидемия среди животных.
И если вы думаете, что это все было давно, и сейчас вирус не представляет никакой опасности, вы крупно ошибаетесь: согласно данным ВОЗ 2007 года, он ежегодно уносил жизни 55 тысяч человек по всему миру [3]. Это около 151 смерти в день! Такой постоянно высокий показатель говорит о человеческой уязвимости, эпизоотии вспыхивают каждый год, что ставит под опасность жизнь каждого человека. На данный момент случаи заражения бешенством носят регулярный характер в более чем 150 странах мира, в том числе и в России [4] (рис. 1 и 2).
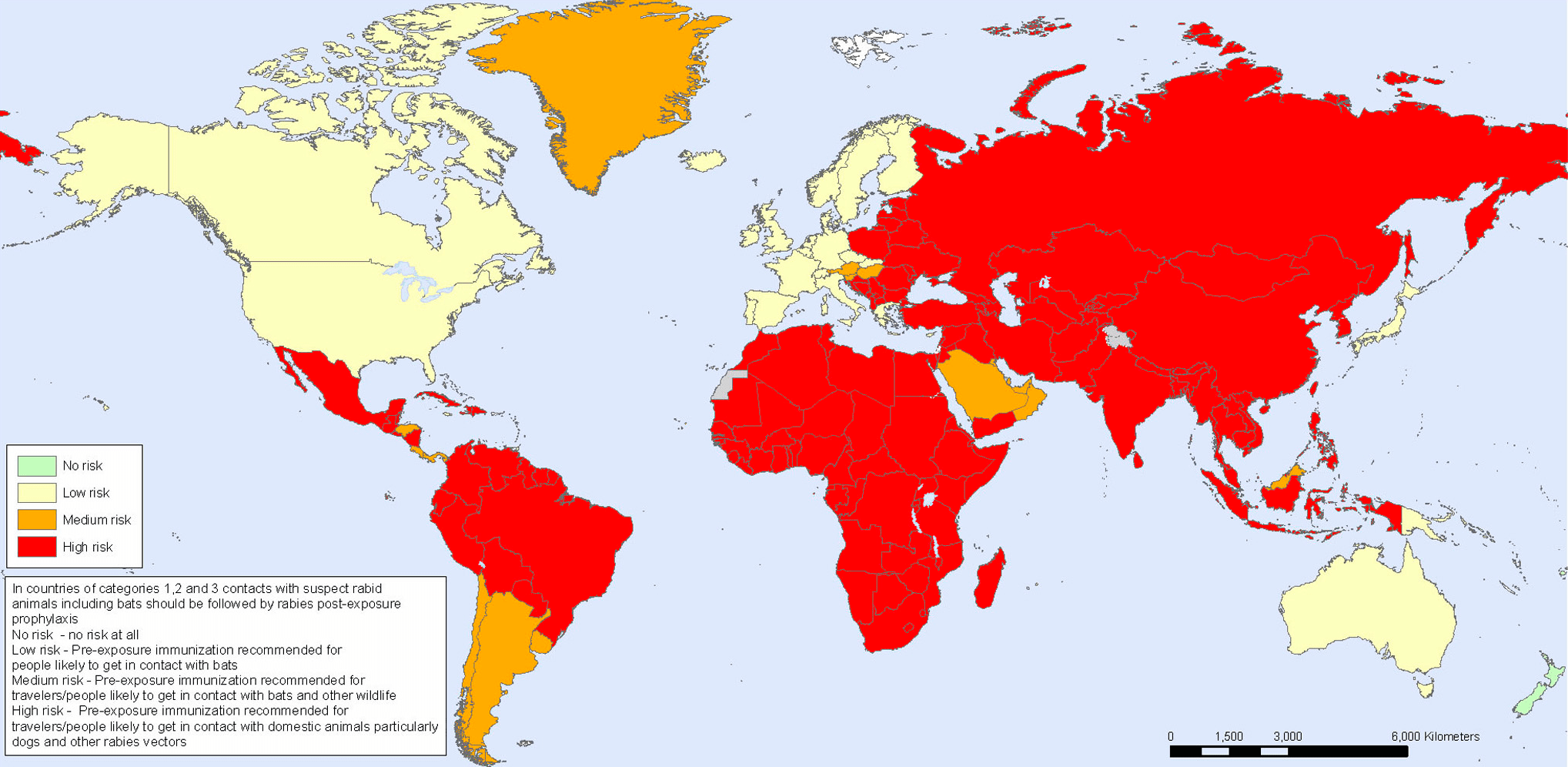
Рисунок 1. Оценка риска заражения бешенством в мире
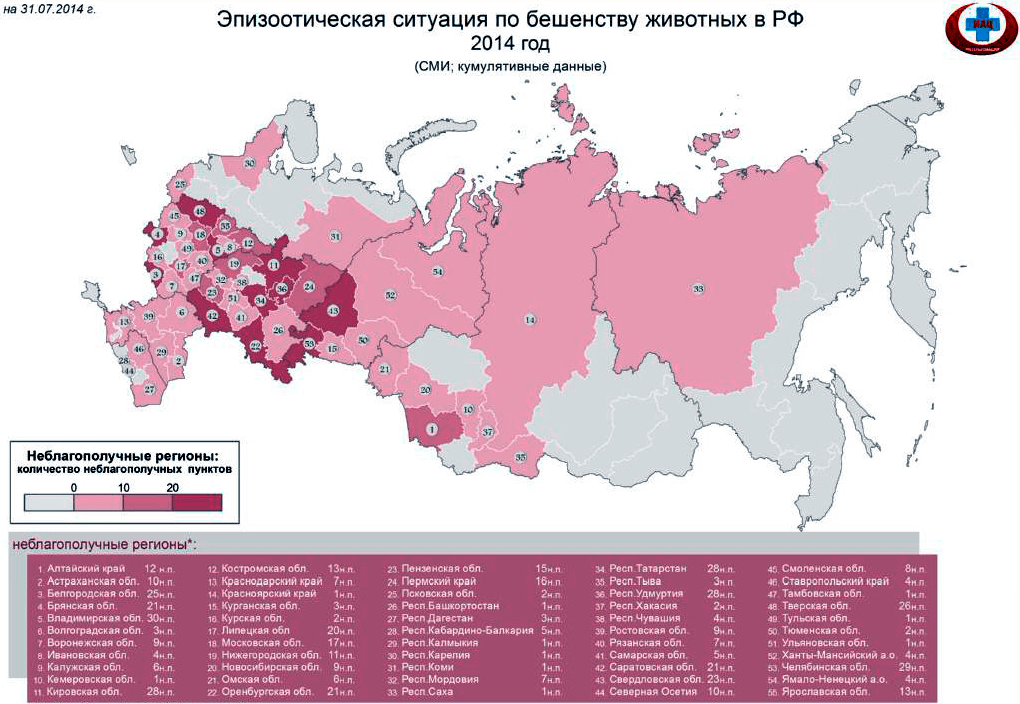
Рисунок 2. Неблагополучные по бешенству регионы России, данные 2014 года подпись
Давайте знакомиться, Neuroiyctes rabid
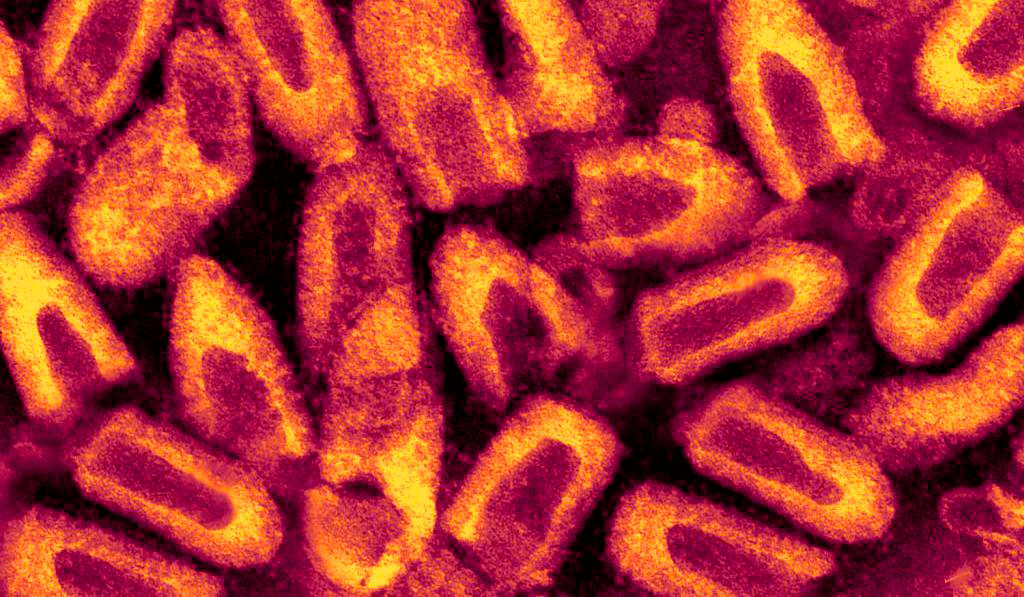
Смертоносная пуля длиной 180 нм и шириной 75–80 нм [6] имеет двухслойную липидную оболочку, которая довольно сильно по строению напоминает привычную нам мембрану клеток. На своей поверхности вирион имеет шипы длиной 10 нм и шириной 3 нм. Упорядоченное расположение шипов на мембране обеспечивает особый гликопротеид, далее мы будет к нему возвращаться еще несколько раз, запомните его, товарищи.
Вирион — полноценная вирусная частица, находящаяся вне клетки-хозяина.
Под прочной оболочкой внутри вируса залегает одна молекула РНК, свернутая в спираль, она мало похожа на привычные нам РНК клеток и вообще не способна к инфицированию. Но она имеет важное значение для жизни хитрого вируса, поскольку несет в себе минус-цепь РНК или, как её еще называют, рибонуклеопротеид (РНП), который послужит матрицей для синтеза вирусной РНК (вРНК) по правилу комплементарности, как только попадет в клетку-хозяина.
РНК вируса бешенства довольно небольшая и содержит всего 5 генов, кодирующих необходимые белки. Чтобы лучше понимать, что необходимо Neuroiyctes rabid для существования, нам вместе с тобой, уважаемый читатель, стоит лучше разобраться в этом вопросе.
Итак, мы знаем, что у цепи РНК есть два конца: 5′ (место присоединения остатка фосфорной кислоты) и 3′ (место присоединения рибозы).
Начиная с 3′ гены вируса бешенства расположены так:
- Ген нуклеокапсидного белка N, окружающего цепь РНК.
- Ген белка NSV — одного из компонентов вирусной транскриптазы, входящего в состав капсида.
- Ген, кодирующий матриксный белок M, выстилающий липидную мембрану с внутренней стороны.
- Ген белка G — внешнего гликопротеида вирусного суперкапсида (оболочки, покрывающей капсид с внешней стороны и содержащей шипы), который отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами (антитела именно к этому гликопротеиду нейтрализуют вирус бешенства).
- Ген белка L — высокомолекулярного компонента вирусной транскриптазы [5] (рис.4).
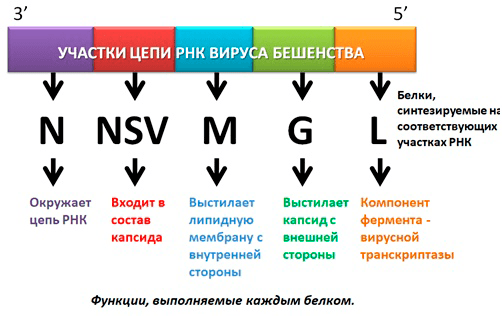
Рисунок 4. Схематичное изображение РНК вируса бешенства, белки, синтезируемые на определенных участках, и их функции
рисунок автора статьи
Когда все необходимые белки синтезируются в клетке-хозяине, то белки G и M будут располагаться с двух сторон от оболочки вируса, а N, NSV и L прилегать к минус-цепи РНК (рис. 5).
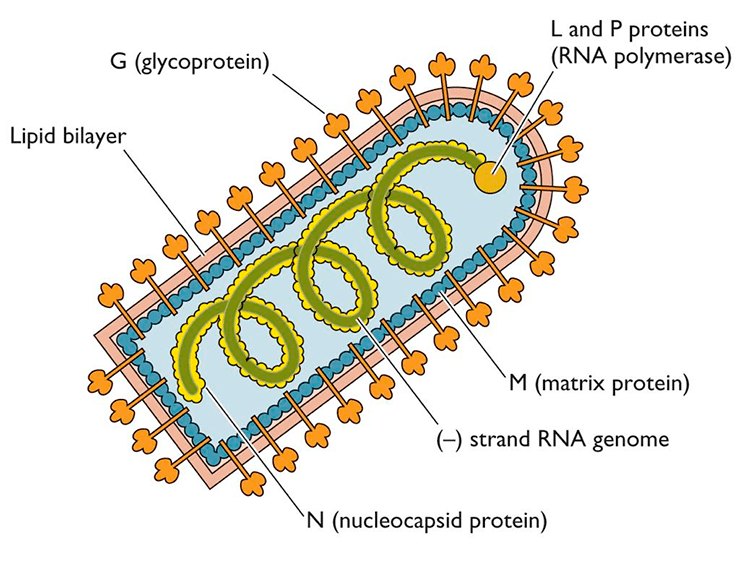
Рисунок 5. Схематичное строение вируса бешенства
На самом деле различают несколько диких и один культивированный штаммы вируса бешенства. Первые циркулируют в природе, имеют длительный инкубационный период, чаще образуют специфические тельца, локализуются в нервных клетках, слюнных железах и роговице глаза. К ним относят [7]:
- вирус классического бешенства — RABV;
- вирус рукокрылых Лагос — LBV;
- вирус Дювенхейдж — DUVV;
- лиссавирусы европейских рукокрылых EBLV-1 и EBLV-2;
- лиссавирус австралийских рукокрылых — ABLV;
- вирус Мокола — MOKV.
Культивированный (фиксированный) вирус впервые выделил Луи Пастер в 1885 году путем длительного заражения лабораторных кроликов дикой формой вируса, которая мутировала и приобрела определенные, выгодные для нас, качества. Например, она опасна только для лабораторных животных, на которых ее выводили, имеет очень короткий инкубационный период, не образует специфических телец и поражает только ЦНС. Организм человека она не убивает, но заставляет иммунную систему вырабатывать антитела, которые могут защитить и от других, более опасных, штаммов вируса бешенства. Стоит ли говорить, что люди с радостью стали использовать взвесь мозга больных животных в качестве вакцины и успешно практиковали такой метод до сравнительно недавнего времени [5].
Чтобы создать подобные себе копии, вирусу бешенства, как и любому другому клеточному паразиту, для начала нужно попасть в организм хозяина и найти интересующую его клетку. Мы уже знаем, что излюбленным местом для его размножения является нервная ткань, в особенности — ЦНС. После попадания с зараженной слюной в ткани, шипастый негодяй проводит в мышечной ткани нового хозяина до нескольких дней, затем адсорбируется на нервные окончания с помощью уже известного гликопротеида G и проникает в нервную клетку путем эндоцитоза (рис. 6).
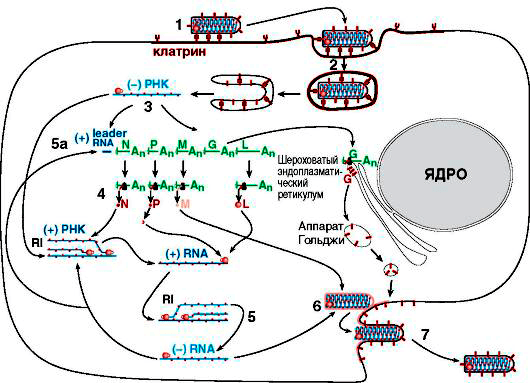
Рисунок 6. Схематичное изображение жизненного цикла вируса бешенства. RNA = РНК.
Дальнейшая скорость протекания жизненного цикла вируса зависит от места попадания в организм: чем дальше от ЦНС, тем дольше вирус будет распространяться по аксонам, ведь скорость его передвижения составляет примерно 3 мм/ч.
Проникнув в клетку, вирус бешенства сливается с мембраной лизосомы, и его внутреннее содержимое высвобождается. Затем в ход идет вирионная транскриптаза, которая обусловливает считывание информации с минус-РНК, и синтез на ней, как на матрице, вРНК. Далее все идет по стандартной схеме биосинтеза белка: к кодонам вРНК по правилу комплементарности пристраиваются антикодоны тРНК, последние перемещаются к рибосомам, где в дальнейшем синтезируются вирусспецифические белки, с которыми мы уже знакомы. вРНК связывается с N, L и NSV в нуклеокапсид, который подходит к назначенному месту, где уже в плазмалемму (клеточную мембрану) клетки-хозяина успешно встроились M и G. Затем генетическая информация и прилежащие белки обволакиваются мембраной, и путем эндоцитоза в области дендритов (отростков нервных клеток) выходят новые вирионы.
Кроме того, вирус бешенства может блокировать биосинтез нормальных белков клетки [5] и повышать экспрессию и выделение цитокинов (клеточных медиаторов) в близлежащих, незараженных клетках, что, вероятно, способствует развитию энцефалита [9].
Когда меры предосторожности не сработали
Я искренне надеюсь, что вам никогда в жизни не понадобится несколько следующих абзацев, но с моей стороны было бы преступно упустить это.
Итак, если вас все же покусал или облизал зверь (рис. 6), лучше не надеяться на лучшее, а экстренно применять необходимые меры. Для начала хорошенько промойте место укуса водой с мылом, а затем прижгите спиртовым раствором йода. Если вы вдруг врач-эпидемиолог, спешащий на работу, или обычный смертный, в руках у которого почему-то есть антирабический иммуноглобулин, то это как раз то время, когда стоит его применить по назначению. Сходить к врачу все равно придется, но шансы на выживание у вас резко возрастут.
Если вы хотите, чтобы больше никто не пострадал (а я уверена, что хотите), то вызовите бравую бригаду СББЖ (станции по борьбе с болезнями животных), они усыпят животное и доставят его в лабораторию целиком или только голову, иногда могут достать головной мозг и законсервировать его 50-процентным глицерином, если поездка обещает быть достаточно долгой. Трупный материал упаковывают в плотный полиэтиленовый мешок, а мозг в банку с пробкой, которую к тому же заливают парафином, а потом все это дополнительно помещают в водонепроницаемую тару, чтобы полностью себя обезопасить.
На СББЖ материал с подозрением на бешенство без очереди и всякого промедления исследуют смелые ветеринары, ведь в данном случае речь может идти о сохранении жизни укушенного человека. Работая с, вероятно, зараженным мозгом, надевают две пары перчаток, защитные очки на глаза и шесть марлевых повязок, прикрывающих нос и рот, все манипуляции проводят в стерильных условиях [10]. Представляете, как все серьезно?
Скорость течения болезни может сильно варьировать: инкубационный период длится от 10 до 90 дней и более, но обычно около месяца. Быстрее всего он проходит при попадании вируса в области лица и головы, причем для этого не обязательно, чтобы вас за щечки покусала собака с пеной у рта, ведь проникновение вируса в организм возможно не только через повреждение кожных покровов, но и через слизистые оболочки.
Как только вирус попал в рану или на слизистую, он не спешит оттуда уходить и только через 1–4 дня проникает в нервную ткань. Конечно, ему не терпится скорее попасть в ЦНС и вызвать смертельный энцефалит, но ведь тело хозяина имеет еще парочку пригодных мест, интересующих вирус бешенства, а именно: слюнные железы и роговица глаза. Проникновение в первые из перечисленных имеет принципиальное значение для передачи вируса новым хозяевам.
В развитии заболевания выделяют три стадии: начальную (она идет сразу после инкубационного периода), возбуждения и параличей [11], [12]. В любом случае, не советую вам ждать ни одну из них. Когда появятся симптомы, будет уже слишком поздно, ведь излечение возможно только во время инкубационного периода. Впрочем, существует гипотеза, согласно которой бешенство можно вылечить путем ингибирования пептидов вируса непосредственно в зараженном организме [13], так что, вероятно, через несколько лет данная проблема будет решена, но пока что будем читать и бояться.
1. Начальная стадия.
Появляются беспокойство и страх, тошнота, головокружение, зуд и покраснение в области укуса. Длится от 1 до 3 дней.
2. Стадия возбуждения.
Возбуждение, судороги гортани и глотки, водобоязнь, агрессивность, галлюцинации. Именно в этот период появляются наиболее привычные симптомы бешенства. Из-за невозможности глотать слюну, она взбивается в пену и валит изо рта. Есть даже предположение, что водобоязнь провоцирует животное разбрасывать слюну, так как даже вид жидкости вызывает болезненные спазмы глотки. Домашние животные, которые обычно не отходят от дома дальше, чем на один километр, беспокойно бегают, превращаются в бродяг и стремятся напасть на все, что движется (или даже не движется), что, конечно, способствует распространению заболевания. Дикие животные теряют страх перед человеческими поселениями и выходят из леса, чаще всего, кусая домашних животных, реже — человека. Иногда может наблюдаться, наоборот, излишняя ласковость зараженных животных, их стремление поскорее облизать вас, что на самом деле еще более опасно, так как вызывает меньше подозрений.
3. Стадия параличей.
Через 5–7 дней после начала появления симптомов смерть наступает от паралича дыхательной или сердечной мускулатуры, так как нервная система перестает посылать им сигналы о необходимых сокращениях.
Современные же вакцины имеют ряд неоспоримых преимуществ [14]:
- Их выращивают не в живых существах, а в культурах клеток эмбрионов птиц, что делает процесс создания вакцины более контролируемым и гуманным.
- Они более безопасны, так как почти не вызывают побочных эффектов.
- Они экономичнее. Объем для успешной вакцинации нужен меньший, а хранить такие вакцины можно дольше.
Сплошные плюсы! Более того, в настоящее время используют препарат, состоящий не из цельных вирусных частиц, а из гликопротеина вируса бешенства (того самого G), который обладает высокой иммуногенностью. В этом случае количество необходимых инъекций снижается до шести, а в некоторых случаях даже до трех. Активный иммунитет к бешенству достигается последовательностью инъекций ослабленного вируса и может не снижаться от одного года до трех лет [3].
Если вирус попал в область головы и шеи, то, как я уже говорила, он развивается очень быстро, поэтому людям вводят готовый специфический иммуноглобулин, который создает пассивный иммунитет, что несколько продлевает инкубационный период и несколько отдаляет момент гибели зараженного. Антирабический иммуноглобулин получают из 10-процентной сыворотки крови зараженных бешенством лошадей [15].
Просто о сложном. Лабораторная диагностика
В лаборатории СББЖ проводится четырехступенчатый анализ материалов, которые были добыты от того животного, которое на вас напало. Принято придерживаться данной последовательности методов лабораторной диагностики:
1. Гистологический метод для обнаружения телец Бабеша—Негри.
В зараженных клетках можно обнаружить специфические включения, так называемые тельца Бабеша—Негри, которые могут быть размером до 25 мкм, а значит, они хорошо видны в световой микроскоп. Их точная функция до сих пор не ясна.
Из головного мозга животного с левой и правой сторон берут материал на гистологические срезы или мазки. Вирус бешенства локализуется в определенных частях головного мозга, таких как Аммонов рог (гиппокамп), мозжечок, кора полушарий и продолговатый мозг (рис. 7). Суммарно получается восемь гистопрепаратов. Мазки или срезы подвергаются окраске по Селлерсу (тельца получаются розово-красного цвета (рис. 8)) или Муромцеву (окраска телец фиолетовая с темно-синими включениями (рис. 9)).
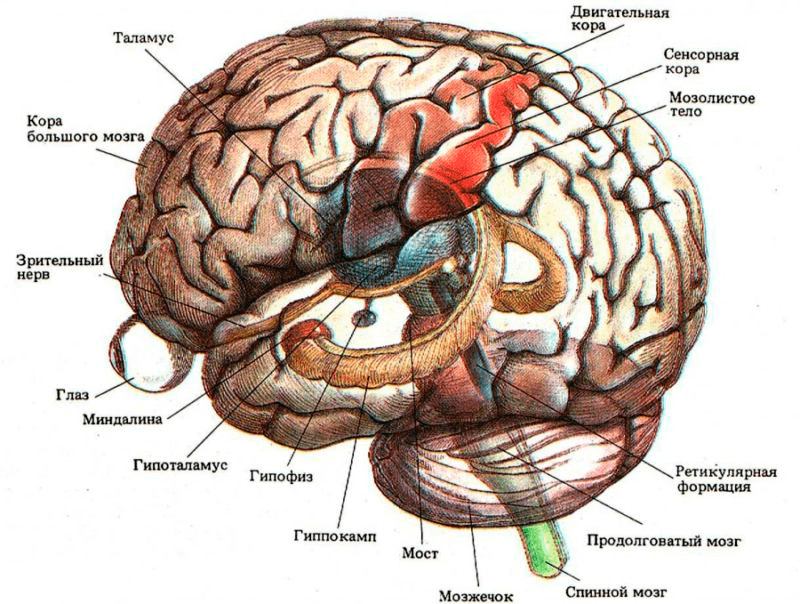
Рисунок 7. Места локализации телец Бабеша—Негри в головном мозге: гиппокамп, продолговатый мозг, мозжечок, кора полушарий
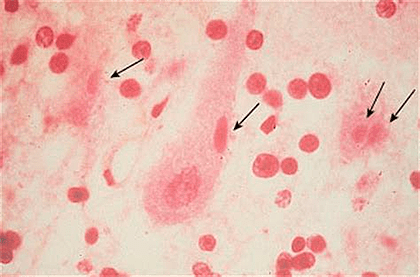
Рисунок 8. Тельца Бабеша—Негри насыщенного розового цвета, окраска по Селлерсу
Читайте также:


