Вакцины вирусные и бактериальные
Вакцины – это препараты для создания активного искусственно приобретенного иммунитета. Вакцины применяют для профилактики, реже – для лечения заболеваний.
Действующее начало вакцин – специфический антиген.
1. Живые вакцины:
2. Неживые вакцины:
а) цельноклеточные и цельновирионные;
б) субклеточные и субвирионные;
в) синтетические, полусинтетические.
3. Ассоциированные вакцины.
Характеристика живых вакцин
Живые аттенуированные вакцины – препараты из ослабленных микробов, потерявших вирулентность, но сохранивших иммуногенность. Ослабленные микробы – это вакцинные штаммы.
Способы получения вакцинных штаммов:
а) метод отбора мутантов с ослабленной вирулентностью;
б) метод направленного (искусственного) снижения вирулентности (выращивание на неблагоприятных питательных средах, длительное пассирование (последовательное заражение) через организм маловоспримчивых лабораторных животных);
в) метод генной инженерии (инактивация гена, который отвечает за образование факторов вирулентности патогенных микробов).
Вакцинные штаммы микробов сохраняют способность размножаться в месте введения и распространяться по организму. В результате этого возникает вакцинная инфекция (заболевание протекает в легкой форме). Вакцинная инфекция всегда приводит к формированию иммунитета к патогенным микробам данного вида, к которым относится вакцинный штамм.
Дивергентные вакцины – препараты из живых микробов, не болезнетворных для человека, но сходных по антигенным свойствам с болезнетворными микробами. Например, для прививки против оспы человека используют вирус оспы коров.
Векторные рекомбинантные вакцины получают методом генной инженерии. Для этого в геном вакцинного штамма встраивают ген (вектор), контролирующий образование антигенов другого возбудителя (чужеродного антигена). Например, в штамм вируса оспенной вакцины встраивают антиген вируса гепатита В(HBs – антиген). Такая векторная вакцина создает иммунитет и против оспы и против гепатита В.
Получение живых вакцин:
1) выращивают вакцинный штамм в асептических условиях на оптимальной питательной среде;
2) биомассу микробов концентрируют, стандартизуют (определяют титр – количество микробов в 1мл), добавляют стабилизатор (сахарозожелатиновый агар, человеческий альбумин), который защищает антигены от разрушения, лиофильно высушивают, фасуют в стерильные ампулы или флаконы.
После получения вакцины проходят государственный контроль – проверяется реактогенность, безвредность и иммуногенность.
Преимущества живых вакцин:
1) создание прочного (напряженного) и длительного иммунитета (5-7 лет);
2) прививки делают однократно более простыми способами (перорально, интраназально, накожно, подкожно);
3) менее реактогенны, т.к. не содержат консервантов и адъювантов.
Недостатки живых вакцин:
1) трудоемкость получения вакцинных штаммов;
2) малый срок хранения (1 – 2 года);
3) хранение и транспортировка при пониженной температуре (+4°С - +8°С).
Для обеспечения безопасности живых вакцин необходимо проводить постоянный контроль реверсии вирулентности возбудителя, строго соблюдать требования, обеспечивающие сохранность и активность вакцинных микробов.
Примеры живых вакцин:
1) бактериальные вакцины – туберкулезная (БЦЖ), чумная, туляремийная, сибиреязвенная, бруцеллезная, против Ку-лихорадки;
2) вирусные вакцины – полиомиелитная, коревая, гриппозная, паротитная, против желтой лихорадки.
Корпускулярные вакцины – препараты из инактивированных культур патогенных (высоко вирулентных) или вакцинных штаммов бактерий и вирусов.
Способы инактивирования:
2) химические – формалин, спирт, ацетон, b-пропиолактон.
Корпускулярные вакцины из целых бактерий называют цельноклеточными, а из целых (неразрушенных) вирусов – цельновирионными.
Получение корпускулярных вакцин:
1) выращивают в асептических условиях чистую культуру микробов;
2) проводят инактивацию в оптимальном режиме (нужно лишить микроорганизмы жизнеспособности, но сохранить их иммуногенность), например, гретые вакцины инактивируют путем прогревания взвеси микробов при 56°С;
3) стандартизуют (по концентрации микробов), добавляют консервант (мертиолат, формальдегид, 2-феноксиэтанол и др.), который подавляет постороннюю микрофлору при хранении, фасуют;
Вакцины могут быть жидкие (суспензии) или сухие. Готовые вакцины подвергают контролю на стерильность, безвредность, иммуногенность, проверяют густоту вакцины или титр (количество микробов в 1 мл).
Преимущества цельноклеточных и цельновирионных вакцин:
1) простота получения;
2) большая устойчивость при хранении и более длительный срок хранения.
Недостатки цельноклеточных и цельновирионных вакцин:
1) менее прочный и продолжительный иммунитет;
2) необходимость 2-х и 3-х-кратных прививок парентеральным путем (подкожно, внутримышечно), иногда перорально;
3) реактогенность – боль, чувство жжения на месте введения, повышение температуры, судорожный синдром и т.д.
Примеры вакцин: против гриппа, коклюша, холеры, гепатита А, герпеса, вирусного энцефалита и др. Они используются для профилактики соответствующих заболеваний. Некоторые вакцины используют для лечения (вакцинотерапии) хронических инфекционных заболеваний – бруцеллеза, хронической дизентерии, хронической гонореи, хронических стафилококковых инфекций. Для лечебных целей используют и аутовакцины – препараты из убитых бактерий, выделенных из организма больного.
Корпускулярные вакцины из разрушенных бактерий и вирусов называются субклеточными и субвирионными. Такие вакцины содержат антигенные комплексы, выделенные из бактерий и вирусов после их разрушения.
Раньше эти вакцины назывались химическими. Однако этот термин более применим к вакцинам, полученным методам химического синтеза.
Получение субклеточных и субвирионных вакцин более сложное, чем цельноклеточных и цельновирионных (например, ферментативное переваривание с последующим осаждением антигенов этиловым спиртом), но они содержат меньше баластных веществ.
Преимущества субклеточных и субвирионных вакцин:
1) содержат только иммунологически активные части клеток – антигены без других компонентов;
2) менее реактогены;
3) более стабильны и лучше подвергаются стандартизации и более точной дозировке;
4) можно вводить в больших дозах и в виде ассоциированных препаратов.
Недостатки:
1) слабая иммуногенность;
2) малые размеры, что приводит к быстрому выведению и к краткому антигенному раздражению.
Для устранения недостатков к таким вакцинам добавляют адъванты. Адъванты усиливают иммуногеность вакцин. Они укрупняют антигенные частицы, создают в месте введения "депо", из которого антигены медленно высвобождаются, что удлиняет время их воздействия на иммунную систему. В качестве адъювантов используют минеральные коллоиды (фосфат алюминия, фосфат кальция, гидрат окиси алюминия, алюмо-калиевые квасцы), полимерные вещества (липополисахариды, синтетические полимеры), растительные вещества (сапонины) и др. Вакцины с адъювантами называются адъювантными, сорбированными, адсорбированными или депонированными вакцинами.
Примеры субклеточных и субвирионных вакцин: против брюшного тифа на основе О-, Н- и Vi –антигенов, против гриппа на основе антигенов вируса (нейраминидаза и гемагглтинин), против сибирской язвы на основе капсульного антигена, проив дизентерии, менингита, холеры.
Молекулярные вакцины – это специфические антигены в молекулярной форме.
Они могут быть получены путем биосинтеза, химического синтеза и генной инженерии.
Метод биосинтеза заключается в том, что из микроба или из культуральной жидкости выделяют протективный антиген в молекулярной форме. Например, возбудители дифтерии, ботулизма, столбняка при росте синтезируют и выделяют в культуральную жидкость молекулы экзотоксинов. После обработки формалином экзотоксины теряют свои токсические свойства, но сохраняют иммуногенность.Таким образом, к типичным молекулярным вакцинам, которые получают путем биосинтеза, относятся анатоксины.
Получение анатоксинов:
1) выращивают возбудителей, которые образуют экзотоксины (возбудители столбняка, ботулизма, дифтерии, газовой гангрены), глубинным способом в жидкой питательной среде, в результате этого в культуральной жидкости накапливается экзотоксин;
2) отделяют микробные клетки от культуральной жидкости путем фильтрации через бактериальные фильтры;
3) добавляют к культуральной жидкости, в которой находится экзотоксин, 0,4% формалин и выдерживают при 37°С в течение 3 – 4 недель;
4) анатоксин очищают, концентрируют, стандартизуют – определяют активность анатоксина, добавляют консервант и адъювант и фасуют. Такие анатоксины называют очищенными сорбированными.
Активность анатоксина выражают в антигенных единицах : единицах связывания (ЕС) или единицах флоккуляции (ЛФ).
1 ЛФ – это то количество анатоксина, которое с 1 МЕ антитоксической сыворотки дает начальную реакцию флокулляции.
Титр анатоксина – это содержание ЛФ в 1 мл вакцины.
Применяют анатоксины подкожно, внутримышечно, 2 или 3-екратно с последующими ревакцинациями. Анатоксины вырабатывают антитоксический иммунитет.
Примеры молекулярных вакцин: противостолбнячный анатоксин, противоботулинический анатоксин, противогангренозный анатоксин.
Получение молекулярных вакцин методом химического (искусственного) синтеза – новое направление. Некоторые низкомолекулярные антигены получены методом химического синтеза. Кроме того, получают синтетические высокомолекулярные носители и соединяют их с естественными антигенами. Например, гриппозная вакцина состоит из антигенов вируса гриппа и полиоксидония, который обладает выраженными адъювантными свойствами.
Молекулярные вакцины получают также методом генной инженерии. Так получена вакцина против гепатита В, антигены которого синтезируются клетками дрожжей.
Ассоциированные вакцины состоят из вакцин разного типа и вырабатывают иммунитет к нескольким заболеваниям. Они еще называются комплексными или поливалентными.
Они могут включать однородные антигены (например, анатоксины) и антигены различной природы (например, корпускулярные и молекулярные антигены, убитых и живых микробов). Антигены в вакцинах содержатся в дозировках, не создающих взаимной конкуренции, чтобы иммунитет вырабатывался ко всем антигенам.
Примеры ассоциированных вакцин: АКДС (ассоциированная коклюшно-дифтерийно-столбнячная вакцина) из столбнячного и дифтерийного анатоксина и коклюшной корпускулярной вакцины; живая ассоциированная полиомиелитная вакцина из штаммов вируса полиомиелита I, II,III типов; гриппозная вакцина из трех штаммов вируса гриппа; менингококковая вакцина из антигенов 4-х серотипов менингококка; живая комплексная вакцина против кори, паротита и краснухи.
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы — возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
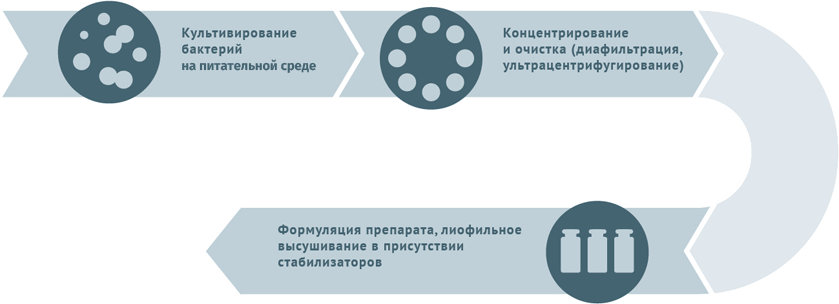
Схема подходит для вакцины БЦЖ, БЦЖ-М.
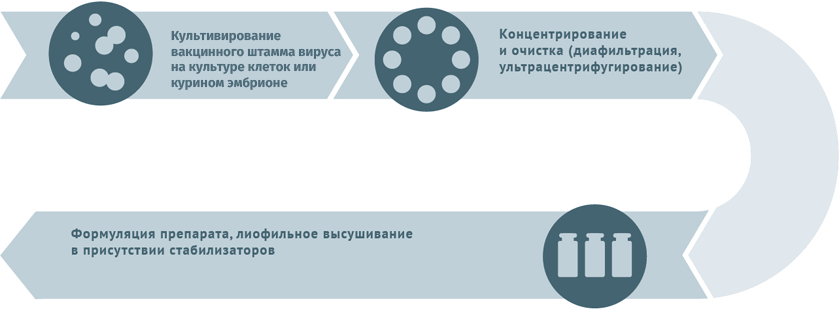
Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
- куриные эмбрионы;
- перепелиные эмбриональные фибробласты;
- первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков);
- перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293).
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
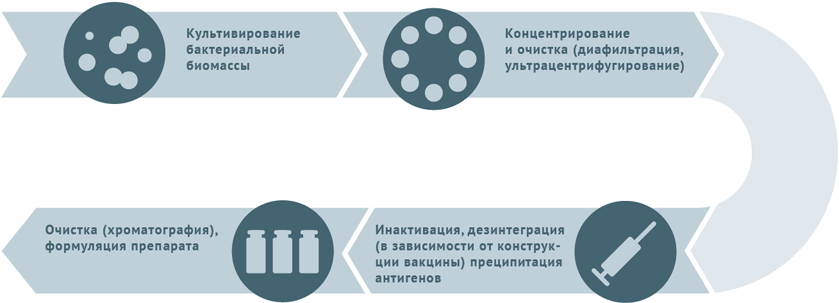
- Культивация и очистка штаммов бактерий.
- Инактивация биомассы.
- Для расщепленных вакцин клетки микробов дезинтегрируют и осаждают антигены с последующим их хроматографическим выделением.
- Для конъюгированных вакцин полученные при предыдущей обработке антигены (как правило, полисахаридные) сближают с белком-носителем (конъюгация).
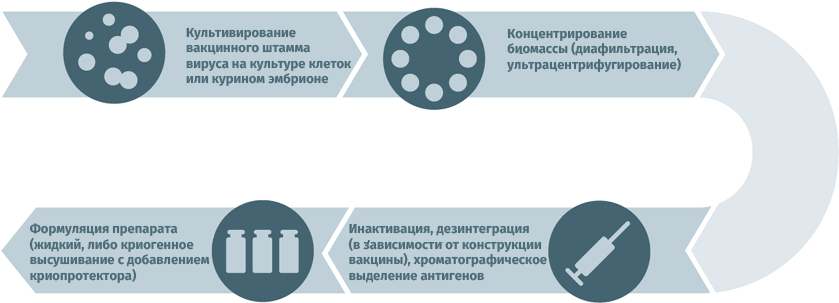
- Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться куриные эмбрионы, перепелиные эмбриональные фибробласты, первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков), перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293). Первичная очистка для удаления клеточного дебриса проводится методами ультрацентрифугирования и диафильтрации.
- Для инактивации используются ультрафиолет, формалин, бета-пропиолактон.
- В случае приготовления расщепленных или субъединичных вакцин полупродукт подвергают действию детергента с целью разрушить вирусные частицы, а затем выделяют специфические антигены тонкой хроматографией.
- Человеческий сывороточный альбумин применяется для стабилизации полученного вещества.
- Криопротекторы (в лиофилизатах): сахароза, поливинилпирролидон, желатин.
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
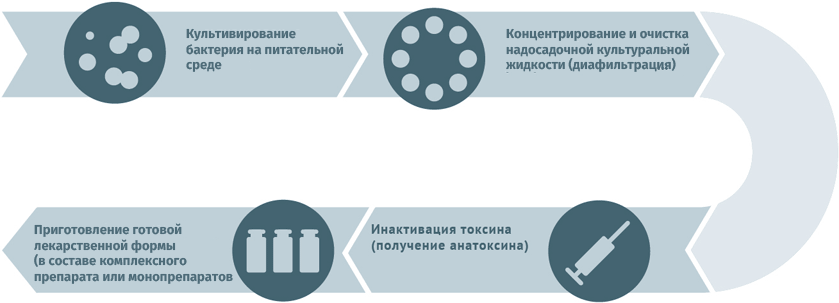
Для дезактивации вредного воздействия токсинов используют методы:
- химический (обработка спиртом, ацетоном или формальдегидом);
- физический (подогрев).
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вакцина "Менюгейт" зарегистрирована в России? С какого возраста разрешена к применению?
Отвечает Харит Сусанна Михайловна
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Вы абсолютно правы, если в контейнере был лед. Но если там была смесь воды и льда- вакцина не должна замерзать. Однако живые вакцины, к которым относится ротавирусная, не увеличивают реактогенность при температуре менее 0, в отличие от неживых, а, например, для живой полиомиелитной допускается замораживание до -20 град С.
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
В нашей стране уже очень долгая история использования многих вакцин – ведутся ли долгосрочные исследования их безопасности и можно ли ознакомиться с результатами воздействия вакцин на поколения людей?
Отвечает Шамшева Ольга Васильевна
За прошлый век продолжительность жизни людей возросла на 30 лет, из них 25 дополнительных лет жизни люди получили за счет вакцинации. Больше людей выживают, они живут дольше и качественнее за счет того, что снизилось инвалидность из-за инфекционных заболеваний. Это общий ответ на то, как влияют вакцины на поколения людей.
На сайте Всемирной Организации Здравоохранения (ВОЗ) есть обширный фактический материал о благотворном влиянии вакцинации на здоровье отдельных людей и человечества в целом. Отмечу, что вакцинация –это не система верований, это - область деятельности, опирающаяся на систему научных фактов и данных.
На основании чего мы можем судить о безопасности вакцинации? Во-первых, ведется учет и регистрация побочных действий и нежелательных явлений и выяснение их причинно-следственной связи с применением вакцин (фармаконадзор). Во-вторых, важную роль в отслеживании нежелательных реакций играют постмаркетинговые исследования (возможного отсроченного неблагоприятного действия вакцин на организм), которые проводят компании — владельцы регистрационных свидетельств. И, наконец, проводится оценка эпидемиологической, клинической и социально-экономической эффективности вакцинации в ходе эпидемиологических исследований.

В условиях пандемии многие государства приступили к созданию лекарств и вакцин от нового коронавируса. Сообщается, что в России разработка прошла первую фазу — так ли это? Значит ли, что скоро можно ждать появления препарата? Чтобы разработать новое лекарство от неизвестного заболевания по всем правилам научного поиска нужно от 5 до 15 лет. Разобрали весь процесс на примере COVID-19 вместе с Равилем Ниязовым, специалистом по регуляторным вопросам и разработке лекарств Центра научного консультирования.
COVID-19 — инфекционное заболевание, вызываемое коронавирусом SARS-CoV-2. В тяжелых формах оно поражает легкие, иногда — сердце и другие органы. Особенно тяжело заболевание протекает, если у больного есть другие нарушения со стороны дыхательной или сердечно-сосудистой систем. Молниеносно возникшая пандемия COVID-19 поставила вопрос разработки лекарств и вакцин от новой инфекции. Это долгий процесс с множеством стадий, на каждой из которых исключают вещества-кандидатов. Только одно или небольшая группа таких веществ в итоге сможет стать безопасным и эффективным лекарством.
Шаг 1: понять, как развивается новое заболевание
Любая болезнь нарушает естественные физиологические и биохимические процессы в организме. Причины заболеваний могут быть разными, в том числе — инфекционными. Инфекционный агент (в случае COVID-19 это коронавирус SARS-CoV-2) заимствует и эксплуатирует биохимический аппарат клеток, перехватывая управление им, в результате чего клетки перестают выполнять свою физиологическую функцию. Для вируса SARS-CoV-2 основной мишенью являются клетки дыхательного эпителия, отвечающие за газообмен, то есть за дыхание.
Лекарством для лечения COVID-19 будет считаться любое вещество или комбинация веществ, которое будет способно (1) инактивировать вирус еще до того, как он успеет поразить клетку, или (2) нарушать жизненный цикл вируса внутри зараженной клетки, или (3) защищать новые непораженные здоровые клетки от инфицирования.
Чтобы создать лекарство от SARS-CoV-2, нужно хорошо знать, каков жизненный цикл вируса в организме человека:
- с какими клетками человека и через какие рецепторы на поверхности клеток он связывается, какой собственный вирусный аппарат для этого он использует;
- как вирус проникает в клетку;
- как вирус эксплуатирует биохимический аппарат клетки, чтобы воспроизводить собственный генетический материал и белки, нужные для сборки новых вирусных частиц;
- как вирус покидает инфицированную клетку, чтобы инфицировать новые клетки;
- как формируется иммунитет против вируса и какой вклад иммунитет вносит в тяжесть заболевания (чрезмерная иммунная реакция может вызывать тяжелое поражение внутренних органов).

Всё перечисленное — это совокупность фундаментальных знаний, необходимых для перехода к следующему этапу разработки лекарства — синтезу или биосинтезу веществ, которые могут нарушать свойства вирусных частиц, убивая вирус и при этом не вредя человеку. Например, так работают лекарства от ВИЧ-инфекции или гепатита C. Но при этих заболеваниях важно применять сразу несколько веществ из разных классов, чтобы вирус не становился устойчивым к терапии. Об этом нужно будет помнить и при разработке лекарств против SARS-CoV-2.
Для лечения вирусных заболеваний также могут использоваться иммуносыворотки, содержащие антитела, способные инактивировать вирус. Такие сыворотки можно получать от животных, например, лошадей или кроликов, но также и от человека, уже переболевшего заболеванием.
Однако самый эффективный подход — профилактика заболевания. Для этого используют вакцины — естественные или генетически модифицированные белки вируса, а иногда и живой, но ослабленный вирус. Вакцина имитирует инфекционное заболевание и стимулирует организм к формированию иммунитета. В последнее время также разрабатываются РНК- и ДНК-вакцины, но пока одобренных препаратов нет.
В отличие от традиционных вакцин, РНК-/ДНК-вакцины содержат не вирусные белки, а гены, кодирующие основные вирусные белки. Введение такой вакцины приводит к синтезу клетками белков вируса, на которые должна реагировать иммунная система и вырабатывать иммунитет против этих белков вируса. Гипотетически это должно препятствовать началу инфекционного процесса при заражении настоящим патогенным вирусом. Важно отметить, такие РНК- и ДНК-вакцины не должны кодировать те белки вируса, которые способны были бы привести к настоящей вирусной инфекции.
Шаг 2: поиск хитов
На ранней стадии разработки синтезируют и тестируют множество веществ — библиотеку. Основная цель этого этапа — найти группу хитов (hit — попадание в цель), которые бы связывались с нужной вирусной мишенью. Обычно это один из белков вируса. Иногда отбор идет из библиотек, состоящих из миллиардов низкомолекулярных веществ. Сейчас активно используют компьютерные алгоритмы — машинное и глубокое обучение — чтобы искать новые потенциально активные молекулы. Одна из компаний, успешно работающая в этом направлении, — InSilico Medicine, создана российскими математиками.
Другой источник потенциальных лекарств — выздоровевшие люди: в их крови содержатся антитела, часть из которых способны связываться с вирусом и, возможно, нейтрализовать его.
Шаг 3: поиск и тестирование лидов
Когда находят группу хитов, способную связываться с вирусным белком, переходят к следующему этапу скрининга. На этом шаге исключаются вещества, которые:
- нестабильны и быстро разлагаются;
- тяжелы/затратны в синтезе;
- токсичны для различных клеток человека в условиях лабораторных экспериментов на культуре клеток. Вещества не должны быть токсичны сами, токсичностью также не должны обладать продукты их метаболизма в организме, продукты их разложения и примеси, возникающие в процессе производства; вместе с тем если процесс производства способен с помощью очистки удалять продукты разложения или примеси, то такой хит может и не будет выведен из разработки;
- плохо растворимы в воде — лекарство должно в достаточном количестве растворяться в биологических жидкостях, чтобы распределиться по организму;
- быстро разлагаются в живом организме;
- плохо проникают через слизистые оболочки, клеточные мембраны или внутрь клетки, в зависимости от пути введения лекарства и расположения вирусной мишени.
Хиты, которые выдерживают эти испытания и проходят все фильтры, переводят в категорию лидов (lead — ведущий).
Лиды тестируют в еще более широкой серии экспериментов для принятия так называемых решений Go/No-Go о продолжении или остановке разработки. На этой стадии инициируются испытания на животных. Такая схема отбора нужна чтобы как можно раньше вывести из разработки бесперспективные молекулы, потратив на них минимальные время и ресурсы, поскольку каждый последующий этап является еще более затратным.
Те несколько лидов, которые успешно проходят очередные испытания, становятся кандидатами. К этому моменту разработка может длиться уже от трех до семи лет.
Шаг 4: испытания кандидатов и клинические исследования

Прежде чем перейти к испытаниям на людях, нужно выполнить исследования на животных и подтвердить отсутствие неприемлемой для человека токсичности, подобрать первоначальную безопасную дозу. На этом этапе кандидаты тоже могут отсеиваться — например, из-за генотоксичности (токсичности для генетического аппарата клетки) или канцерогенности (способности вызывать рак). Еще они могут оказаться небезопасными для беременных женщин или женщин детородного возраста, вызывать поражение головного мозга, печени, почек, сердца или легких. В зависимости от природы молекулы исследования проводят на грызунах, собаках, обезьянах, минипигах, кроликах и т.д.
В зависимости от природы заболевания, особенностей его терапии и свойств лекарства, какие-то исследования могут не проводиться или быть не значимы. Например, оценка канцерогенности лекарства не потребуется, если оно будет применяться в лечении краткосрочных заболеваний, как в случае COVID-19. Генотоксичность не оценивают для биопрепаратов или если лекарство предназначено для лечения метастатического рака и т. д. Суммарно доклинические исследования могут занимать 3–5 лет. Часть из них проводится параллельно с клиническими исследованиями.
Если доклинические исследования успешны, начинается клиническая разработка, которая условно делится на фазы. Это нужно, чтобы постепенно и контролируемо тестировать лекарство на все большем количестве людей. И снова стадийность процесса позволяет прекратить разработку на любом этапе, не подвергая риску многих людей.
- Первая фаза: здесь подтверждают первичную безопасность для людей в принципе, изучают поведение лекарства в организме человека, его биодоступность (способность достигать места действия в достаточных концентрациях), его взаимодействие с другими лекарствами, влияние пищи, половых и возрастных различий на свойства лекарства, а также безопасность для людей с сопутствующими заболеваниями (особенно важны заболевания печени и почек — эти органы отвечают за метаболизм и выведение лекарств), проверяют, не вызывает ли лекарство нарушение ритма сердца. Кроме того, на I фазе оценивают безопасный диапазон доз: эффективные дозы не должны быть неприемлемо токсичными.
- Вторая фаза: здесь начинают проверять эффективность лекарства на пациентах с заболеванием. На ранней II фазе оценивают, работает ли кандидатная молекула на людях с изучаемым заболеванием в принципе, а на поздней II фазе подбирают режим дозирования, если кандидатное лекарство было эффективным. При этом вещество, эффективное в лабораторных экспериментах, на животных моделях заболевания и даже в ранних клинических исследованиях на людях, вполне может не быть таким же рабочим в реальной медицинской практике. Поэтому и нужен длительный процесс поэтапной исключающей разработки, чтобы на выходе получить эффективное и безопасное лекарство.
- Третья фаза: здесь подтверждают эффективность и безопасность лекарства, а также доказывают, что его польза компенсирует те нежелательные реакции, которые неминуемо будет вызывать лекарство. Иными словами, в исследованиях третьей фазы надо понять, что баланс пользы и рисков положителен. Это всегда индивидуально. Например, у людей с ВИЧ в целом допустимо, если противовирусные лекарства вызывают некоторые нежелательные реакции, а в случае онкологических заболеваний приемлемы и более выраженные токсические реакции.
В случае вакцин, которые рассчитаны на здоровых людей, и особенно детей, приемлемы лишь легкие нежелательные реакции. Поэтому найти баланс трудно: вакцина должна быть высоко эффективной, и при этом вызывать минимальное число тяжелых реакций, например реже, чем 1 случай на 1000, 10 000 или даже 100 000 вакцинированных людей. Клиническая разработка может длиться до 5–7 лет, однако низкомолекулярные противовирусные лекарства для краткосрочного применения, как в случае COVID-19, можно протестировать быстрее — за 1–2 года.
Разработка многих отечественных противовирусных и иммуномодулирующих препаратов не соответствует такому научно выверенному процессу разработки.
Шаг 5: производство
Важный этап — наладить производство лекарства. Разработка процессов синтеза начинается в самом начале отбора лидов и постепенно дорабатывается, оптимизируется и доводится до промышленного масштаба.
В настоящее время против SARS-CoV-2 разрабатывается много разных методов лечения:
- низкомолекулярные соединения, которые нарушают жизненный цикл вируса. Трудность в том, что может быть нужно применять сразу несколько противовирусных лекарств. Сейчас надежды возлагают на ремдесивир. Есть данные, что может быть эффективен давно известный гидроксихлорохин, действующий не на сам вирус, а влияющий на иммунитет. Информацию, что комбинация лопинавира и ритонавира оказалась неэффективной у тяжелобольных пациентов, стоит интерпретировать с осторожностью: она может быть эффективна при более легких формах, или для профилактики, или у каких-то определенных подгрупп;
- противовирусные, в том числе моноклональные, антитела, которые связываются с ним на поверхности и блокируют его проникновение в клетку, а также помечают вирус для клеток иммунной системы. Антитела можно получать как биотехнологически, так и выделять из крови переболевших людей. Сейчас тестируются препараты, получаемые с помощью обоих методов;
- вакцины. Они могут представлять собой естественные или модифицированные белки вируса (модификации вводят для усиления выработки иммунитета), живой ослабленный вирус, вирусоподобные наночастицы, синтетический генетический материал вируса (РНК-вакцины) для того, чтобы сам организм человека синтезировал некоторые белки вируса и смог выработать антитела к нему. Одна из проблем в случае вакцин — простое введение белков вируса, пусть и модифицированных, не всегда позволяет сформировать иммунитет, способный защитить от реального заболевания — так называемый стерильный иммунитет. Даже образование антител в ответ на введение вакцины не гарантирует защиты: хорошим примером являются те же ВИЧ и гепатит C, хотя вакцина против гепатита B достаточно проста и при этом высокоэффективна. Хочется надеяться, что отечественные разработчики следуют рекомендациям Всемирной организации здравоохранения по проведению доклинических и клинических исследований вакцин, включая исследования провокации и изучение адъювантов;
- препараты для РНК-интерференции. Так называемые малые интерферирующие рибонуклеиновые кислоты (РНК) — это небольшие отрезки синтетически получаемой РНК, которые способны связываться с генетическим аппаратом вируса и блокировать его считывание, мешая синтезу вирусных белков или воспроизведению генетического материала вируса.
Процесс разработки лекарства — это научный поиск с неизвестным исходом. Он занимает много времени и требует участия большой команды профессионалов разных специальностей. Однако только реальный клинический опыт позволит оценить, удалось ли получить не только эффективное, но и безопасное лекарство, поэтому любое точное определение сроков получения лекарства — спекуляция. Получить эффективную и безопасную вакцину к концу года, если следовать всем правилам научного поиска, вряд ли удастся.
Детальные обсуждения процессов разработки новых лекарств и возникающих в связи с этим проблем — на YouTube-канале PhED.
Читайте также:


