Вирус эпштейна барра при лейкозе
Вирус Эпштейна – Барр. Лимфобластный лейкоз
Здравствуйте, уважаемая Ольга Ивановна!
Я читала многие ваши книги. Мой сын заболел гриппом в марте 1999 года. После гриппа на левой ноге около паха образовалась шишка. Я обратилась к педиатру, он назначил прогревание, после чего у ребенка поднялась температура до 37,5 °C. Я сразу повела его на прием к хирургу. Ребенка положили в районную больницу и начали лечить мазью Вишневского и УВЧ. Через неделю выписали, не сообщив нам даже, каков был анализ крови. Через неделю ребенок опять начал жаловаться на ногу и стал худеть. Я обратилась, уже платно, к другим врачам. Они сделали анализ крови и отправили для уточнения диагноза в детскую больницу. Диагноз: острый лимфобластный лейкоз. Справка прилагается. Ребенок прошел 2 раза химиотерапию и одно облучение. Заразили гепатитом В. После лечения выступили родинки в области шеи, руки, ноги. В данный момент ребенок находится дома. Наблюдается в диспансере ДГБ.
Скорее всего, в 1999 году инфекцию вируса Эпштейна – Барр приняли за ОРЗ-грипп.
Инфекционный мононуклеоз (болезнь Филатова, железистая лихорадка, моноцитарная аигина, болезнь Пфейфера и др.) – болезнь, обусловленная вирусом Эпштейна – Барр, характеризуется лихорадкой, генерализованной лимфаденопатией, тонзиллитом, увеличением печени и селезенки, характерными изменениями крови, в ряде случаев может принимать хроническое течение.
Вирус Эпштейна – Барр обладает способностью избирательно поражать лимфоидную и ретикулярную ткани, что выражается в генерализованной лимфаденопатии, увеличении печени и селезенки.
Лимфаденопатия наблюдается почти у всех больных. Чаще поражаются углочелюстные и заднешейные лимфатические узлы, реже – подмышечные, паховые. Поражаются не только периферические лимфатические узлы. У 25 % больных отмечается поражение кожи. Сроки появления и характер сыпи варьируются в широких пределах. Чаще она появляется на 3—5-й день болезни, может иметь макулопапулезный (кореподобный) характер, мелкопятнистый, розеолезный, папулезный, петехиальный. Элементы сыпи держатся 1–3 дня и бесследно исчезают. Новых высыпаний обычно не бывает. Печень и селезенка увеличены (гепатоспленомегалия) у большинства больных. Гепатоспленомегалия появляется с 3—5-го дня болезни и держится до 3–4 недель и более.
Распознавание основывается на ведущих клинических симптомах (лихорадка, лимфаденопатия, увеличение печени и селезенки, изменения периферической крови). Большое значение имеют исследования формулы крови. Характерны увеличение числа лимфоцитов (свыше 15 % по сравнению с возрастной нормой) и появление атипичных мононуклеаров (свыше 10 % всех лейкоцитов). Однако не следует переоценивать диагностическое значение лейкоцитарной формулы крови.
Специфические методы позволяют лабораторно подтвердить первичную инфекцию. Для этой цели наиболее информативным является определение антител к вирусному капсиду, связанных с иммуноглобулинами IgM, которые появляются одновременно с клиническими симптомами и сохраняются в течение 1–2 месяцев. Однако технически их выявить довольно сложно.
В этот период необходимо было ребенку проводить антивирусную, поддерживающую (витамины) и иммуностимулирующую терапию.
На фоне ослабленного иммунитета произошло инфицирование вирусом гепатита В. Желчный пузырь, скорее всего, забит лямблиями. Появление родинок свидетельствует о размножении в организме аспергилловых грибков. Ослабленный организм перешел в стадию лимфобластного лейкоза.
В данном запущенном случае наши методы уже вылечить не могут, а помогут только улучшить качество жизни. Лечить лямблии и грибки химическими препаратами – нагрузка на организм. Я думаю, что лечение химиотерапией уничтожило лямблий и теперь только можно провести легкий тюбаж желчного пузыря, чтобы освободить его от застойной желчи и мертвых лямблий. Можно провести тюбаж шиповником: 3 ст. ложки шиповника (сухие плоды) на 0,5 литра кипятка заварить в термос на ночь. Утром натощак выпить 150 мл очень теплого настоя шиповника, в котором развести 1 ст. ложку сорбита. Через 20 минут выпить еще 150 мл очень теплого настоя шиповника, но уже без сорбита. Спустя полчаса можно поесть салат из овощей, сочные фрукты или немного орехов и кусочек подсушенного ржаного хлеба. Надо двигаться, сделать легкую гимнастику. Через 1,5–2 часа сделать клизму 0,5 л обычной водой комнатной температуры. Через 1 месяц повторить.
Я устраняю гнев из моей жизни.
Я забываю и прощаю все обиды.
Молитва мученику и чудотворцу Иоанну-воину
О великий Христов мучениче Иоанне, правоверных поборниче, прогонителю и обидимых заступниче. Услыши нас, в бедах и скорбех молящихся тебе, яко дана тебе бысть благодать от Бога печальныя утешати, немощным помогати, неповинныя от напрасныя смерти избавляти и за всех зле страждущих молитися. Буди убо и нам поборник крепок на вся видимыя и невидимыя враги наша, яко да твое помощию и поборством по нас посрамятся вси являющии нам злая. Умоли Господа нашего, да сподобит ны грешныя и недостойныя рабы Своя получити от Него неизреченная благая, яже уготова любящим Его, в Троице Святей славимого Бога, всегда, ныне и присно и во веки веков. Аминь.
Вирусом Эпштейна — Барр (ЭБВ) инфицировано не менее 95 % взрослого населения во всех странах. У большинства людей первичная ЭБВ-инфекция протекает субклинически, а у меньшинства в виде инфекционного мононуклеоза. Случаи летального фульминантного мононуклеоза очень редки и чаще встречаются в группе больных одной из форм врожденного иммунодефицита — Х-сцепленным лимфопролиферативным синдромом (Х-ЛПС, или синдром Пуртильо). Главная особенность при это синдроме — отсутствие способности ограничивать пролиферацию ЭБВ-инфицированных В-лимфоцитов.
Второе по частоте проявление первичной ЭБВ-инфекции у больных с этим синдромом — лимфома Беркитта и, реже, лимфома Ходжкина. Соответственно у всех мальчиков с фульминантным мононуклеозом и семейными случаями лимфом Беркитта и Ходжкина необходимо заподозрить Х-ЛПС.
Резервуаром вируса Эпштейна — Барр (ЭБВ) являются В-лимфоциты и эпителиальные клетки слизистой оболочки носоглотки. Пожизненное латентное состояние вируса поддерживается цитотоксическими ЭБВ-специфическими Т-лимфоцитами, которые составляют около 1 % от всех циркулирующих лимфоцитов крови. При развитии длительного и глубокого дефицита Т-лимфоцитов возможна пролиферация ЭБВ-инфицированных В-лимфоцитов. Это состояние, описанное в конце 70-х годов XX в. у больных реципиентов донорской почки, названо В-клеточным лимфопролиферативным синдромом (В-ЛПС). Любая аллогенная трансплантация (почки, печени, сердца, легких, ГСК) может осложниться В-ЛПС.
Среди гематологических больных наивысший риск развития В-ЛПС отмечается у реципиентов аллогенного костного мозга, хотя отдельные случаи описаны после аутологичных трансплантаций и у реципиентов иммуносупрессивной терапии.
Риск развития В-ЛПС у реципиентов ТГСК оценивается как 1 % в течение 10 лет. В течение 1-го года он составляет 120 случаев на 10 000 пересадок и лишь 5 на 10 000 в последующие годы. Факторами риска развития В-ЛПС являются причины, способствующие возникновению или поддержанию Т-иммунодефицита.
Для клинической картины В-ЛПС характерны увеличение лимфатических узлов, печени, селезенки, высокая лихорадка и инфильтрация нелимфоидных органов. Вовлечение серозных оболочек приводит к развитию полисерозитов с массивными плевральными, перикардиальными выпотами и асцитом. При поражении лимфатических узлов средостения на первый план выступает синдром компрессии: нарушение притока крови к правому предсердию, сдавление трахеи. Нередко, как и при других В-клеточных пролиферациях у больных с Т-клеточным иммунодефицитом, при ЭБВ-ЛПС поражается ЦНС. Известны случаи развития тяжелого гемофагоцитарного синдрома в финальной стадии В-ЛПС.
Для лабораторной картины характерны наличие высокого моноклонального пика иммуноглобулинов класса М или G в сыворотке крови и подъем ЛДГ. Дискордантное восстановление репертуара В-лимфоцитов после аллотрансплантации иногда и в норме приводит к появлению высоких моноклональных пиков иммуноглобулинов, не связанных с В-ЛПС. Другие лабораторные признаки еще менее специфичны.
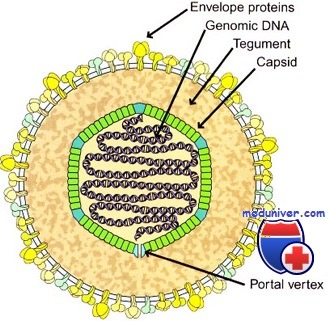
Патологическим субстратом при В-ЛПС являются ЭБВ-трансформированные В-лимфоциты, которые в подавляющем большинстве случаев имеют донорское происхождение. В связи с этим для профилактики В-ЛПС донорского происхождения на ранних стадиях после трансплантации гемопоэтических стволовых клеток (ТГСК) достаточно высокодозного миелоаблативного кондиционирования перед ТКМ, вызывающего глубокое истощение пула В-клеток донора.
Морфологически в отличие от реципиентов солидных органов, В-ЛПС которых имеют морфологию полиморфных крупноклеточных лимфом, В-ЛПС у реципиентов ТГСК примерно в половине случаев имеют морфологию иммунобластных лимфом. Еще одним отличием является олиго- или моноклональность В-ЛПС у реципиентов аллогенной ТКМ, хотя иногда удается проследить становление истинной моноклональной опухоли через стадии поликлональной и олигоклональной лимфопролиферации.
Интересно, что на стадии полиморфной лимфомы моноклональность обнаруживается менее чем в половине случаев, а при иммунобластных лимфомах — практически в 100 %.
Основными факторами риска развития В-ЛПС являются следующие: Т-деплеция трансплантата, лечение или профилактика РТПХ анти-CD3-моноклональными антителами, лечение или профилактика РТПХ антитимоцитарным глобулином, неродственный или родственный неполностью совместимый донор.
Самый высокий риск развития В-ЛПС, составляющий 64,8 ± 17,7 % через 4 года после трансплантации, присущ детям с тяжелыми комбинированными иммунодефицитными синдромами, получивших Т-деплетированный трансплантат от гаплоидентичного донора, тогда как у больных ТКИН, получивших HLA гено- или феноидентичный трансплантат без Т-деплеции, риск составляет 0,9 ± 0,2 %. Среди реципиентов неродственных трансплантаций с Т-деплецией частота посттрансплантационных В-ЛПС равна 5 %, без Т-деплеции — 1 %. Метод Т-деплеции значительно влияет на вероятность развития В-ЛПС.
В прошлом диагностика В-ЛПС основывалась на характерной патоморфологической картине биоптатов лимфатических узлов и пораженных органов и демонстрации наличия ДНК Эпштейна-Барр вируса (ЭБВ) в клетках опухоли. Важным лабораторным ориентиром служит появление моноклонального пика в глобулиновой фракции. Все эти данные являются, однако, поздними маркерами, которые констатируют заболевание на этапе, когда любая терапия малоэффективна. В настоящее время разработаны полуколичественные и количественные методы мониторинга ДНК Эпштейна-Барр вируса (ЭБВ) в крови, которые позволяют на ранних стадиях оценить риск развития В-ЛПС и назначить упреждающее лечение.
При исследовании частоты реактивации Эпштейна-Барр вируса (ЭБВ) в течение 180 дней после аллогенной ТГСК методом измерения количества копий ДНК Эпштейна-Барр вируса (ЭБВ) в крови выяснилось, что частота реактивации (количество копий генома в 1 мл крови более 50) составляет 39 % после трансплантации нативных ГСК и 65 % после Т-деплетированных трансплантаций. Среди больных, у которых количество копий генома Эпштейна-Барр вируса (ЭБВ) оказалось более 1000 в 1 мл, частота В-ЛПС составила 39 %, в то время как ни у кого из больных с показателем менее 1000 копий в 1 мл не развивался В-ЛПС. Таким образом, количественный мониторинг концентрации вирусной ДНК позволяет выявить популяцию высокого риска развития В-ЛПС. Возможно, что мониторинг вирусной ДНК не в цельной крови, а в плазме является еще более эффективным и специфичным методом ранней диагностики В-ЛПС.
Лечение уже развившегося В-ЛПС представляет сложную задачу. Химиотерапия и а-интерферон не показали воспроизводимой эффективности после ТГСК, хотя после трансплантации солидных органов их эффективность может быть выше, чем после ТГСК. Эпштейна-Барр вирус (ЭБВ) нечувствителен к ингибиторам тимидинкиназы типа ганцикловира и ацикловира, в то время как сидофовир может быть эффективен. Редукция иммуносупрессии, которая может быть предпринята после трансплантации солидных органов, чаще всего невозможна у реципиентов аллогенных ТГСК, поскольку может привести к вспышке РТПХ, которая, помимо того, что сама по себе может вызвать смерть пациента, способствует резкому усугублению иммунодефицита.
Несомненно, что в настоящее время мониторинг реактивации Эпштейна-Барр вируса в популяциях высокого риска и упреждающее лечение ритуксимабом являются методами выбора контроля В-ЛПС. Другой эффективный метод лечения В-ЛПС — клеточная терапия. Инфузии нативных донорских лимфоцитов в дозе более 1 * 106/кг высокоэффективны, однако чреваты высокой частотой развития тяжелой РТПХ. В некоторых самых передовых центрах используется введение ЭБВ-специфических Т-лимфоцитов донора, генерированных in vitro. Эффективность данного метода приближается к 80—90 %. Понятно, что клеточные технологии требуют высокого технологического уровня и доступны далеко не везде.
Вирусом Эпштейна — Барр (ЭБВ) инфицировано не менее 95 % взрослого населения во всех странах. У большинства людей первичная ЭБВ-инфекция протекает субклинически, а у меньшинства в виде инфекционного мононуклеоза. Случаи летального фульминантного мононуклеоза очень редки и чаще встречаются в группе больных одной из форм врожденного иммунодефицита — Х-сцепленным лимфопролиферативным синдромом (Х-ЛПС, или синдром Пуртильо). Главная особенность при это синдроме — отсутствие способности ограничивать пролиферацию ЭБВ-инфицированных В-лимфоцитов.
Второе по частоте проявление первичной ЭБВ-инфекции у больных с этим синдромом — лимфома Беркитта и, реже, лимфома Ходжкина. Соответственно у всех мальчиков с фульминантным мононуклеозом и семейными случаями лимфом Беркитта и Ходжкина необходимо заподозрить Х-ЛПС.
Резервуаром вируса Эпштейна — Барр (ЭБВ) являются В-лимфоциты и эпителиальные клетки слизистой оболочки носоглотки. Пожизненное латентное состояние вируса поддерживается цитотоксическими ЭБВ-специфическими Т-лимфоцитами, которые составляют около 1 % от всех циркулирующих лимфоцитов крови. При развитии длительного и глубокого дефицита Т-лимфоцитов возможна пролиферация ЭБВ-инфицированных В-лимфоцитов. Это состояние, описанное в конце 70-х годов XX в. у больных реципиентов донорской почки, названо В-клеточным лимфопролиферативным синдромом (В-ЛПС). Любая аллогенная трансплантация (почки, печени, сердца, легких, ГСК) может осложниться В-ЛПС.
Среди гематологических больных наивысший риск развития В-ЛПС отмечается у реципиентов аллогенного костного мозга, хотя отдельные случаи описаны после аутологичных трансплантаций и у реципиентов иммуносупрессивной терапии.
Риск развития В-ЛПС у реципиентов ТГСК оценивается как 1 % в течение 10 лет. В течение 1-го года он составляет 120 случаев на 10 000 пересадок и лишь 5 на 10 000 в последующие годы. Факторами риска развития В-ЛПС являются причины, способствующие возникновению или поддержанию Т-иммунодефицита.
Для клинической картины В-ЛПС характерны увеличение лимфатических узлов, печени, селезенки, высокая лихорадка и инфильтрация нелимфоидных органов. Вовлечение серозных оболочек приводит к развитию полисерозитов с массивными плевральными, перикардиальными выпотами и асцитом. При поражении лимфатических узлов средостения на первый план выступает синдром компрессии: нарушение притока крови к правому предсердию, сдавление трахеи. Нередко, как и при других В-клеточных пролиферациях у больных с Т-клеточным иммунодефицитом, при ЭБВ-ЛПС поражается ЦНС. Известны случаи развития тяжелого гемофагоцитарного синдрома в финальной стадии В-ЛПС.
Для лабораторной картины характерны наличие высокого моноклонального пика иммуноглобулинов класса М или G в сыворотке крови и подъем ЛДГ. Дискордантное восстановление репертуара В-лимфоцитов после аллотрансплантации иногда и в норме приводит к появлению высоких моноклональных пиков иммуноглобулинов, не связанных с В-ЛПС. Другие лабораторные признаки еще менее специфичны.

Патологическим субстратом при В-ЛПС являются ЭБВ-трансформированные В-лимфоциты, которые в подавляющем большинстве случаев имеют донорское происхождение. В связи с этим для профилактики В-ЛПС донорского происхождения на ранних стадиях после трансплантации гемопоэтических стволовых клеток (ТГСК) достаточно высокодозного миелоаблативного кондиционирования перед ТКМ, вызывающего глубокое истощение пула В-клеток донора.
Морфологически в отличие от реципиентов солидных органов, В-ЛПС которых имеют морфологию полиморфных крупноклеточных лимфом, В-ЛПС у реципиентов ТГСК примерно в половине случаев имеют морфологию иммунобластных лимфом. Еще одним отличием является олиго- или моноклональность В-ЛПС у реципиентов аллогенной ТКМ, хотя иногда удается проследить становление истинной моноклональной опухоли через стадии поликлональной и олигоклональной лимфопролиферации.
Интересно, что на стадии полиморфной лимфомы моноклональность обнаруживается менее чем в половине случаев, а при иммунобластных лимфомах — практически в 100 %.
Основными факторами риска развития В-ЛПС являются следующие: Т-деплеция трансплантата, лечение или профилактика РТПХ анти-CD3-моноклональными антителами, лечение или профилактика РТПХ антитимоцитарным глобулином, неродственный или родственный неполностью совместимый донор.
Самый высокий риск развития В-ЛПС, составляющий 64,8 ± 17,7 % через 4 года после трансплантации, присущ детям с тяжелыми комбинированными иммунодефицитными синдромами, получивших Т-деплетированный трансплантат от гаплоидентичного донора, тогда как у больных ТКИН, получивших HLA гено- или феноидентичный трансплантат без Т-деплеции, риск составляет 0,9 ± 0,2 %. Среди реципиентов неродственных трансплантаций с Т-деплецией частота посттрансплантационных В-ЛПС равна 5 %, без Т-деплеции — 1 %. Метод Т-деплеции значительно влияет на вероятность развития В-ЛПС.
В прошлом диагностика В-ЛПС основывалась на характерной патоморфологической картине биоптатов лимфатических узлов и пораженных органов и демонстрации наличия ДНК Эпштейна-Барр вируса (ЭБВ) в клетках опухоли. Важным лабораторным ориентиром служит появление моноклонального пика в глобулиновой фракции. Все эти данные являются, однако, поздними маркерами, которые констатируют заболевание на этапе, когда любая терапия малоэффективна. В настоящее время разработаны полуколичественные и количественные методы мониторинга ДНК Эпштейна-Барр вируса (ЭБВ) в крови, которые позволяют на ранних стадиях оценить риск развития В-ЛПС и назначить упреждающее лечение.
При исследовании частоты реактивации Эпштейна-Барр вируса (ЭБВ) в течение 180 дней после аллогенной ТГСК методом измерения количества копий ДНК Эпштейна-Барр вируса (ЭБВ) в крови выяснилось, что частота реактивации (количество копий генома в 1 мл крови более 50) составляет 39 % после трансплантации нативных ГСК и 65 % после Т-деплетированных трансплантаций. Среди больных, у которых количество копий генома Эпштейна-Барр вируса (ЭБВ) оказалось более 1000 в 1 мл, частота В-ЛПС составила 39 %, в то время как ни у кого из больных с показателем менее 1000 копий в 1 мл не развивался В-ЛПС. Таким образом, количественный мониторинг концентрации вирусной ДНК позволяет выявить популяцию высокого риска развития В-ЛПС. Возможно, что мониторинг вирусной ДНК не в цельной крови, а в плазме является еще более эффективным и специфичным методом ранней диагностики В-ЛПС.
Лечение уже развившегося В-ЛПС представляет сложную задачу. Химиотерапия и а-интерферон не показали воспроизводимой эффективности после ТГСК, хотя после трансплантации солидных органов их эффективность может быть выше, чем после ТГСК. Эпштейна-Барр вирус (ЭБВ) нечувствителен к ингибиторам тимидинкиназы типа ганцикловира и ацикловира, в то время как сидофовир может быть эффективен. Редукция иммуносупрессии, которая может быть предпринята после трансплантации солидных органов, чаще всего невозможна у реципиентов аллогенных ТГСК, поскольку может привести к вспышке РТПХ, которая, помимо того, что сама по себе может вызвать смерть пациента, способствует резкому усугублению иммунодефицита.
Несомненно, что в настоящее время мониторинг реактивации Эпштейна-Барр вируса в популяциях высокого риска и упреждающее лечение ритуксимабом являются методами выбора контроля В-ЛПС. Другой эффективный метод лечения В-ЛПС — клеточная терапия. Инфузии нативных донорских лимфоцитов в дозе более 1 * 106/кг высокоэффективны, однако чреваты высокой частотой развития тяжелой РТПХ. В некоторых самых передовых центрах используется введение ЭБВ-специфических Т-лимфоцитов донора, генерированных in vitro. Эффективность данного метода приближается к 80—90 %. Понятно, что клеточные технологии требуют высокого технологического уровня и доступны далеко не везде.
Вирус Эпштейна-Барр (ВЭБ) или вирус герпеса человека 4 типа является наиболее встречающимся у людей вирусом. Согласно статистике, вирусоносителями является 90% человечества.
Попадая в организм, патогенный агент поражает иммунную систему, слизистые, дыхательные пути, нейроны ЦНС и почти все внутренние органы.
Пути передачи
Источником заражения вирусом Эпштейна-Барра может быть больной человек в острой фазе, начиная с последних дней латентного периода и на протяжении полугода с момента инфицирования ВЭБ, а также вирусоноситель, который переболел, но способен выделять возбудитель и представлять угрозу для окружающих.
Наибольшая вероятность заражения существует у детей младше 10 лет, женщин в положении, пациентов с различными формами иммунодефицита, в том числе ВИЧ-положительных граждан.
Вирусная инфекция Эпштейна-Барра передаётся различными путями:
- Контактно-бытовой. Чаще всего возбудитель передается со слюной при поцелуях. Через личные вещи, в том числе и игрушки, посуду заражение наблюдается реже, так как ВЭБ не устойчив во внешней среде.
- Аэрозольный. Вирус выделяется со слюной при разговоре, кашле и чихании и при вдыхании попадает на слизистые дыхательных путей здорового человека.
- Гемоконтактный. Заражение возможно при гемотрансфузии, пересадке органов.
- Вертикальный. Вирус может передаваться от женщины к плоду или ребенку, в период беременности, родоразрешения и грудного вскармливания.
- Алиментарный. Инфицирование возможно через еду и воду.
Клиническая картина у взрослых
При остром инфицировании вирус Эпштейн Барра у взрослых вызывает такие же симптомы, как наблюдаются при простудных заболеваниях, ОРЗ и ОРВИ. Это состояние получило название инфекционного мононуклеоза.
Находясь в организме, вирус Эпштейн Барра у взрослых в форме острого мононуклеоза провоцирует следующие симптомы:
общая слабость, повышенная температура тела, ринит, увеличенные лимфатические узлы;- красное, воспаленное горло;
- нарушенное дыхание, кашель;
- потливость;
- миалгия и артралгия;
- головная боль, вертиго, бессонница, проблемы с памятью и вниманием, подавленное настроение;
- увеличенная в размерах печень и селезенка, болевые ощущения слева под рёбрами, желтуха.
Вирус Эпштейн-Барра в хронической форме у взрослых провоцирует следующие симптомы:
- синдром повышенной утомляемости, появившийся непосредственно после перенесенного заболевания;
- малокровие;
- аутоиммунные патологии: ревматоидный артрит (артралгия), красная волчанка (краснота и сыпь на кожных покровах), болезнь Шенгера (воспаление слезных и слюнных желёз);
- частые инфекции, спровоцированные вирусами, грибами и бактериями;
- нарушение пищеварения, угри, высыпания;
- злокачественные новообразования.
Вирус Эпштейн-Барра в вялотекущей форме у взрослых кроме описанных симптомов часто провоцирует другие герпетические и бактериальные заболевания. Болезнь приобретает обширный характер, ее сложно диагностировать и лечить. Она обычно маскируется под прочие хронические инфекции с волнообразным течением — когда ремиссии сменяются обострением.
Если наблюдается вирусоносительство, то вирус Эпштейна- Барра у взрослых может протекать бессимптомно, и человек даже не будет знать, что заражен. Но болезнь никак не проявляет себя, лишь пока иммунная система функционирует нормально.
Активацию вируса могут спровоцировать:
- хроническая интоксикация (алкогольная зависимость, гербициды, выбросы в атмосферу вредных веществ);
- стресс;
- химиотерапия, облучение;
- трансплантация органов;
- хирургическое вмешательство;
- вакцинация.
После активации возбудитель мигрирует из лимфоцитов на слизистые оболочки и отсюда попадает к другим людям и становится причиной инфицирования.
Клиническая картина у детей
Когда иммунная система функционирует нормально, вирус Эпштейна-Барр у детей не вызывает каких-либо симптомов. Поэтому у дошкольников и детей младшего школьного возраста инфекция обычно протекает скрытно, без лихорадки, воспаления и других клинических проявлений болезни.
Вирус Эпштейн-Барра у детей-подростков, как правило, провоцирует типичные для инфекционного мононуклеоза симптомы (боль в горле, лихорадка, увеличеная селезенка и лимфатические узлы). Дело в том, что в подростковом возрасте из-за гормональной перестройки ослабляется иммунитет, поэтому ВЭБ активируется.
Инфекция вирусом Эпштейна-Барра у детей имеет некоторые особенности:
- Сокращается инкубационный период: симптомы заражения вирусом Эпштейна-Барр у детей появляются на 10—20 сутки (у взрослых латентный период длится 40—50 дней).
- Сроки выздоровления напрямую зависит от состояния иммунной системы, у ребенка она обычно функционирует лучше, чем у взрослого (сказываются вредные привычки, гиподинамия). Поэтому у детей клинические проявления болезни проходят быстрее.

Отличия ВЭБ от других вирусов
Герпесвирус человека тип 4 имеет несколько отличий от остальных вирусов герпеса:
- ВЭБ не убивает клетки человека, а наоборот провоцирует их деление и запускает патологический процесс разрастания тканей – полиферацию. Зачастую она приводит к образованию опухолей.
- Если остальные вирусы герпеса хранятся в ганглиях спинного мозга, то ВЭБ депонируется в В-лимфоцитах. Эти клетки в норме защищают организм от патогенных агентов и рака. И в отличие от ВИЧ, герпесвирус их не убивает, а меняет их генетический код, в результате они начинают делиться, что и становится причиной рака.
Из-за того, что ВЭБ мутирует, при вторичном заражении Эпштейн Барра вирусом симптомы могут повториться, поскольку инфекции не поддаются воздействию антител, которые были выработаны раньше при первой встрече.
Диагностика
Врач диагностирует вирус Эпштейна Барр у детей и взрослых на основании жалоб пациента, клинических признаков и лабораторных анализов.
Врачом может быть назначен ряд исследований:
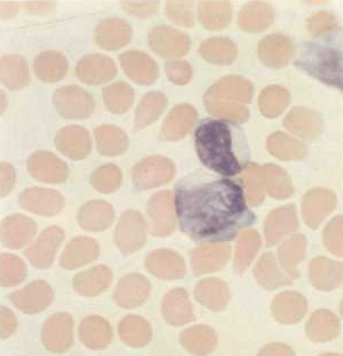
Атипичные мононуклеары при заражении инфекционным мононуклеозом, вызываемом вирусом Эпштейна-Барр
- Клинический анализ крови. В нем будет выявлено повышение лейкоцитов, СОЭ, появление атипичных мононуклеаров. Тромбоциты и гемоглобин могут быть как выше, так и ниже нормы.
- Биохимия крови. Проведенный анализ покажет высокий уровень билирубина, ферментов печени и ряда других энзимов, белки острой фазы, такие как фибриноген, С-реактивный белок.
- Иммунологическое исследование, которое позволит оценить состояние иммунитета больного.
- Оценить количество и класс иммуноглобулинов с помощью серологических реакций. При остром течении заболевания будут преобладать lg M, а позже спустя 2—4 месяца будут выявлены lgG, в этом случае на бланке с результатами анализов будет написано Эпштейна-Барр вирус igg положительный.
- ДНК-диагностика. Она проводится с помощью ПЦР и позволяет выявить возбудитель в различных биоматериалах, в том числе слюне, ликворе, мазках со слизистой органов дыхания, биоптатах внутренних органов.
Если есть показания, могут быть назначены дополнительные обследования:
- сонография абдоминальной полости;
- рентген грудной клетки и околоносовых синусов;
- коагулограмма;
- консультация врача-иммунолога, отоларинголога, онколога, гематолога.
Некоторые факты о медицинской диагностике вируса Вы также можете почерпнуть из приведенного ниже видео.
Осложнения вируса Эпштейна-Барр
Если произошло заражение вирусом Эпштейна-Барр, и симптомы заболевания были оставлены без внимания и не пролечены, то существует риск развития различных осложнений. Согласно статистике, самыми распространенными из них являются:
-
анемия, появляется из-за снижения всех форменных элементов крови, иногда она может сопровождаться желтухой и появлением гемоглобина в моче;
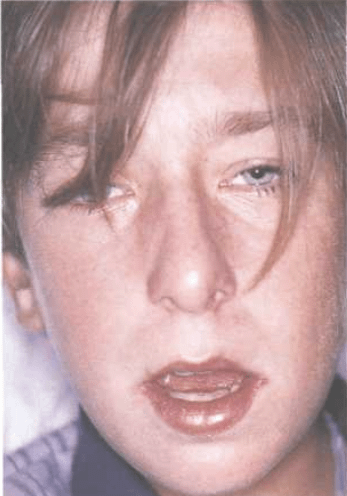
Характерные признаки инфекционного мононуклеоза
Читайте также:


