Вирус герпеса костный мозг
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
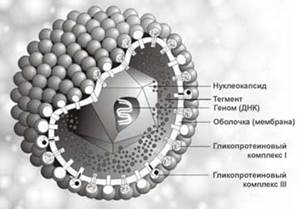
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.


Для большего понимания причин развития болезней, связанных с деградацией мозга, ученые не прекращают изучать ткани мозга людей, имевших болезнь Альцгеймера или иной вид деменции при жизни. И это, конечно, логично.
Недавно американские ученые из нью-йоркского института медицины при исследовании образцов ткани головного мозга тысячи человек обнаружили два вида штаммов герпеса в огромном количестве у пациентов на ранней стадии болезни Альцгеймера по сравнению с теми, кто не имел этого заболевания при жизни (контрольная группа). Автор исследования, профессор неврологии Сэм Гэнди, отмечает, что примерно в 30% образцов ткани головного мозга у пациентов с болезнью Альцгеймера обнаружились вирусные геномы, а в контрольной группе нет. Чтобы преодолеть свой научный скептицизм относительно результатов исследования, Сэм Гэнди изучил образцы тканей головного мозга из другого хранилища ткани головного мозга, позаимствовав 622 образца пациентов с болезнью Альцгеймера и 322 без оной. Результаты оказались идентичными предыдущим.
Самой очевидной разницей между двумя видами тканей головного мозга двух исследуемых групп оказалась генная активность двух видов герпеса – HHV6A и HHV7. Ученые разделились относительно толкования полученных результатов. Одни утверждают, что вирус герпеса действительно может стать запустить развитие болезни Альцгеймера, другие предполагают, что люди с болезнью Альцгеймера становятся мишенью для инфекций.
Несмотря на то, что ученые пока не могут объяснить, как вирус герпеса способствует развитию деменции, они предположили вероятный механизм воздействия вируса на организм человека: некоторые гены вируса усиливают активность известных науке генов болезни Альцгеймера. Однако другие скептически замечают, что в семьях с мутациями в особых генах всегда есть кто-нибудь, кого поражает болезнь Альцгеймера, но это крайне сложно соотнести с вирусной этиологией.
Также стоит отметить, что указанные штаммы вируса герпеса не имеют ничего общего с герпесом, высыпающим на губах, хотя и являются довольно распространенными видами герпеса.
Комментарий специалиста
И вот, два года спустя, все также нет доказательств связи между болезнью Альцгеймера и микробами, однако данное исследование предлагает доказательства в поддержку идеи, что все-таки есть какие-то нити между болезнью Альцгеймера и вирусными и бактериальными инфекциями. Ученые из нью-йоркского института медицины обнаружили, что ряд генов, модифицирующиеся в головном мозге пациентов с болезнью Альцгеймера, известны своей антивирусной и антимикробной активностью. Не останавливаясь на достигнутом, ученые пошли дальше в поисках генов из любых вирусов, и наибольшее количество генов оказалось из вирусов HHV6A и HHV7. Оба они распространены и близкородственны вирусам герпеса, вызывающим у детей сыпь и лихорадку. Что касается HHV-7, то практически каждый из нас является его носителем, а вот HHV6A менее изучен в плане распространенности из-за схожести с близкородственными вирусами. В тканях головного мозга пациентов с болезнью Альцгеймера было найдено огромное количество других вирусных ДНК, и количество HHV хоть и превышало количество других вирусов, но не значительно. Кстати ДНК HSV-1 и HSV-2, передаваемых половым путем, также присутствовала в довольно больших количествах, однако меньше, чем других штаммов вируса герпеса.
Как бы там ни было, считают эксперты, даже если вы будете принимать терапию против вируса герпеса, это не изменит предрасположенности к развитию болезни Альцгеймера. Хотя результаты исследования обнадеживают, поскольку они представили новые доказательства о роли иммунитета в развитии болезни Альцгеймера, что может помочь исследователям найти способ обнаружить ее на ранней стадии и подобрать соответствующую терапию.
Вкратце, можно сказать, что данное исследование поддерживает давно отрицаемую идею о роли вируса герпеса в развитии болезни Альцгеймера. Не исключено, что так и есть. Но какую роль?
Герпес головного мозга – это крайне опасная патология, характеризующаяся воспалением серого и белого веществ в результате поражения тканей вирусом простого герпеса 1 и 2 типов. Это заболевание протекает остро и сопровождается нарушениями, которые в дальнейшем крайне тяжело поддаются коррекции.

В особую группу риска развития этого патологического состояния входят новорожденные дети и пожилые люди. Кроме того, нередко поражение герпесом головного мозга наблюдается у тех, кто страдает от иммунодефицита.
Симптомы герпеса головного мозга
Герпетическое поражение тканей проявляется острой симптоматикой. После перенесенного острого периода герпеса, сопровождающегося высыпаниями, патология не переходит в латентный период. Скрытое течение поражения герпесом головного мозга может наблюдаться от 2 до 20 дней.
В дальнейшем у больного наблюдается процесс реактивации вируса. Из-за этого резкого повышается температура тела выше +39°C, причем снизить ее медикаментами сложно.
Как у взрослых, так и у детей младшего возраста наблюдаются нарушения сознания разной степени тяжести.
При неблагоприятном течении возможна кома. Кроме того, могут появляться следующие признаки поражения головного и спинного мозга:
- судороги;
- нарушения чувствительности отдельных частей тела;
- зрительные и слуховые галлюцинации;
- эпилептические припадки;
- сильная головная боль;
- шаткость походки;
- потеря памяти;
- повышенная потливость;
- возбужденное состояние;
- вегетативные нарушения.






В зависимости от формы и степени выраженности поражения нервных стволов герпесом длительность нарастания острой симптоматики может варьироваться от нескольких дней до недели и более. Состояние пациента становится крайне тяжелым.
Причины появления
Поражение вирусом герпеса структур головного мозга наблюдается редко. Поспособствовать активации вируса и появлению этой патологии могут:
- сниженный иммунитет на фоне СПИДа;
- истощение;
- тяжелый авитаминоз;
- переохлаждение;
- туберкулез;
- ревматизм.

Влияние этих неблагоприятных факторов становится причиной снижения иммунитета. Защитные механизмы организма не могут подавить вирус. После попадания в организм человека герпес уже нельзя устранить полностью, но если иммунная система находится в нормальном состоянии, вирус сохраняется в латентном виде.
Диагностика и лечение
Характерная клиническая картина и данные инструментальных и лабораторных обследований позволяют точно поставить диагноз. Для определения проблемы назначаются:
- пункция спинномозговой жидкости;
- ПЦР;
- КТ;
- МРТ;
- биопсия;
- общий и биохимический анализы крови.






Терапия должна проводиться в условиях стационара. Больному требуется интенсивное медикаментозное лечение. В первую очередь назначаются противовирусные препараты, в том числе:
- Герпевир;
- Ацикловир (подробнее тут);
- Виролекс;
- Зовиракс (подробнее тут).

Форма и дозировка этих лекарственных средств назначается врачом индивидуально. Помимо всего прочего, для коррекции работы иммунной системы назначаются иммуномодулирующие препараты, кортикостероиды и интерфероны.
Для стабилизации состояния может быть проведена дезинтоксикационная терапия. Могут быть назначены лекарственные средства, позволяющие скорректировать симптомы, в том числе диуретики, противосудорожные и жаропонижающие препараты.
В большинстве случаев прогноз завит от своевременности начала лечения.
Осложнения и реабилитация
Герпес мозга может иметь крайне неблагоприятные последствия. При этом патологическом состоянии неврологические нарушения могут оставаться после завершения острого течения болезни. К осложнениям, часто возникающим при этом заболевании, относятся:
- мигрень;
- менингит;
- снижение умственной активности;
- мышечная слабость;
- частичная потеря памяти;
- нарушения зрения, речи и слуха;
- приступы головокружения;
- эпилепсия;
- различные нарушения психики.

В случае если не будет проведена должным образом реабилитация, данные осложнения могут сохраниться на всю оставшуюся жизнь. Если после устранения острой симптоматики человек вынужден работать и психически переутомляется, принимает алкоголь или подвергается влиянию других неблагоприятных факторов, последствия перенесенного вирусного поражения тканей головного мозга могут становиться более выраженными.
Герпетический энцефалит – крайне опасное поражение вирусом герпеса тканей головного мозга. При отсутствии направленного лечения летальный исход наблюдается примерно в 80% случаев. Своевременное обращение за медицинской помощью является профилактикой развития тяжелых осложнений, которые будут сохраняться на протяжении длительного времени. Для снижения риска появления энцефалита, вызванного герпесом, необходимо поддерживать иммунитет на высоком уровне: правильно питаться, регулярно делать физические упражнения, отказаться от всех вредных привычек.
Герпес головного мозга – это инфекционное воспаление мозгового вещества вирусного происхождения. В медицинской нозологии заболевание носит название герпетический энцефалит. Болезнь проявляется общемозговой симптоматикой и специфическими признаками, которые характеры для вируса простого герпеса. Инфекция поражает не только головной мозг, но и другие отделы нервной системы.
Вирусному поражению мозга чаще всего поддаются люди с 5-30 лет и после 50. Сезонность не свойственна.
Заболевание протекает в двух формах:
- Бессимптомное носительство вируса. Герпес не проявляет себя в силу сдерживания его иммунной системой. Больной все же остается потенциальным источником заражения при контакте с другими людьми (пути передачи – через слизистые оболочки и кожу). Симптомов при латентном вирусоносительстве нет.
- Манифестная форма вируса. Характера типовая клиническая картина для герпетического воспаления головного мозга.
Для герпетического энцефалита характерна высокая летальность и тяжелое течение. Возможные исходы заболевания:
При своевременной диагностике и лечении последствия избегаются и больной возвращается к прежнему образу жизни.

Причины и патогенез
Герпетический энцефалит возбуждает вирус герпеса 1 или 2 типа. Сам же вирус, попав во внутрь нервной клетки, не убивает его. Наоборот, нейрон угнетает вирус и не дает ему размножаться. Герпес проявляет себя тогда, когда иммунная система человека, в результате понижающих защитные функции факторов, ослабляется. К таким факторам относится:
- стресс;
- плохая пища;
- недосыпание;
- вредные привычки и зависимости;
- пассивный образ жизни.
Герпес вирус проникает в мозг по нервным путям. Например, инфекция передалась по слизистой оболочке рта и транспортировался оттуда в слизистую носу. Попав в благоприятные условия (тепло, влага, питательная среда), герпес по обонятельным нервам транспонируется во второй нейрон – обонятельную луковицу, по которой вирус достигает лобных и височных долей головного мозга. Такой вариант характерен для взрослых людей.
Второй путь – гематогенный, кровяной. Этот тип заражения характерен для генерализированной инфекции новорожденных, когда мать являлась носителем вируса.
Симптомы и диагностика
Симптоматика герпетического энцефалита обыкновенно имеет типовое начало и динамику. Болезнь начинается с гриппоподобного состояния и проявляется первыми симптомами:
- острое повышение температуры тела до 39-40С;
- сильные головные боли;
- тошнота и рвота;
- астенический синдром: усталость, апатия, раздражительность.
В некоторых случаях болезнь начинается с кашля, чихания и насморка.
На 2-3 день присоединяются характерные признаки воспаления головного мозга:
Диагностируется заболевание на основании клинической картины, лабораторной диагностики и инструментальных методов. К последним относится магнитно-резонансная и компьютерная томография. Они помогают исключить другие заболевания мозга (опухоль, например).
Золотым стандартом считается ПЦР и люмбальная пункция. Первый способ находит ДНК вируса в ликворе, второй – качественные изменения цереброспинальной жидкости (повышение белка, лимфоцитов, лейкоцитов, скорости сворачивания эритроцитов и удельного веса ликвора).

Лечение
Терапия герпеса головного мозга проводится в отделении реанимации и интенсивной терапии:
- Этиотропное лечение (устранение причины): назначается противовирусный препарат – ацикловир.
- Снятие отека мозга с помощью сильных мочегонных (фуросемид).
- Купирование эпилептических припадков: раствор сибазона.
- Коррекция водно-электролитного баланса: натрия гидрокарбонат, раствор Рингера, натрия хлорид.
- Предупреждение бактериальных осложнений: назначаются средства, повышающие иммунитет (интерферон).
Прогноз
Прогноз заболевания неблагоприятный по нескольких причинам:
- Больные, у которых развилась кома, умирают в 70-80%.
- Развивается синдром акинетического мутизма – состояние, при котором пациент не может говорить и двигаться, хотя физическая возможность для речи и движений сохраняется.
- Длительный восстановительный этап: от двух лет и более пациенты возвращают психические функции.
- Грубые расстройства познания. Например, Синдром Клювера-Бьюси. Характеризуется ослаблением эмоций, нарушением пищевого поведения, гиперсексуальностью и зрительной агнозией (потеря способности узнавать предметы через зрительный канал информации).
Аннотация научной статьи по клинической медицине, автор научной работы — Лобанова Татьяна Игоревна, Паровичникова Е.Н., Тихомиров Д.С., Гаранжа Т.А., Троицкая В.В.
Похожие темы научных работ по клинической медицине , автор научной работы — Лобанова Татьяна Игоревна, Паровичникова Е.Н., Тихомиров Д.С., Гаранжа Т.А., Троицкая В.В.
HUMAN HERPES VIRUS 6 IN PATIENTS WITH BLOOD SYSTEM DISEASES DURING CHEMOTHERAPY COURSES AND AFTER AUTOLOGOUS BLOOD STEM CELL TRANSPLANTATION
The aim of the study was to evaluate the frequency of Human Herpes Virus 6 (HHV6) infection in immunocompromised patients and to analyze the efficiency of the antiviral treatment. In retrospective study 273 patients with hematological disorders were analyzed from Jan 2013 to Jul 2017 (72 patients with acute lymphoblastic leukemia (ALL), 141 case with acute myeloid leukemia, 15 cases with high-grade B-cell lymphoma (BCL), 45 aplastic anemia patients. 25 patients underwent autologous stem cell transplantation (19 with ALL, 6 with BCL). DNA of HHV6 was detected in 32.9% of patients, including 11 patients after transplantation . However, the detection of HHV6 with clinical symptoms was identified only in 26 (9.5%) of 273 patients. Febrile neutropenia, hemorrhagic cystitis, enteropathy, pneumonia, 1 case of encephalitis and 1 case of severe cutaneous HHV6 lesion were detected as clinical manifestations of the infection . The importance of prolonged intravenous antiviral treatment was demonstrated. Thus, HHV6 DNA is detected in large percent of cases in hematological patients but its clinical manifestation is not seen very often. The early prolonged and adequate treatment reduces the risks of complications.
О КОЛЛЕКТИВ АВТОРОВ, 2017
Лобанова Т.И., Паровичникова Е.Н., Тихомиров Д.С., | Гаранжа Т. А., Троицкая В.В., Михайлова Е.А., Фидарова З.Т., Савченко В.Г.
ГЕРПЕС-ВИРУСНЫЕ ИНФЕКЦИИ 6-ГО ТИПА У БОЛЬНЫХ С ЗАБОЛЕВАНИЯМИ СИСТЕМЫ КРОВИ ПРИ ПРОВЕДЕНИИ ХИМИОТЕРАПИИ И ПОСЛЕ ТРАНСПЛАНТАЦИИ АУТОЛОГИЧНЫХ ГЕМОПОЭТИЧЕСКИХ
125167, г. Москва, Россия
Ключевые слова: вирус герпеса человека 6-го типа; инфекции; гематология; трансплантация.
Lobanova T.I., Parovichnikova E.N., Tikhomirov D.S., \Garanzha T.Aj Troitskaya V.V., Mikhailova E.A., FidarovaZ.T., Savchenko V.G.
HUMAN HERPES VIRUS 6 IN PATIENTS WITH BLOOD SYSTEM DISEASES DURING CHEMOTHERAPY COURSES AND AFTER AUTOLOGOUS BLOOD STEM CELL TRANSPLANTATION
National Research Center for Hematology, Moscow, 125167, Russian Federation
The aim of the study was to evaluate the frequency of Human Herpes Virus 6 (HHV6) infection in immunocompromised patients and to analyze the efficiency of the antiviral treatment. In retrospective study 273 patients with hematological disorders were analyzed from Jan 2013 to Jul 2017 (72 patients with acute lymphoblastic leukemia (ALL), 141 case - with acute myeloid leukemia, 15 cases with high-grade B-cell lymphoma (BCL), 45 aplastic anemia patients. 25 patients underwent autologous stem cell transplantation (19 with ALL, 6 with BCL). DNA of HHV6 was detected in 32.9% of patients, including 11 patients after transplantation. However, the detection of HHV6 with clinical symptoms was identified only in 26 (9.5%) of 273 patients. Febrile neutropenia, hemorrhagic cystitis, enteropathy, pneumonia, 1 case of encephalitis and 1 case of severe cutaneous HHV6 lesion were detected as clinical manifestations of the infection. The importance of prolonged intravenous antiviral treatment was demonstrated. Thus, HHV6 DNA is detected in large percent of cases in hematological patients but its clinical manifestation is not seen very often. The early prolonged and adequate treatment reduces the risks of complications.
Keywords: human herpes virus 6; infection; hematology; transplantation.
Acknowledgments. The study had no sponsorship. Conflict of interest. The authors declare no conflict of interest. Received 13 Nov 2017 Accepted 29 Dec 2017
Гематология и трансфузиология. 2017; 62(4) Оригинальная статья
Lobanova Tatiana I., hematologist in National Research Center for
Hematology, Moscow, 125167, Russian Federation. E-mail: lobanova_ tanya@yahoo.com.
Information about authors:
Энцефалит, вызванный ВГЧ-6, - одно из самых тяжелых проявлений инфекции, сопровождается нарушением памяти, головными болями, дезориентацией [8, 13-15]. Диагноз устанавливают при выявлении ДНК ВГЧ-6 в спинномозговой жидкости в концентрации более 500 копий/мл, а также при обнаружении на магнитно-резонансной томографии (МРТ) высокоинтенсивных сигналов в лобных долях головного мозга [15]. Больным, у которых по каким-либо причинам выполнить люмбаль-ную пункцию было невозможно, диагноз устанавливали при наличии трех признаков: типичная клиническая картина, обнаружение ДНК вируса в периферической крови и изменения по данным МРТ. ВГЧ-6 способен интегрировать в теломерный регион хромосом человека. Такие клетки с интегрированным ВГЧ-6 передаются клеткам и органам реципиента при трансплантации и активизируются в условиях экстремальной иммуносупрессии. Пациенты с интегрированным вирусом плохо поддаются лечению, количество таких больных достигает 0,1-1% среди всей популяции в развитых странах [16], а количество копий ДНК вируса в крови обычно доходит до рекордного количества (1 млн клеток в 1 мл) [17].
В данных литературы информация о клинически значимых инфекциях ВГЧ-6 у больных АА немногочисленна. В 2010 г. описан случай ассоциированного с ВГЧ-6 гепатита у трехлетнего ребенка, подтвержденный результатами ПЦР-диагностики ДНК вируса в биоптате печени и крови больного. Через 2 мес после установленного диагноза у пациента развилась клиническая картина спонтанной кровоточивости, а результаты гистологического исследования трепанобиоптата подтвердили развитие АА [18].
осложнениям, однако у некоторых больных даже на фоне профилактики развивались вирусные энцефалиты [20]. У пациентов с активной инфекцией ВГЧ-6 отмечено медленное восстановление количества CD8+ Т-клеток, которое может длиться до 6 мес после ТКМ, а общая выживаемость этих больных после трансплантации хуже [21].
Исследования по изучению антивирусного действия показали, что ВГЧ-6 малочувствителен к аналогам нуклео-зидов [22, 23]. С определенным успехом в лечении были использованы ганцикловир и фоскарнет [24, 25]. К основным этиотропным лекарственным средствам относят три группы препаратов: ациклические аналоги гуанозина, интерфероны и иммуноглобулины [7, 22, 23]. Фоскарнет натрия (фоскарнет) является ингибитором вирусной ДНК-полимеразы и, в меньшей степени, РНК-полимеразы. Из-за высокой токсичности он считается средством 2-го ряда. Новыми противогерпетическими химиопрепа-ратами являются цидофовир и бривудин. Эти лекарственные средства обладают более высокой эффективностью, чем ацикловир и ганцикловир, но хуже переносятся, что ограничивает их клиническое применение. Их следует использовать при угрожающих жизни формах герпесви-русных инфекций при условии известной или ожидаемой резистентности к ацикловиру и ганцикловиру [2]. Мало известно об эффективности превентивной противовирусной терапии ВГЧ-6. До сих пор лечение ВГЧ-6-инфекции у иммунокомпрометированных больных начинают лишь в случае совокупности проявлений: выделения ДНК в биологической жидкости и наличия клинической картины. Как бы ни была высока вирусная нагрузка в биологических жидкостях, только клиническая симптоматика определяет необходимость назначения терапии. Основными противовирусными препаратами для таких больных являются ганцикловир, фоскарнет и цидофовир. Часто лечение вирусного энцефалита сопровождается комбинацией препаратов (ганцикловир и фоскарнет) в стандартной дозе. У больных, получающих химиотерапию, важны уменьшение объема иммуносупрессивной терапии или ее полная отмена в случае выявления ВГЧ-6. Необходимо отметить, что до сих пор не было исследований, где определялась бы длительность противовирусной терапии и дозы. Общая схема терапии используется для лечения ВГЧ-6 и ЦМВ-инфекции, поэтому в большинстве случаев приблизительная продолжительность составляет 3-4 нед, иногда несколько месяцев [26, 27]. В последних исследованиях рекомендуемая терапия вирусного поражения центральной нервной системы (ЦНС) включает высокие дозы ганцикловира (18 мг/кг в сутки) либо фоскарнета 90 мг/кг каждые 12 ч (180 мг/кг в сутки) [28]. Эффективность терапии определяется значимым уменьшением клинических проявлений заболевания, а также уменьшением или исчезновением копий вируса (как и при ЦМВ-инфекцией) [29]. Резистентость к проводимой терапии инфекции ВГЧ-6 - редкое явление, однако в контексте сочетания этого вируса с ЦМВ-инфекцией возможна невосприимчивость к стандартному лечению. Для установления алгоритма лечения необходимы рандомизированные исследования [30]. Профилактическое лечение ганцикловиром может предупредить реактивацию ВГЧ-6 [31], у больных после алло-ТКМ не во всех случаях превентивная терапия оказалась успешной [32]. В настоящее время нет консенсуса, определяющего адекватные превентивные методы терапии герпесвирусной инфекции 6-го типа [14].
Цель работы - оценить частоту встречаемости ВГЧ-6 у иммунокомпрометированных больных и определить оптимальную тактику терапии.
Russian Journal of Hematology and Transfusiology. 2017; 62(4)
Материалы и методы
У всех больных исследовали биологические жидкости в зависимости от клинических проявлений (кровь, костный мозг, БАЛ, моча, кал, спинномозговая жидкость, слюна), а также у 2 больных исследовали дополнительно биоптат кожи на выявление ДНК ВГЧ-6 при наличии инфекционных осложнений без подтвержденной бактериальной/грибковой инфекции, высокой лихорадки, длительной нейтропении в периоде глубокой имму-носупрессии (после курсов химиотерапии и после ауто-ТГСК крови в период нейтропении).
Статистическую обработку данных, проверку независимости качественных признаков осуществляли с помощью критерия Пирсона. Независимыми считали признаки при р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Читайте также:


