Вирус и иммунный белок
Глюкоза помогает синтезировать иммунные сигналы, стимулирующие противовирусное воспаление.
Мы часто слышим, что пациенты с новым коронавирусом страдают от слишком сильного иммунного ответа – защитная иммунная реакция начинает вредить незаражённым тканям, что особенно опасно при хронических заболеваниях. Но такой неоправданно сильный иммунный ответ имеет место не только при коронавирусной инфекции, но и, например, при гриппе. Более того, иммунитет порой продолжает бушевать даже после того, как инфекция пошла на спад.
Мы говорили, что так может происходить оттого, что вирус долгое время остаётся незамеченным: некоторые коронавирусы умеют подавлять сигналы тревоги от заражённых клеток. Другая причина может быть в особенностях самой иммунной системы: как известно, в иммунитет встроены самоограничители, которые регулируют силу иммунных реакций, стараясь, чтобы они были адекватны угрозе. Если есть проблемы с клетками и молекулами, которые работают регуляторами-ограничителями, то есть большая вероятность, что иммунная система при первой возможности пойдёт вразнос.
И ещё одна причина слишком сильного иммунного ответа связана с особенностями обмена веществ. Этот слишком сильный иммунный ответ развивается оттого, что повышается уровень сигнальных белков-цитокинов: их становится всё больше и больше, воспаление всё усиливается и усиливается, иммунные клетки, которые выделяют токсичные вещества для убийства заражённых клеток, выделяют их всё больше и больше, убивая здоровые клетки. Повышенный уровень воспалительных цитокинов и последствия, к которым это приводит, называют цитокиновым штормом.
Но ведь воспалительные цитокины тоже откуда-то берутся – их синтезируют клетки в ответ на вирусную инфекцию. Цитокины, как и любые белки, закодированы в ДНК. Гены цитокинов, как и любые другие гены, могут быть более активными и менее активными. Активность генов зависит от специальных регуляторных белков, называемых транскрипционными факторами: они садятся на ДНК в начале гена и взаимодействуют с белками, которые синтезируют РНК – которая потом пойдёт в цитоплазму и станет матрицей для сборки белков. Синтез РНК называется транскрипцией, и белки-транскрипционные факторы могут транскрипцию подавлять или усиливать.
На генах воспалительных цитокинов транскрипцию усиливает фактор под названием IRF5, или интерферон-регулирующий фактор 5. Но и сам IRF5 тоже может быть активным или неактивным. Сотрудники Уханьского университета пишут в Science Advances, что IRF5 становится активным, когда к нему присоединяется молекула под названием уридиндифосфат-N-ацетилглюкозамин, или UDP-GlcNAc. Исследователи экспериментировали с мышами, которых после заражения вирусом гриппа ждал цитокиновый шторм – но если у мышей отключали ген фермента, который активировал IRF5, то мыши переносили инфекцию спокойно (как, кстати, и при отключении гена самого IRF5).
Откуда берётся UDP-GlcNAc – активатор IRF5? Он берётся из серии метаболических реакций, которые называются гексозаминовым путём. Синтез UDP-GlcNAc начинается с глюкозы, и тут становится понятно, как связаны вирусная инфекция и слишком сильная иммунная реакция на неё. И вирусу, и иммунным клеткам нужно много глюкозы: во-первых, это источник энергии, во-вторых, она нужна для реакций, в которых создаётся строительное сырьё для более сложных молекул. Но чем больше глюкозы поступает в клетки, тем активнее идут и гексозаминовые реакции, увенчивающиеся UDP-GlcNAc. С одной стороны, всё правильно: против вируса нужны активные действия, и, следовательно, нужны иммунные сигналы-цитокины. С другой стороны, инфекция может уже идти на спад, а IRF5 будет продолжать стимулировать синтез цитокинов, потому что сам будет активирован UDP-GlcNAc.
Как можно догадаться, повышенный уровень глюкозы в крови будет здесь серьёзным фактором риска. Уровень глюкозы повышается при диабете, и хотя при диабете ей трудно проникать в клетки (из-за проблем с инсулином), всё же, если глюкозы оказывается слишком много, она может чрезмерно разогнать реакции синтеза UDP-GlcNAc, и клетка получит слишком активный IRF5.
Больные диабетом действительно часто умирают от осложнений при гриппе и нынешнем COVID-19; и возможно, что и при COVID-19 происходит такая же сахарно-метаболическая переактивация иммунитета. Вероятно, здесь помогли бы средства, снижающие уровень глюкозы, или подавляющие гексозаминовый путь, или же снижающие активность того фермента, который с помощью UDP-GlcNAc активирует IRF5; при этом такие средства, конечно, не должны успокаивать иммунную систему настолько, чтобы она вообще перестала бороться с инфекцией.
Пост скопирован с Яндекс Дзена:
Со временем вирусы мутируют в лёгкую форму и живут с нами, во многом даже помогая организму. Пример тому - коронавирус долго жил мирно в животных. Сейчас он просто перепрыгнул на человека. Ему нужно время, чтобы снизить свою активность и перестать убивать нас, то есть его среду обитания.
Начну с того, что вирусы всегда находятся в нашем организме, и мы от этого не умираем!* Среда обитания людей - "организм" Земля, среда обитания вирусов - организм человека. И люди, и вирусы могут чрезмерно паразитировать в своей среде, или нет. Если да, то организм перестаёт жить. Такова природа жизни.
Наш иммунитет, если он работает как надо, не даёт бесконтрольно паразитировать вирусам. А работает он как надо почти у всех людей.
Если вы здоровы, молоды и уверены, что ваш защитник иммунитет справится, то укрепляйте его(закаляйтесь и т. п.), а не мешайте ему таблетками и прочим. Ничего лишнего, природа уже обо всём позаботилась.
Коронавирус не хочет нас убивать. Ему просто нужно местечко для существования. Его цель размножиться. Но он может делать это слишком активно, что его среда обитания, организм, гибнет.
*например, много людей переносят туберкулёз, но не в форме прямо болезни-болезни
В эти дни, когда у вас много свободного времени, постарайтесь сделать что-то полезное, неважно что, неважно насколько.
Статья написана после просмотра этого видео:

Лимоны из солнечного Узбекистана
Сегодня был в магазине Глобус. Имбиря вообще нет, лимоны только одного сорта по цене мраморной говядины.

Вирусы. Часть 2 и 3
часть 2. Чужой внутри нас.
Человек — вершина эволюции. Десятки тысяч лет эффективного приспособления привели нас на вершину пищевой цепи. Насколько непоколебимо наше положение? Блага цивилизации позволили создать значительное конкурентное преимущество над другими видами. Но за пределами видимого мира, которым верховодит наш научно-технический прогресс, скрывается еще один, неведомый глазу микромир, где превосходство человека не так очевидно. Это самое густонаселенное место планеты, мириады обитателей которого не прочь поживиться за наш счет. Кто победит в этой борьбе, тот и будет править всем. Станет ли мы пищей, либо сможем диктовать правила -- это зависит от нашей иммунной системы.
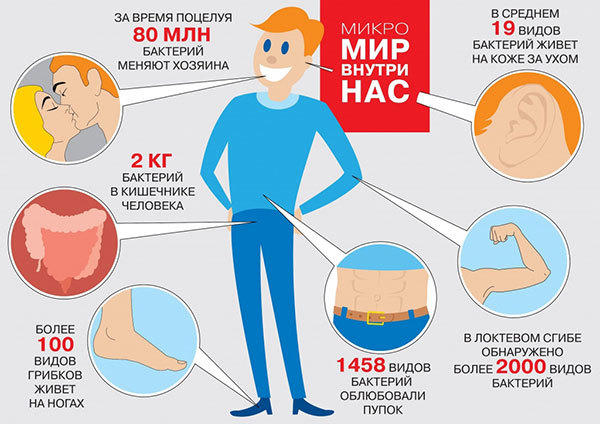
Городские улицы. Бесконечные вереницы вечно спешащих горожан изо дня в день идут по знакомым маршрутам. Утром в тесном метро и автобусах, вечером -- в парках и скверах. Работа -- развлечения -- дом. Каждое мгновение жизни нас окружают десятки тысяч невидимых обитателей -- бактерии, водоросли, дрожжи, простейшие, споры грибов и вирусы. В здании популярного торгового центра или большого офиса может распологаться до 20 тысяч микроорганизмов на 1 кубический метр воздуха. На улице -- около 5 тысяч. На ферме или за городом -- до 2 миллионов микроорганизмов на 1 куб.м. Их настолько много, что они даже внутри нас. И многие из этих незваных гостей абсолютно не против такого соседства. На человеке эффективно паразитирует более тысячи различных видов микроорганизмов. Их самые любимые места -- кисти рук и заушные впадины, а также полость рта (около 20% от всех обитателей). Все это разнообразие жизни на человеке называют микробиомом кожи. По нему можно определить образ жизни и наше место обитания. Всю микрофлору, обитающую на человеке, разделяют на постоянную – резидентную (около 90 % обитателей), факультативную (условно-патогенную) – около 9,5 % и случайную (транзиторную) – 0,5 %. За тысячелетия совместной жизни резидентная микрофлора вполне научилась сосуществовать с нами, не причиняя очевидного ущерба, либо даже выполняя полезные функции. С остальными 10% все не так однозначно.
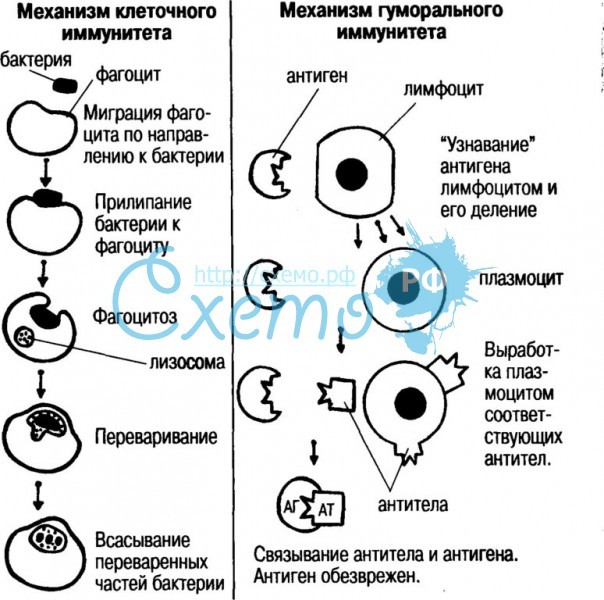
Все микроорганизмы, паразитирующие на нашем теле, принято разделять на две категории -- внеклеточные и внутриклеточные. Как не сложно догадаться, к внеклеточным паразитам относятся микроорганизмы, которые не могут проникнуть внутрь нашей клетки -- это крупные бактерии, грибки, токсины и даже другие животные. Они стремятся поселиться на нашей коже, либо в каких-нибудь органах и тканях, перемещаясь по телу благодаря системе кровообращения. Для борьбы с ними мать-природа создала достаточно эффективные механизмы -- кожный гомеостаз и гуморальный иммунитет.
Иммунитет — одна из самых древних систем, присущих живым организмам, возникшая более миллиарда лет назад, задолго до разделения животных и растений на отдельные царства. Первыми микроорганизмами, обладающими иммунной системой, на данный момент, считаются социальные амебы Dictyostelium discoideum. История ее появления достаточно интересна.
Социальные амебы Dictyostelium discoideum представляют собой организмы, образующиеся при слиянии одиночных амеб, которые при недостатке еды сползаются вместе и формируют плазмодий более чем из 100 тыс. клеток. При этом примерно 20% клеток жертвуют собой, чтобы создать плодоножки, а 80% становятся спорами. Около 1% сохраняет свои фагоцитарные функции и становятся иммунной системой, используя фагоцитоз (процесс захвата и переваривания клеткой твердых частиц) и сетки ДНК для уничтожения бактерий, которые поставили бы под угрозу выживание единого организма.
Фагоцитоз является основой клеточного иммунитета -- одной из двух основных форм иммунного ответа, наравне с гуморальным, присущим живым организмам в целом, и человеку в частности .
Кожный покров является первым барьером на пути микроорганизмов. Переднюю линию обороны на нем составляют уже обитающие там резидентные микроорганизмы. Наша кожа -- слишком густонаселенной место и ее постоянные жители отнюдь не в восторге от мысли, что им приедятся потесниться, вступают с пришельцами в ожесточенное противостояние. Если они не справляются, приходит черед кожного гомеостаза. Данный иммунный механизм изучен достаточно слабо, но мы знаем, что кожа полагается на непрерывное удаления мертвых клеток.
Если внеклеточные паразиты все же попадают в наш организм, проникая через повреждения кожи и слизистые оболочки, при дыхании или с едой, в бой вступает гуморальный иммунитет. В общем понимании, он представляет собой естественную реакцию организма на раздражитель (бактерии, грибки, токсины, животные-паразиты), попавший в кровь. Если опустить все детали и сильно обобщить, то говоря о работе гуморального иммунитета, мы подразумеваем создание антител, направленных на уничтожение инородного материала (антиген) в кровотоке. В этом нам помогают группы белков, гликопротеинов и полипептидов, выполняющих ферментативные, рецепторные и сигнальные функции:

Кроме внеклеточных патогенов, нам постоянно приходится сталкиваться с еще одним видом внешней угрозы -- внутриклеточным. Вирусы - это внутриклеточные паразиты, не проявляющие за пределами живой клетки никаких своих свойств. Проникнув в клетку, вирус изменяет в ней обмен веществ, направляя всю ее деятельность на производство вирусной нуклеиновой кислоты и белков, чтобы начать процесс репликации -- производства собственных копий. В организме среднестатистического жителя планеты Земля одновременно обитает от 5 до 15 вирусов. Они могут жить в клетках организма от нескольких часов до 7 дней, активно размножаясь и никак не давая о себе знать. Такие вирусы называют "спящими", а период их незаметного нахождения в организме "инкубационным".
Жар, кашель, светобоязнь, головная боль и слабость — это далеко не полный список симптомов самого распространенного заболевания в истории человечества — ОРВИ (острая респираторно-вирусная инфекция). Это группа заболеваний, вызванных вирусами, куда включают грипп (типа A, B и С), парагрипп, аденовирусную инфекцию и другие вирусные инфекции верхних дыхательных путей.
ОРЗ (острое респираторное заболевание) -- широкое понятие, включающее в себя заболевания верхних дыхательных путей, вызванные бактериями и вирусами. Когда же мы говорим об ОРВИ, то речь всегда идёт только о вирусной инфекции. На раннем этапе симптомы ОРВИ вирусного происхождения и ОРЗ бактериального происхождения зачастую очень похожи. При этом ОРВИ, будучи вирусной инфекцией, на поздних этапах своего течения проявляется, как правило, более выраженными симптомами: высокой температурой, ознобом, сильной головной болью, болями в мышцах и суставах
Часть 3. Незримый страж. Врожденный иммунитет.
Взаимодополняющая работа клеточного и гуморального иммунитета является гарантией нашей выживаемости в борьбе с вирусами и другими микроорганизмами. Но для начала разберемся, как работает наш иммунитет.
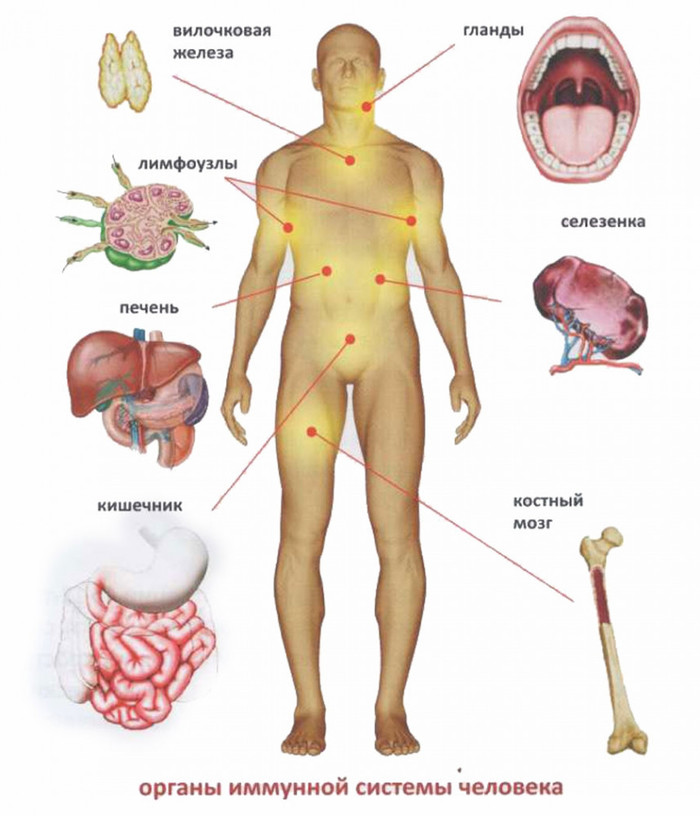
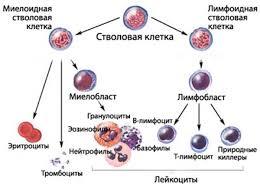
Основой человеческого иммунитета является костный мозг. Именно там образуются иммунные клетки, в дальнейшем поступающие в места своего хранения -- лимфатические узлы, селезенку и другие органы. Нейтрофилы и моноциты создаются в своем окончательном варианте и сразу отправляются в кровь. Но есть такие клетки, которым приходится проделать более долгий путь. Речь идет о лимфоцитах, которые выходя из костного мозга поступают в еще один важный орган иммунной системы -- тимус.
Тимус — это вилочковая железа, образование, которое лежит на сердце и осуществляет функцию по отбору лучших лимфоцитов. Дело в том, что лимфоциты в одинаковой мере способны реагировать как на клетки собственного организма, так и на чужеродные микроорганизмы. Поэтому тимус уничтожает все лимфоциты, которые чересчур сильно реагируют на свое. Так запускается природный механизм отрицательной селекции, в результате работы которого гибнет около 95% созданных костным мозгом лимцофитов.
Что происходит, когда патоген попадает в наш организм? Все защитные факторы нашего организма можно разделить на врожденные (неспецифические или наследственные) и приобретенные (адаптивные). Первые представляют собой глубокий пласт иммунной системы, сформированный в процессе эволюции. Он защищает нас с самого рождения и позволяет не болеть рядом заболеваний, присущих животным и растениям (например, чумка собак или грибковые поражения растений). Врожденный иммунитет представляет собой первую линию защиты, моментально вступая в бой и позволяя выиграть время, чтобы наше тело смогло изучить геном патогена и выработать специфические антитела. Первыми удар принимают клетки-разведчики -- дендриты.
Один тип дендритных клеток позволяет вирусам проникнуть в свою структуру и начать процесс репликации -- воспроизводства вирусного РНК/ДНК. В то же время другой тип дендритных клеток подхватывает эти фрагменты и использует их для обучения Т-клеток иммунитета борьбе с этим вирусом. При этом, главной загадкой дендритных клеток является то, что при этом они не гибнут и не заражаются, как это происходит с обычными клетками.
Пока адаптивный иммунитет готовит на основе данных, полученных от дендритов, специфические антитела, способные бороться именно с этим видом микроорганизмов, врожденная иммунная система всеми силами старается выиграть время и не дать агрессору разгуляться. На переднем краю обороны оказываются фагоциты. Фагоциты -- большущие (по меркам микромира) клетки-пожиратели, которые регулярно защищают наш организм от внеклеточных бактерий, неправильно работающих клеток организма и отходов клеточной жизнедеятельности. Их главное оружие -- поедание врага. Заключенная в фагоцит бактерия (они способны поглотить любое вещество) погибает в течении нескольких минут. Фагоциты эффективны против внеклеточных бактерий, но против вирусов слабы, т.к. вирусы орудуют в собственных клетках организма. Поэтому основную нагрузку по борьбе с вирусом принимают лимфоциты, уничтожающие зараженные клетки, в то время как фагоциты выводят из организма их остатки.
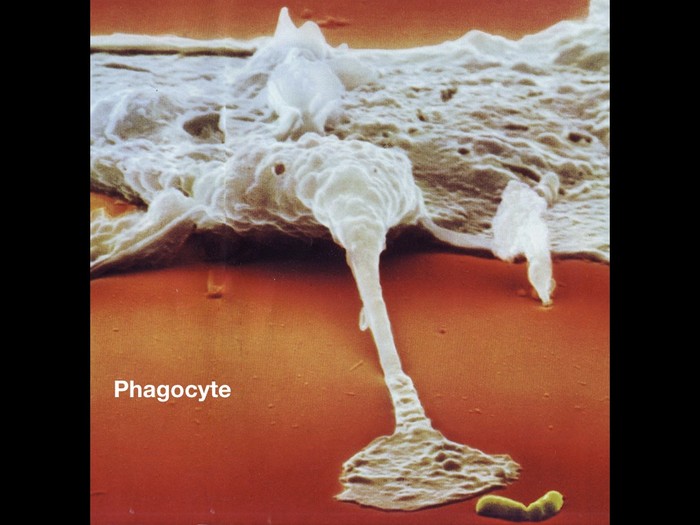
Рядом с фагоцитами, плечом к плечу, идут "система комплимента" и "естественные киллеры".
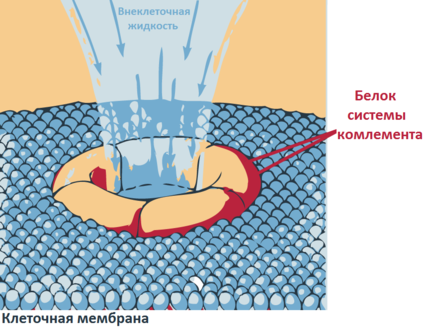
Система комплемента — комплекс сложных белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов (расщепляют пептидную связь между аминокислотами в белках), предназначенная для гуморальной защиты организма от действия чужеродных агентов в кровотоке.
Простыми словами, система комплемента работает следующим образом: определенные белки прикрепляются к чужеродным клеткам и начинают делать в них дырки (лизис), разрушая оболочку. Если фагоциты являются частью клеточного врожденного иммунитета, то система комплимента относится к гуморальному врожденному иммунитету. Система комплемента может действовать тремя различными способами:
1) через хемотаксис: различные компоненты (факторы) комплемента могут привлекать иммунные клетки, которые атакуют бактерии и пожирают их (фагоцитируют)
2) через лизис: компоненты комплемента присоединяются к бактериальным мембранам, в результате чего образуется отверстие в мембране и бактерия лизируется (разрушается)
3) через опсонизацию: компоненты комплемента присоединяются к бактерии, в результате чего образуется метка для узнавания фагоцитирующими клетками (например, макрофагами и лейкоцитами), имеющими рецепторы к компонентам комплемента
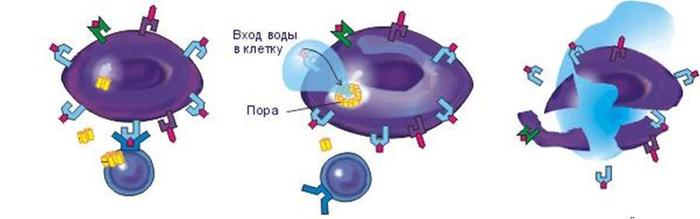
Следующие герой -- естественный киллер (NK) -- клетки врожденного иммунитета, способные убивать опухолевые клетки или клетки, зараженные вирусами. Они образуются из клеток-предшественников (рождаются в костном мозге) в различных тканях и органах (лимфатических узлах, селезенке, печени, кишечнике, тимусе, матке и других). Естественные киллеры важны для защиты от внутриклеточных инфекций, например вирусов, и для защиты от опухолей. Если этот механизм защиты нарушен, люди страдают рецидивирующими вирусными инфекциями, у них повышена вероятность возникновения опухолей. Механизм их работы таков:
В качестве ядов естественные киллеры используют несколько белков: перфорин, гранзим и гранулизин. Киллер образует герметичный контакт с клеткой-жертвой и внутрь этого герметичного просвета между клетками выделяет яд, который убивает неправильную клетку. Сама клетка-киллер защищена от этого яда. В качестве ядов естественные киллеры используют несколько белков: перфорин, гранзим и гранулизин.
Перфорин встраивается во внешнюю мембрану клетки-жертвы и образует в мембране поры, через которые проходят гранзим и гранулизин. Они входят в клетку, включают ее механизм апоптоза — самоликвидации. В течение 10–20 минут клетка переварит свое содержимое до простейших молекул и упакует эти безопасные останки в небольшие мешочки, которые охотно съедят фагоциты. Так очень аккуратно, не навредив соседним, здоровым клеткам, инфицированная или опухолевая клетка самоликвидируется по команде клетки-киллера. Естественный киллер — серийный убийца, он может поразить 30–40 клеток-мишеней подряд.
Как естественные киллеры находят клетки, которые надо убить? Дело в молекулярных витринах (молекулах MCH).
Каждая клетка организма представляет на своей поверхности элементы того, что синтезируется внутри клетки. Это необходимо, чтобы иммунитет мог обнаружить любые болезненные изменения в каждой клетке организма — признаки чужих, инфекционных молекул или собственные молекулы, существенно измененные в результате мутаций. Довольно часто инфицированные и опухолевые клетки прячут признаки болезни, не показывая на поверхности молекулы-витрины. Сенсоры естественных киллеров следят за тем, чтобы на поверхности каждой клетки организма обязательно были представлены молекулы-витринки. Отсутствие или существенное снижение количества MHC-молекул (витринок) на клетке рассматривается естественным киллером как признак, достаточный для смертного приговора.
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
- Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. - СПб, 2003.
- Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. - СПб, 2003.
- Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. СПб, 2007. - 254 с.
- Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. - М., 2006. - С.226-247.
- Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. - М., 2005. - С.159-175.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М., 2005. - С.287-292.
- Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. - М., 2002.
- Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. - М., 2004. - С.5-9.
- Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
- Романцов М.Г., Ершов Ф.И.Часто болеющие дети: Современная фармакотерапия. - М., 2006. - 192 с.
- Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. - Санкт-Петербург. - 2004. - С.82-95.
- Лекарственные средства в фармакотерапии патологии клетки / под ред. Т.Г.Кожока. - М., 2007.
Читайте также:


