Вирус из клеток vero
Однако, вероятность того, что ДНК из постоянных клеточных линий способна вызывать опухоли у людей, считается крайне низкой. Даже подкожное введение людям больших количеств клеток HeLa не сопровождалось канцерогенным действием. Анализ имеющихся экспериментальных данных показывает, что концентрация ДНК в культуральных жидкостях постоянных линий клеток гораздо ниже возможных трансформирующих уровней.
Совещание экспертов ВОЗ в Лондоне в 1989 г. определило, что предельное содержание гетерогенной ДНК (из клеточных систем и сконструированных векторов) в одной парентеральной дозе вакцин медицинского назначения не должно превышать 100 пкг. Подкожное введение 2 мкг ДНК вируса полиомы вызывает образование опухолей у 50% чувствительных животных. 100 пкг гетерогенной ДНК составляет 0,5х10-4 туморогенной дозы. Контаминирующая ДНК способна подавлять супрессорные гены или активировать протоонкогены после интеграции в клеточный геном. Риск мало зависит от происхождения контаминирующей ДНК. Все последовательности ДНК, обладающие характеристиками сильных промоторов, могут после рекомбинации создавать одинаковый риск.
Вероятность присутствия опасной активности на 1 молекулу ДНК составляет 10 -6 —10 -19 . Особую опасность могут представлять многокопийные плазмиды, амплифицированные сильные промоторные последовательности. Белковые контаминанты с коротким сроком жизни представляют меньший риск. Таким образом, принято считать, что риск, связанный с примесью гетерогенной клеточной ДНК, ничтожен, если ее количество не превышает 100 пкг в одной дозе препарата, вводимого парентерально. При оральном применении вакцины этот риск еще более снижается. Агенты, применяемые для инактивации вирусов в вакцинах, могут снижать или устранять биологическую активность гетерогенной клеточной ДНК, повышая тем самым их безопасность даже в тех случаях, когда количество ДНК в дозе вакцины, вводимой парентерально, превышает 100 пкг.
Кроме того, современные методы очистки вирусных препаратов позволяют снизить содержание клеточной ДНК до уровня, при котором ее присутствие даже теоретически не представляет опасности. Высокая степень очистки от клеточной ДНК (10 пкг/мл) достигнута при изготовлении лимфобластоидного интерферона, вакцины против полиомиелита на клетках Vero и поверхностного антигена вируса гепатита В в клетках СНО.
Риск, обусловленный вирусной контаминацией постоянных линий клеток может быть связан с полными вирусами, механизм репликации которых известен, вирусными частицами, напоминающими ретро-вирусы типа А, а также вирусными генами, интегрированными в ДНК таких клеток. При использовании постоянных клеточных линий для снижения или устранения риска вирусной контаминации следует, прежде всего, применять систему посевных клеток.
Создание резервных запасов постоянных линий клеток, проверенных в соответствии с требованиями ВОЗ (1982, 1987 гг.), является необходимым условием производства лицензированных вакцин. Предполагаемый риск, связанный с белками, кодируемыми онкогенами постоянных линий клеток, ограничен лишь факторами роста, действие которых транзисторно и обратимо. В обнаруживаемых концентрациях они не представляют серьезной опасности и, кроме того, многие из них быстро разрушаются.
Методы контроля должны гарантировать отсутствие в конечном препарате биологически активных количеств потенциально онкогенных примесей (гетерогенная ДНК, трансформирующие белки, эндогенные вирусы). Исследовательские группы, рассматривавшие проблему приготовления медицинских иммунобиологических препаратов, пришли к заключению, что несмотря на существование потенциального риска, данные, подтверждающие безопасность препаратов, оправдывают их применение.
В настоящее время в ряде стран широко используют постоянные линии клеток для изготовления медицинских биопрепаратов. Использование постоянных линий клеток в качестве субстрата в производстве вирусных вакцин имеет ряд преимуществ. Они не требуют сложных условий культивирования, их можно выращивать в промышленных культиваторах и ферментерах, хорошо изучить и охарактеризовать, а маточные расплодки, свободные от контаминации эндогенными и экзогенными вирусами, длительно хранить при низкой температуре. Многие ученые считают, что приготовление вакцин с использованием клеток Vero по сравнению с первичными культурами клеток почек обезьян, представляет меньший риск вирусной контаминации. Накапливается все больше данных, что клетки Vero и ВНК-21 - безопасные субстраты для производства медицинских биопрепаратов.
Клетки Vero не обладали туморогенными свойствами, а клетки ВНК-21 (клон 13) оставались кариологически стабильными в течение 52 пассажей.
Изучение чистоты и биологической безопасности белка клеток показало отсутствие посторонних вирусов, а также следов вирусных последовательностей в геноме клеток Vero.
Клетки Vero используют в производстве вакцин против полиомиелита и бешенства человека. Инактивированная полиовакцина улучшенного качества лицензирована в 1982 г., в последующие 5 лет ею было привито более 20 млн. детей без побочного эффекта. В 1988 г. ее производство составило 60 млн. доз. Инактивированная вакцина против бешенства лицензирована в 1985 г. В последующий период были использованы сотни тысяч доз вакцины при низком уровне клинических реакций. Успешно завершились широкомасштабные клинические испытания живой полиовакцины для орального применения из вируса, размноженного в клетках Vero.
В 1987 г. во Франции лицензирована компонентная вакцина против гепатита В, изготавливаемая на основе рекомбинантной линии клеток СНО. В Великобритании, Японии и Китае получали интерферон в культуре постоянной линии клеток Namalva.
В связи с возможностью клинического применения моноклональных антител, актуальность приобретает культивирование таких клеток в больших масштабах. Предварительные результаты показывают, что непрерывное крупномасштабное культивирование гибридом в свободной суспензионной культуре в сочетании с непрерывным диализом культуральной среды может дать хороший урожай секретируемых антител (100—140 мг/л). При крупномасштабном производстве один работающий 1000-литровый ферментер фирмы Celltech может обеспечить получение килограммовых количеств моноклональных антител. Кроме того, гибридные клеточные линии сами по себе могут быть использованы в качестве субстрата для репродукции вирусов.
Таким образом, только пересмотр существующих ограничений по применению тканевых культуральных систем для производства вирусных вакцин позволяет использовать индустриальные методы массового выращивания вирусов на основе суспензионного культивирования - подобно тому, как это делают в микробиологической промышленности. Ученых, работающих в этой области, не обескураживают даже очевидные успехи генной инженерии. Многие ученые считают, что генная инженерия с использованием микроорганизмов может упразднить проблемы, связанные с развитием и использованием массового культивирования клеток животных, и поэтому технология, основанная на их применении, не имеет будущего. Однако в конкуренции традиционной и новой технологий изготовления вирусных препаратов, где решающее значение имеет качество конечного продукта, обнаружились непредвиденные обстоятельства.
Во-первых, при попытке экспрессии вирусных генов в прокариотических организмах не всегда получены удовлетворительные практические результаты.
Во-вторых, с тех пор как стало возможным клонировать в клетках животных гены, кодирующие вирусные белки, важность крупномасштабного производства клеточных культур еще более возросла. Данные обстоятельства позволили выразить надежду, что биотехнология клеток животных сохранит свою авангардную роль.
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Генералов Сергей Вячеславович, Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г.
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Генералов Сергей Вячеславович, Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г.
A STUDY OF THE ULTRASTRUCTURE OF THE SURFACE OF THE TRANSPLANTABLE LINE VERO CELLS INFECTED WITH THE RABIES VIRUS (RABV, LISSAVIRUS, RHABDOVIRIDAE)
Генералов С.В., Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г., Никифоров А.К., Щербакова С.А.
изучение ультраструктуры поверхности клеток линии vero,
инфицированных вирусом бешенства (rabv, LISSAVIRUS, rhabdoviridae)
Ключевые слова: вирус бешенства; клеточная культура Vero; атомно-силовая микроскопия; шероховатость,
ультраструктура поверхности клетки. Для цитирования: Генералов С.В., Ерохин П.С., Красовская Т.Ю., Осина Н.А., Абрамова Е.Г., Никифоров А.К., Щербакова С.А. Изучение ультраструктуры поверхности клеток линии Vero, инфицированных вирусом бешенства (RABV, Lissavirus, Rhabdoviridae). Вопросы вирусологии. 2017; 62(5): 227-232.
Generalov S.V., Erokhin P.S., Krasovskaya T.Yu., Osina N.A., Abramova E.G., Nikiforov A.K.,
A STUDY OF THE ULTRASTRUCTURE OF THE SURFACE OF THE TRANSPLANTABLE LINE VERO CELLS INFECTED WITH THE RABIES VIRUS (RABV, LISSAVIRUS, RHABDOVIRIDAE)
K e y w o r d s: Rabies virus; cell culture Vero; atomic force microscopy; roughness; surface ultrastructure of cells.
Acknowledgments. The study had no sponsorship.
Conflict of interest. The authors declare no conflict of interest.
Received 03 February 2017 Accepted 28 February 2017
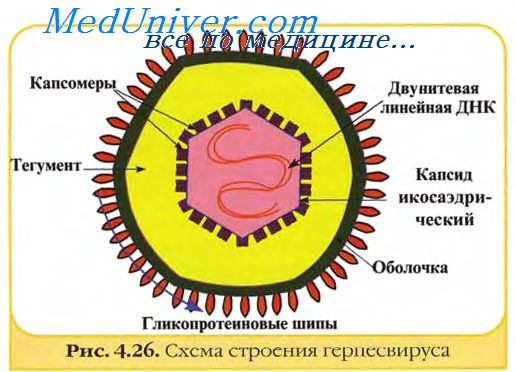
Вирус бешенства, принадлежащий к семейству Rhab-doviridae и роду Lyssavirus, способен вызывать смертельно опасное заболевание, характеризующееся поражением центральной нервной системы. Проникновение вируса бешенства в клетку происходит главным образом путем эндоцитоза, а размножение — в цитоплазме клеток восприимчивого организма или тканевой культуры [1]. При изучении взаимодействия вируса бешенства и клеточных культур экстраневрального происхождения методом фазово-контрастной микроскопии далеко не всегда наблюдается цитопатическое действие [2, 3], которое обычно предполагает деструктивные изменения отдельных клеток и клеточного монослоя. Тем не менее некоторые штаммы вируса бешенства проявляют цито-патические свойства, которые обнаруживаются методом фазово-контрастной микроскопии в поздние сроки культивирования вируса [4]. На наш взгляд, при исследовании цитопатического действия вируса бешенства методом фазово-контрастной микроскопии инфицированный клеточный монослой в ряде случаев сложно отличить от интактного, особенно в поздние сроки культивирования, когда происходит отмирание и не инфицированных вирусом клеток.
Более полную характеристику взаимодействия вируса с клеткой позволяют получить методы атомно-силовой микроскопии (АСМ), которые в последние годы находят все большее применение для изучения поверхностной структуры микрообъектов: бактерий [5—7], вирусов и эукариотических клеток [8—12]. Эта технология дает возможность изучить процессы, происходящие на поверхности микрообъектов (экспрессию биомолекул, адгезивные свойства, упругость и шероховатость) при различных условиях, а также оценить и описать изменение морфофункциональных характеристик микрообъекта в целом в зависимости от влияния различных условий (изменение pH, температуры, присутствие антибиотиков и т. д.) [5, 7]. Методы АСМ широко используются для изучения процессов взаимодействия вирусов как с эукариотическими, так и с прокариотическими клетками [6, 8—12].
Цель исследования заключалась в изучении изменения ультраструктуры поверхности клеток перевиваемой линии Vero, инфицированных вирусом бешенства, методом АСМ в зависимости от длительности и степени воздействия вируса на клетку.
Материал и методы
Культивирование клеток и вируса осуществляли на питательной среде Игла МЕМ с добавлением 10% сыворотки крупного рогатого скота (КРС) во флаконах с площадью поверхности 25 см2, а также 24- и 96-луночных
планшетах при 37°C и 5% CO2. Состояние клеточного монослоя оценивали методом фазово-контрастной микроскопии с помощью инвертированного микроскопа Биомед-3И (Россия). После формирования монослоя, занимающего от 80 до 90% ростовой поверхности, клетки открепляли от поверхности флакона раствором трипсина и версена, взятых в соотношении 1:2, и суспендировали в питательной среде. Затем к клеточной суспензии добавляли вируссодержащую жидкость. Для инфицирования клеток вирус вносили в дозе от 0,01 до 1 ИД50/кл. Конечная концентрация клеток при этом составляла от 1,5 • 105 до 2,2 • 105 кл/мл. Отрицательным контролем являлась культура клеток, подготовленная аналогичным образом, но без добавления вируссодержащей жидкости. Активность вируссодержащей жидкости (титр) и специфичность взаимодействия вируса с клеточной культурой Vero оценивали методом иммунофлюоресценции с помощью люминесцентного микроскопа Nikon (Япония) [13, 14]. Для окрашивания использовали специфичный к вирусу бешенства иммуноглобулин, меченный ФИТЦ (г. Владимир).
Атомно-силовая микроскопия. Исследования проводили с помощью сканирующего зондового микроскопа Solver P47-PRO (NT-MDT, Россия) в режиме прерывистого контакта полуконтактным методом и методом рассогласования [5]. При этом использовали кремниевые зонды серии NSG01 (NT-MDT, Россия) жесткостью 5,1 Н/м с радиусом кривизны 10 нм и резонансной частотой 150 кГц. Исследования проводили при оптимальных значениях основных параметров сканирования: амплитуды колебаний кантилевера Resonance 22 ед., начальной фазы его колебаний Phase 240°, скорости сканирования Frequency 0,75 Гц, коэффициента усиления цепи обратной связи FB Gain 0,3 ед., Set Point 19 ед. (величина Set Point и начальный уровень сигнала DFL определяли величину силы взаимодействия зонда с поверхностью образца). Среднюю арифметическую шероховатости поверхности клеточной стенки определяли методом Roughness analysis по 10 значениям, полученным в эксперименте, с указанием абсолютной погрешности [7].
Образцы для исследования методом АСМ готовили следующим образом. В стерильную пробирку из флакона переносили питательную среду, на которой культивировали клетки. Затем клетки промывали раствором DPBS, открепляли раствором трипсина и версена (1:2) и переносили в указанную пробирку. После центрифугирования при 1500 об/мин удаляли супернатант, а осадок для фиксации суспендировали в растворе глутарового альдегида (2,5%) и инкубировали в течение 2 ч при 4°C. Затем клетки осаждали центрифугированием в течение 5 мин при 1500 об/мин, удаляли надосадочную жидкость и добавляли бидистиллированную воду в объеме 1 мл, ресуспендировали и повторно центрифугировали. На покровное стекло наносили 4 мкл суспензии и высушивали при комнатной температуре.
Обработку и анализ изображений проводили с использованием программы Image Analysis (NT-MDT, Россия). Статистическую обработку результатов осуществляли с помощью программ Nova (NT-MDT, Россия), Microsoft Excel.
На первом этапе эксперимента оценивали динамику изменений исследуемых параметров с момента инфицирования клеточного монослоя до гибели клеток. Среднее время наблюдения составляло 96 ч.
Рис. 1. Фазово-контрастная микроскопия интактного и инфицированного вирусом бешенства монослоя клеточной культуры Vero (ув. 100): а — интактный монослой (отрицательный контроль), 72 ч культивирования; б — интактный монослой (отрицательный контроль), 96 ч культивирования; в — инфицированный монослой, 72 ч культивирования; г — инфицированный монослой, 96 ч
При оценке клеточного монослоя методом фазово-контрастной микроскопии через 48 ч культивирования не установлено различий между интактными и инфицированными клетками. Начало отмирания клеток инфицированного монослоя регистрировали на 3—4-е сутки культивирования (рис. 1). В интактном монослое мертвые клетки появлялись на 1 или 2 сут позже, при этом процесс отмирания инфицированного клеточного монослоя происходил быстрее. Методом люминесцентной микроскопии обнаруживали появление фокусов флюоресценции в инфицированном монослое через 48 ч после заражения, что свидетельствовало о репродукции вируса в клетке (рис. 2).
При анализе клеток Vero методом АСМ установлено, что вирус бешенства вызывал изменение ультраструктуры поверхности клетки (рис. 3). Уже после нескольких часов инфицирования на поверхности клетки регистрировали изменения, вызванные адсорбцией вируса и его внедрением в клетку. Через несколько суток после инфицирования наблюдали выпячивания клеточной мембраны, разрушения мембранной границы и экструзию содержимого клетки. Размеры инфицированной клетки варьировали на протяжении всего периода наблюдения в сторону как увеличения, так и
уменьшения, превышая при этом размеры интактной клетки (табл. 1).
Значения шероховатости клеточной стенки возрастали при воздействии вируса бешенства на протяжении всего эксперимента начиная с первых часов взаимодействия вируса с клеткой (рис. 4).
В первые 4 ч значение шероховатости инфицированных клеток возрастало в 2,5 раза относительно интактных клеток. К завершению эксперимента шероховатость инфицированных клеток увеличивалась более чем в 8 раз относительно исходного значения. При этом у интактных клеток Vero происходило незначительное изменение шероховатости. Таким образом, возраст культуры практически не оказывал влияния на состояние шероховатости клеточной мембраны.
Следующим этапом эксперимента являлся анализ изменений исследуемых параметров в зависимости от дозы вируса. Для заражения клеток использовали вируссо-держащую жидкость, активность которой составила 4,8 lg ИД50/мл. Из указанной вируссодержащей жидкости готовили серию десятикратных разведений на питательной среде Игла МЕМ с 10% содержанием сыворотки
ЦП Щя-'jf ■ TIL Ik i .^j-L^rr " P- ДГ*• ' <¡fat
ir. ЗтЖШтЦк. те-Ж''^ Ж SMEfiHo* *5¡lr «¿¿to:
Рис. 2. Люминесцентная микроскопия интактного (а) и инфицированного вирусом бешенства монослоя (б) клеточной культуры Vero после 48 ч культивирования (ув. 200; окрашивание специфической сывороткой, меченной ФИТЦ).
Рис. 3. АСМ интактного и инфицированного вирусом бешенства монослоя клеточной культуры Vero: а, г — интактные клетки Vero (отрицательный контроль) после 72 ч культивирования; б, д — клетки Vero через 4 ч после инфицирования; в, е — клетки Vero
через 72 ч после инфицирования. Стрелками показаны изменения на поверхности клеток, вызванные вирусом бешенства.
КРС в разведениях от 100 до 10-7. Затем к вируссодержа-щей жидкости в указанных выше разведениях добавляли клеточную суспензию до конечной концентрации от 0,5 • 105 до 1,0 • 105 кл/мл. Значения геометрических размеров клетки и шероховатости поверхности клеточной мембраны оценивали через 4 ч. Результаты представлены в табл. 2 и на рис. 5.
мой линии Vero способствовал изменению их размеров. Установлено, что увеличение инфицирующей дозы приводило к более резким изменениям геометрических размеров клеток. Следует отметить, что увеличение размеров эукариотических клеток при их взаимодействии с вирусами, зарегистрированное методами АСМ, описано в ряде работ [10, 11]. Так, G. Lee и соавт. [10] наблюдали увеличение диаметра и периметра клеток Sf9 при инфицировании бакуловирусами, M. Moloney и соавт. [11] описывают увеличение геометрических размеров клетки BHK-21, инфицированной вирусами леса Семлики и энцефаломиелита мышей. Увеличение размеров ин-
Время, ч Длина (M ± m), мкм Ширина (М± m), мкм Высота (M ± m), мкм
интактные клетки инфицированные клетки интактные клетки инфицированные клетки интактные клетки инфицированные клетки
0 8,5 ± 0,8 8,5 ± 0,8 2,5 ± 0,1 2,5 ± 0,1 0,80 ± 0,01 0,80 ± 0,01
1 8,5 ± 0,9 8,5 ± 0,7 3,0 ± 0,1 5,5 ± 0,2 1,70 ± 0,03 2,00 ± 0,01
4 9,0 ± 1,0 9,5 ± 1,1 5,5 ± 0,2 4,3 ± 0,1 1,90 ± 0,02 1,60 ± 0,01
24 13,0 ± 0,5 25,0 ± 1,1 6,5 ± 0,3 8,0 ± 0,3 2,10 ± 0,02 3,20 ± 0,04
48 15,0 ± 0,9 23,0 ± 1,3 4,0 ± 0,2 8,5 ± 0,1 1,70 ± 0,02 8,50 ± 0,03
72 7,0 ± 0,5 12,5 ± 0,8 3,0 ± 0,1 7,5 ± 0,2 1,40 ± 0,01 6,40 ± 0,02
96 7,0 ± 0,5 9,0 ± 0,5 3,2 ± 0,1 9,0 ± 0,3 2,20 ± 0,02 5,50 ± 0,04
Исследуемый образец Длина (M ± m), мкм Ширина (M ± m), мкм Высота (M ± m), мкм
Исходная (интактная) культура клеток Vero 7,0 ± 0,1 3,6 ± 0,1 0,80 ± 0,01
Отрицательный контроль(интактная культура клеток Vero) 6,0 ± 0,1 3,0 ± 0,1 0,80 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 100 41,0 ± 1,1 1,3 ± 0,1 2,8 ± 0,06
Культура клеток Vero, инфицированная вирусом в разведении 10-1 37,0 ± 1,5 9,2 ± 0,3 1,5 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-2 33,0 ± 1,0 11,5 ± 0,4 2,5 ± 0,04
Культура клеток Vero, инфицированная вирусом в разведении 10-3 18,0 ± 0,7 11,0 ± 0,2 2,5 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-4 12,0 ± 0,3 8,5 ± 0,2 1,7 ± 0,03
Культура клеток Vero, инфицированная вирусом в разведении 10-5 6,0 ± 0,1 2,5 ± 0,1 1,0 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 10-6 8,5 ± 0,3 3,5 ± 0,1 1,5 ± 0,01
Культура клеток Vero, инфицированная вирусом в разведении 10-7 6,5 ± 0,2 2,5 ± 0,1 1,7 ± 0,02
фицированной клетки, по-видимому, связано с изменением структуры клеточной мембраны и как следствие с нарушением водно-солевого обмена. Увеличение размеров клетки также может быть обусловлено изменениями строения цитоскелета, нарушением цикла деления клетки, накоплением и выходом вирусных частиц [9, 12].
Интересным фактом, выявленным при изучении поверхности инфицированной клетки Vero, является резкое возрастание ее шероховатости в течение первых часов после заражения. Значительное увеличение шероховатости, на наш взгляд, можно объяснить адсорбцией вируса и проникновением его в клетку, а дальнейшее повыше-
ние значений шероховатости связано с выходом вируса из клетки и разрушением мембраны. В аналогичных исследованиях, посвященных изучению взаимодействия вирусов с клетками методами АСМ, также зарегистрированы различные изменения в морфологии мембраны [8—12], в том числе факт увеличения ее шероховатости [10, 11]. При этом М. Moloney и соавт. [11] отмечали сначала уменьшение значений шероховатости в течение первых часов взаимодействия клетки BHK-21 с вирусом, а затем ее возрастание, связав это с репродукцией вирусов. В исследованиях G. Lee и соавт. [10] также продемонстрировано увеличение шероховатости клеточной мембраны при культивировании бакуловируса на клетках Sf9, при этом авторы предложили использовать изменения значений шероховатости мембраны клетки для оценки выхода образующихся вирусных частиц.
В настоящем исследовании изменение шероховатости клеточной мембраны наглядно демонстрирует зависимость данного показателя от дозы заражения: ее повышение приводило к более заметному увеличению шероховатости. При анализе исследуемых образцов вирус-содержащей жидкости установлено, что максимальное разведение, которое вызывало достоверное изменение шероховатости мембраны клетки, соответствовало 10-5. Следует отметить, что аналогичный результат был получен при исследовании вышеуказанных образцов вирус-содержащей жидкости методом иммунофлюоресценции. Наибольшие разведения, при которых обнаруживали
В составе вакцины ИПВ читаю вирусы убитые выращенные на клеточной линии ВЕРО..Вроде звучит безобидно, но что это за клеточная линия Веро. Начала искать и нашли интересный материал.
Потом думаешь и всё это колется молодому поколению, ужас в общем.
Статья.Проблема патогенного загрязнения вакцин
Перевиваемые бессмертные клеточные линии
В резюме этой журнальной статьи речь идёт о клетках Веро, представляющих собой перевиваемую клеточную линию африканских зелёных мартышек, обычно используемую в производстве вакцин. Авторы заявляют:
[Термин "пассаж" в этом контексте обозначает количество раз, когда клеточная линия была культивирована].
Существует другая очень важная проблема, о которой сообщают в исследованиях и которую очевидно игнорируют. Она касается долгосрочной эффективности и безопасности вакцин. Есть несомненные свидетельства того, что перевиваемые бессмертные клеточные линии по-разному реагируют в лаборатории с животными тканями разных видов. Например, ткани одного вида раньше приводят бессмертные клетки к раковым изменениям, чем ткани другого. Возникает вопрос: насколько тщательно изучались перевиваемые клеточные линии на человеческих тканях, и варьировали ли полученные результаты от одной человеческой ткани к другой? И что происходит спустя продолжительное время… если бессмертная клетка из клеточной культуры оказываются в конечном продукте – вакцине, продолжает ли она делиться и в человеческом организме? Или другой вариант: та часть ДНК, что отвечает за опухолевый рост, попадает в вирусный геном, который потом инъецируют человеку… а что потом?
Кроме того, учитывая тот факт, что близкородственные животные ткани (например, различных видов обезьян) по-разному реагируют на контакт с бессмертными клетками, следует ли нам также принять во внимание и то, что одна вакцина, предназначенная для всех людей, по-разному будет вести себя с разными расами, этническими группами, полами? А какое воздействие окажут контаминанты вакцин на лиц с иммуносупрессией, на пожилых, на младенцев?
Для примера: научному сообществу потребовалось примерно 40 лет, чтобы признать, что мы столкнулись с серьёзной проблемой в результате заражения полиовакцин обезьяньим вирусом (SV40) в конце 1950 – начале 1960-х гг. Несмотря на имеющиеся свидетельства, что некоторые опухоли головного мозга человека и другие опухоли содержат этот вирус , медики не спешили признать несомненную связь между SV40 и раком у человека. Однако два независимых исследования обнаружили недавно этот вирус в 43% случаев неходжкинских лимфом . Другое исследование обнаружило его наличие в 36% опухолей мозга, в 16% нормальных анализов крови, и в 22% нормальных анализов спермы . Странно, но было найдено, что вирусом SV-40 были инфицированы дети. Учитывая, что дети нашего времени не должны были получить вирус с вакциной, это обозначало, что SV-40 передаётся от одного человека другому доселе неизвестными путями.
Другие обезьяньи вирусы также могут загрязнять обезьяньи клеточные линии (Веро), используемые для производства вакцин. Например, сообщается о загрязнении вирусом SV-20 – онкогенным обезьяньим аденовирусом.
Итак, отрицаем ли мы, что вакцины переносят вирусы, ДНК и белки от чужеродных животных (и, возможно, нездоровых человеческих) источников людям, и это может самым непосредственным образом способствовать нынешнему невероятному росту рака и других серьёзных хронических заболеваний? Изменяют ли чужеродные животные гены нашу ДНК? Кроме того, учитывая, что присутствие вирусов иногда может лишь спустя годы привести к выраженным симптомам болезни, и учитывая склонность служб здравоохранения и корпораций к краткосрочным решениям и быстрому заработку, будем ли мы когда-либо (до того времени, когда уже станет слишком поздно) знать о долгосрочных последствиях такой политики?
Заражение из куриного источника
Вирусы для некоторых вакцин выращиваются на куриных яйцах. Наиболее распространённые человеческие вакцины, для которых используется этот метод, включают вакцины против гриппа, эпидемического паротита, кори, жёлтой лихорадки и др. Подобно вакцинам, включающим бычий материал, производство вакцин с использованием культур эмбрионов цыплят, также отнюдь не свободно от серьёзных проблем вирусного загрязнения.
Загрязнение токсинами
Бактериальное загрязнение – нанобактерии
Нанобактерия – недавно открытый патоген, инфицирующий человека. Сегодня он считается мельчайшей бактериальной формой, известной науке. Он ускользает от обычных процессов фильтрации и может легко проникать в другие клетки и приводить их к гибели. Нанобактерии считают плеоморфными, что означает их способность изменять физическую форму. Обнаруженные у человека нанобактерии могут вызывать огромное количество болезней, или быть с ними связанными. Вот лишь некоторые из них: атеросклероз, болезни коронарных артерий, почечные камни, болезни почек, артрит, рассеянный склероз, болезнь Альцгеймера, некоторые виды рака и др..
Бактериальное загрязнение – микоплазма и родственные формы
В течение долгого времени микоплазмы и их разновидности формы связывают с различными болезнями, включая рак, синдром хронической усталости, фибромиальгию, артрит, синдром войны в заливе и многими другими . Было бы невозможным перечислить в этой краткой статье все публикации, имеющие отношение к этой гигантской проблеме микробиологии, которую медицинское сообщество часто игнорирует, иногда – с трагическими последствиями. Не вызывает вопроса, что микоплазмы могут изменять клеточные мембраны и их антигены, разрывать ДНК и изменять клеточный метаболизм как in vitro, так и in vivo .
Перекрёстное загрязнение клеточных линий
Так как мы упоминали, что вирусные вакцины могут производиться лишь с использованием клеток, чистота клеточных линий – важнейший вопрос. Самый известный пример того, как многочисленные клеточные линии были загрязнены из внешних источников – история, случившаяся со знаменитой и тщательно оберегаемой клеточной линией раковых клеток HeLa в 1960-х гг. Она прекрасно документирована и даже стала темой для целой книги . В одном исследовании от 1976 г. перечисляется огромный список загрязнений во всех проверенных первичных и перевиваемых клеточных линиях: были обнаружены как вирусы в большом количестве, так и клетки HeLa. Сообщения продолжали поступать и в дальнейшем: в одном из них от 1984 г., например, рассказывается о меж- и внутривидовых перекрёстных загрязнениях клеток, причём 35% всех клеточных линий были испорчены, и это в основном были (по своему происхождению) человеческие клетки .
Я прошу читателя припомнить сказанное ранее о том, что обсуждаются предложения производить вакцины и другие биопродукты, используя непосредственно раковые клеточные линии, включая HeLa . Разумно ли это, особенно если учесть, что существующие линии опасно заражены HeLa и, возможно, другими раковыми клетками? Вспомните, пожалуйста, что в одной дозе вакцины допускается содержание 100 000 000 кусочков ДНК исходных клеток (и это не включая вирусное загрязнение)? Кому нравится подкожное введение бульона из раковых человеческих клеток? С фрагментами обезьяньих клеток на гарнир и вирусами для украшения?
Другие заслуживающие внимания проблемы
В программах массовых прививок для того, чтобы сберечь время и избежать неудобств, связанных с иглами и шприцами, часто используются безыгольные инъекторы. Однако исследование, опубликованное в июле 2001 г., обнаружило, что четыре исследованных инъектора могли передавать от реципиента к реципиенту мельчайшие количества жидкости и крови и, соответственно, такие вирусы, как вирусы гепатитов B и С, ВИЧ и др.. Многочисленные статьи (включая и ту, в которой сообщалось о вспышке гепатита В, связанной с использованием инъектора), подтверждают опасность, и ставят под вопрос безопасность таких приспособлений.
Решение о том, согласиться на прививку или отвергнуть её, является сугубо личным, но что бы вы ни решили, постарайтесь получить информацию об истинных пользе и риске. Никто не может быть принужден к какой бы то ни было медицинской процедуре, особенно сомнительной ценности.
Читайте также:


