Вирус поражающий бактерии или актиномицеты
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
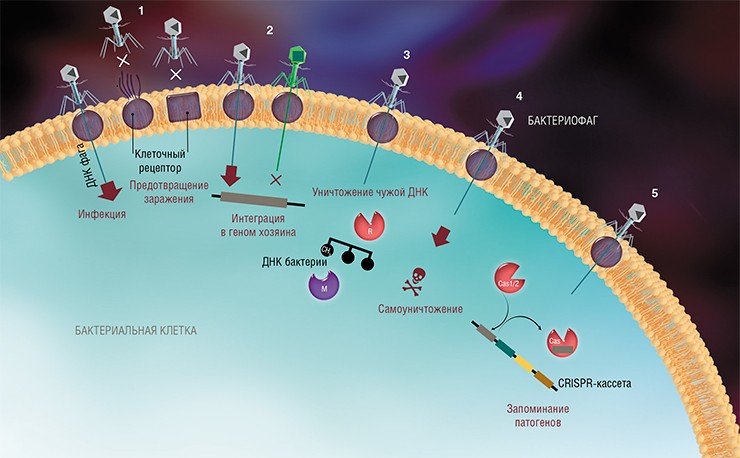
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Теория по микробиологии. Тема: Морфология и состав бактерий, вирусов. Актиномицеты, спирохеты, риккетсии, хламидии, микоплазмы. Патогенные представители.
При создании данной страницы использовались труды: Бухарин О.В. — Медицинская микробиология; Д.В. Тапальский, Т.Н. Ильинская, Л.В. Шевцова, Л.В. Лагун — Курс лекций по микробиологии, иммунологии, вирусологии.
Редактор: Irina
Классификация микроорганизмов. Основные структуры бактериальной клетки
Клеточная стенка имеет два слоя:
- наружный – пластичный;
- внутренний – ригидный.
Пептидогликан представлен параллельно расположенными молекулами гликана, состоящего из повторяющихся остатков N-ацетилглюкозомина и N- ацетилмурамовой кислоты, соединённой гликозидной связью.
Функции:
- защитная, осуществление фагоцитоза;
- регуляция осмотического давления;
- рецепторная;
- принимает участие в процессах питания деления клетки;
- антигенная (определяется продукцией эндотоксина– основного соматического антигена бактерий);
- стабилизирует форму и размер бактерий;
- обеспечивает систему коммуникаций с внешней средой;
- косвенно участвует в регуляции роста и деления клетки.
Цитоплазматческая мембрана:
По структуре она похожа на плазмолемму клеток животных и состоит из двойного слоя липидов, главным образом фосфолипидов, с интегральными, полуинтегральными и поверхностными белками — жидкостно-мозаичная модель .
Она обладает избирательной проницаемостью , принимает участие в транспорте питательных веществ, выведении экзотоксинов, энергетическом обмене клетки , является осмотическим барьером, участвует в регуляции роста и деления, репликации ДНК, является стабилизатором рибосом.
Цитоплазма:
Имеет жидкую структуру, в которой находится её компоненты, представленные различными включениями в виде гранул гликогена , полисахаридов и полифосфатов .
Функции:
- объединение всех компонентов клетки в единую среду,
- среда для прохождения химических реакций,
- среда для существования и функционирования органоидов.
Нуклеоид:
Нуклеоид — эквивалент ядра у бактерий. Он расположен в центральной зоне бактерий в виде двунитевой ДНК, замкнутой в кольцо и плотно уложенной в клубок. Участвует в делении клетки , а также хранит и передаёт наследственную информацию.
Плазмиды:
Внехромосомные факторы наследственности, представляющие собой ковалентно замкнутые кольца ДНК., расположенные в цитоплазме или интегрированные с хромосомой.
Рибосомы:
Рибосомы бактерий имеют размер около 20 нм и коэффициент седиментации 70S. Могут диссоциировать на 2 субъединицы 50S и 30S. На рибосомах происходит синтез белка и полипептидных молекул.
Споры и капсулы бактерий
Капсула
Слизистая структура толщиной более 0,2 мкм, прочно связанная с клеточной стенкой бактерий и имеющая четко очерченные внешние границы. Капсула гидрофильна , включает большое количество воды. Состоит из полисахаридов, полипептидов.
Капсула и слизь предохраняет бактерии от повреждений, высыхания, так как, являясь гидрофильными, хорошо связывают воду, препятствуют действию защитных факторов макроорганизмов гликокаликсом.
Споры
Форма спор может быть овальной, шаровидной , расположение – терминальное, субтерминальное и центральное .
Снаружи спора имеет тонкий экзоспориум, под которым расположена оболочка споры, а под ней кортекс, состоящий из пептидогликана. Внутри кортекса находится клеточная стенка спор.
Споры образуются при неблагоприятных условиях, УФ-облучении, дефиците питательных веществ.
Некоторые роды бактерий при неблагоприятных условиях образуют защитные формы — эндоспоры .
Споры представляют собой покоящиеся клетки с крайне низкой метаболической активностью . Они обладают высокой устойчивостью к высушиванию, действию повышенной температуры и различных химических веществ.
Включения и жгутики у бактерий
Включения
В цитоплазме имеются различные включения в виде г ранул гликогена, полисахаридов, бета-оксимасляной кислоты и полифосфатов (волютин). Они являются запасными веществами для питания и энергетических потребностей бактерий.
Волютин обладает сродством к основным красителям и легко выявляется с помощью специальных методов окраски (например, по Нейссеру) в виде метахроматических гранул. Характерное расположение гранул волютина выявляется у дифтерийной палочки в виде интенсивно прокрашивающихся полюсов клетки.
Включения имеют актиномицеты, риккетсии.
Жгутики
Жгутики — это особые выросты на поверхности бактериальной клетки, содержащие белок – флагелин.
Количество и расположение жгутиков может быть различным. Толщина 12-20 нм, длина 3-15 мкм.
Состоят из трёх частей:
- спиралевидной нити,
- крюка,
- базального тельца, содержащего стержень со специальными дисками.
Дисками жгутики прикреплены к цитоплазматической мембране и клеточной стенке. Жгутики обеспечивают подвижность бактериальной клетки. Механизм вращения обеспечивает протонная АТФ-синтетаза.
По характеру расположения жгутиков и их количеству бактерии делят на следующие группы:
- атрихи – не имеют жгутиков;
- монотрихи — один полярно расположенный жгутик;
- лофотрихи — пучок жгутиков на одном конце;
- амфитрихи — пучки жгутиков на обоих концах клетки;
- перитрихи — множество жгутиков, расположенных вокруг клетки.
Морфология актиномицетов, патогенные представители
Актиномицеты :
- Грамм+ бактерии.
- Нет капсулы, жгутиков, ворсинок.
- Есть включения.
- Имеют вид длинных и ветвящихся несептированных нитей (длина 500-600 мкм, толщина 0,2-1,2 мкм).
- Встречаются палочковидные и кокковидные формы, они образуются при фрагментации мицелия.
- Как и грибы, образуют мицелий – нитевидные переплетающиеся клетки (гифы).
- Размножаются спорами, поперечным делением, почкованием.
- 2 рода:
- Actinomyces,
- Nocardia.
- Являются представителями нормальной микрофлоры организма человека.
- Продуцируют антибиотики.
- Для человека патогенны очень немногие виды актиномицетов ― возбудители актиномикоза и нокардиоза .
Морфология спирохет, патогенные представители
Спирохеты :
- Грам- бактерии.
- Это извитые, тонкие, обладающие активной подвижностью микроорганизмы.
- Не образуют спор, нет капсулы.
- Есть жгутики.
- Наделенные чертами сходства с простейшими: образуют цисты, способны к движению.
- Длина 3-20 мкм, толщина 0,1-0,5 мкм.
- Состоят из наружной мембраны (клеточной стенки), окружающей протоплазматический цилиндр с цитоплазматической мембраной и аксиальной нитью (аксостиль). Аксиальная нить находится под наружной мембраной и как бы закручивается вокруг протоплазматического цилиндра спирохеты, придавая ей винтообразную форму.
- Аксиальная нить состоит из фибрилл – аналогов жгутиков бактерий, а внутри сократительный белок флагеллин. Фибриллы участвуют в передвижении спирохет, придавая клеткам вращательное, сгибательное и поступательное движение.
- 3 Рода:
- Treponema,
- Borrelia,
- Leptospira.
- Патогенные представители:
- Treponema pallidum – возбудитель сифилиса,
- Borrelia recurrentis – возбудитель возвратного тифа,
- Leptospira interrogans – возбудитель лептоспироза.
Морфология риккетсий, патогенные представители
Риккетсии :
- Грам- бактерии.
- Прокариоты, наделенные чертами сходства с вирусами: абсолютный внутриклеточный паразитизм и невозможность культивирования на искусственных питательных средах. Риккетсии обладают независимым от клетки-хозяина метаболизмом, но они получают от него макроэргические соединения для размножения.
- Мелкие, размеры от 0,5 до 3-4 мкм.
- Нет капсулы, жгутиков, не образуют спор, могут иметь включения.
- Обладают полиморфизмом : имеют кокковидную, палочковидную или нитевидную форму.
- Размножаются простым делением, дроблением.
- 3 Рода:
- Rickettsia,
- Orientia,
- Bartonella.
- У человека риккетсии вызывают:
- эпидемический сыпной тиф (Rickettsia prowazekii),
- клещевой риккетсиоз (R. sibirica),
- лихорадку цуцугамуши (R. tsutsugamushi),
- пятнистую лихорадку Скалистых гор (R. rickettsii),
- Bartonella quintana ― возбудитель волынской лихорадки ,
- Сoxiella burnetii ― возбудитель Q-лихорадки .
Морфология хламидий, патогенные представители
Хламидии :
- Грам- бактерии.
- Облигатные внутриклеточные паразиты.
- 2 фазы в цикле развития:
- элементарные тельца — внеклеточная, инфекционная форма
- и ретикулярные тельца — внутриклеточные.
- Полиморфные : имеют шаровидную, овоидную или палочковидную формы.
- Размеры 0,2-1,5 мкм.
- Капсул, спор, жгутиков не образуют.
- Морфология зависит от стадии их внутриклеточного цикла развития, который характеризуется превращением небольшого шаровидного элементарного образования в крупное инициальное тельце с бинарным делением.
- Рода:
- Chlamydia,
- Chlamydophila
- Виды:
- Chlamydia trachomatis ― возбудитель трахомы, паратрахомы, лимфогранулематоза,
- Chlamydophila psittaci ― возбудитель орнитоза, пситтакоз,
- Chlamydophila pneumoniae ― возбудитель пневмонии.
Морфология микоплазм, патогенные представители
Микоплазмы :
- Грам- бактерии.
- Отличаются от бактерий полным отсутствием клеточной стенки. Вместо нее содержат трехслойную липопротеидную цитоплазматическую мембрану.
- Нет клеточной стенки, нет капсулы, не образуют спор. Образуют колонии в виде яичницы-глазуньи.
- Делятся почкованием, нитевидная форма может образовывать псевдомицелий (грибы).
- Амебоидное движение, могут быть псевдоподии или жгутики(простейшие).
- Размеры 0,15-0,3 мкм, мелкие, проходят через бактериальный фильтр.
- Полиморфны : имеют форму круглых, овальных или нитевидных образований.
- Род:
- Mycoplasma,
- Ureaplasma,
- Acholeoplasma.
- Виды:
- Mycoplasma pneumoniae ― возбудитель пневмонии,
- Ureaplasma urealyticum, hominis – возбудитель урогенитальных воспалительных процессов, бесплодия,
- Mycoplasma hominis ― условно-патогенный организм, могут вызывать артриты.
Морфология вирусов
Вирусы – это мельчайшие микроорганизмы, относящиеся к царству Vira, не имеющие клеточного строения, белоксинтезирующей системы, содержащие только один тип нуклеиновой кислоты (ДНК или РНК).
Они отличаются особым разобщенным способом размножения (репродукции) : в клетке отдельно синтезируются нуклеиновые кислоты вирусов и их белки и затем происходит их сборка в вирусные частицы. Вирусы, являясь облигатными внутриклеточными паразитами, размножаются в цитоплазме или ядре клетки. Сформированная вирусная частица называется вирионом.
Вирусы имеют различную форму вирионов:
- палочковидная (вирус табачной мозаики),
- пулевидная (вирус бешенства),
- сферическая (вирусы полиомиелита, ВИЧ),
- в виде сперматозоида (многие бактериофаги).
Вирусы имеют разные размеры , которые определяют с помощью электронной микроскопии, методом ультрафильтрации через фильтры с известным диаметром пор, методом ультрацентрифугирования.
Одним из самых мелких вирусов является вирус полиомиелита (около 20 нм), наиболее крупным – натуральной оспы (около 350 нм).
Вирусы имеют уникальный геном , так как содержат либо ДНК, либо РНК. Поэтому различают ДНК-содержащие и РНК-содержащие вирусы. Они обычно гаплоидны , т.е. имеют один набор генов. Геном вирусов представлен различными видами нуклеиновых кислот : двунитчатыми, однонитчатыми, линейными, кольцевыми, фрагментированными.
Среди РНК-содержащих вирусов различают вирусы с положительным (плюс-нить РНК) геномом . Плюс-нить РНК этих вирусов выполняет наследственную функцию и функцию информационной РНК (иРНК). Имеются также РНК-содержащие вирусы с отрицательным (минус-нить РНК) геномом.
Минус-нить РНК этих вирусов выполняет только наследственную функцию. Геном вирусов способен включаться в состав генетического аппарата клетки в виде провируса, проявляя себя генетическим паразитом клетки. Нуклеиновые кислоты некоторых вирусов (вирусы герпеса и др.) могут находиться в цитоплазме инфицированных клеток, напоминая плазмиды.
Вирусы различают по строению:
- просто устроенные (например, вирус полиомиелита),
- сложно устроенные (например, вирусы гриппа, кори) вирусы.
У просто устроенных вирусов нуклеиновая кислота связана с белковой оболочкой, называемой капсидом (от лат. capsa – футляр). Капсид состоит из повторяющихся морфологических субъединиц – капсомеров. Нуклеиновая кислота и капсид, взаимодействуя друг с другом, образуют нуклеокапсид.
Вирусы различают по типу симметрии капсида:
- спиральный – обусловлен винтообразной структурой нуклеокапсида,
- кубический– обусловлен образованием изометрически полого тела из капсида, содержащего вирусную нуклеиновую кислоту,
- сложный.
Капсид и суперкапсид защищают вирионы от влияния окружающей среды, обусловливают избирательное взаимодействие (адсорбцию) с клетками, определяют антигенные и иммуногенные свойства вирионов. Внутренние структуры вирусов называются сердцевиной.
Принципы классификации вирусов
Классификация вирусов основывается на данных признаках:
- тип нуклеиновой кислоты,
- сложность строения,
- размер вириона,
- тип симметрии,
- чувствительные организмы,
- антигенная структура.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Спирохеты. Спирохеты– это спирально извитые подвижные микроорганизмы. Спирохеты представляют собой цитоплазматический цилиндр, ограниченный мембраной и окружённый очень тонкой клеточной стенкой. В цитоплазме содержатся нуклеоид, рибосомы, мезосомы и включения. Спирохеты передвигаются в результате волнообразного сокращения цитоплазмы клетки.
К спирохетам относятся трепонема (Treponema), боррелиа (Borrelia) и лептоспира (Leptospira).
Спириллы и вибрионы, представляют собой спиралевидно изогнутые палочковидные грамотрицательные бактерии с тонкой клеточной стенкой. Спириллы имеют 4-6 изгибов и полярно расположенные жгутики, а вибрионы – один изгиб, напоминающий запятую или изогнутую палочку.
Актиномицеты. Актиномицеты – это особые микроорганизмы с морфологическими признаками бактерий и грибов. Строение и биохимические свойства – аналогичны бактериям, а характер размножения, способность образовывать гифы и мицелий такие же, как у грибов.
Актиномицеты не имеют дифференцированного ядра (прокариоты), размножаются спорами. Некоторые виды не имеют мицелия и размножаются путём прямого деления.
Обитают актиномицеты в почве, на растительных остатках. Они участвуют в превращении органических и минеральных веществ, продуцируют аминокислоты, витамины и другие, биологически активные вещества.
Большинство актиномицетов – сапрофиты, однако, некоторые виды могут вызывать различные заболевания человека и животных (актиномикоз, актинобациллёз и др.). К актиномицетам относится также возбудитель туберкулёза у человека и животных.
Риккетсии. Риккетсии – это группа микроорганизмов, занимающих промежуточное положение между бактериями и вирусами. Риккетсии представляют собой палочковидные организмы. Они не образуют спор и капсул, неподвижны, грамотрицательны, имеют клеточную стенку, цитоплазматическую мембрану, рибосомы и нуклеоид, не окружённый оболочкой, размножаются путём прямого деления. Риккетсии в отличие от бактерий не растут на обычных питательных средах, но репродуцируются в развивающихся куриных эмбрионах, переживающих клетках млекопитающих, а также клетках насекомых и клещей.
Это внутриклеточные паразиты, вызывающие ряд заболеваний (риккетсиозы, сыпной тиф, Ку-лихорадка, гидроперикардит и др.). Болезни передаются при укусах вшей и клещей, в клетках которых они размножаются.
Микоплазмы. Микоплазмы представляют собой бактерии, лишённые клеточной стенки. Они окружены трёхслойной цитоплазматической мембраной, имеют цитоплазму, рибосомы и нуклеоид. Для роста нуждаются в холестерине, нативных белках и ростовых факторах, содержащихся в дрожжах. Микоплазмы вызывают ряд заболеваний человека (болезнь Итона) и животных (пневмония, воспаление суставов, воспаление молочной железы).
Грибы.Грибы составляют большую группу организмов, лишённую хлорофилла и нуждающихся для развития в готовых органических соединениях. Большинство грибов –сапрофиты, однако, имеются и паразиты, которые вызывают заболевания животных и человека (микозы). Кроме того, грибы – паразиты могут выделять в процессе роста ядовитые продукты в субстрат, что приводит к отравлениям (микотоксикозам).
Грибы играют важную роль в круговороте веществ в природе, разрушая и минерализуя органические соединения. Их широко используют в качестве продуцентов антибиотиков, а некоторые виды – при производстве спирта, вина, пива, сыра, хлеба, колбас, кормовых белков и др. Многие грибы вызывают порчу пищевых продуктов.
Грибы размножаются спорами, имеют вегетативное тело в виде мицелия. Интерес для ветеринарной микробиологии представляют плесени, дрожжи и несовершенные грибы.
П л е с е н и (гифомицеты) образуют длинные гифы, формирующие грибницу (мицелий). Гифы имеют оболочку, цитоплазму и ядро. В цитоплазме находят включения, зёрна и вакуоли. Широко распространены в природе мукоровые грибы (головчатая плесень). Они имеют ветвящийся одноклеточный мицелий, развиваются в сырых местах.
Плесень пенициллиум (кистевидная плесень) также широко распространены в природе, её обнаруживают в почве, на грубых кормах, в молочных продуктах. Представители этого рода – продуценты пенициллина.
Д р о ж ж и относятся к классу сумчатых грибов – аскомицетов. Это одноклеточные организмы округлой, овальной или удлинённой формы с двухконтурной оболочкой и ядром. Размножаются почкованием или спорообразованием. Большое значение имеют расы дрожжей, вызывающие спиртовое брожение, а также используемые для приготовления кефира. Патогенным для лошадей является возбудитель эпизоотического лимфангита.
Н е с о в е р ш е н н ы е г р и б ы - группа грибов, имеющих многоклеточный мицелий, размножаются спорами, бесполым путём. Имеют оболочку, цитоплазму, ядро, включения. К ним относятся возбудители дерматомикозов – трихофитии, микроспории, парши (фавуса).
Вирусы.Вирусы – это внутриклеточные паразиты. Они не размножаются на обычных питательных средах, а репродуцируются только в живых клетках млекопитающих и развивающихся куриных эмбрионах. Инфекционная частица вируса называется вирионом, который имеет очень малые размеры. Размер вируса 15 – 350 нм (нм – нанометр; 1 нм= 10 -6 м). Форма вирионов различных вирусов может быть овальной, палочковидной, многоугольной и нитевидной.
В отличие от бактерий вирионы содержат один тип нуклеиновой кислоты – ДНК или РНК. Первые вирусы называют ДНК – содержащими, вторые – РНК – содержащими.
ДНК или РНК вириона упакована в белковый субстрат и образует нуклеоид, выполняющий функцию ядра. Нуклеоид обладает способностью вызывать патологические изменения в клетках млекопитающих. Он окружён белковой оболочкой, состоящей из многочисленных субъединиц. Белковая оболочка вириона называется капсидой, а составляющие ее субъединицы – капсомерами.
Цикл репродукции вирусов состоит из ряда последовательных этапов. Вирион адсорбируется на поверхности живой клетки, проникает через оболочку в цитоплазму, где происходит освобождение нуклеиновой кислоты. Нуклеиновая кислота встраивается в ядерный аппарат клетки хозяина, в результате чего изменяется метаболизм клетки – клетка начинает синтезировать вирусные белки и вирусные нуклеиновые кислоты. В дальнейшем вирусные нуклеиновые кислоты связываются с вирусными белками и происходит сборка новых вирионов. Образовавшиеся вирионы разрушают клетку хозяина и выходят в окружающую среду. Процесс разрушения клетки называется цитопатогенным действием.
В настоящее время открыты сотни вирусов, вызывающих инфекционные болезни человека (оспа, грипп, полиомиелит и др.), животных (ящур, чума, бешенство и др.), растений (мозаика табака и др.).
Бактериофаги. Они встречаются повсюду, где есть микроорганизмы: В почве, водоёмах, выделениях животных, пищевых продуктах и состоят из головки и удлинённого отростка. В головке бактериофага заключена нуклеиновая кислота (ДНК или РНК), окружённая белковой оболочкой. Отросток бактериофага представляет собой полый белковый стержень, на конце которого могут быть нитеобразные шипы. С помощью шипов или концевого участка отростка бактериофаг прикрепляется к поверхности бактериальной клетки и впрыскивает внутрь её нуклеиновую кислоту. Развитие бактериофага в клетке бактерий аналогично развитию вируса. Наиболее чувствительны к бактериофагам бактерии, находящиеся в стадии деления.
Вопросы для самоконтроля:1. П о каким признакам можно отличить бактерии от
вирусов и грибов.
2. Чем отличаются дрожжи от плесневых грибов?
ТЕМА: ОБМЕН ВЕЩЕСТВ У МИКРООРГАНИЗМОВ.
Читайте также:


