Вирус устойчивый ко всем антибиотикам
Откуда берутся устойчивые к антибиотикам бактерии? Можно ли победить их вирусами? Где используется бо́льшая часть производимых антибиотиков? (Спойлер: в промышленном животноводстве.)
Но насколько подобные опасения оправданны?
Общий ответ — да, ваши друзья правы, надо пить до победного, весь курс. Конечно, если вас замучили ужасные побочные эффекты, то пытать себя не стоит, нужно вновь обратиться к врачу, и он подберет вам что-нибудь получше. Но гарантий, что резистентность обойдет стороной, никто не даст. В чем же проблема?

Многие убеждены, что из-за короткого курса или низкой дозы бактерии получают возможность приспособиться к антибиотику и, вместо того чтобы погибнуть, тренируются, качают мышцы и закаляются в боях. Пока вы неправильно лечите свой насморк, коварные микробы стремительно начинают мутировать, чтобы подстроиться под ваше лекарство, и, если не добить их, они в этом преуспеют.
Пока вы не достали антибиотик из упаковки, бактерии внутри вас процветают и захватывают всё больше пищи и территории, хотя вам, может, и неприятно так думать о своем организме. Не исключено, что среди них есть какая-то конкуренция, но мы о ней не знаем. Когда же антибиотик проникает в ткани, он становится главным фактором естественного отбора, и весь расклад меняется. У большей части популяции бактерий, с которыми вы сражаетесь, нет никаких механизмов, позволяющих противостоять этой химатаке, и они погибают.
Но предположим, что среди ваших маленьких врагов есть немногочисленная группа микроорганизмов, обладающих защитой от антибиотика. Тогда именно они начинают размножаться и распространяться в отсутствие конкурентов. Возможно, ваш организм справится сам с небольшой популяцией устойчивых к антибиотикам бактерий. Но когда вы бросаете курс на полпути, вероятность этого снижается. Если же настырные микропаразиты выдержали натиск иммунитета, то инфекция может вернуться на фоне приема антибиотиков.
Если человеку не помогло лечение, то надо применять другой антибиотик, искать тот, который подействует. Но последствия проигранной пациентом схватки с представителями микромира могут быть намного серьезнее для окружающих, чем для него самого: если они заразятся, то им придется бороться уже с устойчивым штаммом. И таким больным тоже не поможет антибиотик, который обычно назначают против этих бактерий. А если инфицированных много и они принимают разные препараты?

Это проблема любой современной клиники: нередко иммунитет у пациентов ослаблен, из-за чего те более подвержены инфекциям. Больным назначают инвазивные процедуры (хотя бы банальные инъекции), повышающие вероятность заражения, многие из них получают антибиотики.
Российские ученые создали наглядную карту, показывающую, насколько устойчива кишечная флора в разных странах.
Возбудитель гонореи Neisseria gonorrhoeae обладает очень высокой способностью к горизонтальной передаче генов, поэтому может противостоять многим антибиотикам. В марте 2018 года в Англии был зафиксирован первый случай гонореи, устойчивой к азитромицину и цефтриаксону, которые обычно применяются для борьбы с ней. Пациента стали лечить эртапенемом. Этот устойчивый штамм он подхватил в Юго-Восточной Азии, куда ездил месяцем ранее.
Большой вопрос, выявляют ли такие случаи и сообщают ли о них в странах с менее развитой медициной, чем в Англии. Это повод пересмотреть отношение к ЗППП. Еще недавно самыми опасными из них казались вирусные болезни — ВИЧ и гепатиты. Но если антибиотики перестанут действовать, не придется ли нам вернуться во времена, когда сифилис был неизлечим? Если вас не пугает такой сценарий, перечитайте что-нибудь из литературы XIX или начала XX века, чтобы прочувствовать масштаб бедствия.
С проблемой устойчивых штаммов медицина столкнулась уже через несколько лет после начала применения этого вещества, и Флеминг предупреждал о таком развитии событий.

В окружающей среде живет огромное количество разных микроорганизмов, конкурирующих между собой за пищу и место. Одни продуцируют вещества против других, подобно плесени, выделяющей пенициллин против стафилококка. Именно эти вещества и стали основой примерно двух третей всех современных антибиотиков. Их получили из актиномицетов — бактерий, распространенных в почве.
Разнообразие генов устойчивости к антибиотикам, которыми обладают бактерии в естественной среде, например в почве, поражает. В 2006 году канадские ученые составили библиотеку из 480 штаммов таких микроорганизмов. Все они имели устойчивость более чем к одному антибиотику, а в среднем — к 7–8 (из 21, которые тестировались в ходе эксперимента), причем и природного, и синтетического происхождения, и даже к тем, что еще не вышли в широкое обращение.
Конечно, люди и здесь не могли не повлиять на окружающую среду. Производя и используя лекарственные средства, мы постоянно загрязняем ими воду и почву. Метаболиты антибиотиков выделяются из организма, со сточными водами попадают в окружающую среду и могут оказывать свое селективное действие на бактерии.
В местах производства таких препаратов ситуация еще хуже. Недалеко от индийского города Хайдарабад находятся очистные сооружения, получающие сточные воды с нескольких десятков фармацевтических заводов. В этой местности антибиотики обнаруживаются в высоких концентрациях даже в колодцах с питьевой водой, в реках и озерах и, конечно, в самих очистных сооружениях. Вот уж где идет настоящая селекция на устойчивость! И результаты дают о себе знать. Индия впереди планеты всей по доле устойчивых штаммов, и это при относительно невысоком уровне применения антибиотиков. Более 50 % образцов клебсиеллы пневмонии здесь имеют иммунитет к карбапенемам — препаратам широкого спектра действия.
(Посмотреть уровень устойчивости бактерий к антибиотикам в разных странах можно на этой карте.)
NDM — один из генов, который производит фермент, расщепляющий карбапенемы и другие бета-лактамные антибиотики, — был впервые обнаружен в Нью-Дели и назван в его честь. За десяток лет, прошедших с того момента, эта разновидность стала встречаться по всему миру у отдельных пациентов или в виде вспышек внутрибольничной инфекции.
Антибиотики используют не только для лечения животных, но и в профилактических целях, а также добавляют в пищу: в низких дозах они способствуют быстрому росту, поэтому широко применяются во многих странах.
При таком развитии событий можно было бы предложить вести гонку вооружений: используем антибиотик, а когда устойчивых к нему бактерий становится слишком много, просто берем новый и лечим им. Да, мы не отыщем панацеи, и хитрые микроорганизмы все равно изобретут способ противостоять нам, но мы постоянно будем находить новые временные решения и тем самым отражать угрозу.
Поначалу примерно так и происходило. 40–70-е годы принято считать золотой эрой антибиотиков, когда постоянно открывались новые классы веществ: в 1945-м — тетрациклины, в 1948-м — цефалоспорины, в 1952-м — макролиды, в 1962-м — фторхинолоны, в 1976-м — карбапенемы… За это время появилось множество препаратов, и проблема устойчивости к ним бактерий не стояла остро.
Тому есть несколько причин. Существуют реальные научные сложности с нахождением новых антибиотиков. Эти вещества должны отвечать сразу нескольким требованиям: легко проникать в ткани организма (и накапливаться там в достаточных концентрациях), а также в клетки бактерий, быть эффективными против них и при этом нетоксичными для человека. Ученые исследуют множество молекул, но так и не могут найти новой, подходящей для этих целей. Почвенные бактерии очень плохо растут в лабораторных условиях, что ограничивает поиск.

Ряд проблем связан с регулированием и, как следствие, финансированием. Современные лекарства проходят строжайший отбор, испытания и многочисленные проверки на эффективность и безопасность. Единицы из исследуемых молекул в итоге выйдут на рынок.
Кроме того, чтобы сразу не выкладывать перед бактериями все козыри на стол, повышая их шансы, новый антибиотик, вероятно, будут использовать в крайних случаях, как резервное оружие, что тоже невыгодно производителю. Из-за указанных трудностей многие фармкомпании свернули свои разработки. А это, в свою очередь, привело к снижению числа квалифицированных специалистов.
И при проникновении в бактерию, и при выходе из нее вирусы используют ферменты лизины, применение которых в лечении инфекций считается перспективным направлением, и с ними связывают немало надежд, полагая, что эти вещества придут на смену антибиотикам.
Первые статьи об успешных экспериментах на инфицированных лабораторных мышах с использованием лизина появились в самом начале 2000-х годов. Это привлекло гранты на разработку препаратов такого рода против сибирской язвы и резистентного золотистого стафилококка. В 2015-м стартовали клинические испытания первой фазы на людях.
Резистентность бактерий — крайне серьезная проблема, с которой столкнулось человечество, и со временем она будет лишь обостряться. Во всем мире это отлично понимают и уже бьют в набат. Никто не хочет возвращаться в доантибиотиковую эпоху, когда любая инфекция могла привести к смерти, каждая операция была сопряжена с огромным риском, а полагаться приходилось только на силы собственного организма.
В феврале 2018 года ВОЗ выпустила краткую рекомендацию, объясняющую, как сдержать антибиотикорезистентность, для всех групп, участвующих в процессе: больных, медиков, представителей власти, фарминдустрии и сельского хозяйства.
Каждая страна вырабатывает свои правила и методы решения проблемы. В Евросоюзе с 2006 года запрещено использование кормовых антибиотиков в животноводстве, и другие государства постепенно перенимают этот опыт. Некоторые препараты ограничивают в применении, чтобы оставить их как резерв; принимаются меры, призванные предотвратить распространение внутрибольничных инфекций.
Общей инструкции для всех нет, и вряд ли такая появится — слишком уж много различий между государствами: уровень (да и сама система) здравоохранения, финансирование, условия жизни людей.
Дело в том, что здесь всего тридцать клиник общего профиля, от крупных (1000+ коек) до совсем крошечных (меньше 100), и полтора десятка медицинских центров, где лежат люди с заболеваниями, требующими длительного лечения.

В середине 2000-х в Израиле произошла крупная вспышка внутрибольничной инфекции, вызванная энтеробактериями, устойчивыми к карбапенемам. Когда ситуация стала угрожающей и о проблеме заговорили СМИ, минздрав создал специальный орган для ее решения и для улучшения инфекционного контроля в стране. Были выпущены инструкции по лечению таких пациентов и уходу за ними.
Клиники стали ежедневно отчитываться о новых выявленных носителях, о том, где и в каких условиях они госпитализированы, об их перемещениях между отделениями, о переводе в другие больницы. Была создана база всех таких пациентов, и теперь при госпитализации человека у персонала есть возможность позвонить и проверить, является ли он носителем устойчивой бактерии и нужно ли его поместить отдельно от других больных.
Небольшая команда, изначально состоявшая из трех человек (со временем, конечно, штат расширился), смогла контролировать перемещение таких пациентов по всей стране. Это удалось осуществить в том числе благодаря современным способам выявления устойчивости.
Одна из основных проблем — информационный вакуум: об устойчивости к антибиотикам мало говорят и пишут. И врачи, и пациенты недостаточно осведомлены о механизмах и причинах. Не так много специалистов знает, что устойчивые бактерии передаются от больного к больному, а не в результате приема антибиотиков.
Но есть и положительные тенденции. Люди в России стали уделять больше внимания вопросам здоровья и расширять свой кругозор в этой области. Еще лет 10–15 назад даже среди врачей мало кто знал о принципах доказательной медицины — сейчас таким термином никого не удивишь, а клиники используют его как маркетинговый ход. Можно надеяться, что и проблема устойчивости к антибиотикам станет темой для широкого обсуждения.
МОСКВА, 3 сен — РИА Новости. Всего через 60 с лишним лет после Нобелевской премии по медицине, которую первооткрыватель пенициллина Александр Флеминг разделил с коллегами Говардом Флори и Эрнстом Чейном, глава Всемирной организации здравоохранения Маргарет Чан заявила, что мир может быть "на пороге пост-антибиотиковой эры".

Поэтому в глобальной битве против устойчивости к антибиотикам, где с одной стороны — фармгиганты и правительства, рядовые врачи и пациенты, а с другой — кишечная палочка, микобактерия и холерный вибрион, пока никто не вышел победителем, и еще неизвестно, на чьей стороне перевес.
"К сожалению, устойчивость к антибиотикам у бактерий — это неизбежный феномен, он возникает ровно потому, что, как любой живой организм, бактерия воспринимает антибиотик как что-то чужеродное, и задача ее — выжить", — объясняет руководитель научно-методического центра по мониторингу антибиотикорезистентности Росздравнадзора, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) Роман Козлов.

Получается, что человек и возбудитель заболевания соревнуются — кто быстрее отреагирует на очередное "достижение" другого. К счастью для нас, не все зловредные микроорганизмы в этой гонке преуспевают — поэтому даже спустя 85 лет и наличие десятков препаратов открытие Флеминга все еще остается актуальным.
"Есть некоторые бактерии, например, возбудители воспаления горла — тонзиллита, фарингита, которые никогда не вырабатывают устойчивость к пенициллину. Есть возбудитель сифилиса, который до сих пор чувствителен к тому же самому пенициллину. Почему — это вопрос очень сложный, на который, честно говоря, ученые ответить не могут. С моей точки зрения, если удастся разгадать этот феномен, может быть, это поможет нам бороться с антибиотикорезистентностью", — сказал Козлов.
"Был вопрос: откуда они взялись? Затем выяснилось, что они присутствовали у бактерий задолго до эры применения антибиотиков, выполняя другие функции. Применение антибиотиков лишь усилило их распространение, заставило их объединиться в новые комбинации", — пояснил Даниленко.
Основной причиной того, что устойчивость к антибиотикам из неизбежной неприятности превратилась в глобальную проблему, является их бесконтрольное использование, будь то продажа в аптеках без рецепта или использование в сельском хозяйстве и ветеринарии. Например, по некоторым оценкам, в США до 80% всех антибиотиков даются не людям, а животным, причем часто абсолютно здоровым — просто для того, чтобы они росли быстрее.
Еще несколько лет назад СМИ всего мира пугали население зловещей аббревиатурой NDM-1 — этот ген якобы превращал обычную бактерию в "супермикроб", устойчивый почти ко всем антибиотикам. Микроорганизмы с этим "супероружием" находили то тут, то там, но, как это часто бывает, со временем внимание журналистов переключилось на другие, не менее впечатляющие заголовки.

"Но проблема заключается в том, что таких механизмов очень много — здесь фактически шумиха возникла только из-за названия, когда правительство Индии выступило с требованием к ученым переименовать NDM-1, потому что название связывает его с Индией. Таких механизмов описывается очень много — здесь дело в том, что Индия почти два года не признавала наличие этой проблемы (устойчивые к антибиотикам микроорганизмы) в стране", — говорит эксперт.
Даже оставшись без всеобщего внимания, микробы, несущие эти гены, успешно добрались почти во все страны мира, в том числе и в России.
"Это действительно проблематичный микроорганизм, но в любом случае чего-то сверхординарного по сравнению с другими механизмами устойчивости нет. Просто здесь само название привело к достаточно серьезному освещению в СМИ, что в целом хорошо для нас, потому что это дополнительно привлекло внимание к проблеме, которая действительно является сверхактуальной", — сказал Козлов.
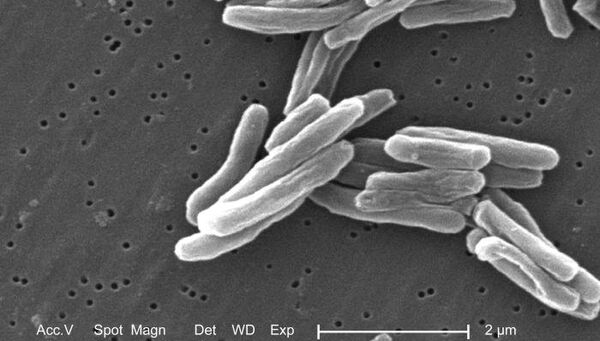
Даниленко отмечает, что ситуация с проблемой распространения штаммов возбудителей туберкулеза за последнее время "к сожалению, ухудшается во всем мире, особенно в России из-за неправильного использования антибиотиков".
"Усилиями американских и российских ученых сформирован и начал работу Международный консорциум по изучению механизмов устойчивости к антибиотикам возбудителя туберкулеза. Кроме России и США, в этот консорциум вошли большинство заинтересованных в решении этой проблемы стран: Китай, Тайвань, ЮАР, Швеция и другие страны", — сказал Даниленко.
Везде этой проблемой занимаются ведущие центры и лаборатории, в том числе и с российской стороны — Институт медицинской химии ФМБА, Институт химической биологии и фундаментальной медицины СО РАН, Институт туберкулеза РАМН, Институт пульмонологии Минздрава РФ, а также институт, который представляет Даниленко.
Проблемой устойчивости к антибиотикам во всем мире занимаются действительно передовые научные центры, но дело это непростое. Игра в "салочки" с микробами — ты им новый антибиотик, они тебе через какое-то время устойчивость — обходится недешево: по данным Козлова, разработка нового антибиотика сегодня стоит от 800 миллионов до 1 миллиарда долларов, и уходит на это обычно 8-10 лет.
"Поэтому многие и говорят о том, что полностью решить проблему только разработкой новых препаратов невозможно, это действительно абсолютно так", — говорит Козлов.
"Полностью решить проблему антибиотикорезистентности, скорее всего, практически невозможно, но замедлить (ее формирование) — это действительно путь реальный", — считает эксперт.
Есть и более экзотические варианты — например, лауреат Нобелевской премии по химии Сидней Олтмен считает, что антибиотики будущего будут напрямую "выключать" генетические процессы в клетках болезнетворных микроорганизмов, и вопроса устойчивости к ним просто не возникнет.
"Может быть, новые идеи, в том числе об отключении генов болезнетворности бактерий или вызове запрограммированной в геноме бактерии гибели патогена, позволят человечеству выйти из существующей патовой ситуации… Ученые мира работают по многим новым направлениям, это и есть тот случай, когда фундаментальные исследования могут принести неожиданные, но нужные результаты", — говорит Даниленко.
Поделиться сообщением в
Внешние ссылки откроются в отдельном окне
Внешние ссылки откроются в отдельном окне
Ученые разрабатывают новый вид антибиотиков, который уже показал обнадеживающие результаты в первых испытаниях. Необходимость в новых лекарствах остра как никогда, если учесть, что укрепляющаяся резистентность бактерий к антибиотикам представляет серьезную угрозу.
Когда в 1940-х годах начали использовать антибиотики, их называли чудо-лекарством. Но сейчас существуют опасения, что из-за их слишком частого применения бактерии выработали устойчивость к препаратам.
Главный врач Великобритании Салли Дэвис заявила, что если антибиотики перестанут работать, медицина по сути дела скатится в средневековье. Но в чем первопричина проблемы?
Что такое антибиотики
Шотландский химик Александр Флемминг изобрел первый настоящий антибиотик в 1928 году. Произошло это практически случайно - в ходе опытов он выяснил, что плесень препятствует росту бактерий. Так появился пенициллин.
Его открытие стало революционным в лечении определенных видов инфекционных заболеваний и помогло спасти бессчетное число людей.
Антибиотики воздействуют на бактерии по-разному: в одних случаях они их уничтожают, в других не дают им распространяться.
Но есть у этих препаратов и слабая сторона.
Резистентность
Антибиотики эффективно нейтрализуют многие виды бактерий, но не все. Некоторые виды бактерий вырабатывают гены, которые защищают их от воздействия лекарств.
Они выживают при лечении и размножаются, передавая потомству свои гены, из-за чего в дальнейшем эффективность медицинских препаратов снижается.
Если человек заражается такими бактериями, устойчивыми к антибиотикам, лечить его лекарствами становится сложнее.
В настоящий момент могут прийти на помощь другие существующие виды антибиотиков, но вариантов становится все меньше, поскольку бактерии приспосабливаются и вырабатывают сопротивляемость к все большему количеству препаратов.
За последние четыре года в Англии количество случаев заражения передающимися через кровь инфекциями с устойчивостью к антибиотикам увеличилось на 35%. Это стало известно во многом благодаря тому, что медики начали активнее выявлять случаи сепсиса.
Но, несмотря на увеличение случаев таких инфекций, соотношение между передающимися через кровь инфекциями с устойчивостью к антибиотикам и инфекциями, поддающимися лечению, осталась на прежнем уровне.
Специалисты в области здравоохранения считают, что нужно приложить все усилия, чтобы не позволять бактериям с устойчивостью к антибиотикам превалировать над другими.
В ходе недавнего исследования ученые выяснили, что без эффективных антибиотиков случаев заражения опасными для жизни инфекциями во время клинических операций может стать больше.
Служба общественного здравоохранения Англии с 2013 года активно призывает сократить объемы антибиотиков, прописываемых пациентам.
Врачи утверждают, что слишком частое употребление антибиотиков является главной причиной появления устойчивости к ним у микроорганизмов. Чем чаще люди прибегают к антибиотикам, тем ниже становится их эффективность.
Нередко врачи прописывают антибиотики пациентам, которые не заражены бактериальными инфекциями, хотя это абсолютно бесполезно.
В целом уровень потребления антибиотиков по Британии с 2013 года снизился примерно на 5%, но данные отличаются в зависимости от региона.
Чем активнее врачи выписывают для лечения антибиотики, тем более высокая устойчивость к ним бактерий.
В 2016 году британские власти призвали за пять лет на 50% снизить употребление антибиотиков.
Когда пациенты приходят в свои поликлиники с жалобой на кашель или простуду, примерно половине прописывают лечение антибиотиками.
Есть опасения, что проблема усугубляется из-за ожиданий пациентов.
По последним данным, 38% пациентов, обращаясь за медицинской помощью, предполагают, что их будут лечить антибиотиками.
Поэтому сейчас в Британии не только пытаются в целом сократить объем выписываемых антибиотиков, но и создать условия, при которых клиники не будут пытаться лечить ими пациентов с заболеваниями, которые проходят естественным образом через несколько дней.
Как обстоят дела в других странах?
Излишнее использование антибиотиков присуще не только Британии.
Европейская сеть по контролю за потреблением антимикробных средств назвала распространение устойчивых к антибиотикам бактерий угрозой здоровью населения.
По приблизительной оценке, каждый год в Европе от связанных с ними инфекций умирают около 25 тыс. человек.
На сегодняшний день потребление антибиотиков в Британии ниже среднего по сравнению с другими странами ЕС.
Многие страны с высоким потреблением антибиотиков обращаются за опытом к другим странам, особенно на севере Европы, где их потребление ниже.
Особо серьезные опасения вызывает лекарственно устойчивый туберкулез.
По данным Всемирной организации здравоохранения (ВОЗ), туберкулез остается самым смертельным инфекционным заболеванием в мире.
Лечение приносит свои плоды - с 2000 по 2017 год удалось спасти жизни 54 млн человек благодаря правильному диагнозу и успешному лечению.
Но даже с учетом снижения коэффициента заболеваемости в мире на 2% в год инфекция остается в первой десятке основных причин смерти в мире.

Вы думаете что апокалипсис начнется с яркого, послегрозового вкуса высоких радиационных полей? Металлического привкуса стронция и циркония? Сладковатого привкуса плутония? Неа. Все будет не так.
Апокалипсис будет выглядеть сухо, и строго. Вот так. К примеру.
Что это бумажка показывает не знаете? Нет? Ну я вкратце - это тест посева на антибиотики. Причем не чего либо - а синегнойной палочки, которая шутить не любит и действует КРАЙНЕ быстро. Что мы видим на данном листке? Полную нечуствительность к антибиотикам. Ага.
Комментарий к фото от врача, это перевод с английского
"Женщине, которая жалуется, потому что я не прописываю антибиотики ее ребенку, больному гриппом. Пациенту, который бросается в истерику, потому что у него болит горло и он хочет, чтобы я оставил ему азитромицин.
Людям, которые принимают амоксициллин от головной боли.
Тем, кто настаивает на том, что от лихорадки лучше всего использовать бензетацил, потому что он излечивает все инфекции и убивает всех возбудителей.
Другу, который принял только половину курса лечения, потому что он захотел выпить в конце недели и потому, что теперь его бактерии адаптировались и приспособились ко всем видам антибиотиков, и все из-за благословенной привычки говорить: "этот врач ничего не знает, с антибиотиками я вылечусь быстрее".
Вам, дамы и господа - бактерии, устойчивые ко всем антибиотикам."
Для понимания - на фото результат посева мочи на чувствительность к антибиотикам, из которого следует, что имеется инфекция - синегнойная палочка, которая у данного пациента устойчива ко всем антибиотикам и лечить больше нечем.
Финита ля комедия. И пациентке тоже.
![]()
Новость №846: Антибиотики нашли в речной воде по всему миру

![]()
Троянский антибиотик.

![]()
В глубоководной губке обнаружили невероятно мощный антибиотик, убивающий супербактерии

Исследователи обнаружили в Атлантическом океане уникальную губку, которая растет на глубине 2 километров. Уникальность ее состоит в том, что в этой губке содержится чрезвычайно мощный антибиотик. Этот чудо-антибиотик был выявлен после того, как исследователи заметили, что крошечная часть губки уничтожила все кишечные человеческие бактерии, находящиеся с ней в одной чашке Петри. В том числе губка поборола такую страшную бактерию как метициллин-резистентный золотистый стафилококк (MRSA). По словам ученых открытие этого вещества может стать золотым веком в применении антибиотиков. Однако они оговаривают, что до того как вещество попадет в руки врачам может пройти еще лет десять, за которые антибиотик будут изучать и тестировать. Открытие совершили эксперты из университета Бристоля. Они задались целью найти губки, растущие в самых экстремальных условиях и обнаружили пять подобных губок на большой глубине в разных местах Атлантического океана.

Ученые собрали и заморозили образцы, а потом в лаборатории выяснили, что кишечные супербактерии губит особая губочная бактерия, которая получила название "Бактерия 46". Это и есть то самое чудо-лекарство, которое в будущем может спасти миллионы человеческих жизней. Сейчас ученые выращивают колонии этих бактерий в лаборатории, чтобы проверить их на токсичность и побочные эффекты. Ведь может оказаться, что вылечив одну болезнь, эти бактерии заразят человека другой. Проблема появления супербактерий, с которыми не помогают бороться даже самые мощные современные антибиотики, в последние годы становится все актуальнее. Согласно медицинским данным сейчас супербактерии каждый год убивают около 50 тысяч человек в Европе и США. Ранее врачи уже выявили один из штаммов пневмонии, с которым не справляется ни один антибиотик.

![]()
Правила приема и назначения антибиотиков. Важно!
Решил я тут, что хватит мне всякую хрень постить, и нужно родить что - то реально интересное и общественно полезное. Что же толкнуло мою ленивую тушку на этот подвиг? Читаем далее)
Самолечение у граждан нашей страны достигло совсем уже угрожающих масштабов, и я сегодня не про алое и мочу, а про самые важные в медицине препараты - антибиотики!
Приходит недавно в стационар мама с ребенком. Кашель не проходит уже месяц. Спрашиваю: чем лечились? Оказывается, неделю принимали Амоксиклав, не помогло, потом неделю кололи ребенку Цефртиаксон, не помогло, решили наконец то обратиться к врачу. Для справки: Амоксиклав и Цефтриаксон - мощные антибиотики широкого спектра действия, которые, при правильном приеме (подробно опишу в конце поста, оставайтесь с нами) и назначении убьют практически любую микрофлору. Почему же не помогло в этом случае? А тут у нас любимая привычка - лечение вирусной инфекции антибиотиками. Я думаю даже последний вьетнамский дворник знает, что антибиотики на вирусы НЕ ДЕЙСТВУЮТ МАТЬ ТВОЮ НАЛЕВО! (о том,как отличить вирусную и бактериальную инфекцию простому обывателю будет в середине текста, оставайтесь с нами). Девочка приобрела в лагере обычный вирусный бронхит, мама решила полечить её антибиотиками, которые имеют свойство несколько снижать иммунитет и попутно уничтожать почти всю ПОЛЕЗНУЮ микрофлору. Вирус чихал на Амоксиклав, маман полирнула Цефтриаксоном. И что мы имеем? Имеем иммуносупрессию, нарушенную микрофлору кишечника, вирусная инфекция (на фоне сниженного иммунитета) перешла с острой практически в хроническую, плюс присоединилась бактериальная флора, которая может быть устойчива к перечисленным выше антибиотикам, которые и принимались то наверно не особо правильно. И что мне с ней делать?
Физио, ингаляции, другие антибиотики, больничный режим. вылечим короче, не впервой.
Итак, переходим к практической части, как обещал. Первое, как отличить бактериальную инфекцию от вирусной? Понятно, что я вам должен сказать, что назначать лечение и ставить диагноз должен только врач, и это на 100% так. Но многие меня не послушают. Так что передам хоть какие - то важные знания, все лучше чем с пустой головой лечить себя или своих детей.
1) При бактериальной инфекции, особенно острой, будет гной. Много гноя - в мокроте, соплях, на гландах в виде желтоватых налетов и пробок.
2) Если речь об ангине - при бактериальной будет четко видна граница между воспаленными (красными) миндалинами и окружающей тканью, на миндалинах будет желтоватый налет и будет дичайшая боль при глотании. При вирусном тонзиллите - нет четкой границы, краснота разлита по всему горлу, налета или нет или он белый, боль умеренная, возможна диарея, коньюктивит
3) Отиты - почти всегда бактериальные, если возникают изолированно (без симптомов по другим ЛОР органам) или на фоне гайморита. Отит кстати очень опасная штука и дети от него нередко умирают, если будет интересно - сделаю про него следующую публикацию.
Так, теперь перейдем к правильному приему антибиотиков
1)Регулярность - недопустимо пропускать прием ни одной таблетки, особенно в первые 4 дня лечения. Иначе рискуем получить устойчивую бактерию и не выздороветь.
2) Прием по часам - если сказано принимать таблетку 3 раза в день, между приемами должно пройти ровно 8 часов, это очень важно, и коллеги мои почему - то никогда об этом пациентам не говорят. 2 раза в день - 12 часов. Если пить с другими промежутками, например 8-6-10, то получим 2 часа передышки у микробов и 2 часа усиленного токсического действия на печень.
3) Длительность - самое маленькое - 5 суток, меньше нельзя, лучше 7. По назначению врача верхняя граница может быть практически любая, например тубик по году лечится.
4) Не запивать горячим чаем, да и вообще чаем - он неплохой сорбент, может украсть часть антибиотика прямо в желудке. Ну и с другими сорбентами не сочетать, конечно же - Смекта, Уголь, Полисорб.
5) Принимать внятные дозы - рассчитывается на массу тела или возраст в инструкции к препарату. Вообще читать инструкции к препарату очень полезно, можно многое узнать)
Прием малых доз лишь тренирует бактерии сопротивляться антибиотикам.
6) Не принимать 2 антибиотика одновременно без назначения врача - некоторые антибиотики делают бактерий временно не чувствительными к другим антибиотикам.
7) Важно! если при бактериальной инфекции начать принимать антибиотик - улучшение состояния (самочувствие, температура, уменьшение гноевыделения) должно наступить уже через двое суток приема! Если пьете антибиотик уже три дня, а не легчает совсем - значит что - то не так, либо не попали в чувствительность, либо лечите вирус, либо таблетки паленые. И не важно, сами вы его назначили или врач - бегом еще раз ко врачу, менять препарат.
Ну вроде все, что сказать хотел. Не болейте, не занимайтесь самолечением, а если вдруг рискнули - делайте это с умом. Теперь с этим вам будет полегче.
Читайте также:


