Вирусно бактериальные ассоциации это
ОРВИ у ЧДБ детей нередко характеризуются затяжным течением и присоединением осложнений в виде обострений хронических очагов бактериальной инфекции ЛОР-органов, респираторного и урогенитального тракта. В ряде случаев пациенты из группы ЧДБ нуждаются в помощи клинического иммунолога, поскольку имеют серьезные нарушения функционирования иммунной системы и интерферонового статуса. Таким пациентам, как правило, показана адекватная иммунодиагностика, исследование интерферонового статуса, микробиоценоза слизистых (ПЦР, бакпосевы) с последующим проведением интерфероно- и/или иммунотерапии, санации хронических очагов инфекции на фоне диагностического мониторинга.
Наиболее часто педиатрами для формирования групп детей ЧДБ используются возрастные критерии, предложенные Барановым А. А. и Альбицким В. Ю. (1986): на первом году жизни — 4 и более острых и обострений хронических заболеваний в год, на втором-третьем годах жизни — 6 и более ОРЗ в год, на четвертом году — 5 и более, на пятом-шестом годах — 4 и более, на седьмом году жизни и старше — 3 и более ОРЗ в течение года.
Именно с персистенцией вирусных и бактериальных антигенов, возникающей на фоне нарушений иммунитета и в то же время их усугубляющей, в последние годы связывают рецидивирующее течение респираторных заболеваний. Причем у 40–60% детей ОРЗ имеют вирусную природу. Среди вирусов ведущее место занимают риносинцитиальные (РС) вирусы, аденовирусы, риновирусы, вирусы гриппа и парагриппа. При неосложненном течении ОРЗ главенствующая роль отводится, как правило, моновирусной инфекции. Элиминация вирусных антигенов значительно затрудняется при частых рецидивах ОРЗ, особенно при наличии вторичной иммунной недостаточности. Так, вирусы гриппа, парагриппа, РС-вирусы, риновирусы, аденовирусы удается идентифицировать в течение продолжительного времени после острого периода болезни — от 2 недель до нескольких месяцев. От 10% до 30% ОРЗ у детей имеют бактериальное происхождение. Из бактериальных возбудителей, вызывающих острые заболевания органов дыхания, доминирующая роль принадлежит пневмококкам, гемофильной палочке. Однако развитие бактериального процесса может быть обусловлено и такими условно-патогенными микроорганизмами, как золотистый стафилококк, клебсиелла, представителями семейства кишечных палочек.
Особую настороженность вызывает возросшая частота заболеваний дыхательных путей, вызванных хламидиями, микоплазмами, уреаплазмами. Эти внутриклеточные паразиты способны к длительной персистенции в клетках эпителия респираторного тракта, особенно у иммунокомпрометированных детей, что и служит причиной инициации бронхообструктивного синдрома, а в дальнейшем формирования хронических воспалительных заболеваний легких, в том числе бронхиальной астмы.
Этиологическая значимость вирусно-бактериальных ассоциаций установлена в 25–30% острых заболеваний респираторного тракта. Клинически смешанная инфекция обусловливает неосложненное и осложненное течение ОРЗ. В случаях развития у детей острого воспалительного процесса нижних дыхательных путей смешанной этиологии вирусный компонент обычно предшествует бактериальному. Наслоение микробной инфекции нередко связывают с агрессией аутофлоры. При повторных ОРЗ, наряду с инфицированием новыми микроорганизмами, происходит активация латентной, персистирующей инфекции вирусного и бактериального генеза, что утяжеляет течение болезни, способствует хронизации процесса.
Ведущими отличительными признаками в клинической картине у ЧДБ детей являются: 1) резистентность (неотвечаемость) к традиционной терапии ОРЗ вирусной или бактериальной этиологии в соответствии с российскими формулярами; 2) проводимое традиционное лечение не предотвращает упорного рецидивирования (повтора) респираторных инфекций; 3) частота повторных инфекций превышает допустимый возрастной уровень и колеблется от 4–6–10 до 12–24 и более в год; 4) длительность ОРЗ превышает 7 дней и может колебаться от 8 до 14 и более дней; 5) ОРЗ вирусной этиологии провоцируют обострение хронических очагов бактериальной инфекции: хронического тонзиллита, хронических риносинуситов, хронического фаринготрахеита, хронического обструктивного бронхита и т. д.; 6) ОРЗ вирусной этиологии осложняется повторными пневмониями, резистентными к традиционной терапии.
Респираторные вирусы — облигатные внутриклеточные паразиты. Они различаются по своему строению и способам размножения. Одни из них вызывают острые инфекции и достаточно быстро элиминируются из организма хозяина, другие способны к персистенции.
К основным механизмам противовирусной защиты респираторного тракта относят: локальный иммунитет слизистых респираторного тракта (секреторный IgA, ИФН альфа, ИФН бета, провоспалительные цитокины, секретируемые эпителиальными клетками респираторного тракта), систему ИФН (ИФН альфа, ИФН бета, ИФН гамма), естественные киллерные клетки (CD3 + CD16 + CD56 + ), Т-клеточное звено иммунитета (CD3 + CD8 + ; CD3 + CD56 + ; CD8 + CD25 + ; CD3 + CD4 + ; CD8 + HLA-DR; CD4 + CD25 + ), гуморальные механизмы (нейтрализующие противовирусные антитела класса IgG). В настоящее время известно три основных типа ИФН: ИФН альфа, ИФН бета, ИФН гамма. В инфицированных вирусами клетках респираторного эпителия возрастает продукция ИФН альфа и ИФН бета. Эффекты ИФН альфа и ИФН бета: 1) активация противовирусных механизмов в неинфицированных клетках респираторного эпителия — протективный эффект, клетки приобретают невосприимчивость к вирусной инфекции; 2) активация генов с прямой противовирусной активностью. Антивирусные эффекты ИФН альфа и ИФН бета развиваются через несколько часов и длятся 1–2 дня.
Формирование иммунной системы и становление противовирусного иммунитета является результатом реализации генетической программы онтогенеза, для полноценного завершения которой необходима внешняя и внутренняя антигенная стимуляция. В этом аспекте неизбежные инфекции респираторного тракта у детей раннего возраста должны вести к иммунному тренингу организма. Склонность детей, особенно первых лет жизни, к ОРЗ отчасти обусловлена возрастными особенностями развития их ИС, в том числе и местного иммунитета. В свою очередь, слишком частые ОРЗ не могут негативно не влиять на становление ИС растущего организма, так, постоянная вирусно-бактериальная стимуляция ИС у детей ЧДБ ведет к возникновению нарушений ее функционирования, что сопровождается формированием стойкой иммунной недостаточности — вторичного иммунодефицита (ВИД). ВИД может быть представлен нарушениями как общего, так и местного иммунитета и носить комбинированный или изолированный характер.
В таблице приведена частота встречаемости нарушений различных механизмов противовирусного иммунитета у ЧДБ детей.
С целью повышения функциональной активности ИС, системы ИФН и ускорения восстановления их нарушенных функций, направленных на элиминацию вирусных и бактериальных антигенов, необходимо проведение заместительной и/или модулирующей иммунотерапии, восстанавливающей и модулирующей силу иммунного ответа, что должно обеспечить адекватный иммунный ответ на присутствие инфекционного патогена с последующей его элиминацией.
Тактика иммунотропной терапии при ВИД с синдромом вирусных и вирусно-бактериальных инфекций отличается тем, что в основе восстановления системы интерферонов и иммунной системы лежит базисная терапия отечественным рекомбинантным ИФН альфа-2 — Вифероном. Далее проводится необходимая иммунотерапия заместительного или модулирующего характера. При этом тактика иммунотерапии и, в первую очередь, ее длительность зависят от вида ВИД — острого или хронического. У детей ЧДБ, как правило, имеет место хронический или персистирующий ВИД, т. е. нарушения функционирования системы ИФН и иммунной системы существуют достаточно длительное время — от 6 месяцев до нескольких лет. Безусловно, при такой ситуации, в отличие от острых ВИД, когда иммунотерапия может занимать от 10 до 14 дней, проведение иммунотерапии в рамках программы иммунореабилитации детей ЧДБ занимает от 2,5–4,5 месяцев, в редких случаях до 2–3 лет.
Разработанная нами программа иммунореабилитации (Нестерова И. В., 1992) включает следующие положения:
Иммунотерапия, заместительного и модулирующего характера, органично включается в программы иммунореабилитации. К лекарственным препаратам, используемым для заместительной иммунотерапии, относятся внутривенные иммуноглобулины IgG и IgM обогащенные (Интраглобин и Пентаглобин), специфические иммуноглобулины против цитомегаловирусной инфекции (Цитотект), интерфероны (комплексный препарат рекомбинантного ИФН альфа-2 с антиоксидантами — Виферон в различных дозировках), тимические факторы (Тимоген, Тактивин).
С нашей точки зрения иммуномодулирующая терапия, используемая в лечении ЧДБ детей, должна иметь направленный характер: точкой приложения используемого иммуномодулирующего препарата должно являться то или иное поврежденное звено иммунной системы. При этом используется преимущественная направленность влияния(ний) иммуномодулятора. Так, для восстановления Т-клеточного звена предпочтительным является применение Тактивина, Тимогена, Имунофана, для восстановления гуморального звена, ЕКК, НГ Ликопида и Полиоксидония. Для восстановления системы ИФН — Виферона, который при определенных условиях обладает и иммуномодулирующими свойствами, направленными на восстановление Т-клеточного звена, системы нейтрофильных гранулоцитов. Для иммунопрофилактики и иммунотерапии бактериальных инфекций у детей ЧДБ может проводиться пролонгированная (в течение 5–6 месяцев) терапия топическими иммуномодуляторами — низкоиммуногенными вакцинами (ИРС 19, Имудон, Рибомунил, Бронхо-мунал и т. д.).
Интерферонотерапия с использованием Виферона обладает не только интерферонкорригирующей, иммуномодулирующей, но и противовирусной активностью и в большинстве случаев при возникновении ОРВИ может использоваться локально и системно, без синтетических противовирусных препаратов. Синтетические противовирусные препараты (Арбидол, Ремантадин) лучше использовать в остром периоде ОРВИ при среднетяжелом или тяжелом течении. При необходимости синтетические противовирусные препараты хорошо сочетаются с Вифероном. Хорошо известным фактом является повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, что по данным В. В. Малиновской (1998) служит основной причиной снижения противовирусной активности интерферона. С целью восстановления взаимоотношений между антиокислительной активностью плазмы крови и перекисным окислением липидов в состав препарата Виферон введены токоферола ацетат и аскорбиновая кислота — антиоксиданты, являющиеся мембраностабилизирующими компонентами. В сочетании с ними противовирусная активность рекомбинантного ИФН альфа-2 возрастает в 10–14 раз, при этом отсутствуют побочные эффекты (повышение температуры тела, лихорадка, гриппоподобные явления, психогенная депрессия), возникающие при парентеральном введении препаратов других природных и рекомбинантных ИФН. Ректальное введение Виферона и комбинация с антиоксидантами, по-видимому, обеспечивают эти позитивные эффекты, также как и быструю высокую концентрацию и длительную циркуляцию в крови ИФН альфа-2. Следующим позитивным моментом является установленный факт: при применении Виферона в течение двух лет не выявлены антитела, нейтрализующие противовирусную активность рекомбинантного ИФН альфа-2. Особенности лекарственной формы Виферона — мазь, гель, ректальные суппозитории в различных дозах создают возможность проведения локальной и системной интерферонотерапии.
Нами разработаны основные принципы дифференцированной терапии Вифероном при вторичных ВИД с синдромом повторных ОРВИ, т. е. для детей ЧДБ (Нестерова И. В., 2003; 2005; 2007):
Ниже приведена разработанная нами ранее программа терапии Вифероном для детей ЧДБ с повторными ОРВИ:
- Местное: обработка ротоглотки и интраназальное использование Виферон-мази: от 2–3 до 4–7 раз в день в течение 2–2,5 месяцев, возможно в сочетании с антисептиками.
- Системное: ректальное введение свечей в возрастной дозе (Виферон 150 000 МЕ — детям до 7 лет, Виферон 500 000 МЕ — детям старше 7 лет) курсом общей продолжительностью 2–2,5 мес:
• базисный курс 1 свеча, 2 раза в день, ежедневно — 10 дней;
• далее 1 свеча, 2 раза в день, 3 раза в неделю — 2 недели;
• далее 1 свеча, 2 раза в день, 2 раза в неделю — 2 недели;
• далее 1 свеча, 1 раз в день, 2 раза в неделю — 2 недели;
• далее 1 свеча, 1 раз в день, 1 раз в неделю — 2 недели.
Общая продолжительность курса 2,5–3,5 месяца.
NB! При необходимости (значительное снижение уровней индуцированного ИФН альфа!) начальная доза Виферона может увеличиваться в 1,5–2 раза, а курс лечения продлеваться до достижения позитивного клинического эффекта.
Использование описанных выше подходов в лечении детей ЧДБ позволяет получать позитивные результаты, которые можно видеть при оценке клинической эффективности лечения: значительно снижается количество ОРВИ с 10–18 в году до 2–3 в году, сокращается число бактериальных осложнений в 4–6 раз, ускоряется выход в клиническую ремиссию в 6–8 раз, длительность ремиссии увеличивается в 8–10 раз, с 7–10 дней до 100–150 дней, повышается качество жизни детей. Положительные клинические эффекты сопровождаются позитивной динамикой со стороны системы ИФН и иммунной системы.
И. В. Нестерова, доктор медицинских наук, профессор
Учебно-научный медицинский центр Управления делами Президента РФ, Москва
Таблица
Дефекты противовирусного иммунитета у ЧДБ детей (частота встречаемости в %)
- Дефекты продукции цитокинов (96,95%):
1.1. Дефект индуцированной продукции ИФН альфа (96,25%)
1.2. Дефект индуцированной продукции ИФН гамма (48,66%)
1.3. Дефицит сывороточного ИФН (24,33%) - Дефекты гуморального иммунитета (37,47%)
- Дефицит естественных киллерных клеток (ЕКК) (35,75%)
- Дефицит Т-клеточного звена (77,27%)
- Дефекты нейтрофильных гранулоцитов (НГ) (54,86%):
5.1. Нейтропения
5.2. Дефекты фагоцитоза
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Острая респираторная вирусная инфекция (ОРВИ) (риниты, синуcиты, фарингиты и пр.) может быть вызвана более чем 200 типами вирусов, однако наиболее распространенными возбудителями являются риновирус, коронавирус, респираторно-синцитиальный вирус или метапневмовирус. Вирус, повреждая эпителиальную выстилку, создает условия для активации микробной флоры (пневмококк, гемофильная палочка и др.), возникают вирусно-бактериальные ассоциации.
Лечение острой респираторной инфекции зависит от стадии заболевания и включает этиотропную терапию (борьбу с вирусом), симптоматическую терапию и мероприятия, направленные на предупреждение и лечение бактериальных осложнений. Средством для профилактики бактериального воспаления в полости носа и глотки является препарат, содержащий коллоидное серебро (Сиалор ® ), оказывающий вяжущее, антисептическое и противовоспалительное действие.
Протеинат серебра диссоциирует с образованием ионов серебра, которые препятствуют размножению бактерий, связываясь с их ДНК. В основе противовоспалительного механизма действия коллоидного раствора серебра на поврежденную слизистую оболочку лежит способность к образованию защитной альбуминатной пленки, уменьшающей проницаемость слизистой оболочки для бактерий и обеспечивающей нормальное функциональное состояние клеток, способствуя быстрому восстановлению слизистой оболочки. Все это особенно важно для профилактики вторичной бактериальной инфекции при ОРВИ.
Ключевые слова: острая респираторная вирусная инфекция (ОРВИ), лечение, профилактика бактериальных осложнений, серебра протеинат, Сиалор.
Для цитирования: Крюков А.И., Туровский А.Б., Колбанова И.Г. и др. Основные принципы лечения острой респираторной вирусной инфекции. РМЖ. 2019;8(I):46-50.
Guidelines for the acute respiratory viral infection treatment
A.I. Kryukov 1,2 , A.B. Turovskii 1,3 , I.G. Kolbanova 1 , K.M. Musaev 1 , A.B. Karasov 1
1 Sverzhevskiy Otorhinolaryngology Healthcare Research Institute, Moscow
2 Pirogov Russian National Research Medical University, Moscow
3 City Clinical Hospital named after V.V. Versaev, Moscow
Acute respiratory viral infection (ARVI) (rhinitis, sinusitis, pharyngitis, etc.) can be caused by more than 200 types of viruses, and the most common are rhinovirus, coronavirus, respiratory syncytial virus, or metapneumovirus. The virus, damaging the epithelial lining, creates the conditions for the microbial flora activation (pneumococcus, hemophilic bacillus, etc.), so that virus-bacterial associations arise. Acute respiratory infection treatment depends on the disease stage and can pursue 3 goals: causal therapy (virus control); symptomatic therapy; measures aimed at preventing and treating bacterial complications. A drug (Sialor ® ) for the bacterial inflammation prevention in the nasal cavity and pharynx contains colloidal silver, which has an astringent, antiseptic and anti-inflammatory effect. Silver proteinate dissociates to form silver ions, which inhibit the bacteria growth by binding to their DNA. The anti-inflammatory action mechanism of the colloidal silver solution on the damaged mucous membrane is based on the ability to form a protective albuminate film, which reduces the mucous membrane permeability for bacteria and ensures the normal functional state of cells, contributing to the rapid restoration of the mucous membrane. All this is especially important for secondary bacterial infection prevention in acute respiratory viral infections.
Keywords: acute respiratory viral infection (ARVI), treatment, bacterial complications prevention, silver proteinate, Sialor.
For citation: Kryukov A.I., Turovskii A.B., Kolbanova I.G. et al. Guidelines for the acute respiratory viral infection treatment. RMJ. 2019;8(I):46–50.
В статье рассмотрены основные принципы лечения острой респираторной вирусной инфекции, акцент сделан на возможности профилактики вторичной бактериальной инфекции.
Введение
В России основная нагрузка в лечении острой респираторной вирусной инфекции (ОРВИ) (ринитов, синуситов, фарингитов и пр.) ложится на врачей общего профиля — врачей общей практики, терапевтов и педиатров. У взрослых простуда встречается от 4 до 6 раз в год, у детей — от 6 до 8 раз в год; острая респираторная инфекция является причиной 40% случаев временной нетрудоспособности, в 30% случаев — причиной пропуска школьных занятий.
Простуда может быть вызвана более чем 200 типами вирусов, однако наиболее распространенными возбудителями являются риновирус, коронавирус, респираторно-синцитиальный вирус или метапневмовирус. Именно вирус, повреждая эпителиальную выстилку, создает условия для активации микробной флоры (пневмококк, гемофильная палочка и др.), возникают вирусно-бактериальные ассоциации.
Передача инфекции происходит главным образом контактным путем — через прикосновение к зараженным поверхностям с последующим попаданием в респираторный тракт, а не воздушно-капельным путем, как это было принято считать ранее. Иногда передача возбудителя инфекции возможна через предметы обихода, игрушки, белье или посуду.
Инкубационный период большинства вирусных инфекций — от 2 до 7 дней. Выделение вирусов больным максимально на 3-и сут после заражения, резко снижается к 5-м сут; неинтенсивное выделение вируса может сохраняться до 2 нед. Симптомы, вызванные простудными заболеваниями, обычно длятся от 1 до 2 нед., и большинство пациентов чувствуют себя лучше уже после 1-й нед. заболевания. Подавляющее большинство случаев простуды разрешается спонтанно. Осложнения встречаются крайне редко и, как правило, возникают у младенцев, очень пожилых людей с ослабленным иммунитетом и больных с хроническими заболеваниями.
Симптомы ОРВИ являются результатом не столько повреждающего влияния вируса, сколько реакции системы врожденного иммунитета. Пораженные клетки эпителия выделяют цитокины, в т. ч. интерлейкины, количество которых коррелирует как со степенью привлечения фагоцитов в подслизистый слой и эпителий, так и с выраженностью симптомов. Увеличение назальной секреции связано с повышением проницаемости сосудов, количество лейкоцитов в секрете может повышаться многократно, меняя его цвет с прозрачного на бело-желтый или зеленоватый, однако это не является признаком бактериального воспаления.
Принципы лечения ОРВИ
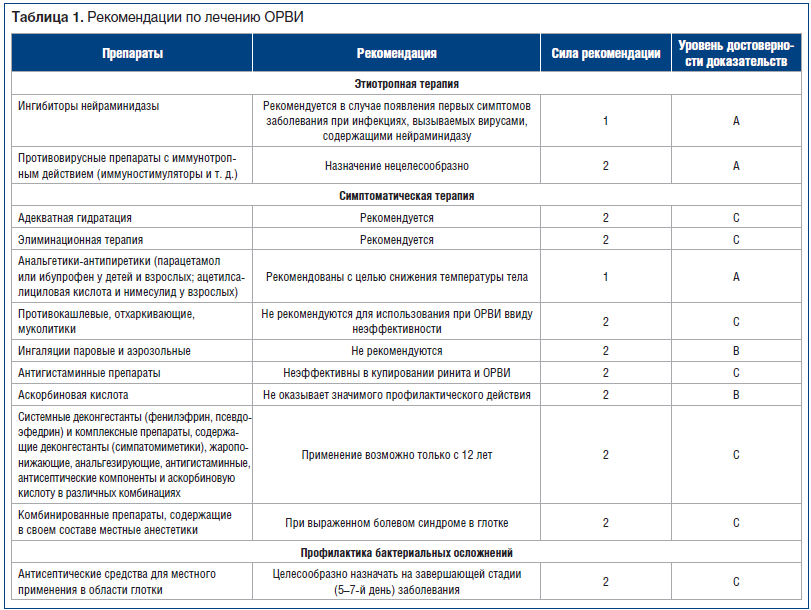
Лечение острой респираторной инфекции зависит от стадии заболевания и включает этиотропную терапию (борьбу с вирусом), симптоматическую терапию и мероприятия, направленные на предупреждение и лечение бактериальных осложнений (табл. 1).
Для профилактики бактериального воспаления также используют местные антибактериальные средства для введения в полость носа в виде мазей, капель, спреев. Эти препараты должны воздействовать на основные патогены и быть безопасными для слизистой оболочки.
Особенности этиотропной терапии ОРВИ
Этиотропная терапия рекомендована при гриппе А (в т. ч. H1N1) и В в первые 24–48 ч болезни [3]. Эффективны ингибиторы нейраминидазы: осельтамивир (с возраста 1 год) по 4 мг/кг/сут, занамивир ингаляционно (всего 10 мг) 2 р./сут, 5 дней [3]. Однако следует помнить, что для достижения оптимального эффекта лечение должно быть начато при появлении первых симптомов заболевания, кроме того, на вирусы, не содержащие нейраминидазы, данные препараты не действуют.
Противовирусные препараты с иммунотропным действием (иммуностимуляторы и т. д.) не обладают значимым клиническим эффектом, их назначение нецелесообразно [5, 6]. Достоверность результатов исследований эффективности использования иммуномодуляторов при респираторных инфекциях невысока.
Симптоматическое лечение ОРВИ
Ведущая роль в лечении респираторной инфекции принадлежит симптоматической терапии.
Адекватная гидратация способствует разжижению секрета и облегчает его отхождение.
Рекомендуется проводить элиминационную терапию, т. к. она эффективна и безопасна. Введение в нос физиологического раствора 2–3 р./сут обеспечивает удаление слизи и восстановление работы мерцательного эпителия [2, 6]. Рекомендуется назначение сосудосуживающих капель в нос (деконгестанты) коротким курсом — не более 5 дней. Данные препараты не укорачивают длительность насморка, но могут облегчить симптомы заложенности носа, а также восстановить функцию слуховой трубы.
С целью снижения температуры тела у детей рекомендуют применять парацетамол до 60 мг/кг/сут или ибупрофен до 30 мг/кг/сут [4, 7, 14]. У взрослых также можно применять ацетилсалициловую кислоту и нимесулид.
Противокашлевые, отхаркивающие, муколитики, в т. ч. многочисленные патентованные препараты с различными растительными средствами, не рекомендуются для использования при ОРВИ ввиду неэффективности [7, 8].
Ингаляции паровые и аэрозольные не рекомендованы к использованию, т. к. не показали эффекта в рандомизированных исследованиях, а также не рекомендованы Всемирной организацией здравоохранения (ВОЗ) для лечения ОРВИ [9, 10].
Антигистаминные препараты не показали эффективности в уменьшении симптомов ринита и ОРВИ [11].
Витамин C не оказывает значимого профилактического действия на среднестатистическое население, однако указанный эффект наблюдается у людей, находящихся в условиях стресса, например спортсменов [12].
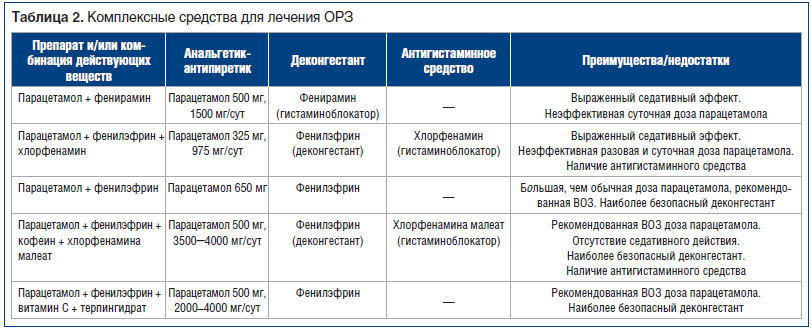
В последнее время широкое распространение получили системные деконгестанты (фенилэфрин, псевдоэфедрин) и комплексные препараты, содержащие деконгестанты (симпатомиметики), жаропонижающие, анальгезирующие, антигистаминные, антисептические компоненты и аскорбиновую кислоту в различных комбинациях. Данные препараты удобны в использовании и показывают сравнимую с другими препаратами своих групп эффективность, однако их применение возможно только с возраста 12 лет (табл. 2).
Для устранения сухости, саднения и болезненности в глотке лечение в основном местное и состоит в исключении раздражающей пищи, назначении полосканий теплыми щелочными и антибактериальными растворами, применении других местных симптоматических средств. Особый интерес представляют комбинированные препараты, например 2,4-дихлорбензиловый спирт и амилметакрезол в сочетании с различными биодобавками, для устранения клинических проявлений заболевания, способные снимать неприятные ощущения в горле, обладающие выраженным антибактериальным действием. При выраженном болевом синдроме в глотке системные анальгетики часто оказываются малоэффективными и применяются лишь в качестве антипиретиков. В этих случаях также применяются комбинированные препараты, содержащие в своем составе местные анестетики. В основном они представлены препаратами в виде аэрозолей и леденцов для рассасывания.
В состав аэрозолей обычно входят антибактериальные (хлоробутанолгидрат, фурациллин, сульфаниламид, сульфатиазол, хлоргексидин) компоненты, ментол, камфора, масла эвкалиптовое, вазелиновое, камфорное, касторовое, оливковое, мяты перечной, анисовое. Они обладают местноанестезирующим, антисептическим, противовоспалительным действием. Леденцы имеют сходный состав (антибактериальный компонент, ментол, масла), уменьшают болевые ощущения в горле и обладают дезодорирующим действием.
Профилактика бактериальных осложнений
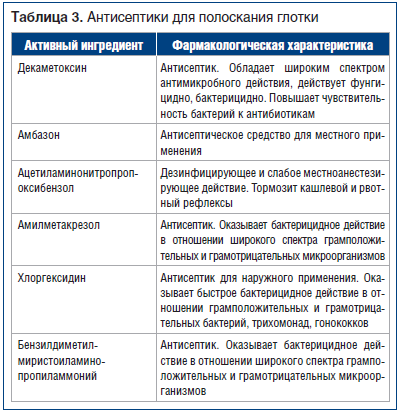
Препараты для профилактики бактериального воспаления при ОРВИ назначаются преимущественно местно, их целесообразно начинать использовать на завершающей стадии (5–7-й день) заболевания. Для этих целей используются полоскания растворами антисептиков (табл. 3).
Для профилактики бактериального воспаления в полости носа целесообразно использовать местные антибактериальные средства, такие как антибактериальные мази, содержащие мупироцин, возможно использование капель и спреев с антибиотиками.
Особняком среди препаратов для профилактики бактериального воспаления в полости носа и глотки стоит препарат, содержащий коллоидное серебро, — серебра протеинат (Сиалор ® ). Этот препарат оказывает вяжущее, антисептическое и противовоспалительное действие. В России традиционно 1–2% раствор протеината серебра использовали для местного лечения бактериальных инфекций верхних дыхательных путей, глаз, органов мочеполовой системы, в Советском Союзе протеинат серебра выпускался с 1964 г. в форме 2% раствора.
Протеинат серебра диссоциирует с образованием ионов серебра, которые препятствуют размножению бактерий, связываясь с их ДНК, таким образом, Сиалор ® обладает бактерицидным и бактериостатическим действием на большинство грамположительных и грамотрицательных бактерий, таких как Streptococcus pneumoniae, Staphylococcus aureus, Moraxella catarrhalis, грибковую флору и др.
В основе противовоспалительного механизма действия коллоидного раствора серебра на поврежденную слизистую оболочку лежит способность к образованию защитной альбуминатной пленки, возникающей за счет осаждения белков. Данная пленка уменьшает проницаемость слизистой оболочки для бактерий и обеспечивает нормальное функциональное состояние клеток, способствуя быстрому восстановлению слизистой оболочки. Все это особенно важно для профилактики вторичной бактериальной инфекции при ОРВИ.
Благодаря широкому антибактериальному спектру действия и уникальной способности к образованию защитной пленки на поверхности слизистой оболочки Сиалор ® обладает крайне широкими показаниями к применению. Этот препарат активно используется в повседневной практике не только для лечения, но и для профилактики инфекций полости носа и носоглотки в осенне-зимний период. Хорошие результаты дает терапия препаратом и при таких неинфекционных воспалительных заболеваниях, как аллергический и вазомоторный риниты.
Раствор готовят непосредственно перед применением (200 мг препарата растворяют в 10 мл воды для инъекций), хранят при комнатной температуре, можно использовать в течение 30 дней после приготовления. В очищенные носовые ходы вводят 1–2 капли 3 р./сут детям 3–6 лет,
2–3 капли (1–2 орошения для форм выпуска с насадкой-
распылителем) 3 р./сут детям старше 6 лет и взрослым
в каждый носовой ход. Длительность курса лечения составляет 5–7 дней [15].
Заключение
Правильная дифференциальная диагностика, оценка состояния пациента и своевременнное лечение ОРВИ с учетом стадии заболевания и грамотным подбором препаратов позволяют быстро купировать симптомы, значительно сократить сроки заболевания и время нетрудоспособности пациентов. Таким образом, при должном патогенетическом подходе, используя 1–2 лекарственных препарата, можно не только эффективно бороться со всем симптомокомплексом респираторных инфекций, но и предупредить развитие их осложнений.
Только для зарегистрированных пользователей
Аннотация научной статьи по клинической медицине, автор научной работы — Наумкина Е.В.
A place of herpes viruses in mixed genital infections caused by opportunistic microorganisms and the role of virobacterial associations in the given pathology were studied. The results of complex microbacterial study of vaginal samples taken from 108 patients were analyzed. Cytomegalovirus was more often revealed separately on the background of vaginal normocenosis as well as in association with Candida spp. At the same time, herpes viruses (HCVI and HCVII) more often associated with urogenital mycoplasmas and were found out in bacterial vaginosis. It was revealed that viral persistence in vaginal mucosa cells results in infringement of integrity of epithelial layer that opens opportunities for display of opportunistic microorganism pathogenic potential.
Похожие темы научных работ по клинической медицине , автор научной работы — Наумкина Е.В.
VIRUSES AND VIROBACTERIAL ASSOCIATION IN VAGINAL INFECTIONS
A place of herpes viruses in mixed genital infections caused by opportunistic microorganisms and the role of virobacterial associations in the given pathology were studied. The results of complex microbacterial study of vaginal samples taken from 108 patients were analyzed. Cytomegalovirus was more often revealed separately on the background of vaginal normocenosis as well as in association with Candida spp. At the same time, herpes viruses (HCVI and HCVII) more often associated with urogenital mycoplasmas and were found out in bacterial vaginosis. It was revealed that viral persistence in vaginal mucosa cells results in infringement of integrity of epithelial layer that opens opportunities for display of opportunistic microorganism pathogenic potential.
УДК 618-15-022.6/ 702 : 618.15-008.87
ВИРУСЫ И ВИРУСНО-БАКТЕРИАЛЬНЫЕ АССОЦИАЦИИ В ЭТИОЛОГИИ ИНФЕКЦИЙ ВЛАГАЛИЩА
Урогенитальные инфекции на современном этапе в большинстве случаев являются смешанными, что делает актуальным совершенствование диагностических подходов, а также изучение взаимного влияния участников микробных ассоциаций, определяющего особенности клинического течения этих заболеваний.
Доля микст-инфекций в структуре данной патологии, по данным разных авторов, варьирует от 51,9 [5] до 82% и выше [1, 3, 4]. Помимо отмечаемых различными исследователями устойчивых ассоциаций возбудителей бактериальной природы, встречаются сообщения о достаточно высокой доле участия вирусов в этиологии данной группы инфекций, а также о наличии вирусно-бакте-риальных ассоциаций.
Так, отмечена более высокая частота встречаемости бактериального вагиноза у больных ВИЧ-инфекцией [8], бактериального вагиноза и хламидиоза у женщин с папилломавирусной инфекцией гениталий [7], а также нарушения микробного пейзажа вагинальной микрофлоры с появлением условно-патогенных микроорганизмов у этой категории больных [2]. S. A. Ross et al. (2005) [6] выявили достоверную ассоциативную связь между цитомегаловирусной инфекцией урогенитального тракта и бактериальным вагинозом.
Целью настоящего исследования явилось изучение места герпес-вирусов в этиологии
урогенитальных смешанных инфекций, вызванных условно-патогенными возбудителями, и роли вирусно-бактериальных ассоциаций в этой патологии.
В образцах вагинального отделяемого от 108 больных методом полимеразной цепной реакции проводилось обнаружение цитоме-галовируса (CMV), а также вирусов герпеса I и II типов (HSV I и HSV II).
Параллельно проводилось изучение состояния вагинального микробиоценоза. Комплексное обследование включало микроскопию мазка по общепринятой мeтодикe и количeствeнный посeв на расширeнный набор потальных срeд, предусматривающий выделение широкого круга аэробных, факультативно-анаэробных, микро-аэрофильных, облигатно-анаэробных микроорганизмов, а также микоплазм и уреа-плазм. Посевы инкубировали аэробно при 37°С в эксикаторе со свечой, а также анаэробно с использованием Genbox anaer (BioMereiux) до 5 суток.
Возбудители герпес-вирусных инфекций были обнаружены более чем у половины обследованных больных (54,6%). Этиологическая структура герпес-вирусных инфекций урогенитального тракта следующая.
Наибольший удельный вес в структуре вирусных инфекций занимает цитомегалови-русная инфекция изолированно (45,7%) или в сочетании с герпес-вирусами I и II типов (22% CMV + HSV I + HSV II; 3,4% CMV + HSV II
Пермский медицинский журнал
2008 том XXV № 3
и 1,7% CMV + HSV I). В 6,8 и 3,4% выявлялись HSV I и HSV II соответственно, и у 20,3% больных герпес-вирусы обоих типов были выявлены одновременно.
Состояние вагинального микробиоценоза при вирусных инфекциях демонстрирует рис. 1.
70 60 50 40 30 20 10 0
Рис 1. Характеристика вагинального микробиоценоза на фоне вирусной инфекции
Цитомегаловирус достоверно чаще выявлялся изолированно на фоне нормоценоза вагинальной микрофлоры, а также в ассоциации с дрожжеподобными грибами рода Candida. В то же время герпес-вирусы чаще ассоциировались с микоуреаплазмами и обнаруживались при бактериальном вагинозе. Сочетание с неспецифическими возбудителями регистрировалось достаточно часто для всех вирусов, и показатели были приблизительно на одном уровне.
Определенный интерес вызывает вопрос о влиянии присоединения вирусной инфекции на интенсивность воспалительного процесса и тяжесть клинических проявлений заболевания при дисбиотических процессах.
Выраженность местной воспалительной реакции в зависимости от этиологии вирусной инфекции и состава ассоциаций представлена на рис. 2.
Горизонтальная линия на рисунке показывает среднее число лейкоцитов в вагиналь-
Рис. 2. Выраженность местной лейкоцитарной реакции
в зависимости от этиологии вирусной инфекции
ном мазке у тех больных, у которых вирусы не были обнаружены. Этот показатель составил 9,57+3,71. В случаях присоединения герпес-вирусной инфекции число лейкоцитов было ниже - 6,5±1,7. Вероятно, данный факт отчасти можно обяснить сочетанием герпес-вирусов в высоком проценте случаев с бактериальным вагинозом, для которого характерен низкий лейкоцитоз ввиду инги-бирующего влияния продуктов метаболизма гарднерелл и облигатных анаэробов на лейкоцитарную активность.
Зато в случаях выявления цитомегалови-руса, в особенности в составе ассоциаций из двух вирусов и более, или при выявлении ви-русно-бактериальных ассоциаций выраженность местной воспалительной реакции существенно увеличивалась (11,53±3,04; 14,4± ± 3,8 и 12,5±2,5 соответственно).
Таким образом, проведенное исследование обнаружило, что возбудители уроге-нитальных инфекций вирусной природы занимают существенное место в структуре этой патологии. Персистирование вирусов в клетках слизистой оболочки приводит к нарушению целостности эпителиального слоя, открывая возможности для проявления патогенного потенциала условно-патогенных микроорганизмов, входящих в состав нормальной микрофлоры влагалища.
1. Значение молекулярных и микробиологических методов диагностики для обоснования этиопатогенетической терапии урогенитального микоплазмоза/В. Н. Че-боткевич и др.//Генодиагностика инфекционных заболеваний: тез. докл. V Всерос. науч.-практ. конф.- М., 2004.- С. 139-141.
2. Онкогенные типы ВПЧ у женщин с заболеваниями шейки матки/Н. П. Евстигнеева и др.//Генодиагностика инфекционных заболеваний: тез. докл. IV Всерос. науч.-практ. конф.- М., 2002.- С. 24-25.
3. Особенности микробного пейзажа и определение терапевтических подходов на фоне урогенитальной хламидийной инфекции у женщин/Д М. Мосин и др.//Клин. лаб. диагностика.- 2000.- № 10.- С. 44.
4. Рюмин, Д. В. Лабораторно-диагностиче-ский скрининг при обследовании больных с инфекциями, передаваемыми половым путем/Д. В. Рюмин, В. Е. Радзинский// Клин. лаб. диагностика.- 2000.- № 10.-С. 13.
5. Якубович, А И. Структура урогенитальной патологии у мужчин, обратившихся в кабинет анонимного обследования и лечения в 2000-2002 гг./А. И. Якубович, А Е. Чупин, А. Р. Корепанов///Журн. инфекционной патологии.- 2003.- Т. 4.- № 10.- С. 120-121.
6. Association betveen genital tract cytomegalovirus infection and bacterial vaginosis/ S. A. Ross et al.//J. Infect. Dis.- 2005.-Vol. 192.- № 10.- P. 1727-1730.
7. Increased frequency of bacterial vaginosis and chlamydia trachomatis in pregnant women with human papillomavirus infec-
tion/C. S. da Silva et al.//Gynecol. Obstet. Invest.- 2004.- Vol. 58.- № 4.- P. 189-193. 8. Longitudinal analysis of bacterial vaginosis: findings from the HIV epidemiology research study/Д J. Jamieson et al.//Obstet. Gynecol.-2001.- Vol. 98.- № 4.- P. 656-663.
VIRUSES AND VIROBACTERIAL ASSOCIATION IN VAGINAL INFECTIONS
A place of herpes viruses in mixed genital infections caused by opportunistic microorganisms and the role of virobacterial associations in the given pathology were studied. The results of complex microbacterial study of vaginal samples taken from 108 patients were analyzed. Cytomegalovirus was more often revealed separately on the background of vaginal normocenosis as well as in association with Candida spp. At the same time, herpes viruses (HCV I and HCV II) more often associated with urogenital mycoplasmas and were found out in bacterial vaginosis. It was revealed that viral persistence in vaginal mucosa cells results in infringement of integrity of epithelial layer that opens opportunities for display of opportunistic microorganism pathogenic potential.
Keywords: herpes viruses, opportunistic microorganisms, infringement of integrity of epithelial layer.
Омская государственная медицинская академия
Читайте также:


