Выделение вируса гриппа набор
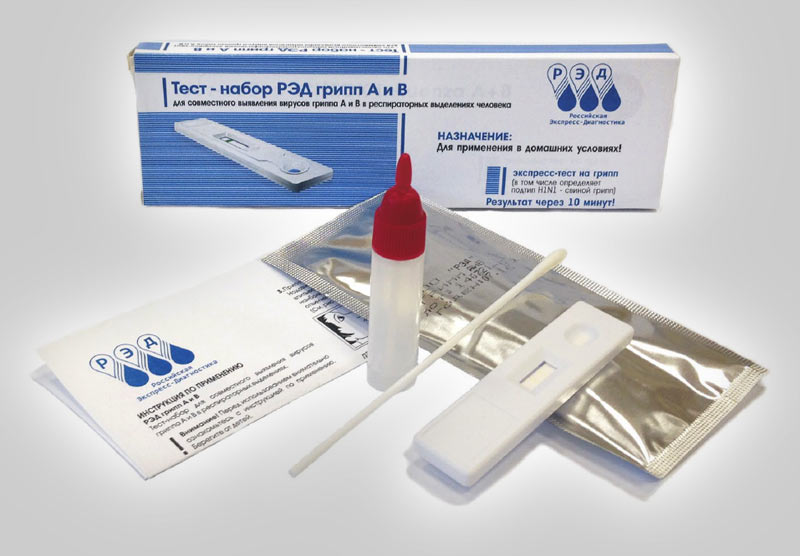
- Форма выпуска: вариант 1: индивидуальная упаковка / 1 исследование; вариант 2: набор / 10 исследований
- Назначение: тест иммунохроматографический для выявления вирусов гриппа А и В в респираторных выделениях
Инструкция по применению
Регистрационное удостоверение: №ФСР 2012/13624 от 29.06.2012
Возбудителем гриппа является вирус, который поражает, главным образом, верхние дыхательные пути – нос, горло, бронхи, реже – лёгкие. Заболевание обычно длится одну-две недели и характеризуется высокой температурой, миалгией, головной болью, недомоганием, сухим кашлем, болью в горле и ринитом.
Для детей, пожилых людей и людей, страдающих заболеваниями лёгких, почек, сердца, диабетом, раком, грипп представляет серьёзную опасность. Эта инфекция может вызвать осложнения основных заболеваний, пневмонию и смерть.
Заболевание человека вызывают, как правило, два типа гриппа – тип А (подтипы H3N2 и H1N1) и тип В. Причиной смертей от гриппа чаще всего является вирус А подтипа H3N2.
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце вируса гриппа А и/или вируса гриппа В они вступают в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против вируса гриппа А и специфическими моноклональными антителами против вируса гриппа B, меченными окрашенными частицами, и продолжают движение с током жидкости. В соответствующих аналитических зонах тест-полоски происходит взаимодействие со специфическими моноклональными антителами против вируса гриппа А и/или вируса гриппа В, иммобилизованными на поверхности мембраны, с образованием окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале вируса гриппа А и/или вируса гриппа В.
В том случае, если в анализируемом образце присутствует вирус гриппа А и вирус гриппа В, на тест-полоске образуются три параллельные окрашенные линии (красная и синяя аналитические, обозначенные буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа по вирусам обоих типов. В случае отсутствия в анализируемом образце вируса гриппа А и вируса гриппа В на тест-полоске образуется одна зелёная контрольная линия (С), что указывает на отрицательный результат анализа по вирусам обоих типов.
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силика-гелем.
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Свежесобранный биологический материал (респираторные выделения из носовой полости человека), не содержащий консерванты.
Образцы респираторных выделений до определения можно хранить при температуре 2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены до комнатной температуры.
1. Ввести стерильный ватный тампон на зонде приблизительно на 3 см в одну ноздрю и, вращая его, взять мазок со стенок носового хода (рис. 1-1).
2. Внести в одноразовую пластиковую пробирку из флакона с крышкой-капельницей 15 капель буфера для растворения образца (рис. 1-2).
 |  |  |
| 1. Взять мазок со стенок носового хода | 2. Внести 15 капель раствора для образца | 3. Вращать тампон в пробирке, выжать жидкость |
3. Поместить тампон с образцом в пробирку, смыть образец, вращая тампон по стенкам пробирки минимум 10 раз. Выдавить жидкость из тампона, сдавливая его стенками пробирки (рис. 1-3). Выбросить тампон.
 |  |
| 1 | 2 |
6. Через 10 мин визуально оценить результат реакции.
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа по обоим типам вируса, т.е. указывает на отсутствие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-1).


Выявление в тестовом окошке кассеты трёх параллельных окрашенных линий (зеленой, красной и синей) свидетельствует о положительном результате анализа по обоим типам вируса, т.е. указывает на наличие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-2). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и красной) свидетельствует о положительном результате анализа по вирусу гриппа А, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа А и отсутствие вируса гриппа В (рис. 3-3). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и синей) свидетельствует о положительном результате анализа по вирусу гриппа В, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа В и отсутствие вируса гриппа А (рис. 3-4). Интенсивность окраски красной и синей аналитических линии может меняться в зависимости от концентраций, соответственно, вируса гриппа А и вируса гриппа В в образце.
Таблица 106 - Обозначения серотипов вируса гриппа А птиц
Таблица 105 - Номенклатура субъединиц вирусов гриппа рода А

Согласно Международной номенклатуре любой штамм вируса гриппа рода А обозначается по следующей схеме: род/источник изоляции/место изоляции/ собственный номер изолята/год изоляции/формула вида - серотипы ГА и нейраминидазы. Для штаммов, изолированных от человека, источник изоляции не пишется; для всех других штаммов год изоляции обозначается 2-мя последними цифрами. Семейство ортомиксовирусов (от греч. orthos -правильный, прямой и mуха - слизь) включает три рода: вирусы гриппа А и В, вирусы гриппа С и тоготоподобные вирусы.
Типичным представителем рода вирусов гриппа А и В является вирус гриппа A/PR/8/34(H1N1). Вирионы представляют собой частицы плеоморфной, чаще округлой формы, диаметром 80-120 нм. Они состоят из фрагментированного нуклеокапсида спиральной симметрии диаметром 9-15 нм и липопротеидной оболочки, на поверхности которой имеются выступы длиной 10,0-13,5 нм. Мол. м. вирионов 250 МД,
Геном состоит из 8-и неодинаковых по размеру (900-2350 нуклеотидов) фрагментов 1-спиральной минус-РНК. Вирионная РНК ортомиксовирусов не обладает инфекционностью. В вирионах обнаружено 7 белков, 4 из которых (РВ1, РВ2, РА, NP) связаны с нуклеокапсидом, а 3 (НА, NA, Ml) входят в состав липопротеидной оболочки, причем 2 из них (НА и NA) являются гликопротеинами. Гликопротеины образуют 2 вида выступов наружной оболочки вирионов. Выступы 1-го вида образованы гемагглютинином (НА) с мол.м. 75-80 кД (около 500 а.к.). Каждый выступ состоит из 3-х молекул НА, которые организованы в палочкообразную структуру. Каждая молекула НА в свою очередь состоит из 2-х субъединиц (НА 1-330 а.к., НА 2-22 - а.к.), соединенных дисульфидной связью. НА ответственен за адсорбцию и проникновение вирионов в клетку и ГА-активность вируса. AT к НА нейтрализуют инфекционность вируса и подавляют его ГА-активность. Выступы 2-го типа образованы нейраминидазой (NA) с мол.м. 60-70 кД (450-470 а.к.). Все подтипы НА и NA вируса гриппа А обозначают последовательными номерами независимо от происхождения вируса. Установлено 14 АГ подтипов по НА и 9 подтипов по NA. Вирус гриппа В не подразделяют на АГ подтипы. Синтез вирусспецифических белков происходит в цитоплазме клетки.
В естественных условиях вирус гриппа А поражает человека, свиней, лошадей и птиц, а вирус гриппа В - только человека. Передаются вирусы аэрогенным путем.
Типичный представитель рода вирусов гриппа С - вирус гриппа C/Taylor/1233/47. Вирус гриппа С обнаружен у человека и свиней.
В состав рода тоготоподобные вирусы входят вирусы Тогото (прототипный вирус) и Дори, переносимые клещами и иногда поражающие человека. Морфологически они сходны с другими ортомиксовирусами и содержат 6-7 фрагментов 1-спиральной минус-РНК.
Грипп кур (классическая чума птиц, грипп птиц А1, подтип 7, экссудативный тиф) - острая контагиозная вирусная болезнь, характеризующаяся общим угнетением, отеками, поражением органов дыхания и пищеварения.
В настоящее время грипп птиц в форме КЧП регистрируется редко. Чаще инфекция проявляется эпизоотическими вспышками, вызываемыми штаммами других АГ подтипов с более низкой, чем вирус КЧП, патогенностью. Такие вспышки зарегистрированы в США, Италии, Англии, ФРГ, СССР и других странах. Вирусы гриппа птиц (ВГП) выделены от кур, индюков, уток, перепёлок, фазанов, глухарей, длиннохвостых попугаев, цесарок и др.
Антигенная вариабельность и родство. В настоящее время вирусы гриппа А птиц на основании их поверхностных АГ - ГА (Н) и нейраминидазы (N) - разделены на 13 по Н-АГ и 9 вариантов по N-АГ (табл. 106). Штаммоспецифические АГ-связи определяются с помощью: РТГА - для определения сходства по ГА; РТНА - для определения сходства или различия по НА; теста двойной диффузии - для определения сходства ГА и НА. У штаммов вируса гриппа А птиц, имеющих АГ характеристику H1N1, выявлено не менее 4 АГ детерминант нейраминидазы. Четкие различия выявлены также у НА штаммов вируса гриппа А птиц с АГ формулой H3N8, следовательно, НА штаммов вируса гриппа А птиц с АГ характеристиками H1N1 и H3N8 имеет на своей поверхности не менее 4-х АГ различных детерминант: 1 общую для вирусов, имеющих одинаковый сероподтип, 2 - перекрестно реагирующих и 1 - штаммоспецифическую.
| Серовариант | Наименование штамма | Формула |
| 1. | А/утка/ Ал ьберта/3 5/7 6/ | H1N1 |
| 2. | А/утка/Германия/ 1215/73 | H2N3 |
| 3. | А/утка/Украина 1/63 | H3N8 |
| 4. | А/угка/ЧССР/56 | H4N6 |
| 5. | А/крачка/Ю . Африка/6 1 | H5N3 |
| 6. | А/индюк/Массачусетс/3 740/65 | H6N2 |
| 7. | А/вирус чумы птиц/Росток/34 | H7N1 |
| 8. | А/утка/Онтарио/б 1 1 8/68 | H8N4 |
| 9. | А/индюк/Висконсин( 1 /66) | H9N2 |
| 10. | А/цыпл енок/Германия/4 9 | H10N7 |
| 11. | А/Утка/ Англ ия/5 6 | H1IN6 |
| 12. | А/утка/ Альберта/60/ 1 6 | H12N5 |
| 13. | А/черноголовый хохотун/ Астрахань/ 142/7 | H13N2 |
Кроме 13 подтипов ГА, все штаммы ВГП содержат в своей структуре НА или птичьего, или человечьего, или лошадиного происхождения. Собственно птичьей НА известно 6 типов, Подтиповая классификация ВГП продолжается и по сегодняшний день, т.к. новые факты выделения их от птиц различных видов регистрируются ежегодно в различных регионах земного шара. В 1971 г. была опубликована номенклатура вирусов гриппа А, рекомендованная группой экспертов ВОЗ. Согласно этой рекомендации каждый штамм обозначается по месту и времени выделения, а в скобках указывается его АГ формула. Эта номенклатура себя оправдала, однако накопившиеся за последние годы данные требуют ее пересмотра В 1980 г. ВОЗ предложила новую номенклатуру ВГП. Предложено обозначать серотипы ГА и НА последовательными номерами, независимо от происхождения вирусов. Таблица эталонных штаммов ВГП свидетельствует о том, что изменения нуклеотидной последовательности и, как следствие, замена аминокислотных остатков сопряжено с изменением патогенности вируса гриппа в отношении птиц и КЭ. Так, например, изолят А/индюк/Висконсин/68

(H5N9) ВГП состоит из 2-х популяций вируса, имеющих разные гены NS и вызывающих разные биологические реакции. Анализ АГ свойств методами ИФА и РТГА свидетельствует о родстве внутренних белков "человеческих" и "птичьих" вирусов гриппа и различиях в структуре поверхностного гликопротеина - ГА.
Спектр патогенности в естественных условиях. Он неоднороден и зависит от АГ подтипа. Известны 2 подтипа ВГП; А5 и А7, вызывающих заболевание типа КЧП. Грипп А7 КЧП чаще поражает птиц семейства куриных, менее восприимчивы водоплавающие птицы.
Дикие утки и др. виды водоплавающей птицы также чувствительны даже к самым слабопатогенным штаммам ВГП и являются не только переносчиками инфекции, но и резервуаром. Сезонные миграции диких птиц вызывают сезонные заболевания болотных птиц.
Из 14 подтипов вируса гриппа А только 3 обнаруживаются у человека (Н1, Н2 и НЗ). Прошло уже 25 лет с тех пор как из человеческой популяции исчез подтип Н2 вируса гриппа. Однако ген ГА Н2 циркулирует среди птичьих штаммов вируса гриппа.
Поставить диагноз на грипп птиц можно путём выделения вируса и идентификации его в РСК, РН и РТГА, а также выявления специфических AT в процессе эпизоотии или по прошествии её (ретроспективная диагностика). В нашей стране биопромышленность выпускает 2 диагностических набора:
а) набор специфических АГ и сывороток к ним для диагностики гриппа птиц 13-и серотипов;
б) диагностический набор для идентификации вируса НБ и Ш (актуального эпизоотического типа).
Выделение вируса.Взятие и подготовка материала. В качестве вируссодержащего материала используют селезёнку, головной мозг, синусы, трахею, лёгкие, воздухоносные мешки, кишечник от больной птицы или свежих трупов. Материал в лабораторию доставляют в замороженном виде в термосе со льдом. Инфекционные титры вируса в назальных смывах бывают максимальными через 2-4 дня после заражения птицы и достигают 10 5 -10 7 ЭИДзо/мл смыва. Изолировать вирусы из клоачных смывов удаётся чаще всего на 5-8-й день после экспериментального заражения птицы.
Заражение куриных эмбрионов. Испытуемую суспензию инокулируют 9-10-дн КЭ (не менее 5 на одну пробу) в аллантоисную или амниотическую (лучше) полости общепринятым методом и инкубируют в течение 72 ч. Экстраэмбриональную жидкость каждого эмбриона раздельно проверяют на ГА-активность капельной РГА с 1 %-ной взвесью эритроцитов кур. При отсутствии положительной РГА проводят еще 3-5 слепых пассажей, используя для заражения КЭ эмбриональную жидкость предыдущего пассажа. Если титры ГА низкие, проводят таким же образом еще 2-3 дополнительных пассажа. Проба испытуемого материала считается отрицательной, если в 3-5 слепых пассажах не будет обнаружено ГА и патогенного действия вируса (гибели КЭ). При положительной РГА проводят идентификацию выделенного вируса.
Заражение культуры клеток. Вирус после 2-5 пассажей хорошо развивается в культуре фибробластов КЭ. ЦПД обычно проявляется через 24-48 ч (в зависимости от дозы и адаптации). Присутствие его устанавливают при помощи РГА и РГАд. Предложен ускоренный метод титрования инфекционности вируса гриппа в культуре клеток путем подсчета гемадсорбирующих клеток. Метод позволяет получить результат через 8 ч после заражения.
Биопроба на цыплятах. Испытуемую суспензию инокулируют цыплятам 2-3-месячного возраста. Летальную инфекцию у цыплят можно вызвать при любом методе заражения (подкожно, внутримышечно, в мозг, конъюнктиву) подтипами А1, А7 и А5. Заражение per os с кормом и водой удается непостоянно, лишь в случае высокой патогенности эпизоотического изолята гриппа. Зараженные цыплята, как правило, гибнут через 36-72 ч в зависимости от дозы и вирулентности возбудителя.
Индикация и идентификация вируса. Для этой цели широко используют методы ИФ, цитоскопию, биопробу (на птице и КЭ) и серологическую идентификацию. С помощью монАТ можно идентифицировать не только разные группы вирусов (ВГП и ПМВ), но и определять подтипы ВГП и серотипы ПМВ птиц, и даже штаммы внутри одного подтипа, а также локализацию компонентов вириона в зараженных клетках (МРВГП - МА клонов 1С6, 5С10, N:2 - МА клоны 303 и т.д.). На основе монАТ можно готовить диагностические препараты для выявления АГ и AT в РТГА, НИФ, РСК, ИФА и др. реакциях.
РГА. Для индикации вируса в патологическом материале можно использовать РГА. Надосадочную жидкость после центрифугирования суспензии проб из органов и тканей больной птицы, а также смывов исследуют в капельной или пробирочной РГА с 1%-ной суспензией эритроцитов кур или 0,5%-ной взвесью эритроцитов морской свинки. Реакцию учитывают через 20 мин и 1 ч. Специфичность определяют в РТГА.
Цитоскопия. Метод заключается в исследовании тканевых элементов в отпечатках, полученных со слизистой оболочки верхних дыхательных путей (лучше) и органов. Препараты высушивают и окрашивают одним из методов: по Романовскому, Пигаревскому, Быковскому и т. п. При окраске по Быковскому и Пигаревскому в цитоплазме клеток при гриппе обычно обнаруживают тельца-включения ярко-красного цвета; при окраске по Романовскому - фиолетового цвета. Внутриклеточные включения находят не только в клетках цилиндрического эпителия, но и в цитоплазме макрофагов, лейкоцитов и плоского эпителия. В настоящее время этот принцип исследования используется с применением люминесцентной микроскопии.
Метод простого флюорохромирования. На мазки-отпечатки из органов и смывов наносят 1-2 капли рабочего раствора акридина оранжевого (1:10000), покрывают покровным стеклом и свежий препарат (в течение 10 мин после приготовления) рассматривают в люминесцентном микроскопе. Ядра клеток выявляются по изумрудно-зеленому свечению, РНК плазмы клеток - в виде не резко ограниченных гранул красного или оранжевого цвета. В препарате, имеющем вирус гриппа, выявляются включения в виде четко отграниченных ярко-красных гранул в цитоплазме клеток.
Грипп - болезнь очень коварная и чревата серьезными осложнениями. Чем раньше установлен диагноз "грипп", тем быстрее и эффективнее его лечение.
От подруги в Москве услышала, что существуют такие тест-полоски, кстати, с ними московские педиатры посешают пациентов. Врачи проводят анализ в случае подозрения на грипп. И назначают соответствующее лечение.
В феврале этого года у дочки слегка поднялась температура, и начался лёгкий кашель. А днём ранее заболел гриппом ребёнок, с которым дочь была в контакте.
При первых же симптомах мы вызвали врача. Всё, что он увидел: лёгкий кашель и температура 38, не повод паниковать. Однако, по моей просьбе он на всякий случай расписал лечение гриппа, если диагноз подтвердится.
Сомнений в том, что это именно грипп было мало, но стоило всё-таки подтвердить диагноз. Мы взорвали весь интернет, обзвонили не одну аптечную сеть, и на другом конце города мужу удалось купить тест-полоски.


Набор для проведения самостоятельного анализа очень прост в использовании.

Инструкция по проведению анализа:


1. Вскрывается стерильная ватная палочка, затем необходимо пошкрябать ей в носике у ребёнка, при этом в инструкции чётко написано, что надо не только слизь но именно с кожи снять то, что сидит непосредственно на слизистой.
2. Ватную палочку с содержимым носа поместить во флакончик со специальным раствором, тщательно перемешать и максимально отдать;
3. 4 капли раствора аккуратно аккуратно накапать в круглое окошко тест-кассеты;
4. Через 10 минут оценить результат:
На упаковке всё хорошо схематично изображено:
- Зеленая полоска - тест сработал;
- Наличие красной полоски говорит о том, что имеется вирус гриппа A;
- Наличие зелёной полоски говорит о том, что присутствует грипп типа B.
- Отсутствие полос вообще - тест недействителен
У нас не с первого раза удалось пошкрябать в носу у дочки, она маленькая и сильно сопротивлялась. Пришлось достать палочку из другого набора. По-этому родителям маленьких детей рекомендую в аптеке взять по запас ещё парочку стерильных палочек.
Тест-полоска показала результат: зелёная и красная полоска, значит вирус гриппа типа А (болели в феврале, к сожалению, фотографию найти не смогла). С одной стороны страшно, с другой стороны мы уже знаем с чем имеем дело, и лечение от врача у нас уже расписано. Зная, что у дочери грипп, я уже не падала в обморок, когда видела на градуснике температуру 40,2. (Днём ранее подруга писала, что у них температура поднималась до 40,7).
Вылечить ребенка от гриппа удалось очень быстро, но иммунитет был убит, после этого болели практически без перерыва.
По неволе пришлось опробовать на одном и том же вирусе разные препарата.
Педиатр назначил ребёнку Тамифлю - мой отзыв об особенностях данного препарата.
Терапевт назначил Арбидол - отзыв о препарате.
Преимущества:
1. Цена. Несмотря на то, что тест дорогой, это дешевле чем в лаборатории и намного дешевле, чем вызвать сотрудника лаборатории на дом;
2. Скорость: результат готов в течении 10 минут;
3. Хорошая инструкция достаточно прост в использовании.
Недостатки:
1. Очень трудно раздобыть: обзвонила очень много аптечных сетей, тест-полос нет, а некоторые даже не знают о существовании таких.
Вывод:
Необходимо иметь такой набор, если в доме есть беременные и дети.
Взрослые и крепкие мужчины от гриппа лежат в бреду, беременным женщинам грипп крайне опасен. Чем раньше начать лечение, тем эффективнее и безболезненно оно пройдёт.
PS когда дочь болела, я была беременна, к счастью, срок позволил пропить "Арбидол" по схеме профилактики при контакте с больным и не заболеть.
PPS Будьте здоровы, берегите себя и близких.
Выявление вируса гриппа серотипов А и В (Influenza virus A/B), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (РНК) вируса в образце биоматериала.
Синонимы английские
Influenza serotypes A/B, RNA [real-time polymerase chain reaction, RT-PCR, quantitative RT-PCR, qPCR, qRT-PCR].
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки) и носа, мокроту.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (воды) за 8-12 часов до сбора мокроты.
- Не принимать пищу, не пить и не полоскать горло в течение 2-3 часов до исследования.
- За 3-4 часа до взятия мазков из ротоглотки (зева) и носа не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не закапывать капли/спреи в нос, не жевать жевательную резинку, не курить. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
Influenza virus – это оболочечный вирус, характеризующийся наличием сегментированного негативного РНК-генома и нуклеокапсида в форме спирали. Он относится к семейству Orthomixoviridae. На основании структурных различий нуклеопротеида выделяют 3 серотипа Influenza: A, B и С. Серотип A встречается как людей, так и у животных, в то время как варианты B и C поражают преимущественно людей. Именно серотип А ответственен за подавляющее большинство случаев сезонных (эпидемических) и пандемических вспышек гриппа.
Идентификация вируса гриппа должна быть осуществлена в кратчайшие сроки, что связано с высокой заразностью этого заболевания. Кроме того, эффективность противовирусных препаратов максимальна при их назначении в первые 48 часов после инфицирования, что также диктует необходимость своевременной постановки окончательного диагноза. Среди многих "быстрых" диагностических тестов особое место занимает полимеразная цепная реакция в режиме реального времени (РТ-ПЦР). Полимеразная цепная реакция в реальном времени (РТ-ПЦР) – это метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в мокроте) фрагменты генетического материала (РНК) возбудителя инфекции. Благодаря высокой чувствительности и специфичности метода, а также возможности получить результат в наболее короткие сроки, РТ-ПЦР заменила другие, применяемые ранее, методы диагностики гриппа: выделение вируса в культуре клеток, а также серологические исследования и иммуноферментный анализ.
Многие прямые лабораторные тесты, разработанные для идентификации Influenza, основаны на выявлении белковых компонентов наружной оболочки вируса: гемагглютинина (H) и нейраминидазы (N). Эти белки являются основными факторами, определяющими степень болезнетворности вируса, а также используются для диагностики и классификации выявляемого вируса гриппа. Они обладают выраженной изменчивостью (известно 16 разновидностей N и 9 разновидностей H серотипа Influenza A) (чем вызваны ежегодные сезонные вспышки гриппа), а также создает определенные трудности при идентификации вируса гриппа с помощью этих методов. Структурное разнообразие антигенов H и N приводит к тому, что чувствительность большинства прямых лабораторных тестов (таких как прямая иммунофлюоресценция и ELISA) составляет около 65-75 %. Исследование РТ-ПЦР основано на выявлении консервативной последовательности ДНК, общей для разных штаммов вируса гриппа серотипов А и В, что обуславливает максимальную чувствительность этого теста (98-100 %).
В отличие от других тестов, чувствительность исследования РТ-ПЦР практически не изменяется при взятии материала на фоне начатой терапии противовирусными препаратами. Это связано с тем, что в реакции выявляется не сам вирусный агент, а фрагмент вирусной ДНК. По этой же причине положительный результат исследования не всегда указывает на наличие живого вируса (репликацию) и не всегда означает, что пациент остается заразным для окружающих.
В отличие от других лабораторных тестов (в первую очередь, экспресс-тестов для определения антигена вируса гриппа), результат РТ-ПЦР в меньшей степени зависит от распространенности гриппа среди населения. РТ-ПЦР характеризуется редкими ложноположительными и ложноотрицательными результатами как во время эпидемии, так и в период низкой заболеваемости гриппом.
Идентификация вируса гриппа с помощью РТ-ПЦР возможна в течение более длительного времени от начала заболевания по сравнению с большинством других тестов. Тем не менее взятие отделяемого носо/ротоглотки для исследования с помощью РТ-ПЦР должно быть произведено не позднее чем через 72-96 часов (оптимально в первые 48-72 часа). Это связано с тем, что интенсивная репликация Influenza при поражении верхних дыхательных путей происходит в течение первых 4 суток заболевания. У пациентов с вовлечением нижних отделов дыхательных путей вирусная нагрузка сохраняется высокой более длительный период. Исследование отделяемого носоглотки и мокроты дает лучшие результаты по сравнению с исследованием отделяемого ротоглотки.
При обследовании пациента с клиническими признаками Influenza-ассоциированной инфекции верхних дыхательных путей следует выполнить анализ отделяемого носо/ротоглотки. При обследовании пациента с признаками Influenza-ассоциированной инфекции нижних дыхательных путей анализ мазков из зева и носа необходимо дополнить исследованием мокроты. Исследование мокроты также должно быть осуществлено при отрицательном результате, который дал анализ отделяемого верхних дыхательных путей у пациента с клиническими признаками гриппа. Следует повторить РТ-ПЦР при отрицательном результате исследования мокроты у пациента с клиническими признаками Influenza-ассоциированной инфекции нижних дыхательных путей.
Для более точной диагностики Influenza рекомендуется сочетание РТ-ПЦР с дополнительными общеклиническими исследованиями. Кроме того, необходимо исключить бактериальную суперинфекцию.
Для чего используется исследование?
Когда назначается исследование?
- острой респираторной вирусной инфекции (внезапное острое начало болезни, лихорадка, боль в горле, боль в мышцах, головная боль, светобоязнь, сухой кашель, боль в грудной клетке, одышка);
- острой энцефалопатии в период эпидемии гриппа (судороги, атаксия, нарушение сознания).
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
Причины отрицательного результата:
- отсутствие Influenza-ассоциированной инфекции.
- Положительный результат исследования не означает, что пациент остается заразным для окружающих.
- Анализ не позволяет выявлять Influenza серотипа С.
Кто назначает исследование?
Инфекционист, педиатр, врач общей практики, анестезиолог-реаниматолог.
Литература
- Kamps B. S, Hoffmann C, Preiser W. Influenza Report 2006 / B. S. Kamps, С. Hoffmann, W. Preiser W. – Flying Publisher, 2006.
- Wang R, Taubenberger JK. Methods for molecular surveillance of influenza. Expert Rev Anti Infect Ther. 2010 May;8(5):517-27.
- Schuchat A, Bell BP, Redd SC. The science behind preparing and responding to pandemic influenza: the lessons and limits of science. Clin Infect Dis. 2011 Jan 1;52 Suppl 1:S8-12.
- Pregliasco F, Mensi C, Camorali L, Anselmi G. Comparison of RT-PCR with other diagnostic assays for rapid detection of influenza viruses. J Med Virol. 1998 Oct;56(2):168-73.
- WHO Global Influenza Surveillance Network. Manual for the laboratory diagnosis and virological surveillance of influenza. – World Health Organization, 2011.
Читайте также:


