Выделение вируса в клеточной культуре
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Для заражения используются чувствительные к данному вирусу культуры с хорошо развитым монослоем клеток, находящиеся в пробирках (флаконах).
Перед заражением клеток питательную среду удаляют и в каждую пробирку (лунку планшета или флакон) вносят по 0,1-0,2мл взвеси испытуемого материала, предварительно обработанного антибиотиками. После 30 - 60 мин. контакта вируса с клетками удаляют избыток материала, вносят по 1,0 - 1,5мл на пробирку поддерживающей среды и оставляют в термостате до выявления признаков репродукции вирусов.
ФЕНОМЕНЫ, ПОЗВОЛЯЮЩИЕ ВЫЯВИТЬ ВИРУС В КУЛЬТУРЕ КЛЕТОК
1. Цитопатический эффект (действие) – (ЦПЭ или ЦПД), который является следствием поражения клеток под действием размножающегося в них вируса.
ЦПД может быть трех основных типов:
а) кругло- или мелкоклеточная дегенерация;
б) образование гигантских многоядерных клеток - симпластообразование;
в) образование внутриядерных или цитоплазматических включений вирусспецифических или неспецифических.
Феномен гемадсорбции (РГадс)
Образование бляшек - феномен Дюльбекко
Феномен интерференции
Принцип метода: феномен интерференции используется для обнаружения вирусов, не дающих отчетливого ЦПД в культуре клеток. Исследуемую культуру повторно заражают вирусом, регулярно вызывающим ЦПД. Индикаторным является ВВС - вирус везикулярного стоматита. При наличии в исследуемом материале нецитопатогенного вируса ЦПД у индикаторного ВВС также будет отсутствовать (клетка "занята" исследуемым вирусом).
3) ЛАБОРАТОРНЫЕ ЖИВОТНЫЕ
Используют преимущественно новорожденных белых мышей, хомяков, морских свинок, крысят. Заражение животных проводится по принципу цитотропизма вируса: пневмотропные вирусы вводятся интраназально, нейротропные - интрацеребрально, дерматотропные - на кожу. Индикация вируса основана на проявлении признаков заболевания у животных, их гибели, патоморфологических изменениях в тканях и органах, а также на положительной реакции гемагглютинации с экстрактами из органов.
СЕРОЛОГИЧЕСКИЙ МЕТОД.
а). Для ранней диагностики заболевания определяют наличие IgM в сыворотке с помощью ИФА или непрямой РИФ.
Диагностически значимым считают нарастание титра в 4 и более раз.
ОСНОВНЫЕ СЕМЕЙСТВА ВИРУСОВ (контрольная)
ДНК- содержащие
| Простые (без оболочек) ДНК- содержащие вирусы 1.Аденовирусы Adenoviridae 2-х нитчатая ДНК 2.Папилломавирусы Papillomaviridae 2-х нитчатая ДНК 3.Полиомавирусы Poliomaviridae 2-х нитчатая ДНК 4. Цирциновирусы Circinoviridae 1- нитчатая ДНК 5.Парвовирусы Parvoviridae 1- нитчатая ДНК | Сложные (с оболочками) ДНК- содерж. вирусы * Поксвирусы Poxviridae 2-х нитчатая ДНК * Герпесвирусы Herpesviridae 2-х нитчатая ДНК * Гепаднавирусы Hepadnaviridae 2-х нитчатая кольцевая ДНК с 1 нитчатым участком |
РНК- содержащие
| Простые (без оболочек) РНК- содержащие вирусы 1.Пикорнавирусы Picornaviridae 1-нитчатая РНК 2.Калицивирусы - Caliciviridae - 1-нитчатая РНК 3.Астровирусы - Astroviridae - 1-нитчатая РНК 4.Реовирусы - Reoviridae - 2-нитчатая РНК фрагментированная | Сложные (с оболочками) РНК- содержащие вирусы *Ортомиксовирусы Orthоmyxoviridae 1-нитч.РНК *Парамиксовирусы Paramyxoviridae 1-нитч. РНК *Тогавирусы Togaviridae 1-нитчатая РНК *Рабдовирусы Rhabdoviridae 1-нитчатая РНК *Филовирусы Filoviridae 1-нитчатая РНК *Флавивирусы Flaviviridae 1-нитчатая РНК *Ретровирусы Retroviridae 1-нитчатая РНК *Аренавирусы Arenaviridae 1-нитчатая РНК *Коронавирусы Coronaviridae 1-нитчатая РНК *Буньявирусы Bunyаviridae 1-нитчатая РНК |
ДЕМОНСТРАЦИИСреды для культивирования клеток: среда 199, раствор Хенкса, сыворотка, гидролизат лактальбумина, трипсин, раствор Версена, лейкоцитарный интерферон.
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
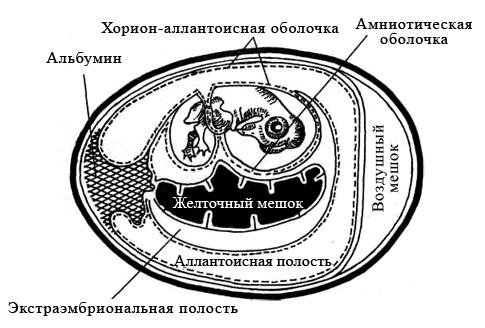
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
13 Назовите способы постановки реакций нейтрализации вирусов.
Для культивирования вирусов в лабораторных условиях используются следующие живые объекты: 1) культуры клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
I. Культуры клеток
Наибольшее распространение имеют однослойные культуры клеток, которые можно разделить на первичные (первично трипсинизированные), полуперевиваемые (диплоидные), перевиваемые, трансфецированные.
По происхождению они подразделяются на эмбриональные, опухолевые и из взрослых организмов; по морфогенезу — на фибробластные, эпителиальные и др.
Первичные культуры клеток — это клетки какой-либо ткани человека или животного, способные культивироваться в виде монослоя на пластмассовой или стеклянной поверхности в специальной питательной среде, но не способные к длительному размножению. Срок жизни таких культур ограничен. В каждом конкретном случае их получают из ткани после механического измельчения, обработки протеолитическими ферментами и стандартизации количества клеток. Первичные культуры, полученные из почек обезьян, почек эмбриона человека, амниона человека, куриных эмбрионов, широко используются для выделения и накопления вирусов, а также для производства вирусных вакцин.
Полуперевиваемые (диплоидные) культуры клеток — клетки одного генотипа, способные in vitro выдерживать до 50100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин.
Перевиваемые клеточные линии характеризуются бессмертием и гетероплоидным кариотипом. Источником перевиваемых линий могут быть первичные клеточные культуры (например, СОЦ — из сердца обезьяны циномольгус, ПЭС — из почек эмбриона свиньи, ВНК-21 — из почек однодневных сирийских хомяков; ПМС — из почки морской свинки и др.), отдельные клетки которых обнаруживают тенденцию к бесконечному размножению in vitro. Совокупность изменений, приводящих к появлению в клетках таких свойств, называют трансформацией, а клетки перевиваемых тканевых культур — трансформированными.
Другой источник перевиваемых клеточных линий — злокачественные новообразования. В этом случае трансформация клеток происходит in vivo. Получены и наиболее широко в вирусологической практике применяются следующие линии перевиваемых клеток: HeLa — получена из карциномы шейки матки; Hep-2 — из карциномы гортани; Детройт-6 — из метастаза рака легкого в костный мозг; RH — из опухоли почки человека.
Трансфецированные культуры клеток. Разработаны экспериментальные линии культур клеток методом трансфекции (переноса) генов вирусов, контролирующих биосинтез поверхностных антигенов. Такие культуры клеток экспрессируют поверхностный белок определенного вируса (HBs-антиген, gp120 и др.) на мембране клеток культуры. Такие культуры клеток используются с целью изучения иммунологических механизмов патогенеза вирусных инфекций, разработки химиотерапевтических и иммунобиологических препаратов.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
Широкое применение находят стандартные синтетические среды, например, синтетическая среда 199 и среда Игла. Независимо от назначения все питательные среды для культур клеток конструируются на основе сбалансированного солевого раствора. Чаще всего им является раствор Хенкса. Неотъемлемый компонент большинства ростовых сред — сыворотка крови животных (телячья, бычья, лошадиная), без наличия 510% которой размножение клеток и формирование монослоя не происходит. В состав поддерживающих сред сыворотка не входит. С целью предотвращения возможного роста микроорганизмов в питательные среды вносят антибиотики.
Выделение вирусов в культурах клеток и методы их индикации
При выделении вирусов из различных инфекционных материалов от больного (кровь, моча, фекалии, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающие наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,10,2 мл взвеси испытуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 3060 мин. контакта вируса с монослоем клеток удаляют избыток материала, в культуру клеток вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Индикатором наличия вируса в зараженных таким образом культурах клеток может служить:
развитие специфической дегенерации клеток — цитопатическое действие вируса (ЦПД), имеющее три основных типа: кругло- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток;
обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
положительная реакция гамагглютинации (РГА) или гемадсорбции (РГАдс);
при отсутствии ЦПД, ГА или ГАдс. можно использовать реакцию интерференции: исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительная). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Семенова Ольга Владимировна, Глотова Татьяна Ивановна, Глотов Александр Гаврилович, Нефедченко Алексей Васильевич
Вирус диареи крупного рогатого скота (BVDV) принадлежит к роду Pestivirus, семейству Flaviviridae. Он представлен двумя генетическими типами BVDV-1 и BVDV-2, а также двумя фенотипами цитопатогенным (ЦП) и нецитопатогенным (НЦП) [21]. По данным некоторых исследователей, насчитывается не менее 21 субтипа BVDV-1 [9, 11, 14, 16, 18] и 4 субтипа BVDV-2 (2a…2d). Актуальность получения изолятов вируса продиктована фрагментарными сведениями в отечественной литературе о данных видах исследований. Кроме того, описанные изоляты относятся в основном к ЦП биотипу, являющемуся тупиковой ветвью эволюции возбудителя. Цель работы. Изучить частоту выявления BVDV среди крупного рогатого скота в Сибири и особенности его выделения в первичной культуре клеток тестикул бычка (ТБ). Материалы и методы. Работу выполняли в 2007-2015 гг. на молочных комплексах Сибири, где не проводилась специфическая профилактика BVDV. Исследовали 1275 проб биоматериала посредством ОТ-ПЦР на присутствие генома вируса. Для выделения BVDV брали пробы биоматериала, положительные в ОТ-ПЦР, и первичную культуру клеток ТБ. Заключение. Частота выявления вируса в пробах биоматериала составила 52,3 %, а выделения в культуре клеток 38,1 %. Получено 25 изолятов вируса BVDV (из них ЦП 17, НЦП 18) с характерными для представителей рода Pestivirus антигенными свойствами. Они были выделены из проб биоматериала от животных преимущественно с респираторной и генитальной формами болезни, а также от персистентно инфицированных. Лучше всего вирус размножался и накапливался в первичной культуре клеток ТБ, в которой к 3…5-му пассажу его титр составлял 5,25…6,75 lg ТЦД50/мл. После адаптации к перевиваемым линиям культур клеток ЦП и НЦП агенты к 5-му пассажу накапливались в титрах 4,5…6,5 lg ТЦД50/мл в культуре коронарных сосудов теленка (КСТ) и 3,25…4,5 lg ТЦД50/мл в культуре клеток почки теленка (MDBK).
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Семенова Ольга Владимировна, Глотова Татьяна Ивановна, Глотов Александр Гаврилович, Нефедченко Алексей Васильевич
Frequency Detection by RT-PCR and BVDV Isolation in Cell Culture in Siberia
Virus of bovine viral diarrhea mucosal disease (BVDV) belongs to the genus Pestivirus within the family Flaviviridae. It is represented by two genetic types BVDV-1 and BVDV-2, and two phenotypes cytopathic and noncytopathic [21]. According to some researchers, there are at least 21 subtypes BVDV-1 [9, 11, 14, 16, 18] and 4 subtypes BVDV-2 (2a. 2d).The urgency of the virus isolation is dictated by the fragmentary information in Russian literature of such scientific data. In addition, the described isolates are related mainly to the cytopathic biotype, which is a dead-end branch of the pathogen evolution. Purpose. To study the frequency of detection of BVDV in cattle of Siberia and to characterize the virus isolation in bovine testicle primary cell culture (TB). Materials and methods. The work was performed in 2007-2015 in dairy complexes of Siberia, where it is not carried out specific prevention of BVDV. 1275 biomaterial samples were examined by RT-PCR for presence of the virus genome. For BVDV isolation were used biomaterial samples are positive in RT-PCR and bovine testicle primary cell culture (TB). Conclusion. The detection rate of the virus in samples of biological material was 52.3%. Obtained 25 BVDV virus isolates (among them: cytopathic are 7, noncytopathic are 18) with typical antigenic properties for representatives of the genus Pestivirus. They have been isolated from samples of biological material from animals mainly with respiratory and genital forms, as well as persistently infected animals. The best way the virus replicated and accumulated in the TB primary cell culture, in which of the 3 … 5th passage the virus titer was 5.25. 6.75 lg TCD50/ml. After adaptation of continuous cell lines cytopathic and noncytopathic agents accumulated at the titer 4.5. 6.5 lg TCD50/ml in the 5th passage in the culture of calf coronary vessels (KST) and at the titer 3.25. 4.5 lg TCD 50/ml in the culture of bovine kidney cells (MDBK).
УДК: 619: 616.98: 578.833.3: 636.2(571.1/.5)
Частота выявления посредством ОТ-ПЦР и выделения в культуре клеток вируса диареи крупного рогатого скота в Сибири
О.В. Семенова, старший научный сотрудник лаборатории вирусологии (k-olga-83@mail.ru), Т.И. Глотова, доктор биологических наук, профессор, заведующая лабораторией вирусологии (t-glotova@mail.ru), А.Г. Глотов, доктор ветеринарных наук, профессор, заведующий лабораторией биотехнологии—диагностический центр (glotov_vet@mail.ru), А.В. Нефедченко, старший научный сотрудник лаборатории биотехнологии — диагностический центр, доцент (nav-vet@mail.ru).
Федеральное государственное бюджетное учреждение науки Сибирский федеральный научный центр агробиотехнологий Российской академии наук (630501 Новосибирская область, Новосибирский район, Краснообск, а/я 463).
Вирус диареи крупного рогатого скота (BVDV) принадлежит к роду РезЫуииз, семейству Р1ау1утд.ае. Он представлен двумя генетическими типами — BVDV-1 и BVDV-2, а также двумя фенотипами — цитопатогенным (ЦП) и нецитопатогенным (НЦП) [21]. По данным некоторых исследователей, насчитывается не менее 21 субтипа BVDV-1 [9, 11, 14, 16, 18] и 4 субтипа BVDV-2 (2а.2й). Актуальность получения изолятов вируса продиктована фрагментарными сведениями в отечественной литературе о данных видах исследований. Кроме того, описанные изоляты относятся в основном к ЦП биотипу, являющемуся тупиковой ветвью эволюции возбудителя. Цель работы. Изучить частоту выявления BVDV среди крупного рогатого скота в Сибири и особенности его выделения в первичной культуре клеток тестикул бычка (ТБ).
Материалы и методы. Работу выполняли в 2007-2015 гг. на молочных комплексах Сибири, где не проводилась специфическая профилактика BVDV. Исследовали 1275 проб биоматериала посредством ОТ-ПЦР на присутствие генома вируса. Для выделения BVDV брали пробы биоматериала, положительные в ОТ-ПЦР, и первичную культуру клеток ТБ.
Заключение. Частота выявления вируса в пробах биоматериала составила 52,3 %, а выделения в культуре клеток — 38,1 %. Получено 25 изолятов вируса BVDV (из них ЦП — 17, НЦП — 18) с характерными для представителей рода Ре8Ыу1ти8 антигенными свойствами. Они были выделены из проб биоматериала от животных преимущественно с респираторной и генитальной формами болезни, а также от персистентно инфицированных. Лучше всего вирус размножался и накапливался в первичной культуре клеток ТБ, в которой к 3. 5-му пассажу его титр составлял 5,25.6,75 ^ ТЦД50/мл. После адаптации к перевиваемым линиям культур клеток ЦП и НЦП агенты к 5-му пассажу накапливались в титрах 4,5.6,5 ^ ТЦД50/м^ в культуре коронарных сосудов теленка (КСТ) и 3,25.4,5 ^ ТЦД50/мл в культуре клеток почки теленка (MDBK).
Ключевые слова: вирус вирусной диареи-болезни слизистых оболочек, крупный рогатый скот, изолят, генотип, фенотип, субтип, цитопатогенный, нецито-патогенный
Сокращения: КРС — крупный рогатый скот, НЦП— нецитопатогенный, ОТ-ПЦР — полимеразная цепная реакция с обратной транскрипцией, ПИ — персис-тентная инфекция, РН — реакция нейтрализации, РНК — рибонуклеиновая кислота, ТЦД — тканевая цитопатогенная доза, ЦП — цитопатогенный, ЦПД — цитопатогенное действие, BVDV — Bovine viral diarrhoea virus (вирус диареи крупного рогатого скота), KST (КСТ) — culture of calf coronary vessels (перевиваемая культура клеток коронарных сосудов теленка), MDBK — madin-darby bovine kidney cells (перевиваемая культура клеток почки теленка), TB (ТБ) — bovine testicle primary cell culture (первичная культура клеток тестикул бычка)
Вирус диареи крупного рогатого скота (BVDV) принадлежит к роду Pestivirus, семейству Flaviviridae. Он представлен двумя генетическими типами — BVDV-1 и BVDV-2, а также двумя фенотипами — ЦП и НЦП [21] и распространен по всему миру [2, 6, 15, 12, 20]. По данным некоторых исследователей, нас-
читывается не менее 21 субтипа BVDV-1 [9, 11, 14, 16, 18] и 4 субтипа BVDV-2 (2а. 2ф. Вызывает широкий спектр клинических признаков, но наиболее значимыми последствиями инфекции являются репродуктивные проблемы и болезни респираторного тракта [1, 6, 15].
Особенность вируса — способность преодолевать плацентарный барьер и инфицировать плод. Если заражение пришлось на 40.125-й день стельности, рождаются персистентно инфицированные телята [1, 6, 10]. Устанавливать такую форму инфекции способны только НЦП штаммы. По мере изучения молекулярной биологии вируса стало известно, что ЦП фенотип возникает путем мутаций из НЦП [17, 19].
Выделение BVDV в культуре клеток — трудоемкий процесс, в котором используют различные клеточные линии, однако предпочтение отдается первичным культурам клеток [2.4, 7].
Сведения о выделении и характеристиках изолятов BVDV в России фрагментарны. Актуальность исследования обусловлена тем, что полученные и охарактеризованные ранее на территории Российской Федерации изоляты вируса относились, в основном, к ЦП фенотипу первого типа [2, 8]. Кроме того, в научной литературе нет данных за последнее десятилетие о выделении BVDV на территории Сибири.
Изучить частоту выявления BVDV среди КРС в Сибири и особенности его выделения в первичной культуре клеток ТБ.
Материалы и методы
Исследования выполнены в 2007-2015 гг. на молочных комплексах, где не проводили специфической профилактики вирусной диареи.
Посредством ОТ-ПЦР исследовали 1275 проб биоматериала от телят до 6-ти месячного возраста, нетелей, коров и быков-производителей.
Для изоляции вируса использовали пробы крови, мезентериальных и легочных лимфатических узлов, селезенки, легких и влагалищных выделений. Из них готовили 10%-е суспензии на стерильном фосфатном буферном растворе (рН 7,4. 7,6) с добавлением 100 ед/мл канамицина и 500 ед/мл гентамицина. Суспензии выдерживали при 4 °С в течение 2.3 ч, затем центрифугировали 30 мин при 3000 мин-1. Полученные супернатанты очищали путем фильтрации через фильтры с диаметром пор 0,22 мкм.
Выделяли BVDV в 24-луночных культуральных планшетах (TPP, Швейцария) в ТБ c последующей адаптацией к субкультуре ТБ и перевиваемым линиям культур клеток КСТ и MDBK. В качестве ростовой использовали питательную среду Игла МЕМ с однократным или двойным набором аминокислот и витаминов, 0,06 % L-глутамина, 100 мкг/мл канамици-на. Клетки культивировали при 37 °С в присутствии 5 % СО2. Для предупреждения возможной контаминации культуры клеток BVDV использовали сыворотку крови лошади (Биолот, Санкт-Петербург).
Выделенные ЦП агенты идентифицировали в РН при помощи моноспецифической сыворотки к референтному штамму вируса. Параллельно вирус титровали с нормальной сывороткой. Индекс нейтрализации, равный 2 lg ТЦД50/мл и выше, свидетельствовал о принадлежности изолята к BVDV. Моноспецифические гипериммунные сыворотки к выделенным изолятам и референтному штамму получали путем гипериммунизации кроликов по схеме [5].
Антигенное родство изолятов определяли в перекрестной РН с сыворотками, полученными на выделенные ЦП агенты и референтный штамм вируса ВК-1. Степень антигенного родства рассчитывали по формуле R%=100Vr1. r2, где:
_ индекс нейтрализации сыворотки 1 к вирусу 2 индекс нейтрализации сыворотки 1 к вирусу 1
_ индекс нейтрализации сыворотки 2 к вирусу 1 индекс нейтрализации сыворотки 2 к вирусу 2
Статистическую обработку данных осуществляли с использованием пакета программ для статистической обработки Microsoft Office Excel, 2003 по общепринятым методам описательной статистики.
Результаты и обсуждение
В 52,3 % исследованных проб биоматериала установили присутствие генома BVDV. Максимальное количество положительных проб (78,1 %) выявили на молочных комплексах с наличием импортного скота. На таких же комплексах без импорта животных количество положительных проб составило 65,5 %; в закрытых средних и мелких товарных хозяйствах без импорта скота — 48,5 %.
Для выделения BVDV использовали первичную культуру ТБ (рис. 1). Сложности получения изолятов вируса обусловлены тем, что животные с наличием клинических признаков болезни не всегда являются подходящим источником для этой цели. Кроме того, выделение вируса во многом зависит от правильного отбора, хранения и транспортировки проб биоматериала, а также от качества используемых культур клеток, которые должны быть свободными от инфицирования НЦП штаммами BVDV
В первичной культуре клеток ТБ на 3.5-е сутки инкубации при 37 оС к 3.5-му пассажу ЦП изоляты вируса вызывали видимые дегенеративные изменения в монослое и накапливались в титрах 5,25.6,75 ^ ТЦД50/мл. ЦПД вируса выражалось в появлении мелкоочаговой, мелкозернистой дегенерации и округлении клеток, истончении и разрыве монослоя и отслоении клеток. В некоторых случаях наблюдали вакуолизацию цитоплазмы пораженных клеток. Конечная картина ЦПД характеризовалась гибелью клеток, их отслоением, наличием на поверхности роста отдельных тяжей и фрагментов (рис. 2).
Характеристика изолятов BVDV, выделенных при разных клинических формах болезни Characterization of virus isolates obtained from different clinical forms
Наименование изолята ЦПД, +/- Клиническая форма болезни
Читайте также:


