Выявление антител к вирусу болезни ауески
Болезнь Ауески (псевдобешенство, бешеная чесотка) — остропротекающая болезнь сельскохозяйственных животных всех видов, пушных зверей и грызунов.
Для заболевания характерны признаки поражения головного и спинного мозга, сильный зуд и расчесы (у всех животных, кроме свиней).
БА впервые описана в 1813 г. в США как заболевание телят, а в 1902 г. венгерский ученый А. Ауески установил небактериальную природу возбудителя этого заболевания, определенного позже как герпесвирус. Заболевание встречается на всех континентах, протекает в форме энзоотии, и наибольший экономический ущерб приносит свиноводству и пушному звероводству.
Характеристика возбудителя. Вирус относится к семейству Herpesviridae, содержит двуспиральный линейный ДНК-нуклеоид. Нуклеоид окружен икосаэдрическим капсидом диаметром 100—110 нм, содержащим 162 частично-полых капсомера. Капсид покрыт содержащей липиды оболочкой и наружной оболочкой с выступами (шипами). Диаметр вириона 150—180 нм.
В составе вириона определено до 32 белков. Установлена роль отдельных белков в вирулентности и индукции иммунного ответа.
Устойчивость к физико-химическим воздействиям. Вирус чувствителен к эфиру и хлороформу. Быстро (за 15—20 мин) инактивируется дезинфицирующими растворами: горячим 3%-ным раствором гидроксида натрия, 20%-ной взвесью свежегашеной извести, 1%-ным раствором формальдегида. Растворы креолина и карболовой кислоты обладают слабым вирулицидным действием. В навозной жиже летом вирус сохраняет активность в течение 1 мес, зимой — около 3 мес, в гниющих трупах — до 1 мес. Ультрафиолетовые лучи обезвреживают ВБА за 1 мин.
Антигенная активность. В оболочке вируса болезни Ауески различают 3 основных гликопротеина, на которые при инъекции свиньям образуются антитела. Их обнаруживают в PH, РСК и РДП. Комплементсвязывающие антитела появляются в сыворотке крови через 3 дня после заражения, и титр их удерживается до 30— 40 дней. Вируснейтрализующие антитела появляются на 5—7-й день, количество их достигает максимума через 3—4 нед, титр их сохраняется до 1,5 лет.
Антигенная вариабельность. Не установлена. Установлено антигенное родство вируса болезни Ауески с вирусом простого герпеса.
Гемагглютинирующие свойства. Гемагглютинин вируса сорбируется на мышиных эритроцитах при температуре 4, 22 и 37 °С.
Культивирование вируса. Вирус болезни Ауески успешно пассируется на кроликах, молодых белых мышах, в первичных культурах клеток куриных эмбрионов, почек крупного рогатого скота, свиней, перевиваемых клетках HeLa, КЭМ-Ла, L, ПЭС с образованием некротических фокусов — бляшек. Наиболее чувствительна к вирусу болезни Ауески первичная культура клеток куриных эмбрионов, в которой вирус вызывает ЦПЭ с округлением клеток, образованием гигантских клеток и телец-включений.
После предварительной адаптации вирус удается культивировать в куриных эмбрионах при инокуляции на ХАО. Эмбрионы гибнут через 24—96 ч, на ХАО наблюдаются специфические фокусы поражения.
Клинические признаки. Инкубационный период болезни колеблется от 1,5 сут до 15—20 дней, что зависит от метода заражения, вирулентности вируса и устойчивости животного.
У свиней заболевание протекает без самого характерного признака болезни — зуда. У новорожденных поросят наблюдаются спазмы глотки, икота, слюнотечение, животные не могут сосать, лежат и погибают в течение суток после появления симптомов болезни. Иногда гибели предшествуют судороги.
Особенно тяжело болеют поросята-сосуны и отъёмыши. В возрасте от 10 дней до 3 мес болезнь начинается с лихорадки (40— 42 °С), угнетения, слизистого истечения из носа. Позже появляются признаки поражения ЦНС: беспокойство, манежные движения, стремление вперед, животные упираются головой в стену. Нередко возникают судороги, параличи глотки, гортани, конечностей. Животное принимает позу сидящей собаки. В течение 3 сут погибает 70—100 % заболевших.
У свиней в возрасте 5 мес и старше болезнь Ауески протекает в течение 3—4 дней в форме доброкачественного гриппоподобного синдрома. Признаки поражения ЦНС проявляются редко. Супоросные матки могут абортировать.
У крупного рогатого скота заболевание проявляется лихорадкой и сильным зудом в области ноздрей, губ, шеи и глаз. Животные трутся зудящими местами об окружающие предметы. Нарастает возбуждение, но агрессивности не наблюдается. Нередки судорожные сокращения жевательных и шейных мышц. Смерть наступает через 1—2 сут с момента появления первых признаков болезни.
У овец и коз болезнь Ауески проявляется сходно с течением ее у крупного рогатого скота. При наиболее тяжелых случаях ягнята первых суток жизни гибнут.
У лошадей заболевание протекает всего 2—4 дня доброкачественно, без признаков поражения ЦНС.
У плотоядных животных (путные звери, кошки, собаки) отмечают сильный зуд, беспокойство, извращение аппетита. Отмечается нападение на других животных, но не на людей. Гибель наступает на 2—3-й день болезни.
Патологоанатомические изменения. На трупах животных, погибших при явлениях зуда, видны расчесы и разрывы кожи. Легкие темно-вишневого цвета с пенистой кровянистой жидкостью на разрезе. Слизистая желудочно-кишечного тракта покрыта кровоизлияниями и дифтеритическими пленками. На поверхности паренхиматозных органов видны точечные кровоизлияния. Кровеносные сосуды мозга и его оболочек расширены, мозговое вещество отечно.
При вскрытии павших свиней обнаруживают крупозные дифтеритические пленки и некротические фокусы на слизистых оболочках глотки, желудочно-кишечного тракта, в паренхиматозных органах; в сердечной мышце — сильные дистрофические изменения.
Гистологические изменения характеризуются очаговым некрозом клеток в миндалинах, глотке, печени и селезенке. В головном и спинном мозге наблюдается картина негнойного менингоэнцефалита. У поросят-сосунов и отъемышей в головном и спинном мозге значительно выражены воспалительные процессы.
Локализация вируса. Локализация вируса зависит от пути проникновения его в организм, штамма, а также возраста животного. Вирус, попав в организм аэрогенным путем, первично локализуется на слизистой оболочке носа и глотки и обнаруживается здесь до двух недель. Далее он проникает через слизистые оболочки и распространяется нейролимфогенным путем. Через 48 ч достигает головной и спинной мозг, где и обнаруживается.
При проникновении вируса через кожу он активно размножается в месте внедрения в жировой, соединительной и мышечной тканях. Затем с кровью и лимфой распространяется по всему организму. Вирусемия сопровождается развитием лихорадки, сосудистыми нарушениями.
Поскольку вирус пантропен, он может размножаться и накапливаться в верхних дыхательных путях и легких, в головном мозге, селезенке, печени, почках, миндалинах, лимфоузлах и слюнных железах.
Источник инфекции. Обычно это больные животные или бессимптомные вирусоносители, что особенно часто встречается среди свиней, когда легко переболевшие взрослые свиньи становятся вирусоносителями и могут заражать как свиней, так и животных других видов. Источником инфекции могут быть боенские отходы и субпродукты, полученные от больных свиней или животных-вирусоносителей.
В естественных условиях восприимчивы все сельскохозяйственные животные, пушные звери, дикие плотоядные и грызуны. Наиболее восприимчивы свиньи. Реже болеют рогатый скот и лошади. Птицы и приматы к вирусу болезни Ауески не чувствительны.
Резервуар вируса в природе — мыши, крысы, еноты. Чувствительны к болезни собаки и кошки, которые чаше заражаются от свиней и гибнут на 2—3-й день болезни. Передача животными этих видов вируса свиньям обычно ведет к возникновению заболевания лишь на отдельных фермах.
В условиях ферм заражение животных происходит чаще респираторным путем, алиментарно, через воду и корма, загрязненные выделениями больных животных. При прямом контакте больных животных со здоровыми заражение происходит через поврежденную кожу и слизистые оболочки. Распространение вируса болезни Ауески в стаде может происходить при искусственном осеменении животных. Возможны внутриутробное заражение плода и заражение поросят-сосунов через инфицированное молоко.
Переболевшие животные, чаще взрослые свиньи, остаются вирусоносителями с переходом в латентную форму, при которой вирус может пожизненно персистировать в ЦНС, миндалинах и лимфоузлах. При стрессовых воздействиях такие животные выделяют вирус и могут быть источником инфекции.
Диагностика. Диагноз ставят на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований.
Для лабораторной диагностики от больных свиней направляют носовые секреты, плоды и плаценту от абортировавших животных. От трупов наилучшим материалом для выделения вируса являются миндалины, головной мозг, кусочки легких, селезенки, печени, лимфоузлов. От латентно инфицированных свиней вирус может быть выделен из ганглиев тройничного нерва.
Лабораторная диагностика. Индикацию вируса в патологическом материале можно проводить с помощью экспресс-методов (ПЦР, РИФ, РИГА, ИФА) и биопробой.
Полимеразная цепная реакция (ПЦР) как метод индикации вируса обладает 100%-ной чувствительностью и 94,2%-ной специфичностью. РИФ дает возможность видеть при малом увеличении широкие полоски флуоресцирующих нейронов коры головного мозга с отдельными флуоресцирующими клетками. В РИГА при использовании эритроцитарного иммуноглобулинового диагностикума обнаруживают вирусный антиген. ИФА прямым иммунопероксидазным методом обнаруживает антиген вируса болезни Ауески в мазках-отпечатках из мозга и слизистой оболочки гортани.
Активный вирус в патологическом материале можно обнаружить путем биопробы на лабораторных животных и в культуре клеток. Из лабораторных животных наиболее чувствительны к вирусу кролики массой 2—2,5 кг, которым внутримышечно или подкожно вводят по 1 мл 10%-ной суспензии исследуемого материала. Биопробу считают положительной, если кролики погибают с признаками болезни Ауески (нервная форма, зуд, расчесы) через 2—10 дней после заражения. Если кролики погибают без признаков болезни, биопробу повторяют, используя патологический материал второго пассажа. Гибель кроликов при биопробе без признаков зуда и расчесов может свидетельствовать о выделении вакцинных штаммов вируса болезни Ауески.
Материалом для выделения вируса от погибших кроликов служат ткани головного и спинного мозга, а также паренхиматозные органы (легкие, печень).
Биопроба в первично-трипсинизированных культурах клеток (почек и щитовидной железы свиней, семенников телят, фибробластов КЭ), перевиваемых культурах клеток (РК-15, ВНК-21) эффективна даже при диагностике атипичного течения болезни, при которой биопроба на кроликах может дать отрицательный результат.
Идентификацию выделенного вируса осуществляют PH в той же живой системе, на которой был выделен вирус. Могут быть использованы более быстрые методы идентификации: РИГА, РИФ, РДП, ИФА.
Ретроспективная диагностика. Определяют титры антител в парных сыворотках с помощью PH в культуре клеток. В сыворотках переболевших свиней их иногда удается обнаружить в течение 4,5 лет. Для обнаружения и титрования антител, кроме PH, применяют РИГА, РДП, РСК, ИФА, РЛA (реакциюлатексагтлютинации).
Аллергическая проба позволяет в короткий срок ставить диагноз непосредственно в хозяйствах. Чувствительность реакции достаточно высокая: 72 % переболевших животных реагируют положительно.
Дифференциальная диагностика. Болезнь Ауески у свиней следует дифференцировать от болезни Тешена, чумы, бешенства, гриппа, сальмонеллеза, отечной болезни, пастереллеза, стрептококкоза, гипогликемии, солевого отравления, аскаридоза, авитаминоза.
Иммунитет и специфическая профилактика. Гуморальный и клеточный иммунитет проявляется на 8—10-й день после инфицирования или вакцинации, достигает пика через 30 дней и сохраняется 5—6 мес.
У поросят, родившихся от иммунных свиноматок, выраженный колостральный иммунитет продолжается, как правило, не менее грех недель после рождения. Активная иммунизация свиноматок за две недели до опороса способствует защите подсосных поросят от заражения.
Для специфической профилактики болезни Ауески у животных многих видов в нашей стране применяют живые вакцины (ВГНКИ, штаммы БУК 628 и УНИИЭВ-18) и инактивированную культуральную вакцину. Живые вакцины, в отличие от инактивированных, обеспечивают напряженный клеточный и относительно слабый гумморальный иммунитет. С учетом этого строится стратегия специфической профилактики.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Болезнь Ауески (БА, псевдобешенство, инфекционный бульварный паралич, зудящая чума, бешеная чесотка) – остро протекающая болезнь с/х животных всех видов, пушных зверей и грызунов. Из млекопитающих устойчивы приматы. Молодые животные восприимчивее взрослых. Птицы не чувствительны. БА характеризуется признаками поражения головного и спинного мозга, сильным зудом и расчесами (у всех видов животных, кроме свиней).
Болезнь встречается во всех европейских странах, Южной и Северной Америке, Африке, Азии в виде энзоотий и наносит большой экономический ущерб.
Вирус болезни Ауески (ВБА) относится к семейству Herpesviridae, подсемейству Alphaherpesvirinae, роду Varicellavirus. Впервые установил и описал болезнь в Европе венгерский учёный А. Ауески в 1902г.АГ вариантов у ВБА не установлено.Методом перекрестной ИФ установлено АГ родство ВБА и простого герпеса.Вирус индуцирует образование ВНА, КСА, ПА.
Диагноз ставят на основании эпизоотологических данных, симптомов болезни, патологоанатомических изменений и результатов лабораторных исследований.
Основные методы лабораторной диагностики: выделение вируса, прямая и непрямая иммунофлюоресценция, РДП, радиоиммунологический метод, кожная проба, РН, РСК, ELISA и биопроба.
Выделение вируса.Взятие и подготовка материала. Для выделения возбудителя болезни Ауески используют головной мозг, кусочки легких, селезенки, печени, лимфатических узлов, миндалин, полученные при вскрытии погибших животных. При жизни от больных свиней вирус можно выделить из носовых секретов, в которых он появляется на 4-6-й день болезни и сохраняется в течение 5-11 дней после выздоровления. От абортировавших животных используют плоды и плаценту.
При сборе материалов для вирусологического исследования следует помнить о неравномерном распределении вируса в разных участках мозга, поэтому, чтобы избежать ошибок при постановке диагноза, следует брать минимум 2-3 пробы из разных участков мозга, расположенных на некотором расстоянии друг от друга. Обычно при вскрытии отбирают кусочки мозжечка, продолговатого мозга из разных мест больших полушарий головного мозга.
Собранный материал помещают в стерильные пенициллиновые флаконы или пробирки и доставляют в лабораторию в термосе со льдом. Материал можно консервировать в 50%-ном забуференном растворе глицерина (pН 7,2-7,4). Секреты носовой полости собирают стерильными ватными тампонами, которые вводят в носовые ходы, а затем погружают в пробирки с раствором Хенкса. содержащим антибиотики.
В сопроводительном документе необходимо дать сведения о проведении иммунизации животных и применяемой вакцине.
В лаборатории материалы обрабатывают обычными методами: готовят 10%-ную суспензию, центрифугируют при 3-5 тыс. об/мин в течение 15-30 мин. Материалы, консервированные глицерином, предварительно отмывают от него.
Для большей вероятности выделения вируса и уменьшения количества исследуемых образцов кусочки из различных отделов мозга от одного животного объединяют в общую пробу, которую затем измельчают, обрабатывают антибиотиками и исследуют. Для лучшей сохраняемости вируса в суспензии к ней можно добавить 1-2% нормальной инактивированной сыворотки крови телят. До использования суспензию лучше хранить и замороженном виде (минус 30°С) или при 4°С.
Заражение животных. В качестве лабораторной модели для выделения вируса Ауески из патологических материалов обычно используют двух кроликов массой 2-2,5 кг, которым внутримышечно или подкожно вводят по 1 мл 10%-ной суспензии исследуемого материала. Инкубационный период в этом случае продолжается 36-48 ч. иногда он может длиться 4-6 дней, а в некоторых случаях — даже до 12 дней.
Различают энцефалитическую. менингеальную, паралитическую, зудневую и стертую формы болезни. Течение экспериментальной инфекции но многом зависит от способа заражения.
Энцефалитическая форма начинается беспокойством. переходящим в сильное возбуждение, — животное бегает по клетке, боязливо оглядываясь, у него отмечают расширение зрачков, повисание ушей, скрежетание зубами, обильное истечение слюны изо рта. Возбуждение сменяется депрессией — больные кролики лежат на боку или на животе, задние лапы часто вытянуты, при попытке встать животные теряют равновесие и падают. Смерть наступает в период приступа возбуждения или угнетения; гибели часто предшествуют параличи конечностей.
Зудневая форма наиболее характерна для кроликов при внутримышечном или подкожном введении материала. В положительных случаях у животных после 2-3-дневного инкубационного периода появляется сильный зуд в месте инокуляции. Вначале отмечают общее беспокойство, животное часто вздрагивает, оглядываясь на место введения материала, затем начинает лизать и вырывать шерсть в этой области. Часто можно наблюдать, как кролик с ожесточением грызет кожу и подлежащие мышечные ткани на месте инъекции. Иногда зуд отмечают и на других участках тела, что приводит к особенно сильному беспокойству. Кролик падает на бок и может погибнуть внезапно, без развития параличей, или же они появляются незадолго до смерти.
Менингеальная форма характеризуется сильным возбуждением, скрежетом зубов и опистотонусом. Животное падает на бок и погибает при наличии клонических судорог. Однако при вскрытии в менингеальных оболочках макроскопически иногда не обнаруживают никаких следов воспаления. Они могут быть выявлены лишь гистологически (следы лимфоцитарного менингита).
При стертых и молниеносных формах болезни Ауески у большинства кроликов не проявляется никаких симптомов болезни. Погибают они обычно ночью. Вечером накануне гибели животное кажется вполне нормальным, а утром обнаруживают его труп в характерном положении — на боку.
Биопробу считают положительной, если кролики погибают с клиническими признаками болезни Ауески (нервная клиника, зуд, расчесы) через 2-10 дней после инокуляции суспензии из патологического материала. Если кролики погибают без признаков болезни Ауески, биопробу повторяют, используя патологический материал первого пассажа. Считают, что инокуляция материала в переднюю камеру глаза кролика приводит к характерной зудневой форме болезни. Материалом для выделения вируса от погибших кроликов служат ткани головного и спинного мозга, а также паренхиматозные органы (легкие, печень). Гибель кроликов после введения патологического материала от свиней или пушных зверей без признаков зуда и, расчесов может свидетельствовать о выделении вакцинных штаммов вируса болезни Ауески.
Показано, что культуры клеток так же чувствительны к вирусу Ауески, как и кролики; к тому же они могут быть использованы для лабораторной диагностики атипичного течения болезни, при котором опыты по выявлению вируса в мозгу свиней путем заражения кроликов дают отрицательные или нетипичные результаты.
Заражение культуры клеток. Для выделения вируса от павших, больных свиней и кроликов обычно используют первично-трипсинизированные культуры клеток почек и щитовидной железы свиней, семенников телят, фибробластов куриных эмбрионов, перевиваемые линии РК-15, ВНК-21. К вирусу высокочувствительны субкультуры первого пассажа клеток почки поросенка и крупного рогатого скота.
При первичном выделении вируса из патологического материала лучше помещать пробирки во вращающийся барабан, что способствует сокращению сроков появления цитопатогенного действия. Для выявления последнего пробирки на протяжении 5 сут ежедневно просматривают под микроскопом. При отсутствии цитопатических изменений на 5-й день культуры подвергают однократному замораживанию и оттаиванию и делают повторный пассаж. Каждый материал пассируют 3-5 раз.
При первичном выделении вируса признаки цитопатогенного действия появляются на 4-5-й день после инокуляции культуры. В последующих пассажах сроки появления ЦПД сокращаются до 15-20 ч, причем оно становится более выраженным. Характер цитопатических изменений в различных культурах может быть неодинаковым, что обусловлено различным действием вируса на клетки эпителиального и фибробластического типов. В культуре клеток почки поросенка, эмбриона свиньи или крольчонка цитопатогенные действия вируса выражаются в образовании синцития. Сначала в культуре появляются очаги округлых клеток, границы между которыми исчезают; а ядра перемещаются к центру и образуют конгломераты, окруженные обшей оболочкой. Через несколько часов группы этих клеток принимают шарообразную форму, в цитоплазме их появляется зернистость. Затем происходит обильное отслаивание клеток с поверхности стекла.
В культуре фибробластов куриного эмбриона цитопатогенное действие вируса проявляется в округлении клеток, появлении зернистости и вакуолизации цитоплазмы с последующим отслоением клеток от поверхности стекла. Титры вируса в период максимального развития ЦПД обычно достигают 10 6,5 -10 7,5 ТЦД 50/мл.
Диагноз на болезнь Ауески ставят в том случае, если видовая принадлежность вируса, выделенного в культуре клеток, подтверждена в РН. Вирулентные штаммы вируса образуют типичные симпласты. Штаммы, многократно пассированные в культуре куриных фибробластов, вызывают менее выражении симпластообразование и пролиферацию клеток. Штаммы, пассированные в культуре фибробластов куриных эмбрионов в 10-50 раз снижают свою вирулентность.
Успешное выполнение намеченной ХХVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозных болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные в справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
Методические указания по лабораторной диагностике
болезни Ауески животных
(Рекомендованы 18 мая 1978 г.)
обнаружении и идентификации вируса этой болезни в патологическом материале методами непрямой гемагглютинации (РНГА) или иммуноосмофореза;
выявлении специфических антител в сыворотке крови больных и переболевших животных в РНГА или в реакции нейтрализации (PH) на культуре клеток (ретроспективная диагностика);
постановке биологической пробы.
1.2. РНГА, реакцию иммуноосмофореза и PH применяют для исследования патологического материала и сывороток крови только от невакцинированных против болезни Ауески животных.
1.3. Лабораторный диагноз на болезнь Ауески ставят при получении положительного результата хотя бы по одному из методов исследования, указанных в п. 1.1.
Окончательный диагноз на болезнь Ауески устанавливают на основании эпизоотологических, клинических и патологоанатомических данных с учетом результатов лабораторного исследования.
2.1. В качестве исследуемого материала отбирают пробы патологического материала из разных участков головного мозга (полушарий, мозжечка, продолговатого мозга), заглоточных и бронхиальных лимфоузлов, легких, печени, селезенки, почек свиней, павших или вынужденно убитых в агональном состоянии.
Патологический материал измельчают, растирают в ступке и готовят суспензию (1:5) на физиологическом растворе для РНГА и суспензию (1:5) на веронал-мединаловом буферном растворе (pH 8,6) для метода иммуноосмофореза.
2.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные антителами к вирусу болезни Ауески);
контрольный положительный антиген (вакцинный штамм вируса болезни Ауески) в рабочем разведении;
контрольный отрицательный антиген в рабочем разведении;
нормальная лошадиная сыворотка.
2.2.2. Подготовка исследуемого материала. Суспензию из органов (1:5) выдерживают одни сутки при температуре минус 20 °С в холодильнике, затем центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость очищают хлороформом, добавляя его в количестве 1/4 части объема жидкости, затем вновь центрифугируют при 4 тыс. об/мин в течение 20 мин.
Надосадочную жидкость используют в РНГА в качестве испытуемого антигена.
Испытуемые и контрольные антигены разводят 1:2 и выше в объеме 0,05 мл 1 %-ным раствором нормальной лошадиной сыворотки. Затем добавляют по 0,025 мл эритроцитарного диагностикума. Смесь встряхивают и выдерживают при комнатной температуре в течение 2 - 3 ч.
контрольный положительный антиген + эритроцитарный диагностикум;
контрольный отрицательный антиген + эритроцитарный диагностикум;
эритроцитарный диагностикум + 1 %-ный раствор нормальной лошадиной сыворотки.
2.2.4. Учет реакции. Учет РНГА проводят при полном оседании эритроцитов в контроле с отрицательным антигеном. Положительными считают те пробы антигенов, которые в разведении 1:8 и выше вызывают агглютинацию эритроцитов при положительном результате в контроле со специфическим антигеном и отрицательном результате с контрольным отрицательным антигеном.
2.3. Реакция иммуноосмофореза.
2.3.1. Компоненты реакции:
специфическая к вирусу болезни Ауески иммуноасцитическая жидкость белых крыс (ИАЖ);
контрольный положительный антиген;
контрольный отрицательный антиген;
Для постановки реакции необходимо иметь камеру из плексигласа для электрофореза, универсальный источник питания УИП-1, агар Дифко, веронал-мединаловый буфер с pH 8,6, стекла обезжиренные (9×12), металлический штамп, пробирки, центрифугу.
2.3.2. Подготовка исследуемого материала. Суспензию из органов (1:5) подвергают однократному замораживанию (при минус 15 - 20 °С) с последующим оттаиванием. Затем суспензию центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость используют в качестве испытуемого антигена.
2.3.3. Приготовление агаровой среды. Для постановки реакции готовят 1,5 %-ный гель из агара Дифко на веронал-мединаловом буфере с pH 8,6. Пропись буфера: веронал - 1,66 г, мединал - 10,51, молочнокислый кальций - 1,536 г, дистиллированная (слегка подогретая) вода - 1 л. В качестве антибактериального средства в агаровую среду вносят мертиолят из расчета 1:10000 и хранят в холодильнике.
Для постановки реакции агар, расплавленный и остуженный до 50 - 56 °С, наносят пастеровской пипеткой на стекла размером 9×12 см. Толщина агаровой пластинки 4 - 5 мм. Расход агара около 15 мл. В затвердевшем агаре выштамповывают лунки диаметром 5 мм, с расстоянием между лунками 5 мм.
2.3.4. Постановка реакции. В лунки, которые расположены ближе к катоду, вносят исследуемые антигены; в лунки, расположенные ближе к аноду, вносят специфическую асцитическую жидкость в рабочем разведении. Иммуноосмофорез проводят в камере для электрофореза на бумаге при напряжении тока 200 - 220 В в течение 1 - 2 ч. В качестве контроля используют положительный антиген со специфической асцитической жидкостью.
2.3.5. Учет реакции. Результаты иммуноосмофореза учитывают через 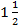
- 2 ч с момента включения камеры в сеть.
Реакция считается положительной при образовании линии преципитации между лунками с исследуемыми антигенами и специфической асцитической жидкостью при положительном результате в положительном контроле (контрольный положительный антиген + ИАЖ) и отрицательном результате в отрицательном контроле (контрольный отрицательный антиген + ИАЖ).
3.1. Ретроспективная диагностика основана на обнаружении специфических к вирусу болезни Ауески антител в сыворотке крови больных и переболевших животных в реакции непрямой гемагглютинации, а также в реакции нейтрализации на культуре клеток.
3.2. Реакция непрямой гемагглютинации.
3.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные вакцинным штаммом вируса болезни Ауески);
контрольная положительная иммуноасцитическая жидкость;
3.2.2. Подготовка исследуемых и контрольных сывороток. Перед постановкой РНГА исследуемые и контрольные сыворотки разводят 1:2 забуференным раствором, инактивируют в водяной бане при температуре 56 °С в течение 30 мин и истощают эритроцитами барана.
В 1 мл сыворотки вносят 0,1 мл 5 %-ной взвеси отмытых эритроцитов барана, выдерживают в термостате при температуре 37 °С в течение 30 - 40 мин и удаляют эритроциты центрифугированием. При массовых исследованиях сыворотки после истощения можно выдерживать в течение 12 - 24 ч при 4 °С, затем их исследуют в РНГА в разведении 1:2 и выше.
3.2.3. РНГА проводят по методике, описанной в п. 2.2.
3.2.4. Учет реакции. Результаты реакции учитывают при полном оседании эритроцитов в контроле с отрицательной асцитической жидкостью.
Положительными к вирусу болезни Ауески считают те пробы сывороток, в которых при разведении 1:8 и выше наблюдают агглютинацию эритроцитов.
3.3. Реакция нейтрализации.
3.3.1. Реакцию нейтрализации проводят на культуре клеток ПП, СПЭВ и первично-трипсинизированной культуре куриных фибробластов.
3.3.2. Компоненты реакции:
вирус болезни Ауески (вакцинный штамм);
исследуемые сыворотки крови (инактивированные);
контрольная положительная сыворотка.
3.3.3. Для постановки реакции необходимо предварительно провести пассаж вакцинного штамма вируса болезни Ауески на культуре клеток и определить его титр.
3.3.4. Чтобы провести пассаж вакцинного штамма вируса, содержимое ампулы разводят до нативного состояния (1:1), затем готовят разведение вируса 1:10 на питательной среде. Разведенный вирус в дозе 1 мл вносят в культуру клеток, выращенную в пенициллиновых флаконах, и инкубируют при температуре 37 °С. Через 24 ч клетки сморщиваются, округляются, монослой нарушается и образуются островки клеток. Через 72 ч монослой полностью нарушается и на стекле остаются единичные клетки.
Культуральный (вакцинный) штамм вируса хранят в холодильнике при температуре 4 °С и освежают один раз в 3 мес.
3.3.5. Для титрования вируса готовят десятикратные разведения вируса (от 10 -1 до 10 -8 ) на питательной среде без сыворотки. Каждым разведением в объеме 1 мл заражают отмытую раствором Хенкса культуру клеток (по 4 пенициллиновых флакона). Культуру клеток инкубируют при 37 °С, ежедневно просматривая ее под микроскопом. Окончательный учет результатов проводят через 72 ч.
Титром вируса считают наибольшее его разведение, вызывающее цитопатическое действие (ЦПД) в 50 % культур клеток. Титр вычисляют по методу Рида и Менча и выражают количество ЦПД в 1 мл.
3.3.6. Постановка реакции нейтрализации. PH ставят с дозой вируса, равной 100 ТЦД50 в 0,1 мл. Исследуемые сыворотки разводят 1:2 и выше в объеме 0,5 мл. К каждому разведению сыворотки добавляют равный объем (0,5 мл) вируссодержащей культуральной жидкости. Пробирки со смесью встряхивают и оставляют при температуре 37 °С в течение 60 мин. После инкубации смесь вируса с сывороткой вводят во флаконы с культурой клеток и результаты учитывают через 72 ч.
Для контроля заражают культуру клеток смесью вируса с контрольной положительной сывороткой, вирусом без сыворотки и одновременно в одном флаконе с культурой клеток сменяют питательную среду (контроль культуры клеток).
3.3.7. Учет реакции нейтрализации. Подавление цитопатического действия вируса специфической (контрольной) сывороткой и исследуемыми сыворотками при наличии ЦПД в контроле (культура клеток, зараженная вирусом без сыворотки) указывает на наличие специфических антител к вирусу болезни Ауески в сыворотке крови свиней.
4.1. Для постановки биопробы патологический материал (селезенку, печень, головной мозг, легкие) растирают в ступке с физиологическим раствором в соотношении 1:10. Полученную суспензию вводят внутримышечно кролику или кошке в дозе 1 мл. Через 2 - 3 сут после заражения при наличии вируса в патологическом материале животное заболевает.
Болезнь характеризуется беспокойством, зудом, расчесами на месте инъекции. Если зараженные животные погибают на 3 - 6-й день, но у них не наблюдалось зуда и расчесов, то патологический материал от павшего кролика (или кошки) пассируют еще раз на таких же животных.
Читайте также:


