Забор смывов из носоглотки на вирусы
ОРВИ
Острые респираторные вирусные инфекции (ОРВИ) – группа вирусных заболеваний верхних и нижних дыхательных путей, передаются воздушно-капельным путем и характеризуются симптомами инфекционного токсикоза. В настоящее время вирусные инфекции респираторного тракта представляют собой актуальную медицинскую проблему, имеющую важное социально-экономическое значение. По данным Роспотребнадзора, в структуре инфекционных и паразитарных болезней преобладают острые инфекции верхних дыхательных путей множественной и неуточненной локализации, составляя 92,2 %. Официально регистрируется более 30 млн случаев острых респираторных заболеваний, из них более 21 млн случаев – у детей до 17 лет. Однако в большинстве случаев пациенты с легкими формами заболевания не обращаются в лечебно-профилактические учреждения, что значительно увеличивает реальное количество заболевших острыми респираторными вирусными инфекциями.
Клинические особенности ОРВИ и их осложнения
Этиологическая структура ОРВИ представлена вирусами гриппа, парагриппа, риновирусами, аденовирусной и респираторно-синцитиальной инфекцией, коронавирусами. В настоящее время известно более 300 вирусов, поражающих верхние и нижние отделы дыхательной системы. При этом распространенность различных вирусов существенно различается в разных группах пациентов. В последние десятилетия исследователи подтверждают этиологическую значимость метапневмовируса и бокавируса в возникновении инфекционных заболеваний дыхательных путей у детей. Выявление двух и более вирусов у пациента встречается примерно в 5 % случаев. Наиболее часто полиэтиологичное инфицирование регистрируется в организованных коллективах. Для ОРВИ характерна цикличность и сезонность эпидемиологического процесса, чередование подъемов и спадов заболеваемости. Источником инфекции является больной человек, однако наибольшую опасность представляют пациенты со стертыми клиническими формами инфекции, а также вирусоносители. ОРВИ распространяются преимущественно воздушно-капельным и воз- душно-пылевым путями, однако передача некоторых вирусов возможна и контактно-бытовым пу- тем. ОРВИ регистрируются в виде спорадических заболеваний, вспышек, эпидемий и пандемий. Причинами быстрого повсеместного распространения вирусной инфекции дыхательных путей яв-ляются высокая контагиозность, короткий инкубационный период, полиэтиологичность инфицирования, снижение иммунного статуса населения, отсутствие иммунитета к новым реассортантам, урбанизация, миграция населения и т. д. Наиболее подвержены инфицированию дети дошкольного возраста, пожилые люди, беременные, пациенты с тяжелыми хроническими заболеваниями и иммунодефицитными состояниями. Клиническая картина заболевания развивается от нескольких часов до 14 дней с момента инфицирования в зависимости от этиологического агента. Для вирусных инфекций дыхательных путей характерны интоксикационный и катаральный синдромы различной степени выраженности. Осложнения ОРВИ и гриппа проявляются в виде отитов, синуситов, пневмоний – присоединения бактериальных агентов, обострения хронических заболеваний органов и систем и т.д.Дифференциальная диагностика по характерным симптомам затруднена и возможна лишь на ранней стадии заболевания. На пике заболевания патологический процесс в дыхательных путях нередко распространяется с вовлечением всей слизистой оболочки – как верхних, так и нижних отделов дыхательных путей. Кроме того, сходные с ОРВИ симптомы могут наблюдаться при других вирусных заболеваниях, таких как инфекционный мононуклеоз и гепатит. Помимо вирусов некоторые виды бактерий, в том числе хламидии и микоплазмы, способны поражать дыхательные пути, вызывая сходные с ОРВИ симптомы.
Риск заболевания и смертности для беременных при гриппе выше, чем для небеременных женщин, что первую очередь связано с развитием осложнений, а именно пневмоний, регистрируемых в период эпидемий. При этом следует отметить лидирующее место ОРВИ в структуре экстрагенитальной патологии при беременности (более 2/3 от общей заболеваемости острыми инфекция- ми), что обусловлено высокой восприимчивостью беременных к вирусным инфекциям, склонностью к хронизации патологических процессов. Для беременных характерно затяжное течение ОРВИ при отсутствии тяжелых клинических проявлений, это связано с повышенной способностью вирусов респираторной группы к репликации в плаценте, а также особенностями иммунной системы беременной женщины . Основной проблемой является решение вопроса о необходимости назначения противовирусной терапии при беременности, поскольку традиционно в лечении больных ОРВИ широко используют симптоматические средства, а этиотропные препараты рекомендуются только для тяжелых форм ОРВИ и в случаях, когда эпидемиологические данные дают основание подозревать наличие вируса гриппа.
Другой наиболее уязвимой категорией пациентов в плане развития тяжелых форм ОРВИ являются дети первых лет жизни, прежде всего – рожденные раньше положенного срока. Это обусловлено целым рядом факторов. Особенно опасной для таких пациентов является 4 респираторно-синцитиальная вирусная инфекция. Для сравнения: летальность при ней превышает таковую от гриппа у детей в возрасте до 1 года в 8,8 раза. Учитывая отсутствие широких возможностей для лечения респираторно-синцитиальной вирусной инфекции у детей, в настоящее время на первый план выходит ее диагностика и профилактика. Лабораторное обследование с целью выявления гриппа и ОРВИ необходимо проводить лицам с высоким риском неблагоприятного исхода инфекционного процесса (беременные, лица с хроническими заболеваниями органов и систем, новорожденные), больным с тяжелым и нетипичным течением заболевания, пациентам, госпитализированным с подозрением на гриппоподобные заболевания, в первую очередь лицам, находящимся в организованных коллективах (интернаты, приюты, общежития, казармы и т.д.). При систематическом мониторинге и расшифровке этиологии заболеваний гриппом и ОРВИ рекомендовано использовать методы быстрой лабораторной диагностики (иммуноферментный анализ и полимеразную цепную реакцию).
Определение возбудителя ОРВИ в каждом конкретном случае имеет важнейшее значение для выбора терапии, поскольку позволяет:
1. на самых ранних стадиях заболевания поставить этиологический диагноз;
2. определить тактику ведения пациента (лечение может быть как симптоматическим (при риновирусной инфекции), так и предполагающим использование этиотропных противовирусных препаратов;
3. оценить прогноз течения заболевания и риск вероятных осложнений;
4. осуществлять динамическое наблюдение за течением заболевания;
5. проводить быструю расшифровку вспышек ОРВИ и мониторинг эпидемиологической обстановки эпидемиологическими службами;
6. принять обоснованное решение о возможности госпитализации пациента с катаральными симптомами в неинфекционные отделения или о необходимости перевода такого пациента в специализированную клинику.
Метод ПЦР позволяет выявлять и идентифицировать ДНК или РНК вируса в течение нескольких часов. Использование метода наиболее эффективно при стертых и атипичных формах заболевания, на ранних стадиях острого инфекционного процесса, а также при проведении дифференциальной диагностики ОРВИ с патологическими процессами в респираторном тракте, вызванными бактериальными агентами, что позволит своевременно назначить лекарственную терапию инфекционного процесса до возникновения осложнений.
Материал: мазки из полости носа и ротоглотки, смывы из полости носа и ротоглотки, мокрота (либо аспираты из носоглотки и трахеи), бронхоальвеолярный лаваж (БАЛ), секционный материал.
Мазки из полости носа
Взятие материала: мазки (слизь) берут сухими стерильными свабами на пластиковом аппликаторе. Рабочую часть зонда вводят легким движением по наружной стенке носа на глубину 2−3 см до нижней раковины. Затем зонд слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. После взятия материала рабочую часть зонда с велюр-тампоном помещают в стерильную одноразовую пробирку с защелкивающейся (или закручивающейся) крышкой, содержащую соответствующую транспортную среду, и аккуратно обламывают пластиковый стержень, оставляя рабочую часть зонда с материалом в транспортной среде. Пробирку плотно закрывают крышкой.
Условия хранения и перевозки материала: 1) при комнатной температуре в течение 6ч; 2) при температуре 2−8 ° С в течение 3 суток.
Мазки из ротоглотки
Взятие материала: мазки берут сухими стерильными свабами на пластиковом аппликаторе вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки. После взятия материала рабочую часть зонда с велюр-тампоном помещают в стерильную одноразовую пробирку со специальной транспортной средой и аккуратно обламывают пластиковый стержень, оставляя рабочую часть зонда с материалом в транспортной среде. Пробирку плотно закрывают крышкой.
Условия хранения и перевозки материала: 1) при комнатной температуре в течение 6 ч; 2) при температуре 2−8 ° С в течение 3 суток.
Смывы из полости носа
Взятие материала: взятие материала проводят в положении больного сидя с отклоненной назад головой путем введения с помощью одноразового шприца (зонда) теплого стерильного изотонического раствора натрия хлорида (3−5 мл) поочередно в каждый из носовых ходов. Промывную жидкость собирают через стерильную воронку в одну стерильную пробирку.
Не допускается повторное использование воронки без предварительного обеззараживания паром под давлением.
Условия хранения и перевозки материала: 1) при температуре 2−8 °С в течение 6 ч; 2) при температуре 2−8 ° С в течение 3 суток.
Смывы из ротоглотки
Взятие материала: перед взятием смывов из ротоглотки проводят предварительное полоскание полости рта водой. После этого проводят тщательное полоскание ротоглотки в течение 10−15 с 25−40 мл изотонического раствора натрия хлорида. Жидкость собирают через стерильную воронку в стерильный флакон объемом 50-60мл
Условия хранения и перевозки материала: 1) при комнатной температуре — в течение 6 часов; 2) при температуре 2−8 ° С в течение 3 суток.
Мокрота
Взятие материала: взятие материала осуществляют в количестве не менее 1,0 мл в одноразовые градуированные стерильные флаконы с широким горлом и завинчивающимися крышками объемом не менее 50 мл
Условия хранения и перевозки материала: 1) при комнатной температуре — в течение 6 часов; 2) при температуре 2−8 ° С в течение 3 суток.
Бронхо-альвеолярный лаваж или промывные воды бронхов (ПВБ)
Взятие материала: взятие материала осуществляют в одноразовые, плотно завинчивающиеся пробирки объемом 50 мл
Условия хранения и перевозки материала: 1) при температуре 2−8 ° С в течение 1 суток;
Биопсийный или аутопсийный материал
Взятие материала: материал забирают из зоны предполагаемого местонахождения возбудителя инфекции, из поврежденной ткани или из пограничного с поврежденным местом участка. Кусочки ткани диаметром не более 5 мм помещают в одноразовые стерильные пробирки объемом 2 мл, содержащих соответствующую транспортную среду. Пробирку плотно закрывают. Макроаутоптат помещают в контейнер с физиологическим раствором или специальной транспортной средой.
Условия хранения и перевозки материала: 1) при комнатной температуре в течение 6 часов; 2) при температуре 2−8 ° С в течение 3 суток.
Посевы слизи из зева производятся при дифтерии, менингококковой инфекции, ангине, острых респираторных вирусных заболеваниях, коклюше и других инфекциях. Тампон, с помощью которого забирается материал, должен быть заранее простерилизован в лаборатории. Обычно ватный или марлевый тампон навертывается на деревянную палочку или проволоку из нержавеющего материала и опускается в пробирку.
Мазок из зева берут натощак или не ранее 2 ч после полоскания, питья либо еды под визуальным контролем с использованием шпателя, как при осмотре зева, не касаясь тампоном слизистых оболочек рта, языка, зубов. Корень языка придавливают книзу и кпереди шпателем, держа его левой рукой, а правой рукой осторожно вводят в ротовую полость тампон и снимают налет. Лучше всего снять налет или слизь на границе пораженного участка, где возбудителей больше, чем в других местах.
Перед взятием слизи из носа необходимо предварительно очистить нос (предложить больному высморкаться) сухим ватным фитилем и удалить корки. Тампон вводят в каждую ноздрю, плотно прикасаясь всеми сторонами его к стенкам и перегородке носа. Полученный материал с тампона немедленно высевается на соответствующие плотные питательные среды, а также наносится на предметное стекло, обводится стеклографом, подсушивается и направляется в лабораторию для микроскопического исследования.
Забор материала для риноцитологического исследования производится следующим способом. Небольшой ватный тампон на деревянной палочке, увлажненный физиологическим раствором, вводят в носовой ход на глубину 2 - 3 см, слегка прижимая всеми сторонами к слизистой оболочке нижней носовой раковины. Затем с тампона делаются отпечатки на чистом, обезжиренном эфиром предметном стекле. Границы отпечатков обводятся стеклографом. Отпечатки подсушиваются и направляются в лабораторию, где после специальной окраски при микроскопии в них определяются клеточный состав и характер внутриклеточных включений.
Мазки-отпечатки слизистой носа можно приготовить также на специальных пластинках из стекла или плексигласа. Пластинки должны иметь длину 70 - 80 мм, ширину 5 - 6 мм, толщину 2 - 2,5 мм, закругленные и хорошо отшлифованные края. После обработки пластинки эфиром ее вводят в носовой ход на глубину 2 - 3 см, слегка прижимая к носовой перегородке. Выводят пластинку наружу также по носовой перегородке, стараясь не смазать отпечаток. Границы отпечатка отмечают стеклографом, подсушивают и направляют в лабораторию для дальнейшего исследования.
Для иммунофлюоресцентной диагностики (метод ускоренной диагностики гриппа и других ОРВИ в первые дни болезни) исследуемый материал обрабатывают сыворотками, содержащими специфические антитела, меченные флюорохромами. Соединение меченых антител с гомологичными антигенами сопровождается характерным свечением комплексов, выявляемых в люминесцентном микроскопе.
Смывы из носоглотки используются главным образом для выделения вирусов при гриппе, кори, краснухе, ветряной оспе и других вирусных инфекциях. Они производятся в первые дни болезни, когда возбудитель интенсивно размножается в эпителиальных клетках дыхательных путей. Больному предлагают прополоскать горло стерильным физиологическим раствором. Процедуру повторяют трижды, используя при этом каждый раз по 10 - 15 мл жидкости. Смывы собирают в широкогорлую стерильную банку. Кусочками стерильной ваты, захваченной пинцетом, протирают заднюю стенку глотки и носовые ходы. Ватные тампоны опускают в банку со смывом. Материал направляют в лабораторию для последующего изучения (вирусологический, иммунофлюоресцентный и другие методы исследования).
Микроскопия мазка на дифтерию. Одним из методов ускоренной диагностики дифтерии является предварительная бактериоскопия патологического материала (слизь из зева или носа и пленки). Такое исследование выполняют только по требованию лечащего врача. В этих случаях материал берут двумя тампонами, один из которых используют для выделения культуры возбудителя, а другим делают несколько мазков для бактериологического исследования. Мазки окрашивают щелочным раствором метиленового синего по Леффлеру или другими способами.
При положительных результатах под микроскопом среди банальной (преимущественно кокковой) микрофлоры зева и носа видны дифтерийные палочки, расположенные под углом друг к другу. Дифтерийные палочки полиморфны, часто утолщены на концах, неравномерно окрашены. На концах палочек имеются зерна волютина (тельца Бабеша - Эрнста), окрашивающиеся темнее, чем остальное тело палочки, что особенно хорошо выявляется при окраске по Нейссеру (тело палочки светло-коричневое, а зерна волютина темно-синие).
При микроскопии мазка дифтерийную палочку следует дифференцировать от ложнодифтерийной (палочка Гофмана), которая характеризуется отсутствием полиморфизма, равномерным окрашиванием (отсутствие зерен волютина), параллельным расположением палочек. Бактериоскопическое исследование должны проводить опытные специалисты (в предварительном мазке типичные дифтерийные палочки редко встречаются в достаточном количестве). Примерно у 50% больных дифтерией можно обнаружить возбудителя, таким образом, однако это не позволяет установить вид коринебактерий, их тип и токсигенность.
Вместе с тем надо помнить, что положительный результат предварительного исследования очень ценен для лечащего врача. Кроме того, при бактериоскопическом исследовании можно выявить возбудителя ангины Симановского-Плаута-Венсана (спирохеты и веретенообразные палочки) и микотической ангины, а тем самым провести дифференциальную диагностику этих двух заболеваний и дифтерии. После бактериоскопии мазка обязательно проводится бактериологическое исследование материала. Цель его - выделить культуру возбудителя, изучить ее свойства с обязательным определением токсигенности.
ОСНОВНЫЕ ПРАКТИЧЕСКИЕ НАВЫКИ ИНФЕКЦИОНИСТА
ЗАБОР МАТЕРИАЛА ДЛЯ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Бактериологические методы основаны на выделении микробов-возбудителей в чистой культуре путем посевов материала, взятого от больного, на искусственные питательные среды. Кроме того, имея микроб-возбудитель в чистой культуре, можно определять его чувствительность к антибиотикам и химиопрепаратам.
Забор материала для бактериологических исследований должен осуществляться до начала лечения этиотропными средствами, посев необходимо производить немедленно после забора материала непосредственно у постели больного. Если собранный материал нельзя направить в лабораторию, в него добавляют консервирующую смесь. При отсутствии последней материал нужно хранить в холодильнике при температуре +4°С или на льду.
Посев крови лучше всего делать в начальном периоде болезни или в разгаре, сразу после озноба (наиболее выраженная бактериемия). Посев крови производится на жидкие питательные среды - сахарный, сывороточный, желчный бульон и др. Состав среды выбирается в зависимости от биологических особенностей возбудителя предполагаемой у больного инфекции. Чтобы избежать влияния бактерицидных свойств крови, ее необходимо разводить большим количеством среды, примерно в отношении 1:10. Обычно берут 10 - 20 мл крови и засевают в колбу, содержащую 90 - 180 мл среды. Переливать кровь из шприца в колбу надо над пламенем спиртовки, предварительно сняв иглу. Колбу с посевом направляют в лабораторию, а вечером и ночью помещают в термостат. При отсутствии питательной среды кровь собирают в стерильную пробирку с соблюдением таких же правил.
Посевы испражнений производятся при кишечных инфекциях (брюшной тиф, паратифы А и В, дизентерия, сальмонеллезы, эшерихиозы и др.), а также когда возникает подозрение на кишечные инфекции или имеются признаки поражения желудочно-кишечного тракта.
Забор испражнений (2 - 3 г) производится стерильным деревянным шпателем или стеклянной палочкой из судна, горшка, специального лотка, а также непосредственно из прямой кишки с помощью ватных тампонов, металлических петель или через трубку ректоскопа. В судне или горшке не должно оставаться следов дезинфицирующего средства, для чего их необходимо тщательно промыть горячей водой. Нужно стремиться взять слизь, гной, фибринные пленки, избегая примеси крови в связи с ее бактерицидным действием. Забор материала из прямой кишки не зависит от числа дефекаций и может быть сделан в любой момент. Для забора материала петлей (тампоном) больного просят лечь на бок с приведенными к животу бедрами и ладонями развести ягодицы. Петля осторожным движением вводится в задний проход на глубину 5 - 6 см и также осторожно вынимается. Затем петля помещается в стерильную пробирку и направляется в лабораторию. Лучше всего сразу же сделать посев материала на питательную среду.
Мочу(20 - 30 мл) собирают в стерильную, плотно закрывающуюся посуду при помощи стерильного катетера после предварительного обмывания половых оргнов с мылом и ополаскивания их стерильным физиологическим раствором. У мужчин допустим сбор мочи при естественном мочеиспускании после туалета наружных половых органов (для посева используется , вторая порция мочи).
Желчь(10 - 20 мл) забирается во время дуоденального зондирования. В отдельные стерильные пробирки собирают все три порции желчи (А, В и С). Конец зонда предварительно обрабатывают спиртом, затем после выделения 1 - 2 мл желчи (не используется для исследования) наполняют пробирки непосредственно через зонд или с помощью стерильного шприца. При наличии кислой реакции (примеси желудочного сока), хлопьев, белесоватого оттенка жидкости материал считается непригодным.
Промывные воды желудка (20 - 50 мл) собираются в стерильные банки после промывания желудка кипяченой водой без добавления натрия гидрокарбоната, калия перманганата и др.
ВЗЯТИЕ МАЗКОВ ИЗ ЗЕВА И НОСА, СМЫВОВ ИЗ НОСОГЛОТКИ
Посевы слизи из зева производятся при дифтерии, менингококковой инфекции, ангине, острых респираторных вирусных заболеваниях, коклюше и других инфекциях. Тампон, с помощью которого забирается материал, должен быть заранее простерилизован в лаборатории. Обычно ватный или марлевый тампон навертывается на деревянную палочку или проволоку из нержавеющего материала и опускается в пробирку.
Мазок из зева берут натощак или не ранее 2 ч после полоскания, питья либо еды под визуальным контролем с использованием шпателя, как при осмотре зева, не касаясь тампоном слизистых оболочек рта, языка,зубов. Корень языка придавливают книзу и кпереди шпателем, держа его левой рукой, а правой рукой осторожно вводят в ротовую полость тампон и снимают налет. Лучше всего снять налет или слизь на границе пораженного участка, где возбудителей больше, чем в других местах.
Перед взятием слизи из носа необходимо предварительно очистить нос (предложить больному высморкаться) сухим ватным фитилем и удалить корки. Тампон вводят в каждую ноздрю, плотно прикасаясь всеми сторонами его к стенкам и перегородке носа. Полученный материал с тампона немедленно высевается на соответствующие плотные питательные среды, а также наносится на предметное стекло, обводится стеклографом, подсушивается и направляется в лабораторию для микроскопического исследования.
Забор материала для риноцитологического исследования производится следующим способом. Небольшой ватный тампон на деревянной палочке, увлажненный физиологическим раствором, вводят в носовой ход на глубину 2 - 3 см, слегка прижимая всеми сторонами к слизистой оболочке нижней носовой раковины. Затем с тампона делаются отпечатки на чистом, обезжиренном эфиром предметном стекле. Границы отпечатков обводятся стеклографом. Отпечатки подсушиваются и направляются в лабораторию, где после специальной окраски при микроскопии в них определяются клеточный состав и характер внутриклеточных включений.
Мазки-отпечатки слизистой носа можно приготовить также на специальных пластинках из стекла или плексигласа. Пластинки должны иметь длину 70 - 80 мм, ширину 5 - 6 мм, толщину 2 - 2,5 мм, закругленные и хорошо отшлифованные края. После обработки пластинки эфиром ее вводят в носовой ход на глубину 2 - 3 см, слегка прижимая к носовой перегородке. Выводят пластинку наружу также по носовой перегородке, стараясь не смазать отпечаток. Границы отпечатка отмечают стеклографом, подсушивают и направляют в лабораторию для дальнейшего исследования.
Для иммунофлюоресцентной диагностики (метод ускоренной диагностики гриппа и других ОРВИ в первые дни болезни) исследуемый материал обрабатывают сыворотками, содержащими специфические антитела, меченные флюорохромами. Соединение меченых антител с гомологичными антигенами сопровождается характерным свечением комплексов, выявляемых в люминесцентном микроскопе.
Смывы из носоглотки используются главным образом для выделения вирусов при гриппе, кори, краснухе, ветряной оспе и других вирусных инфекциях. Они производятся в первые дни болезни, когда возбудитель интенсивно размножается в эпителиальных клетках дыхательных путей. Больному предлагают прополоскать горло стерильным физиологическим раствором. Процедуру повторяют трижды, используя при этом каждый раз по 10 - 15 мл жидкости. Смывы собирают в широкогорлую стерильную банку. Кусочками стерильной ваты, захваченной пинцетом, протирают заднюю стенку глотки и носовые ходы. Ватные тампоны опускают в банку со смывом. Материал направляют в лабораторию для последующего изучения (вирусологический, иммунофлюоресцентный и другие методы исследования).
Микроскопия мазка на дифтерию. Одним из методов ускоренной диагностики дифтерии является предварительная бактериоскопия патологического материала (слизь из зева или носа и пленки). Такое исследование выполняют только по требованию лечащего врача. В этих случаях материал берут двумя тампонами, один из которых используют для выделения культуры возбудителя, а другим делают несколько мазков для бактериологического исследования. Мазки окрашивают щелочным раствором метиленового синего по Леффлеру или другими способами.
При положительных результатах под микроскопом среди банальной (преимущественно кокковой) микрофлоры зева и носа видны дифтерийные палочки, расположенные под углом друг к другу. Дифтерийные палочки полиморфны, часто утолщены на концах, неравномерно окрашены. На концах палочек имеются зерна волютина (тельца Бабеша - Эрнста), окрашивающиеся темнее, чем остальное тело палочки, что особенно хорошо выявляется при окраске по Нейссеру (тело палочки светло-коричневое, а зерна волютина темно-синие).
При микроскопии мазка дифтерийную палочку следует дифференцировать от ложнодифтерийной (палочка Гофмана), которая характеризуется отсутствием полиморфизма, равномерным окрашиванием (отсутствие зерен волютина), параллельным расположением палочек.
Бактериоскопическое исследование должны проводить опытные специалисты (в предварительном мазке типичные дифтерийные палочки редко встречаются в достаточном количестве). Примерно у 50% больных дифтерией можно обнаружить возбудителя, таким образом, однако это не позволяет установить вид коринебактерий, их тип и токсигенность. Вместе с тем надо помнить, что положительный результат предварительного исследования очень ценен для лечащего врача. Кроме того, при бактериоскопическом исследовании можно выявить возбудителя ангины Симановского- Плаута-Венсана (спирохеты и веретенообразные палочки) и микотической ангины, а тем самым провести дифференциальную диагностику этих двух заболеваний и дифтерии. После бактериоскопии мазка обязательно проводится бактериологическое исследование материала. Цель его - выделить культуру возбудителя, изучить ее свойства с обязательным определением токсигенности.
Целью мазка из зева является определение микрофлоры. Он проводится при воспалительных заболеваниях. Для проведения процедуры необходимы:
- обеззараженная мензурка с пробкой, через которую пропущен стержень с ватным тампоном на конце;
- чистый шпатель;
- направление в лабораторию для проведения бактериологических исследований.
Рассмотрим алгоритм взятия мазка из зева и носа.

Техника совершения мазка
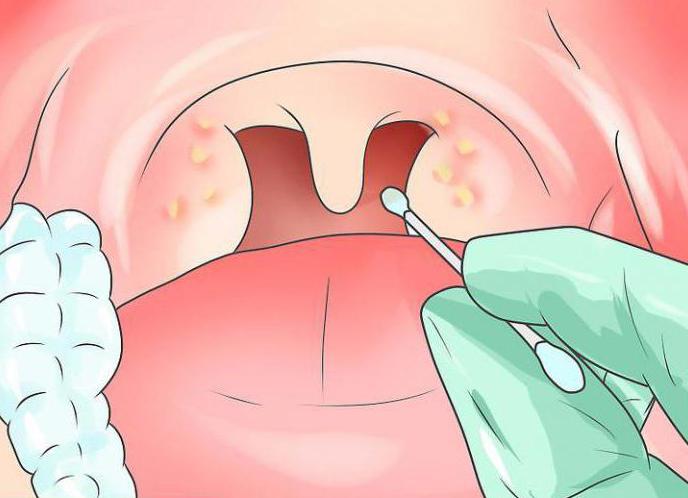
Полость рта тщательным образом осматривается. Первым делом обратите внимание на зев, язык, миндалины. Определяется то место, из которого берется отделяемое для проведения исследования.
Придерживать пробку с осторожностью, извлекать стержень из мензурки, не прикасаясь к ее наружным стенкам и окружающим предметам.
Затем пробирку помещают в штатив. Так берется мазок из зева и носа на стафилококк.
Первым, вторым и третьим пальцами левой руки взять чистый шпатель и сказать пациенту, чтобы он открыл рот. Шпателем прижать язык, вставить тампон в ротовую полость и снять отделяемое с конкретного места.
Быстро и осторожно вытащить тампон из ротовой полости и, не прикасаясь к наружным стенкам мензурки и окружающим предметам, опустить его в пробирку.
Точное время, когда взято отделяемое, указывается в направлении.
Не позднее 2-х часов с момента забора необходимо доставить мензурку с направлением в лабораторию.
Результаты исследования подклеить в историю болезни.

Целью мазка из носа является исследование микрофлоры слизистой.
Оно проводится при наличии инфекционных заболеваний, относящихся к верхним дыхательным путям.
Для проведения процедуры необходимы:
Техника взятия мазка из зева и носа довольно проста.
Для проведения бактериологического исследования необходимы мазки из зева и носа. Они отражают как качественные, так и количественные показатели микрофлоры, которая находится на слизистой ротоглотки и носоглотки. Врач может диагностировать инфекционное заболевание при наличии болезнетворного микроорганизма, а также определяет чувствительность микробов к действию ряда антибиотиков.
Зачем может понадобиться мазок из зева и носа на стафилококк? Об этом далее.
Показания для назначения анализа на микрофлору из зева
Исследование назначается при следующих патологиях:
- тонзиллит, который появляется при активации стрептококка;
- болезнь фурункулез, которая развивается из-за размножения стафилококков;
- дифтерия и подозрения на нее, когда нужно выявить бациллы Леффлера;
- простудные заболевания;
- подозрение на ларингит и мононуклеоз.
Кроме того, диагностику микрофлоры проводят с целью профилактики для того, чтобы выявить людей, которые переносят бактерии после произошедшего контакта с заболевшим человеком. Зачастую человеку назначают проведение мазка на стафилококк, когда он устраиваются на работу в лечебные учреждения, детские сады, заведения общественного питания. Беременных женщин обследуют для того, чтобы установить риск развития заболевания. Специальная подготовка к мазку из зева и носа не требуется.
О микрофлоре
На слизистой оболочке ротоглотки и носоглотки находится огромное количество микроорганизмов, которые могут быть как полезными, так и болезнетворными. Однако они не всегда вызывают различные заболевания. Главным показателем является их количество.
В определенных условиях, в частности, когда снижается иммунитет на фоне острой респираторной вирусной инфекции, общего переохлаждения организма, обостренного хронического заболевания, происходит появление болезнетворных бактерий. Они начинают размножаться интенсивными темпами.
При отсутствии заболевания в мазках могут присутствовать такие виды микроорганизмов, как стрептококки, непатогенные нейссерии, кишечная палочка, менингококки, кожный стафилококк, бактероиды, псевдомонады, дифтероиды, актиномицеты, клебсиеллы пневмонии, грибки и другие бактерии.
При условиях, благоприятных для бактерий, относительно-болезнетворные микробы в состоянии вызывать различные недуги. Также болезни могут получить свое развитие при первичном заражении организма, появляясь на слизистых оболочках верхних респираторных путей.
К микроорганизмам, которые в состоянии спровоцировать развитие отклонений, следует отнести пневмококк, гемолитический стрептококк, менингококк, золотистый стафилококк, бордетеллу, бациллы Леффлера, листерию, бранхамеллы, гемофильную палочку.
Алгоритм взятия мазка из зева и носа должен обязательно выполняться.
Предварительный этап

Для того чтобы получить максимально точные результаты исследования, обязательным является соблюдение следующих рекомендаций:
- за семь дней до сбора материала прекратить прием антибактериальных препаратов;
- использовать полоскание или спрей с противомикробным действием запрещается за два дня до диагностики;
- проводить анализ необходимо только на голодный желудок;
- перед проведением исследования не следует чистить зубы, пить воду.
Если вы будете придерживаться перечисленных правил взятия мазка из зева и носа, то результат будет верный.
Как именно нужно брать мазок?
- Усадить пациента и попросить его слегка поднять голову.
- Из штатива берется мензурка левой рукой, а извлекают стержень с тампоном правой. Сделать это необходимо очень аккуратно, не прикасаясь тампоном к окружающим предметам.
- Склянку ставят в штатив.
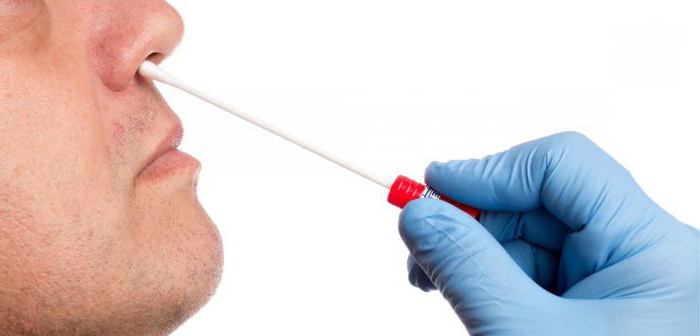
- Приподнять левой рукой кончик носа пациента и легкими вращательными движениями правой руки в нижний носовой ход ввести тампон на глубину 2 сантиметра.
- Извлечь тампон и быстро опустить в мензурку.
- Отправить пробирку в лабораторию для бактериологических исследований.
Алгоритм взятия мазка из зева и носа нужно хорошо изучить.
Примечание
Исследования в лаборатории можно отнести к вспомогательным методам. Они являются одной из наиважнейших частей обследования пациента. В огромном количестве случаев данные, которые получены с помощью анализов в лаборатории, имеют определяющее значение для постановки диагноза. Результаты дополнительных исследований в большей массе зависят от правильности подготовки пациентов. Некоторые исследования можно проводить всем без исключения больным, а отдельные из них осуществляют в строгом порядке, в соответствии с показаниями и в зависимости от диагноза.
Мы рассмотрели алгоритм взятия мазка из зева и носа.
Читайте также:


