Адинамическая болезнь кости это
Аннотация научной статьи по клинической медицине, автор научной работы — А. П. Ильин, В. Ф. Богоявленский
Похожие темы научных работ по клинической медицине , автор научной работы — А. П. Ильин, В. Ф. Богоявленский
№ 1/2002 ОСТЕОПОРОЗ И ОСТЕОПАТИИ
АДИНАМИЧЕСКАЯ КОСТНАЯ БОЛЕЗНЬ (АКБ)
У ПАЦИЕНТОВ С ТЕРМИНАЛЬНОЙ СТАДИЕЙ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ (ХПН)
А.П. ИЛЬИН, В.Ф. БОГОЯВЛЕНСКИЙ
Казанская медицинская академия, кафедра терапии и семейной меди,
(зав. кафедрой - доц. P.M. Газизов), ГУЗ ОКБ, г. Ульяновск (главный врач - В.А. Сихарулидзе)
На протяжении последних 10лет в Ульяновском областном центре почечно-заместительной терапии из 207 больных ХПН 189 пациентов систематически лечились программным гемодиализом.
С целью дальнейшего повышения эффективности лечения больных с АКБ, находящихся на лечении программным ГД, продления сроков и улучшения качества их жизни изучены закономерности развития и особенности изменения минеральной плотности костной ткани методом денситометрии.
fОстеопороз является широко распространенным метаболическим заболеванием костей. Так как общество стареет в целом, проблемы его становятся еще более важными [3]. Развитие его может рассматриваться как частая причина заболеваемости и смертности, ведущая к увеличению расходов на здравоохранение [4]. Различают две формы остеопороза: с высоким и низким типом обмена костной ткани. Эти формы диагностируются не только у женщин, достигших возраста 45-50 лет с пре- и постменопаузами, но и у пожилых мужчин [1,2].
Низкооборотный вариант поражения костей у больных с уремией, находившихся на лечении программным гемодиализом (ГД), характеризуется появлением остеомаляции и возникновением адинамической костной болезни (адинамического заболевания скелета)*. При этом состоянии в костной ткани отсутствуют остеобласты, остеокласты, остеоид, полностью прекращается ремоделирование костной ткани. АКБ может быть следствием гипопаратиреоза, причины которого при ХПН окончательно не ясны.
Среди факторов, угнетающих синтез паратиреоидного гормона (ПТГ), отмечают повышение уровня Са++ крови, гемохроматоз, албминиевую интоксикацию, гипофосфатемию, дефицит инсули-ноподобного фактора роста, ятрогенные причины (применение избыточных доз препаратов Са, ак-
тивных метаболитов D, глюкокортикоидов, сан-диммуна и т.д.) [1,9,10].
АКБ - одна из частых форм костной патологии у больных с диабетической нефропатией и лиц пожилого и старческого возраста, находящихся на лечении программным гемодиализом (ГД), пациентов, получающих лечение перитонеальным диализом, а также реципиентов почечного трансплантата [2,5].
Клинически АКБ проявляется костными болями и осложняется патологическими переломами. Содержание паратиреоидного гормона в сыворотке крови больных колеблется от 6,9 пмоль/л до 18 пмоль/л (в норме уровень ПТГ составляет 0,8-3,9 пмоль/л) [4,10]. Тяжелая гиперкальциемия может быть спровоцирована назначением препаратов Са - кальцитриола, но иногда развивается и спонтанно. Отмечено отложение нерастворимых солей Са в разных органах, при этом уровень щелочной фосфатазы может быть низким или нормальным. Для аплазии костного мозга при АКБ характерна тяжелая эритропоэтин-резистентная анемия. В настоящее время диагноз АКБ верифицируется по результатам патогистологического исследования костных биоптатов [4,5].
С целью дальнейшего повышения эффективности лечения больных с АКБ, находящихся на лечении программным ГД, и продления сроков и качества их жизни мы поставили перед собой следующие задачи: выявить закономерности развития АКБ у больных, на-
* Mnthirhe НИ Mnwior f-'/ПОРГО \JС- ¡>\l i.i nAvHnmi, hnna i/iWu /11 f'.'.'V-,,t/ ' r. /1' /C,,m,/ 1P1. tlUit . ' 1
холящихся на лечении программным ГД, изучить особенности изменения минеральной плотности костной ткани при АКБ методом денситометрии.
МАТЕРИАЛЫ И МЕТОДЫ
В период с 1990 по 2000 год в Ульяновском областном центре почечно-заместительной терапии на лечении находилось 207 пациентов (118 мужчин - 57%, 89 женщин - 43%). На начало 2000 года 143 выжили, 64 умерли. Преобладали больные хроническим гломе-рулонефритом (28%, п=58), гипертонической болезнью с исходом в нефросклероз (26,5%, п=55), хроническим пиелонефритом (14,5%, п=30), сахарным диабетом (10,2%, п=21), аномалиями развития почек (10,8%, п=22). Другие группы пациентов страдали кол-лагенозами (ревматоидный артрит, подагра и т.д.) (5,3%, п=11) и прочими казуистическими заболеваниями (4,8%, п=10).
АКБ (гистологически не подтвержденная) была клинически диагностирована у 23,8% выживших больных, находившихся на лечении программным ГД. Чаше всего АКБ обнаруживалась у лиц старше 55 лет (24,5%, п=12). У больных в возрасте моложе 40 лет она наблюдалась в 15,6% случаев (п=12), у пациентов с сахарным диабетом или у лиц, находившихся на пе-ритонеальном диализе.
Гемодиализ проводился 3 раза в неделю сеансами длительностью 210+30 минут на аппарате 4008Е (Фра-зениус, Германия) с точным волюметрическим контролем с использованием полисульфоновых мембран (F6HPS), стерилизованных паром, ацетатного концентрата AF-72 и бикарбонатного концентрата BI-84; поток концентрата 500 мл/мин, скорость кровотока -265±10 мл/мин, ЙД - 1,47±0,06. Антикоагуляция проводилась фраксипарином пропорционально массе тела и уровню гематокрита у пациента.
Биохимические исследования выполнялись на приборе НйасЫ-902 (Австрия) (определялись концентра-
ция в крови общего кальция, ммоль/л; Са++, ммоль/л; фосфора, ммоль/л; активность щелочной фосфатазы, ед/л; ммоль/л).
Концентрация ПТГ в крови исследовалась имму-ноферментным методом тест-системами (ОСТЕ1А ® intact PTH IEMA kit).
Измерения минеральной плотности костной ткани (МПКТ) выполнялись на аппарате PIXI "Lunar"B зоне дистального участка предплечья [8,9]. Оценивались как абсолютная плотность костной ткани, так и Т-крите-рий. В оценке критерия остеопороза по зоне дистального участка предплечья (Т-отклонение более |—3,5)) мы руководствовались данными Lunar News |6,7|.
Полученные клинико-инструментальные данные подвергнуты вариационной статистической обработке. Приведенные в таблицах цифры представлены пределами М±м.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Адинамическая костная болезнь диагностировалась при уровне ПТГ от 4,0 до 10,0 пмоль/л, повышенной концентрации общего кальция, при нормальных или умеренно пониженных уровнях фосфора, активности щелочной фосфатазы (табл. 1).
Как видно из табл. 1, относительно низкий уровень ПТГ коррелирует с уровнем щелочной фосфатазы в сыворотке крови. У больных с АКБ в зависимости от длительности лечения гемодиализом было отмечено снижение МПКТ, причем у пациентов, более 4 лет находившихся на лечении, она была значительно ниже, что может увеличивать степень риска возникновения переломов.
Нарушения метаболизма Са (гиперкальииемия) при АКБ можно рассматривать как фактор риска развития осложнений со стороны сердечно-сосудистой системы [5]. В наших исследованиях мы выявили поражение клапанного аппарата сердца в 71,4% случаев, что сопоставимо с частотой импрегнации
Изменение биохимических и денситометрических показателей у пациентов с АКБ в зависимости от сроков лечения
Пациенты с АКБ ПТГ, пмоль/л МПКТ, г/см2 Z-критерий (%) Т-крите-рий +SD Са общ., ммоль/л Р, ммоль/л Щелочная фосфатаза, ед/л [Са.Р]
Длительность лечения ГД 25,4+3,2 мес. (п=16) 5,3+0,5 0,48910,015 83,2+3,1 -1,65+0,29 2,6+0,2 1,49+0,03 234+10,2 3,84+0,29
Длительность лечения ГД 51,2+4,2 (п=6) 5,2+1,2 0.385+0,020 70.4+2,4 -2.8+0,2 2,2+0,1 1,65+0,05 239+11,2 3,55+0,27
Р >0,05 0,05 >0,05 >0,05 >0.05
№ 1/2002 ОСТЕОПОРОЗ И ОСТЕОПАТИИ
Биохимические и денситометрические показатели у больных с АКБ при гипофосфатемии (длительность лечения ГД 34,0+4,1 мес.)
Группа больных птг, пмоль/л мпкт, г/см2 Т-критерий Са общ., ммоль/л Щелочная фосфатаза, ед/л Са+ + , ммоль/л
Пациенты (п=6) с пониженным уровнем фосфора в крови (0,7±0,03) 14,8+3,2 0,423+0,021 -1,6+0,4 2,45+0,15 306,0+52,0 1,02+0,02
солями Са клапанов сердца при вторичном гиперпа-ратиреозе (73,2%).
Гипофосфатемия (уровень Р ниже 0,7 ммоль/л) чаше всего диагностировалась у пациентов с АКБ при уровне ПТГ от 6,9 до 18 пмоль/л (табл. 2).
Как видно из табл. 2, биохимические параметры характеризовались нормальным уровнем общего Са, нормальным или слегка повышенным уровнем щелочной фосфатазы, увеличением ПТГ в 2-3 раза от нормы и незначительным снижением МПКТ (Т-крите-рий до [-2,0]).
Периоды белкового анаболизма могут сочетаться с гипофосфатемией в результате внутриклеточного перемещения фосфора. При ограничении белкового питания без дополнительного замещения дефицита протеинов незаменимыми аминокислотами можно предполагать появление гипофосфатемии, однако у пациентов с терминальной стадией ХПН она развивается редко, несмотря на поступление в организм фосфора до 4 мг в день [10].
Гиперкальциемия может быть спутником АКБ или проявлением третичного гиперпаратиреоза (ВГПТ), при которых значительно нарушен кальций-фосфорный баланс (табл. 3).
У больных с гиперкальциемией с АКБ и ВГПТ отмечается увеличение [Са*Р] произведения, что является прогностически неблагоприятным фактором, способствующим развитию сердечно-сосудистых осложнений у пациентов, находившихся на лечении про-
граммным ГД [10]. Снижение показателей МПКТ при ВГПТ может увеличивать степень риска возникновения переломов костей.
Гиперкальциемия возникает у пациентов с терминальной стадией ХПН также и при сопутствующей патологии: миеломе, саркоидозе, злокачественных новообразованиях, при алюминиевой интоксикации [5]. Она наступает наиболее часто не только при ВГПТ, когда масса ткани парашитовидных желез увеличивается и не подавляется высоким уровнем кальция в крови, но и у пациентов, получающих лечение перитонеальным диализом [2]. Гипоальбуминемия, развивающаяся у пациентов на перитонеальном диализе, затрудняет коррекцию гиперкальциемии. У них быстро наступает дефицит активных метаболитов витамина D,. Высокий уровень алюминия в сыворотке крови увеличивает белково-связанную фракцию кальция и снижает Са++. В таких случаях происходит мобилизация Са из скелета в сосудистое русло, что ведет к повышению общей концентрации кальция в крови. Гиперкальциемия во многих случаях является следствием лечения большими дозами препаратов кальция, кальцитриолом, длительного лечения гемодиализом с использованием концентрата, содержащего высокий уровень кальция, или совокупности этих терапевтических мероприятий. Гиперкаль-циемия увеличивается, когда даже только один из вышеперечисленных методов лечения был использован при АКБ [5]. При длительно некупируемой
Группы больных ПТГ, пмоль/л МПКТ, г/см2 Т-крите-рий Фосфор, ммоль/л Щелочная фосфатаза, ед/л Са++, ммоль/л [Са.Р]
АКБ, Са общий 3,3+0,2, ммоль/л, "диализный возраст" 37,0+3,2 мес. (п=9) 4,8+1,0 0,512+0,031 -1,6+0,4 1,53+0,03 235+10,2 1,1+0,1 4,98+0,22
ВГПТ, Са общий 2,9+0,3, ммоль/л,, "диализный возраст " 68,8+8,9 мес. (п=8) 64,6+10,7 0,323+0,062 -3,72+0,3 2,0+0,2 1108+385 0,82+0,08 5,69+0,45
Сравнительная оценка уровня биохимических и денситометрических показателей у больных с АКБ И ВГПТ с выраженной гиперкальциемией
Корреляция уровня ПТГ с концентрацией кальция и магния в крови
Характеристика фуш Общий Са, ммоль/л Mg, ммоль/л
Пациенты с уровнем ПТГ 9-18 пмоль/л (п=12) 2,35±0,05 1,34±0,03
Пациенты с уровнем ПТГ свыше 50 пмоль/л (п= 15) 2,17±0,05 1,15±0,03
Р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
гиперкальциемии для уточнения диагноза необходимо проведение биопсии [1].
Уровень магния у пациентов с терминальной стадией ХПН обычно повышается вследствие потери экскреторной функции почек. Общая абсорбция его не снижается, хотя кишечная абсорбция магния в таких случаях подавлена. Около 20% его связано с альбумином; повышение уровня сывороточного магния приводит к повышению содержания его в костях, что влечет за собой развитие признаков остеомаляции [5].
На содержание магния в крови влияют два основных фактора: употребление его с пищей и поступление из диализного концентрата. Гипомагниемия возникает при нарушении всасывания магния в кишечнике, снижении поступления его с пишей, а также при нефротическом синдроме. Гипермагниемия вызывает феномен гипотермии при уремии. Высокий уровень магния в крови может снизить секрецию ПТГ. Гипермагниемия посредством изменения уровня ПТГ изменяет уровень Са в крови, снижая активность остеобластов и остеокластов, что стимулирует развитие АКБ [5]. Отмеченные закономерности констатированы и в наших наблюдениях (табл. 4).
Данные табл. 4 подтверждают факт корреляции уровней общего кальция и магния при различной продукции ПТГ.
Таким образом, колебание уровня ПТГ в сыворотке крови в пределах от 4,0 до 10,0 пмоль/л может предрасполагать к риску развития АКБ. Если при этом содержание кальция в крови превышает 2,7 ммоль/л, необходимо под жестким лабораторным контролем временно понизить концентрацию кальция в диализной жидкости ниже 1,5 ммоль/л, нормализовать поступление соединений кальция с диетой, снизить дозу принимаемого витамина Б3.
1. АКБ чаще всего встречается при ХПН у пациентов пожилого возраста, находящихся на лечении гемодиализом, и молодых больных (моложе 40 лет), страдающих одновременно с ХПН сахарным диабетом, а также использующих лечение перитонеальным диализом. Она характеризуется нормо- или гипо-фосфатемией, гиперкальциемией, близким к нор-
ме уровнем паратиреоидного гормона и щелочной фосфатазы.
3. Длительно существующая АКБ, диагностированная по данным костной денситометрии, проявляется снижением минеральной плотности костной ткани и может увеличивать степень риска появления переломов у больных ХПН.
1. Ермоленко В.М. Фосфорно-кальциевый обмен и почки // Нефрология: Руководство для врачей / Под ред. И.Е. Тареевой. М: Медицина, 2000. С. 62
2. Николаев А.Ю., Миливанов Ю.С. Лечение почечной недостаточности. М.: МИА, 1999. С. 270— 273.
3. Consensus development conference: diagnosis, prophylaxis and treatment of osteoporosis // Am J Med 1993; 94: 646-650.
4. Matluche H.H., Monier-Faugere M.C.: Risk of adynamic bone disease in dialyzed patients // Kidney (Suppl 38); 1992, s 62.
5. Llach F. Rental osteodystrophy. In: Replacement of renal function by dialysis/ Fourth edition, ed by Winchester J.F. // Kluwer academic publishers. 1996. P. 1159-1235.
6. Lunar News. T-score. Contention is increasing // Lunar News Winter, 1. 2000. P. 11-12.
7. Lunar News. Bone Densitometry. Reimbursement in US. Expanded // Lunar News. Autumn, 4. 1998. P. 6.
8. Mazess R.B. T-scores differ among skeletal sites // Calcif Tissue Int 1999. 64. S. 104.
9. Rix M., Andreassen H., Eskildsen P., Langdahl В., Olgaaard K. Bone mineral density and biochemical markers of bone turnover in patients with predialysis chronic renal failure // Kidney Int 1999. 56: 1084-1093.
Костные осложнения характерны для хронической почечной недостаточности, они редко диагностируются и нечасто привлекают внимание.
Почечную остеодистрофию можно классифицировать по типу костного ремоделирования: низкое, нормальное или высокое; по степени минерализации: нормальная или сниженная; по величине костного объема: низкий, нормальный или высокий. Кроме клеточного компонента, кость состоит из большого количества органического вещества (остеоида) и неорганического матрикса (минерального). Ежегодно происходит оборот около 15% костной ткани. Остеоид, синтезируемый остеобластами, представлен главным образом коллагеном I типа с протеогликанами и другими белками, представленными в относительно небольших количествах, включая фибронектин и остеонектин. Неорганический компонент состоит в основном из кристаллов гидроксиапатита. Кроме количества минерализованной костной ткани (которая определяет МПКТ) и ненарушенной микроструктуры кости, необходим правильный баланс между органическими и неорганическими компонентами для обеспечения нормальных механических свойств (прочность, способность амортизировать удар и способность к деформации). ПТГ и концентрация активного витамина D (1,25-дигидрокси-витамин D3; кальцитриол) служат самыми важными показателями структуры костной ткани и метаболизма кальция. ПТГ поддерживает содержание кальция в плазме путем повышения абсорбции в кишечнике, повышения реабсорбции почками и мобилизации кальция из костной ткани. Избыток ПТГ приводит к повышению ремоделирования костной ткани. Это касается и губчатых, и трубчатых костей. Более 98% активного витамина D3 синтезируется в эпителии проксимальных канальцев почек, и синтез этот снижен у пациентов с почечной недостаточностью. Синтез в норме повышается под действием ПТГ, существует обратная отрицательная связь, посредством которой витамин D3 снижает секрецию ПТГ. Ключевыми показателями, оцениваемыми при биопсии костной ткани, служат объем костной ткани, костное ремоделирование (с использованием двойного связывания с тетрациклином), минерализация остеоидной ткани и отложение металлов (особенно алюминия). Это способствует диагностике некоторых форм заболеваний костей, вызванных почечной недостаточностью.
Заболевание с высокой интенсивностью обмена костной ткани (фиброзно-кистозный остеит)
Оно характеризуется избыточным количеством ПТГ и повышенной активностью остеобластов и остеокластов. Равновесие может быть нарушено в сторону или чрезмерного образования кости, или избыточного распада. Первая ситуация приводит к чрезмерной выработке остеоида и перитрабекулярному фиброзу, которые могут нарушить образование костного мозга. Чрезмерный распад костной ткани может привести к характерному кистозному изменению. Повышенная пористость губчатой кости способствует повышенному риску возникновения переломов. Заболевание обычно носит бессимптомный характер, показатели рутинного биохимического анализа крови в пределах нормы, за исключением повышенной концентрации ПТГ. Увеличение содержания витамина D (активной фракции, действующей на рецепторы витамина D) и кальция (действующего через рецепторы, чувствительные к кальцию) служит мощным стимулом снижения секреции ПТГ. Обе реакции угнетаются при вторичном гиперпаратиреозе, и секреция ПТГ неадекватно высокая. Триггером данного повышения ПТГ, вероятно, служат низкие концентрации кальцитриола. Высокие концентрации фосфатов приводят к связыванию кальция, затем к снижению концентрации ионизированного кальция и соответственно повышению секреции ПТГ. Кроме этого, фосфат может прямо повышать секрецию ПТГ и угнетать 1α-гидроксилазу почек.
Нарушенная минерализация (остеомаляция)
Это прямое следствие субоптимального содержания витамина D, хотя она обычно не носит тяжелый характер, требующий постановки клинического диагноза остеомаляции. В прошлом основным фактором риска было воздействие алюминия, и поскольку сейчас это не так распространено, чистая остеомаляция становится менее характерной для хронической почечной недостаточности.
Смешанная почечная остеодистрофия
Симптомы избытка ПТГ сочетаются с нарушенной минерализацией, обусловленной относительной недостаточностью витамина D.
Адинамическая болезнь кости (состояние низкого оборота костной ткани)
Это противоположная сторона состояния, наблюдаемого при избытке ПТГ, и особенно она характерна для пациентов пожилого возраста и лиц с сахарным диабетом. По данным анализа биопсийных образцов, она встречается с частотой до 50%. Адинамическая болезнь кости больше всего характерна в тех случаях, где существует избыточная терапия препаратами кальция и витамина D, после паратиреоидэктомии или при алюминиевой интоксикации. Адинамическая болезнь кости представлена снижением объема остеоида и очень небольшими признаками активности остеобластов или остеокластов, а также отсутствием связывания с тетрациклином. Данное заболевание ассоциировано с повышенным риском возникновения переломов, костной боли и эктопической кальцификации. При адинамической болезни костей минерализация костной ткани нормальная.
Обследование должно включать определение сывороточного ПТГ, кальция (откорректированного по концентрации альбумина или ионизированного), фосфата, ЩФ и бикарбонатов плазмы, а также визуализацию очагов кальцификации в мягких тканях. В то время как точный диагноз почечной остеодистрофии требует проведения биопсии кости, широкое применение данного метода ограничено вследствие его инвазивности, необходимости длительной подготовки пациента с применением двойной тетрациклиновой метки и возможности интерпретации лишь в специализированных центрах. ПТГ — единственный наиболее приемлемый биомаркер, его концентрация повышена при усилении костного ремоделирования. Место маркеров костного ремоделирования в диагностике не установлено, хотя они могут помочь в мониторинге эффектов проводимого лечения. Маркеры образования костной ткани включают остеопротегерин, общую и специфичную для костной ткани ЩФ, остеокальцин и проколлаген I типа с карбоксиконцевым пептидом. К маркерам резорбции костной ткани относят пиридинолин и деоксипиридинолин, тартрат-резистентную кислую фосфатазу (TRAP) и проколлаген I типа с перекрестно связанным карбоксиконцевым пептидом.
Определение МПКТ полностью не коррелирует с риском переломов. Дистальный отдел лучевой кости служит предпочитаемым местом определения МПКТ при хронической почечной недостаточности. Проблема заключается в том, что низкая МПКТ не обязательно указывает на остеопороз и, следовательно, на необходимость антирезорбтивной терапии. Биопсия кости показана, когда биохимические проявления трудно интерпретировать, когда манифестирует перелом или костная боль и когда они не могут быть объяснены при помощи неинвазивных методов, при возможности алюминиевой интоксикации и в случаях, когда имеется выраженная и прогрессирующая кальцификация сосудов. Гистоморфометрия кости использует показатели ремоделирования, минерализации и объема для классификации почечной остеодистрофии (классификация TMV). Биопсию обычно берут из гребня подвздошной кости. Применение двух курсов тетрациклина в течение 4 нед до проведения биопсии позволит оценить образование костной ткани и степень минерализации.
В целом метаболические аномалии, приводящие к нарушению морфологии кости и кальцификации сосудов, не встречаются до тех пор, пока СКФ не снизится ниже 60 мл/минх1,73 м 2 . Однако эти костные и сосудистые изменения наблюдаются у детей и молодых взрослых при более легком снижении СКФ ( 2 ). Следует проявлять осторожность в диагностике чистого остеопороза у пациента с почечной недостаточностью. При рутинном скрининге кальцификацию сосудов лучше всего выявлять с помощью простой рентгенограммы брюшной полости в боковой проекции, определяя кальцификацию аорты. КТ дает более точную информацию; описаны количественные методы в исследовательских целях, но рутинное применение КТ в настоящее время неоправдано.
Высокие концентрации фосфатов можно снизить с помощью эффективной почечной заместительной терапии (диализ или трансплантат), хотя ответ на диализ часто неполный. Следует ограничить поступление фосфатов с пищей. Многим пациентам необходимо лечение препаратами, связывающими фосфаты. Употребление до еды препарата алюкап (алюминия гидроксидр) очень эффективно, но при длительном применении существует риск токсических эффектов на костную ткань и головной мозг. Препараты кальцикью, тайтралакр и фосс-Экс (кальция ацетат) — кальцийсодержащие фосфатсвязывающие лекарственные средства, которые принимают за 15 мин до еды. Севеламер стали применять недавно, это фосфатсвязывающий препарат, не содержащий ни алюминия, ни кальция. Необходимо провести адекватное лечение витамином D. Поскольку существует проблема образования в почках активного 1,25-дигидрокси-витамина D3, обычно требуется применение активного аналога витамина D, например альфакальцидола. Цинакалцет — агонист кальция, действующий на кальций-чувствительный рецептор в клетках паращитовидных желез, приводит к снижению секреции ПТГ. Препарат относительно дорогой, но эффективный. Хирургическое удаление паращитовидных желез показано пациентам с очень высокими значениями ПТГ.
Результаты последних исследований
Получены новые данные, что у многих пациентов могут быть скрытые незначительные аномалии при ранней стадии нарушения функции почек, и эти аномалии играют роль в прогнозе. Левин (Levin) и соавт. изучили 1814 пациентов с различной степенью нарушения функции почек. Субоптимальные значения витамина D ( 80 мл/мин и у более 60% с СКФ 80 мл/мин).
У пациентов с заболеванием почек кальцификация сосудов приводит к структурным изменениям в сосудистой стенке и усиленному атерогенезу. Однако пациенты с бессимптомным гиперпаратиреозом могут иметь незначительные нарушения функции сосудов, которые способствуют развитию макрососудистых состояний. Эти нарушения включают инсулинорезистентность, активацию эндотелия и повышение ригидности артерии. У пациентов с бессимптомным течением заболевания изменения толерантности к глюкозе быстро не прогрессируют. Фалло (Fallo) и соавт. показали повышение концентраций растворимого Е-селектина и фактора VIII фон Виллебранда у пациентов с гиперпаратиреозом. Эти показатели предоставляют данные об активации эндотелия и могут помочь оценить сердечно-сосудистый риск до и после лечения гиперпаратиреоза.
Нарушения минерального обмена способствуют развитию инсулинорезистентности и сахарного диабета II типа. С другой стороны, лечение сахарного диабета может повлиять на состояние костной ткани и минерального обмена. Тиазолидиндионы (росиглитазон и пиоглитазон) широко используют при лечении сахарного диабета II типа. В костной ткани эти препараты усиливают адипогенез и снижают дифференцировку остеобластов. Именно поэтому вызывает беспокойство, что они могут предрасполагать к развитию остеопороза. Недавно полученные данные свидетельствуют, что применение глитазоновых препаратов может снизить МПКТ. Необходимо определить, обусловливает ли это повышенный риск переломов.
Детский и подростковый возраст являются критическими для роста и развития костной системы и сосудов. ХБП повреждает регуляцию минерального обмена с последующим нарушением роста, моделирования и ремоделирования костей. Кроме того, нарушения минерального обмена при ХБП часто сопровождаются кардиоваскулярной кальцификацией.
Наиболее яркие клинические проявления последствий ХПН связаны с почечной остеодистрофией - специфической формой метаболической болезни кости, проявляющейся в виде тяжелых нарушений формирования скелета на фоне растущего организма. С тех пор как диализ и почечная трансплантация стали рутинными методами лечения у детей с ТПН, на проблемах нарушения роста и костных поражений был сосредоточен значительный интерес клиницистов, поскольку диализ их не решает. Костная ткань формируется остеобластами, поддерживается остеоцитами и резорбируется остеокластами. Эти клетки происходят из мезенхимальных клеток, которые способны к дифференцировке в фибробласты, костные или хрящевые клетки. Остеобласты обеспечивают формирование новой кости. Остеоциты осуществляют метаболический обмен между тканевой жидкостью и костью, забирают или откладывают минералы. Основными функциями остеокластов является резорбция кости, и организация архитектоники кости. Паратгормон (ПТГ) повышает активность остеокластов.
ПТГ является одним из главных уремических токсинов. Длительное воздействие высокого уровня ПТГ приводит к повышению активности остеокластов и фиброзным изменениям костей. ПТГ участвует в развитии кардиоваскулярной кальцификации. Гиперпаратиреоз способствует развитию артериальной гипертензии (за счет повышения ригидности сосудов) и анемии (являясь одной из причин резистентности к эритропоэтину). В норме роль ПТГ состоит в поддержании постоянной концентрации Ca ++ в плазме крови через мобилизацию Ca из кости, повышения канальцевой реабсорбции Ca. ПТГ влияет на продукцию кальтриола, который усиливает кишечную абсорбции Ca. Секреция ПТГ регулируется следующими механизмами:
2) Роль фосфора Высокий уровень фосфора вызывает гипертрофию и пролиферацию паратиреодных клеток, повышая секрецию ПТГ. Фосфор препятствует действию 1,25(OH)2D3 (кальцитриол), вероятно путем снижения количества рецепторов витамина D (VDR) на паратиреоидной железе или связываясь с этими рецепторами.
3) Роль Кальцитриола (1,25(OH)2D3) 1,25(OH)2D3 активно влияет на свойства органической матрицы кости, тормозя образование зрелого коллагена, стимулируя синтез гликозоаминогликанов в делящихся хондроцитах, анионные группы которых связывают ионы кальция, инициируя оссификацию. 1,25(OH)2D3 активирует остеокласты, резорбцию, ремоделирование в условиях гипокальциемии, способствует выходу кальция из кости в кровь. Кальцитриол связывается с рецептором витамина D (VDR) на клетках паратиреоидных желез и снижает транскрипцию гена ПТГ. Недостаток 1,25(OH)2D3 вызывает снижение синтеза кальций-связывающего белка (остеокальцин) и всасывания солей кальция в кишечнике, уменьшает способность органической матрицы костей фиксировать их, вызывая снижение синтеза цитратов в тканях.
При снижении СКФ до 70 мл/мин´1,73м² начинает развиваться вторичный гиперпаратиреоз(рис.15). При этом снижение процессов гидроксилирования витамина D в почках вызывает уменьшение кишечной абсорбции Ca, что приводит к активации CaSR и снижению активности VDR с последующим высвобождением ПТГ. Снижение почечной экскреции фосфора ведет к гиперфосфатемии, которая также стимулирует секрецию ПТГ. В последние годы описан фосфатурический гормон, фибробластный фактор роста фибробластов 23(FGF-23), который также может участвовать в патогенезе вторичного гиперпаратиреоза. Уровень FGF-23 повышается по мере прогрессирования ХПН, выраженный подъем отмечается у пациентов на диализе. На ранних стадиях ХБП, повышенный сывороточный уровень FGF-23 ассоциируется с угнетением продукции кальцитриола и, возможно, участвует в ранней стимуляции высвобождения ПТГ.
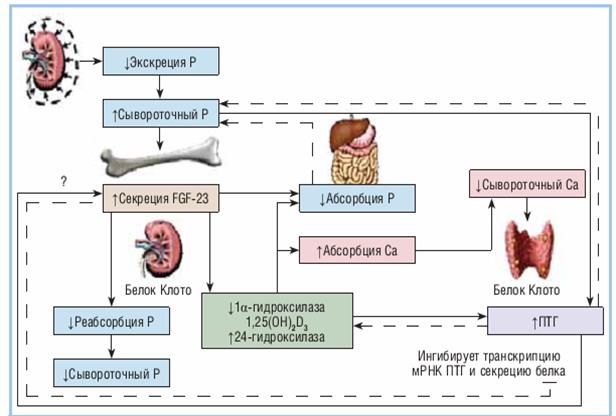
Рисунок 15. Патофизиология нарушений минерального метаболизма при ХБП
Третичный гиперпаратиреоз обусловлен развитием узловой гиперплазии паращитовидных желез и резистентностью скелета к действию ПТГ. Данное состояние может сформироваться в том случае, если гипокальциемия и гиперфосфатемия не коррегируется диетой и медикаментозно, что приводит к постоянной гиперсекреции ПТГ и относительному повышению синтеза 1,25(OH)2D3, стимулированному ПТГ. Увеличение абсорбции фосфора в кишечнике усугубляет гиперфосфатемию, замыкая цикл стимуляции ПТГ. Персистирующая стимуляция паратиреоидных желез низким уровнем плазменного Ca и высоким уровнем фосфора ведет к гиперплазии, которая является практически необратимой. На гипертрофированной железе уменьшается экспрессия CaSR и VDR, в результате чего супрессия ПТГ кальцием и 1,25(OH)2D3 ослабевает. В дальнейшем этот процесс может прогрессировать, что делает необходимым проведение паратиреоидэктомии.
Клиника почечной остеодистрофии. На ранних стадиях ХПН повреждения скелета проявляются в метафизах, где происходит быстрое моделирование костной ткани по сравнению с другими участками скелета, что проявляется артропатиями, обусловленными эпифизеолизом и метафизарными переломами. Клиническими признаками ПОД являются деформации костей скелета, прежде всего конечностей; задержка физического и моторного развития; дистрофические изменения зубной эмали; артропатии, миопатии; при развитии метастатической внекостной кальцификации отмечается кожный зуд и в тяжелых случаях пальпируемые кальцификаты в мягких тканях. На ранних стадиях ПОД изменения выявляются только при лабораторном и инструментальном обследовании больного. Целесообразно определение следующих показателей:
· Общего и ионизированного Ca, фосфора и щелочной фосфатазы в крови.
· Рахитические изменения: периостальное возвышение, расширение зоны условной кальцификации, грубая трабекулярная матрица, эпифизиолиз головок бедренных костей, искривление длинных костей, сдавление тел позвонков, диффузная деминерализация кости, блюдцеобразное расширение метафизов.
· Гиперпаратиреоз: субпериостальные эрозии, особенно на радиальной стороне фаланг, фалангеальных пучков и дистальных отделов ключиц.
· Остеосклероз: позвоночник, таз, ребра, длинные кости и основание черепа.
· Метастатическая кальцификация: мягкие ткани, особенно по ходу кровеносных сосудов.
· Содержания ПТГ в сыворотке крови.Существующий “интактный” иммунорадиометрический анализ (IRMA) определяет как целые молекулы ПТГ, так и его фрагменты. Доля циркулирующих фрагментов ПТГ возрастает при ХПН и повышением уровня ПТГ. Для более точного определения ПТГ используется метод, учитывающий только молекулы ПТГ с полным N-терминальным концом, так называемый “целый” ПТГ. Оказалось, что уровень “целого” ПТГ на 30-60% ниже иПТГ.
· R-логическое обследование. Признаки ПОД включают:
Наиболее очевидными признаками являются периостальная резорбция и метафизарные изменения. Для подростков специфическим симптомом остеомаляции являются зоны разрежения. У дошкольников дистальные метафизы лучевой и локтевой костей могут иметь лишь незначительные изменения, тогда как в дистальных и проксимальных эпифизах бедренных костей наблюдаются тяжелые повреждения.
Для адинамической болезни кости не характерны какие-либо определенные радиологические изменения, однако на нее могут указывать очаги внекостной кальцификации, переломы или остеопения.
Биопсии кости у диализных пациентов свидетельствуют, что АБК формируется при уровне ПТГ менее 2 норм. Поэтому в большинстве случаев рекомендуется поддерживать ПТГ в 2-4 раза выше нормы, чтобы обеспечить ребенку нормальный рост, и достаточное поступление Са ++ в костную ткань, что предотвращает сосудистую кальцификацию.
Факторы риска для развития АБК - высокое потребление кальция (Ca-содержащие фосфат-биндеры), терапия высокими дозами активными метаболитами витамина D, перитонеальный диализ с использованием диализата с высоким содержанием кальция и возраст (подростки после скачка роста).
Биохимически гиперкальциемия и/или уровень ПТГ в пределах или ниже нормы характерны для АБК, которая может неблагоприятно влиять на рост детей на диализе. Поэтому, если ПТГ падает ниже нижней границы нормы, терапия витамином D должна быть уменьшена или остановлена. Если ПТГ остается ниже нормы, несмотря на нормализацию Ca и фосфора, необходимо использовать диализат с низким содержанием Ca (1,0 или 1,25 ммоль/л) чтобы стимулировать секрецию ПТГ. Значительное увеличение концентрации ПТГ (>4 норм) в сочетании нормальным или повышенным уровнем Ca сыворотки и высокой щелочной фосфотазой почти всегда указывает на фиброзный остеит. Исключение - интермитирующая терапия высокими дозами витамина D3, так как 1,25(OH)2D3 непосредственно ингибирует функцию остеобластов и пролиферацию.
При гиперпаратиреозе из-за чрезмерной костной резорбции часто наблюдается гиперфосфатемия. У детей с хорошим контролем ПТГ (≥2 норм) до развития терминальной ХПН не развивается скелетная резистентность к ПТГ, сохраняется нормальный рост и плотность кости на диализе. У детей с недостаточным контролем ПТГ трудно достичь уровня ПТГ меньше 2 норм без гиперкальциемии. Однако потенциальный риск АБК может быть уравновешен тем фактом, что ПТГ является независимым фактором риска для сердечно-сосудистой патологии.
Лечение почечной остеодистрофии. Целью коррекции нарушений минерального обмена при ХБП является нормализация структуры и роста скелета и предотвращение кардиоваскулярной кальцификации.
1) Коррекция метаболического ацидоза. Хронический метаболический ацидоз (МА) ведет к увеличению резорбции кости, также ингибирует эндохондральное формирование кости. МА должен быть исправлен пошаговым подходом: первый шаг - оптимизация диализного режима. Если коррекция МА не достигается, бикарбонат натрия должен приниматься per os. Доза подбирается индивидуально под контролем кислотно-основного состояния (КОС).
2) Поддержание нормального уровня фосфора –ключевой момент лечения гиперпаратиреоидизма и предупреждения сердечно-сосудистой патологии. Уровень фосфора крови должен находиться в пределах нормального возрастного диапазона (50-ой перцентиль). У детей с ХПН гиперфосфатемия появляется при уровне СКФ ниже 40 мл/мин/1.73м 2 и почти всегда наблюдается у детей на диализе.
Контроль уровня фосфора осуществляется с помощью диетических мероприятий и назначением фосфат-биндеров. Физиологическая диета содержит 800-1500 мг фосфора, из которых 50-70% всасывается. Сокращение потребления фосфора само по себе повышает интестинальную абсорбцию Cа (обусловленную 1,25(OH)2D3) и рост сывороточного Ca, в результате чего снижается ПТГ, и этого может быть достаточно при умеренной ХПН.
Следующий шаг – назначение фосфат-биндеров, в качестве которых наиболее часто используются карбонат Са (CaCO3, содержание элементного кальция - 40 %) и ацетат Ca (CaAц, содержание элементного кальция -25%), которые могут снизить абсорбцию фосфора на 30-40%, особенно если принимаются перед едой. Ацетат Ca имеет более высокую фосфор-связывающую способность, независимую от pH.
Ca-содержащие фосфат-биндеры должны назначаться в стартовой дозе приблизительно из расчета 500мг на 200мг фосфора диеты или в зависимости от возраста:
- в 0-1лет-по 500мг´1-2раза в день;
- в 1-4 года, 2-3раза в день по 500мг;
- в 5-8 лет 500мг 3-4 раза в день;
- в 9-18 лет 5раз по 500мг.
Альтернативный подход – стартовая доза приблизительно 50 мг/кг/день. Доза регулируется в зависимости от концентрации фосфора и кальция в сыворотке. Фосфат-биндеры должны приниматься с пищей.
Для взрослых диализных пациентов DOQI рекомендуют ограничивать потребление элементарного кальция 2 г/день. Для детей не установлен безопасный верхний уровень, однако в растущем скелете должен поддерживаться положительный баланс кальция в диапазоне +200- + 300 мг, но нужно избегать высокой нагрузки кальцием, так как совокупное потребление кальция - один из идентифицированных факторов риска для кальцификации мягких ткани у детей с ХБП.
Ca-содержащие фосфат-биндеры в высоких дозах могут вызывать гиперкальциемию, особенно у пациентов на диализе с олигоанурией. В этой ситуации могут использоваться Ca-несодержащие фосфат-биндеры. Единственный коммерчески доступный фосфат-биндер, не содержащий алюминий и кальций – Севеламер (Ренагель). Альтернативный фосфат-биндер – карбонат лантана (Фосренол), имеющий высокое сродство к фосфору, и минимально абсорбирующийся в кишечнике.
В рандомизированных исследованиях у взрослых пациентах, карбонат лантана хорошо контролировал уровень фосфора в плазме и реже индуцировал адинамическую болезнь кости, чем CaCO3. Однако длительная терапия карбонатом лантана может приводить к накоплению лантана в различных органах и тканях, отдаленные последствия которого пока не определены.
Очень трудно контролировать фосфор и у пациентов на диализе. В течение 4-х часовой процедуры гемодиализа удаляется около 60 мг фосфора (в расчете на 1м² S диализатора), причем большая часть его удаляется за 1-й час диализа, так как скорость движения фосфора из клеток не велика, и она еще больше замедляется, по мере достижения нормального уровня фосфора. За 12 последующих часов восстанавливается 80% предиализного уровня. Фосфор также медленно транспортируется через перитонеальную мембрану в диализат при перитонеальном диализе. Отношение фосфора в диализате к плазменному фосфору (Д/П) почти в 2 раза ниже по сравнению с мочевиной. Поэтому даже на диализе больные не могут отказаться от ограничения фосфора в диете и приема фосфат-биндеров.
3) Лечение витамином D.На ранних стадиях ХПН увеличение ПТГ отрицательно коррелирует с уровнем 1,25(OH)2D3. Почечный синтез 1,25(OH)2D3 нарушается при ХБП, однако, внепочечные клетки, то есть, макрофаги и остеобласты, также способны производить 1,25(OH)2D3. В отличие от почечного, внепочечный синтез 1,25(OH)2D3 - строго субстрат- зависимый. Для всех детей на 2-4 стадиях ХБП с вторичным гиперпаратиреоидизмом показаны пищевые добавки с 25(ОH) D и витамин D из естественных пищевых источников. Если ПТГ увеличен у детей на додиализной стадии ХПН или если ПТГ увеличен, больше чем два-три раза по сравнению с нормой, а P 5.0 ммоль²/л²:
- Уровень ПТГ нормальный или снижен (возможно развитие АБК):необходимо отменить вит. D, перейти на Ca-несодержащие фосфат-биндеры, перейти на низкокальциевый диализ.
- Уровень ПТГ нормальный или повышен: отменить витамин D.
При высоком фосфоре -назначить гипофосфатную диету, увеличить прием фосфат-биндеров.
При высоком содержании Ca – перейти на низкокальциевый диализ, назначить Ca-несодержащие фосфат-биндеры. У больных с остаточной функцией почек и гиперкальциемией могут использоваться петлевые диуретики (например фуросемид), повышающие экскрецию кальция.
Уровень ПТГ постоянно очень высокий: субтотальная партиреоидэктомия.
Паратиреоидэктомия.Притяжелом гиперпаратиреозе отсутствует реакция даже на высокие дозы 1,25(OH)2D3 и уровень фосфора не снижается. Во взрослой практике на необходимость паратиреоидэктомии указывают: сохраняющийся чрезвычайно высокий уровень ПТГ на фоне высоких доз витамина D3, R-логических симптомов гиперпаратиреоидизма в области лучезапястного сустава, и/или высокого Ca сыворотки и нормального фосфора и/или увеличенного Ca´P произведения. Однако ПТГ стимулирует костный оборот и регулирует гомеостаз кальция, что исключительно важно для растущего скелета. Поэтому в детской практике нет описания случаев паратиреоидэктомии.
Связь между ХПН, костной системой и сосудистой циркуляцией.Кардио-васкулярные болезни являются ведущей причиной смертности, как среди взрослых, так и среди детей с ХБП. Таким образом, предупреждение прогрессирования кардио-васкулярной заболеваемости – ключевой момент контроля нарушений минерального обмена при ХБП. Этиология сосудистых болезней при ХБП – мультифакториальна и включает традиционные факторы риска, такие как гиперлипидемия, гипертензия, воспаление, а также нарушения минерального метаболизма, специфические для ХБП. Нормализация минерального метаболизма, в отсутствии избыточного подавления ПТГ, гипертензии, поддержания нормального содержания сывороточного фосфора и произведения Ca´P актуальны для всех больных с ХБП. Для предотвращения прогрессирования кальцификации сосудов рекомендуется снизить потребление кальция в 2 раза по сравнению с возрастной нормой в дополнение к рутинному мониторингу биохимических параметров и добавлению фосфат-биндеров и витамина D.
Таким образом, начинать терапию витамином D и фосфат-биндерами необходимо на ранних стадиях ХБП. Это позволяет избежать формированияПОД, приводящей к тяжелой инвалидизации больных. В то же время, коррекция последствий ПОД на поздних стадиях часто оказывается неэффективной.
Читайте также:


