Aeromonas hydrophila в анализе дисбактериозе действия
Бредихина Данилы
Таксономия
› Aeromonas hydrophila subsp. hydrophila
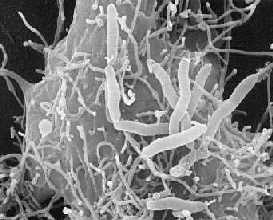
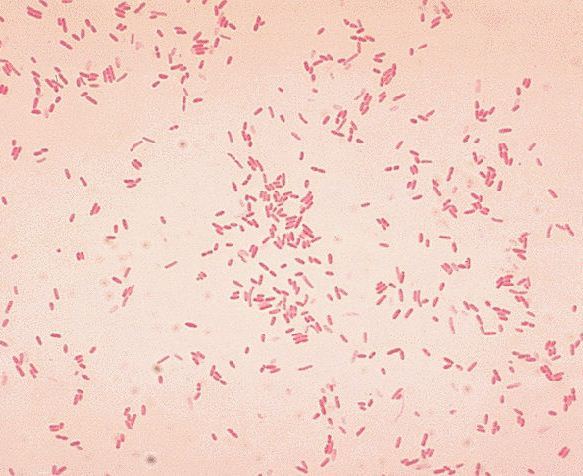
Описание
Aeromonas hydrophila - это гетеротрофная, грамотрицательная бактерия стержневой формы, находят которую, в основном, в районах с теплым климатом. Эту бактерию также можно найти в свежей, солёной, морской, устьевой, хлорированной и нехлорированной воде. A. hydrophila способна выжить как в аэробных, так и в анаэробных условиях. Эта бактерия может переварить вещества, такие как желатин и гемоглобина. A. hydrophila была изолирована от людей и животных в 1950-х. Эта бактерия является самой известной из шести видов Aeromonas. Она также обладает высокой устойчивостью ко многим лекарствам, хлору и низким температурам.
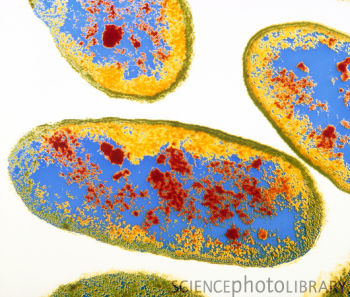
Инвазивную подвижную грамотрицательную палочку A. hydrophila находят обычно в воде. Обитающая в водной среде, эта бактерия, как сообщается, является причиной вторичного заражения ран, сепсиса, целлюлита, пневмонита, некротического фасциита и гастроэнтерита, а также вызывает язвенный синдром рыб. А. hydrophila связана со 100% смертностью от септического шока.
В качестве лечения обычно рекомендуются антибиотики; цефотаксим и другие цефалоспорины (β-лактамные антибиотики) третьего поколения также могут служить эффективным методом лечения. Однако вакцины до сих пор не существует.
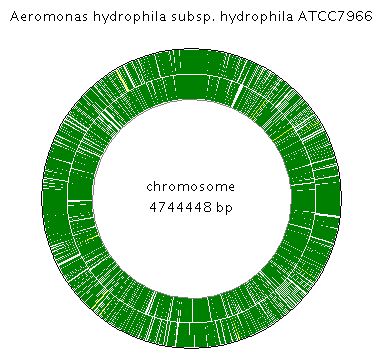
Секвенирование (т.е. определение первичной аминокислотной или нуклеотидной последовательности) Aeromonas hydrophila подвида hydrophila ATCC 7966 было завершено 8 ноября 2006 года Институтом геномных исследований (TIGR). Круговая карта генома включает в себя 4744448 пар азотистых оснований, он состоит из одной круговой хромосомы, кодирующей 4122 белков.
База данных PubMed
В базе данных PubMed можно найти (например, по запросу Aeromonas hydrophila ATCC[TI]) интересную статью учёных из Института геномных исследований под названием Геномная последовательность Aeromonas hydrophila АТСС 7966T: мастер на все руки. (Идентификатор статьи в PubMed - 16980456; авторы статьи - Seshadri R, Joseph SW, Chopra AK и другие.) Вот аннотация этой статьи:
Полный геном Aeromonas hydrophila АТСС 7966 (T) был секвенирован. Aeromonas , вездесущая водная бактерия, была помещена Агентством по охране окружающей среды от в список потенциальных загрязнителей (the Contaminant Candidate List) из-за её способности вызывать заболевания человека. Аннотация генома (4.7мбаз) этого возбудителя показала, что данная бактерия обладает широкими возможностями обмена веществ и (как следствие) высоким потенциалом вирулентности (степени способности данного инфекционного агента заражать данный организм). Большой массив генов вирулентности позволяет бактерии инфицировать широкий спектр хозяев. Учитывая повсеместность и свободно живущий образ жизни этого организма, существует сравнительно мало доказательств изменяемости элементов генома данного конкретного штамма. Известные аспекты метаболизма А. hydrophila включают в себя особые ферменты, которые могут иметь промышленный потенциал, а также потенциал для использования в биоремедиации - комплексе методов очистки вод, грунтов и атмосферы с использованием метаболического потенциала биологических объектов. Таким образом, геном А. hydrophila дает ценную информацию о ее способности процветать как в водной среде, так и в организме хозяина.
Сама статья доступна для чтения в Журнале бактериологии.
Кстати, расшифровка специальной системы секреции А. hydrophila может способствовать разработке подходящих вакцин, а также лучшему пониманию патогенеза A. hydrophila .
[youtube.player]
История изучения бактерий рода Aeromonas насчитывает более ста лет. Долгое время их считали сапрофитами, но исследования последних лет позволяют отнести их к условным патогенам, вызывающим при определенных условиях заболевания людей и животных [1]. Бактерии рода Aeromonas широко распространены в окружающей среде, их выделяют из речной воды, сточных вод, почвы, от гидробионтов, растений, теплокровных животных [9, 10].
Актуальность разработки методов детекции бактерий рода Aeromonas и в частности Aeromonas hydrophila в пищевой продукции из гидробионтов обусловлена тем, что контаминированные аэромонадами рыбное сырьё и продукция представляют собой источник пищевых и кормовых инфекций человека и животных [6, 8].
Обнаружение и типирование аэромонад является трудоемким и длительным исследованием, затрачивающим до 120 часов [11, 12]. Типирование до рода Aeromonas требует применения сложных и дорогостоящих сред и проведения широкого перечня тестов, что формирует значительный процент ошибочных результатов. Внутривидовая идентификация бактерий данного рода из-за незначительных различий между видами сложна и может служить причиной получения ложных результатов анализов [3, 5,13].
Перечисленное актуализирует необходимость разработки методов индикации бактерий рода Aeromonas, обладающих следующими критериями:
– простота в применении,
Метод фагодетекции полностью отвечает поставленным задачам [2, 4, 7]. Строгая специфичность бактериофагов позволяет дифференцировать отдельные виды [7]. Согласно литературным данным наборы тест-систем на основе бактериофагов для диагностики аэромонадных инфекций в настоящее время отсутствуют [1, 11, 12, 13].
Для реализации названного метода нами был разработан биопрепарат на основе выделенного и изученного бактериофага Ф43-УГСХА и параметры его применения в схеме фагодетекции.
Материалы и методы исследования
Для выделения бактериофагов были исследованы 103 пробы воды из водоемов Ульяновской области. В качестве индикаторной культуры использовали референс-штамм A. hydrophila A.h.-43, полученный из музея кафедры микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы Ульяновской ГСХА им. П.А. Столыпина. Выделение и изучение биологических свойств фагов проводили по методам, описанным С.Н. Золотухиным (2007), Д.А. Викторовым (2011) [2].
Селекцию бактериофагов и повышение их литической активности проводили пассированием фагов на бактериальной культуре штамма A. hydrophila A.h.-43 с периодическим пересевом типичных для данного изолята негативных колоний. Основные биологические свойства выделенных бактериофагов изучались по общепринятым методикам [3, 7]. Литическую активность определяли методами Аппельмана и Грациа. Для определения спектра литической активности применяли референс-штамм и выделенные нами ранее 14 полевых штаммов. Для определения специфичности использовали штаммы бактерий гетерологичных родов: Proteus, Morganella, Klebssiella, Bacillus, Citrobacter, Yersinia, Pseudomonas, полученные из музея кафедры. Реакцию нарастания титра фага проводили по методам, изложенным в работах Васильева Д.А., Викторова Д.А. [2].
Результаты исследований и их обсуждение
В результате нами было выделено 5 изолятов бактериофагов, активных в отношении бактерий A. hydrophila. Выделенные бактериофаги на газоне индикаторной культуры имели округлые прозрачные негативные колонии диаметром 0,5–1,0 мм. Литическая активность селекционированных фагов по методу Аппельмана составила от 10–5 до 10–8, по методу Грациа от 3,0(±0,2)·105 до 2,0(±0,1)·108 БОЕ/мл.
Для изучения спектра литической активности выделенных нами фагов мы использовали 15 имеющихся у нас штаммов бактерий A. hydrophila. Для этого исследуемые бактериофаги в концентрации 107–109 БОЕ/мл наносили на газон изучаемой бактериальной культуры. По результатам исследований спектр литической активности выделенных нами бактериофагов составил от 13,3 до 86,7 % из 15 имеющихся у нас штаммов бактерий вида Aeromonas hydrophila (рисунок).
Для изучения температурной устойчивости выделенных бактериофагов фаголизаты прогревали в ультратермостате при температуре от 58 до 66 °С с интервалом 2 °С в течение 30 минут [2]. По результатам проведённых исследований все изучаемые бактериофаги являлись термолабильными.
Для определения устойчивости выделенных бактериофагов к воздействию хлороформа разведения фагов обрабатывали хлороформом в соотношении 1:10 в течение 15, 30, 45 минут с обязательной постановкой контроля и определения количества негативных колоний методом агаровых слоев по Грациа [2, 3].
Исходя из результатов, приведённых в таблице 1, выделенные бактериофаги являются не устойчивыми к воздействию хлороформа в соотношении 1:10 до 45 минут (сроки наблюдения).
Для определения специфичности выделенных бактериофагов были использованы гетерологичные штаммы бактерий родов Yersinia, Pseudomonas, Streptococcus, Klebsiella, Enterococcus, Citrobacter, Enterobacter, Proteus, Bacillus, а также штаммы бактерий рода Aeromonas: Aeromonas veronii biogroup sobria ATCC 9071, Aeromonas caviae ATCC 15468, Aeromonas salmonicida ATCC 33658, полученные из музея кафедры. Специфичность определяли методом нанесения бактериофагов в концентрации 108–109 БОЕ/мл на газон исследуемой культуры [2]. Отсутствие лизиса на газоне бактерий гетерологичных родов и видов свидетельствовало о видовой специфичности выделенных бактериофагов по отношению к Aeromonas hydrophila.
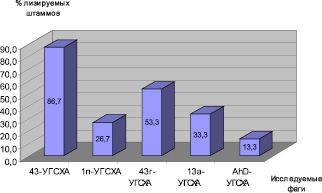
Спектр литической активности выделенных бактериофагов
Результаты исследования устойчивости выделенных бактериофагов к обработке хлороформом
Титр исследуемых бактериофагов по Грациа, БОЕ/мл
[youtube.player]В бланке анализа на дисбактериоз имеется перечень различных показателей микрофлоры. Для неподготовленных людей он представляет определенную трудность, дающую возможность неправильных интерпретаций и порой необоснованного беспокойства.
Обычно в бланке анализа показатель патогенных энтеробактерий идет первым. К указанной группе микроорганизмов микробиологи относят такие бактерии, которые вызывают острую кишечную инфекцию (сальмонеллы, шигеллы – возбудители дизентерии, брюшного тифа). Наличие этих микроорганизмов служит для врача показателем уже не дисбактериоза, а серьезного инфекционного заболевания кишечника.
Основные представители нормальной кишечной микрофлоры – это бифидобактерии, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, синтезируют витамины, а также способствуют их усвоению из пищи; при участии бифидобактерий проходит всасывание в кишечнике железа, кальция и других важных микроэлементов; бифидобактерии стимулируют моторику кишечной стенки и способствуют нормальному опорожнению кишечника; бифидобактерии нейтрализуют различные токсические вещества, попадающие в кишечник извне или образовавшиеся в результате жизнедеятельности гнилостных микроорганизмов. В бланке анализа указывается показатель бифидобактерии: не меньше 107 – 109. Его существенное снижение всегда признак выраженного дисбактериоза.
Вторые по представительству (5% в совокупности микроорганизмов кишечника) и по значимости представители нормальной флоры – это лактобактерии. Микробиологи к ним относят лактобациллы, молочнокислые микробы, молочнокислые стрептококки. Судя по названию, лактобактерии, или молочнокислые микробы, вырабатывают молочную кислоту – важнейший компонент для нормальной работы кишечника. Лактобактерии обеспечивают противоаллергическую защиту, способствуют нормальному опорожнению кишечника, вырабатывают высокоактивную лактазу – фермент, расщепляющий молочный сахар (лактозу). В анализе их количество должно быть не меньше 106 – 107. Дефицит лактобактерий может привести к развитию аллергических заболеваний, запорам, лактазной недостаточности.
Третий представитель обычной микрофлоры – кишечная палочка с нормальной ферментативной активностью. Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна. Во-первых, она является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий, таким образом, создаются комфортные условия для основных бактерий кишечной флоры. Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку).
Кишечная палочка со сниженной ферментативной активностью является неполноценной, но не представляет никакого вреда, хотя и не выполняет своих полезных функций. Присутствие такого показателя в анализе является признаком начинающегося дисбактериоза.
В некоторых анализах описываются бактероиды, роль которых неясна, но это не вредные бактерии, обычно их количество не имеет практического значения.
Все остальные показатели микрофлоры представляют собой условно-патогенную флору, в самом названии которой обозначена суть данных микробов. Они потенциально могут вызвать заболевание при определенных условиях в кишечнике: при повышении их абсолютного количества или процентного соотношения к нормальной флоре, при неэффективности защитных механизмов или снижении функции иммунной системы человека. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Условно-патогенная флора – это лактозонегативные энтеробактерии (клебсиелла, протей, цитробактеры, энтеробактеры, гафнии, серрации), гемолизирующая кишечная палочка и различные кокки (энтерококки, эпидермальный, или сапрофитный, стафилококк, золотистый стафилококк). Кроме того, к условно-патогенным микробиологи относят клостридии, которые не всегда определяются при проведении анализа. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами. При этом обычно температура тела не повышается.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей. Если их количество превышает 25% (более 107), это чаще всего связано со снижением нормальной флоры. В редких случаях повышение количества энтерококков является главной причиной дисфункции, связанной с дисбактериозом.
Эпидермальный (или сапрофитный) стафилококк (S. epίdermίdίs, S. saprophyticus) может вызывать нарушения, но его количество до 25% является допустимым.
Даже среди относительно безобидных кокков, названных выше, могут встречаться более патогенные, что и обозначается в этой позиции бланка анализа. Если общее количество кокков составляет, например, 16%, а процент гемолизирующих кокков – 50%, это значит, что половина из 16% – более вредоносные кокки, а их процент по отношению к нормальной флоре составляет 8%.
Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры – золотистый стафилококк (S. aureus). Стафилококки являются распространенными микробами окружающей среды, в частности, они в больших количествах живут на коже и слизистых оболочках верхних дыхательных путей. Даже небольшие их количества способны вызвать выраженные клинические проявления. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Присутствие его в кишечнике может приводить к аллергическим реакциям, гнойничковым кожным высыпаниям, дисфункции кишечника.
Большая группа условно-патогенных бактерий большей или меньшей степени патогенности – это лактозонегативные энтеробактерии. Обычно некоторые количества этих бактерий постоянно живут в кишечнике, не вызывая проблем, и не должны вас беспокоить. Их количество не должно превышать 5% (или в титрах: 103 – 106 – умеренное повышение, более 106 – существенное повышение). Наиболее неприятными из этой группы являются протеи (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми конкурентами лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности. Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка.
Грибы рода Candida – допустимое присутствие до 104. Повышение этого параметра возможно после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено и при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть инфицирования грибами кишечника. Если же количество грибов в анализе на дисбактериоз увеличено, но нет снижения нормальной кишечной флоры, это свидетельствует о том, что грибы живут на коже вокруг заднего прохода, а не в кишечнике, в этом случае достаточно наружной терапии с использованием противогрибковых мазей или кремов.
Клостридии – допустимое количество до 107. Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, изолированно они редко вызывают проблемы (чаще всего разжижение стула). Их количество зависит от функции местного иммунитета кишечника.
Прочие микроорганизмы – описываются редко встречающиеся виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa).
На практике для диагностики дисбактериоза приходится довольствоваться сведениями всего лишь о 15 – 20 видах микробов, содержащихся в кале. Обычно исследуют количество бифидобактерий, лактобацилл, энтеробактерий, кишечных палочек, протея, энтерококка, золотистого стафилококка, синегнойной палочки и кандид. Степень тяжести дисбактериоза определяется степенью снижения бифидобактерий и других облигатных микроорганизмов и повышения числа условно-патогенных видов.
Нормы микрофлоры кишечного тракта
Кишечная палочка – 106 – 107
Споровые анаэробы – 103 – 105
Лактобациллы – 106 и выше
Бифидобактерии – 107 и выше
Патогенная и условно-патогенная микрофлора:
Staphylococcus – до 103
Enterococcus – до 103
Streptococcus – до 103
Candida albicans – до 103
Proteus mirabilis – 102 – 103
Proteus vulgaris – 102 – 103
Патогенные микробы семейства кишечных (Salmonella, Shigella, Yersinia) – 0
Кишечная палочка со слабовыраженными ферментативными свойствами – до 10%
Гемолизирующая кишечная палочка – 0
Лактозо-негативные энтеробактерии (cloacae) – 103
Условно-патогенные грамотрицательные микроорганизмы – 102 – 103
Klebsiella pneumoniae, enterobacter aerogenes, oxytoca, agglomerans – до 103
Listeria monocytogenes, providencia rettgeri, alcalifaciens, stuartii – до 102
Aeromonas, pasteurella, citrobacter freundii, diversus, hafnia alveί – до 102
Правила сбора кала на дисбактериоз
По возможности сбор материала на исследование должен осуществляться до назначения антибиотиков (если невозможно, то не ранее чем через 12 часов после отмены препарата). Для исследования собирают свежевыделенный кал. За 3 – 4 дня до исследования следует прекратить прием слабительных препаратов, касторового и вазелинового масла и воздержаться от введения ректальных свечей. Кал, полученный после клизмы, а также после приема бария (при рентгеновском обследовании), для исследования непригоден. До сбора материала для анализа помочитесь в унитаз, далее путем естественной дефекации в подкладное судно соберите испражнения (надо следить, чтобы не попала моча). Подкладное судно надо предварительно обработать любым дезинфицирующим средством, тщательно промыть несколько раз проточной водой и ополоснуть кипятком.
Кал нужно собрать в чистый одноразовый контейнер с завинчивающейся крышкой и ложечкой или в другую стерильную посуду, полученную накануне в лаборатории, где будет проводиться анализ кала на дисбактериоз. Материал вам необходимо доставить в лабораторию в течение трех часов с момента сбора анализа. Желательно в течение указанного времени материал хранить в холодном месте, но не замораживать.
Условия, соблюдение которых обязательно:
• не допускается длительное хранение (более 5 – 6 часов);
• не допускается неплотно закрытый контейнер;
• не подлежит исследованию биоматериал, собранный накануне.
В противном случае вы потратите свои усилия и драгоценное время впустую. Наверняка результаты анализа будут расходиться с клинической картиной заболевания, не соответствовать вашим жалобам, анализ придется сдавать повторно.
Недостатки анализа на дисбактериоз
В специальной медицинской литературе очень много высказываний за и против этого анализа. Не претендуя на истину в последней инстанции, считаю нужным сообщить о недостатках данного бактериологического анализа, решать же конкретно, нужен он вам или нет, будет ваш лечащий врач.
Итак, недостатки следующие:
1) трудности в трактовке результатов, связанные с широкой вариабельностью нормальных значений, то есть тех же показателей у практически здоровых людей, быстрой сменяемостью нарушений, нестандартностью самого анализа (немало примеров, когда дисбактериоз, установленный в одной лаборатории, отвергается в других);
2) не учитывается содержание бактероидов и других облигатных анаэробов, которые доминируют в нормальной микрофлоре кишечника, тем более что микрофлора фекалий лишь приблизительная копия пристеночной, особенно «глубинной«(криптовой), микрофлоры кишечника;
4) не учитывается микрофлора тонкой кишки, изменение состава которой, прежде всего повышение бактериальной обсемененности, играет существенное значение в патологии пищеварительного тракта.
Перечисляемые самими медиками негативные положения говорят о существующих противоречиях в отношении самих врачей к широко практикуемому ныне анализу на дисбактериоз. Фактически, считают многие, это дорогостоящее трудоемкое исследование с невысокой отдачей. Принимая во внимание огромный опыт такого рода исследований, диагноз почти безошибочно ставится врачами на основании клинической картины болезни.
[youtube.player]Это исследование предназначалось для сравнения клинических представлений Aeromonas hydrophila, A. veronii biovar sobria и A. monia, microomicrobialacteremia ретроспективным методом в трех больницах на Тайване в течение 8-летнего периода. Было 87 пациентов с бактериемией A. hydrophila, 45 с A. veronii biovar sobria bacteremia и 22 с бактерией A. caviae. По сравнению с бактериальной бактерией A. hydrophila и A. veronii biovar sobria бактерия A. caviae была более связанной с охраной здоровья (45 против 30 и 16%, P = 0,031). Пациенты с бактериями A. caviae с меньшей вероятностью имели цирроз печени (27 против 62 и 64%, P = 0,007) и тяжелые осложнения, такие как шок (9 против 40 и 47%, P = 0,009) и тромбоцитопения (45 против 67 и 87%, P = 0,002). Показатель APACHE II был самым важным фактором риска смертности, связанной с бактериемией Aeromonas. Оценка APACHE II бактерий A. caviae была ниже, чем бактериальная бактерия A. hydrophila и бактериальная амброзия B. veronii biovar (7 против 14 и 16 баллов, P = 0,002). В заключение, клиническая картина бактериемии A. caviae сильно отличалась от бактерий A. hydrophila и A. veronii biovar sobria. Тяжесть и смертность бактериемии A. caviae были ниже, чем у A. hydrophila или A. veronii biovar sobria bacteremia.
Aeromonas — это своего рода производящие оксидазу грамотрицательные стержни и относится к семейству Aeromonadaceae. Он широко распространен в глобальном масштабе в водных средах и связан с различными инфекциями человека, включая гастроэнтерит, инфекцию мягких тканей, септицемию, инфекции гепатобилиарных путей, а также иногда плевропульмональные инфекции, инфекции, связанные с инфекцией, менингитом, перитонитом и гемолитическим уремическим синдромом ( 1). Хотя этот патоген мог инфицировать здоровых людей, большинство инфекций было обнаружено у иммунокомпрометированных хозяев, особенно у пациентов с циррозом печени и злокачественными новообразованиями (1-4). Возможный патогенез инфекции Aeromonas является сложным и многофакторным. Возможные порталы входа для бактериемии Aeromonas считались желудочно-кишечными трактами и поражениями кожи (1-5). После адгезии к эпителиальным клеткам кишечника этот патоген создает много потенциальных факторов вирулентности для разрушения эпителиального барьера и ослабления иммунных клеток, включая экзоферменты, цитотоксические и цитотонические энтеротоксины (6, 7).
Среди 21 видов Aeromonas, дифференцированных на основе ДНК-ДНК-гибридизации, Aeromonas caviae, Aeromonas veronii biovar sobria и Aeromonas hydrophila наиболее связаны с инфекциями человека и составляют более 85% всех клинических изолятов (2-5). Они имеют разные биохимические свойства (8, 9) и антимикробные восприимчивости (10, 11). Кроме того, различные виды Aeromonas производят различные факторы вирулентности (12). Однако неизвестно, являются ли различные виды Aeromonas различными клиническими проявлениями. Здесь мы провели ретроспективное исследование, чтобы сравнить клинические проявления бактериемий, вызванные различными видами Aeromonas.
Это ретроспективное исследование, в котором пациенты с диагнозом мономикробная бактериомия Aeromonas были госпитализированы в буддистскую больницу Цзу Чи, буддистскую больницу Dalin Tzu Chi и буддистскую больницу Тайбэй Цзы Чи (Тайвань) с января 2001 года по ноябрь 2008 года. Буддийский цзы Чи Общая больница — это медицинский центр с третичным медицинским центром на 700 мест, расположенный в Восточном Тайване со специальными отделениями для костного мозга и трансплантации органов, ожогового ухода и интенсивной терапии. Буддийская общая больница Далин Цзы Чи и буддийская больница Тайбэй Цзы Чи общей площадью 900 мест расположены в южных районах Тайваня и Северного Тайваня. Демографическая, клиническая и лабораторная информация была получена из медицинских карт включенных пациентов для анализа.
Бактеромию Aeromonas определяли как рост Aeromonas sp. от культуры крови пациента с сепсисом. Бактемию считали связанной с охраной здоровья, если изолят Aeromonas был получен из крови, отобранной после более чем 72 часов госпитализации у пациента, который был бессимптомным для инфекции при поступлении, или у пациента, получившего противоопухолевую химиотерапию в течение предшествующих 2 недель после нанесения кровь для культуры, независимо от симптоматики при поступлении. Связанная с Aeromonas полимикробная бактериемия определяется как одновременный рост Aeromonas sp. и другие микробы (ы) из культуры крови пациента с сепсисом были исключены из этого исследования. Смерть считалась связанной с бактериемией Aeromonas, если во время того же пребывания в больнице смерть произошла в течение 7 дней после положительной культуры крови для бактериемии Aeromonas без других причин смерти, смерть произошла в присутствии клинических признаков стойкого сепсиса или причиной смерти, зафиксированной в свидетельстве о смерти, была бактериомия Aeromonas. Оставшийся в живых из бактериемии Aeromonas определяли так, как если бы пациент был выписан в живых или улучшение симптомов, связанных с бактериемией, произошло в отсутствие рецидива в течение 30 дней во время одного и того же пребывания в больнице.
[youtube.player]A eromonas hydrophila – бактерия, которая широко распространена в пресной и соленой воде, содержится в пище и обработанной питьевой воде, обнаруживается в системах хозяйственного водоснабжения и в водопроводных системах медучреждений. Инфицирование представителями рода Aeromonas происходит, как правило, при употреблении загрязненной воды или морепродуктов или при непосредственном контакте с ними. Наиболее распространенные формы проявления патологии – гастроэнтерит и инфекции мягких тканей от легкой до умеренной тяжести. У лиц с ослабленным иммунитетом (например, страдающих циррозом печени, злокачественными заболеваниями, хронической почечной недостаточностью, сахарным диабетом), или пациентов, принимающих стероиды, широкий спектр инфекций Aeromonas spp. (гепатобилиарная инфекция, инвазивные инфекции кожи и мягких тканей, первичная бактериемия, ожоговые и плевролегочные инфекции, менингит и эндокардит) ассоциирован со значительной смертностью. Более чем в 85% случаев причиной инфекций у человека являются виды А. hydrophila , А. caviae и А. veronii биовар sobria . Инфекция представителями Aeromonas часто полимикробная, уровень смертности составляет от 28 до 46% в случаях бактериемии, вызванной в основном А. hydrophila и А. veronii биовар sobria.
Препарат тоцилизумаб, разработанный для лечения ревматоидного артрита, является гуманизированным моноклональным антителом против рецептора интерлейкина 6; при терапии этим препаратом возможны побочные эффекты в виде инфекций.
Сообщается о редком случае сепсиса и острого гнойного холангита, вызванных А. hydrophila у пожилой пациентки с ревматоидным артритом, принимавшей тоцилизумаб.
72-летняя жительница Японии была госпитализирована с острой болью в надчревной области и рвотой. В анамнезе – ревматоидный артрит, прием тоцилизумаба каждые четыре недели.
Данные осмотра: температура 39,2°С, озноб. Артериальное давление 77/46 мм рт. ст., частота сердечных сокращений 96 в минуту. Наличие желтухи, отсутствие признаков ладонной эритемы; нет отеков щиколоток, утолщений концевых фаланг пальцев, паутинных невусов, признаков повреждения или инфекции кожи. Боль в животе, дискомфорт в правом верхнем квадранте, наличие симптома Мерфи.
Результаты лабораторных исследований: лейкоциты – 7600/мкл (норма: 3100-8800/мкл), нейтрофилы – 97,7% (норма: 50-70%); С-реактивный белок – 2,16 мг/дл (норма: 0-0,25 мг/дл), тромбоциты – 150 × 10 9 /мкл (норма: 140-440 × 10 9 /мкл), аспартатаминотрансфераза – 266 МЕ/л (норма: 13-33 МЕ/л), аланинаминотрансфераза – 432 МЕ/л (норма: 6-27 МЕ/л), щелочная фосфатаза – 890 МЕ/л (норма: 115-359 МЕ/л), общий билирубин – 7,0 мг/дл (норма: 0,3-1,5 мг/дл), прямой билирубин – 5,2 мг/дл (норма: 0-0,2 мг/дл), γ-глутамилтрансфераза – 342 МЕ/л (норма: 10-60 МЕ/л), белок – 59 г/л (норма: 67-83 г/л), альбумин – 33 г/л (норма: 40-50 г/л).
Ультразвуковое исследование органов брюшной полости: желчный пузырь увеличен, наличие камней, дилатация внутрипеченочных и общего желчного протоков.

Рисунок. Компьютерная томограмма: холелитиаз (белая стрелка), холедохолитиаз и расширение общего желчного протока (черная стрелка) с кальцифицированным камнем

Рисунок. Компьютерная томограмма: холелитиаз (белая стрелка), холедохолитиаз и расширение общего желчного протока (черная стрелка) с кальцифицированным камнем
Компьютерная томография: холелитиаз, холедохолитиаз, расширение общего желчного протока с кальцифицированным камнем; печень нормальной формы (рисунок).
Пациентке был поставлен диагноз: сепсис, вызванный острым гнойным холангитом. Были взяты пробы крови и начата терапия инфекции желчных путей: назначен комбинированный препарат цефоперазон/сульбактам – цефалоспориновый антибиотик III поколения, обладающий широким спектром действия в отношении аэробных и анаэробных грамположительных и грамотрицательных микроорганизмов, устойчивый к β-лактамазам – в дозе 1 г внутривенно каждые 12 часов.
Проведена эндоскопическая ретроградная холангиопанкреатография, во время которой удалены два камня со сладжем. Проведена противошоковая терапия сосудосуживающими средствами. Желтуха несколько уменьшилась, но состояние шока, типичное для данного состояния, сохранялось. На 2-й день госпитализации у пациентки наблюдались рвота, проявления гипотензии с брадикардией.
Электрокардиография показала подъем сегмента ST в отведениях I и aVL. Эхокардиография выявила дисфункцию заднебоковой стенки левого желудочка.
Коронарография показала проходимость коронарных артерий.
Поставлен диагноз: стрессиндуцированная кардиомиопатия.
Посевы образцов крови были положительными в отношении А. hydrophila и Klebsiella pneumonia. Оба микроорганизма оказались чувствительными к терапии цефоперазоном/сульбактамом, что подтвердило эффективность назначенной антибиотикотерапии. А. hydrophila оказался устойчивым к пенициллину, ампициллину, ампициллину/сульбактаму и цефалоспоринам первого и второго поколения, восприимчивым к пиперациллину, цефалоспоринам третьего поколения, аминогликозидам, карбапенемам, тетрациклинам, триметоприму/сульфаметоксазолу и фторхинолонам. Культуры кала были отрицательными в отношении А. hydrophila. Дополнительные исследования не выявили признаков злокачественной патологии, цирроза печени, хронической почечной недостаточности или сахарного диабета. На 6-й день количество лейкоцитов в крови пациентки и доля нейтрофилов нормализовались. Антибиотикотерапия цефоперазоном/сульбактамом была остановлена, так как был достигнут желаемый эффект. Функции левого желудочка нормализовались на 12-й день госпитализации.
На 16-й день госпитализации для лечения желчнокаменной болезни проведена лапароскопическая холецистэктомия. Культуральное исследование желчи показало наличие только А. hydrophila. На 18-й день после операции было возобновлено лечение тоцилизумабом, осложнений не наблюдалось. Через два месяца после возобновления терапии тоцилизумабом состояние пациентки оставалось стабильным, без каких-либо серьезных нежелательных явлений.
Представители Aeromonas spp. – повсеместно распространенные подвижные грамотрицательные палочки, которые обнаруживаются в водных источниках. Они вызывают широкий спектр заболеваний у человека; возможны пути передачи через зараженную пищу и попадание возбудителя в раны из внешней среды. Тяжелые инфекции А. hydrophila обычно связаны с ослаблением иммунитета у лиц с хроническими заболеваниями. Бактерии рода Aeromonas производят β-лактамазу, что делает их устойчивыми к ампициллину и цефалоспоринам первого поколения. Наиболее активны против Aeromonas цефалоспорины третьего поколения (например, цефоперазон/сульбактам), имипенем и фторхинолоны. Частота острого гнойного холангита, вызываемого Aeromonas, низкая (менее 3%). Гепатобилиарные инфекции Aeromonas обычно ассоциированы с желчнокаменной болезнью, холедохолитиазом, злокачественными новообразованиями и другими состояниями, сопровождающимися снижением иммунитета, а также недавними хирургическими вмешательствами.
Тоцилизумаб, используемый для лечения ревматоидного артрита, является гуманизированным моноклональным антителом против рецептора интерлейкина 6 (цитокина, играющего многофункциональную и важную роль в иммунной реакции). Инфекции – наиболее частые нежелательные явления, связанные с терапией тоцилизумабом в клинических исследованиях. На фоне приема препарата возможны серьезные бактериальные, вирусные или грибковые инфекции, включая туберкулез. В одном из исследований частота тяжелых инфекций составила 3,6 случая на 100 человеко-лет, однако общий уровень инфекций со смертельным исходом был низким (0,13 случая на 100 человеко-лет).
В описанном клиническом случае у пациентки с ослабленным иммунитетом, получающей лечение тоцилизумабом и страдающей желчнокаменной болезнью, развитие сепсиса, вызванного А. hydrophila и Klebsiella pneumonia, было вторичным по отношению к гнойному холангиту на почве холедохолитиаза. До и во время развития сепсиса не наблюдалось желудочно-кишечных симптомов, копрокультуры не содержали А. hydrophila. Не было признаков инфекции мягких тканей; в течение последнего года пациентка не принимала антибиотики для лечения инфекций. После излечения от холангита в желчном пузыре пациентки обнаруживался только А. hydrophila. Эти результаты позволяют предположить, что проникновение А. hydrophila в желчные пути и их непроходимость вследствие желчнокаменной болезни стали причиной сепсиса с восходящей инфекцией Klebsiella pneumoniae. Любой другой путь инфицирования не представляется вероятным.
Известно, что у здоровых лиц в желчном пузыре бактерии не обнаруживаются, а у больных с желчными камнями доля положительных культур зависит от тяжести заболевания и возраста. Таким образом, следует проводить упреждающее лечение желчнокаменной болезни до начала применения молекулярно-таргетной терапии у пациентов пожилого возраста.
Представлен редкий случай сепсиса, вызванного A. hydrophila, и острого гнойного холангита у пациентки с желчнокаменной болезнью и ревматоидным артритом, принимающей тоцилизумаб. В качестве антибактериального препарата был выбран цефоперазон/сульбактам. Культуральное исследование подтвердило чувствительность возбудителя к препарату, а клиническое улучшение наблюдалось через 6 дней лечения.
[youtube.player]Читайте также:


