Анализ воды на возбудителей кишечных инфекций
Питьевую воду отбирают в количестве 3 л.
Воду открытых водоемов - в количестве 1 л.
Сточную воду - 100 мл.
Пробы воды для бактериологического анализа отбирают с соблюдением правил стерильности: в стерильные бутылки или стерильными приборами - батометрами.
Для отбора воды из открытых водоемов, сточных вод, воды из бассейнов, колодцев удобен так называемый бутылочный батометр.
При отборе проб сточной жидкости используют металлические черпаки на деревянных или другого металла ручках либо бутыли, укрепленные винтовым зажимом на деревянном или металлическом стержне.
Пробы воды из кранов отбирают после их стерилизации путем фламбирования пламенем горящего тампона, смоченного спиртом, и последующего спуска воды в течение 10 - 15 минут при полном открытом кране. В случае, если кран оголовка скважины находится в заглубленной части шахты, то воду из него сливать не следует (избегая затопления шахты), а использовать только обжиг крана. Если отбираемая вода содержит следы остаточного хлора, то для нейтрализации хлора необходимо перед отбором во флаконы добавить 1,5 % стерильный раствор тиосульфата (гипосульфита натрия) из расчета 4 мл на 1 л воды.
При отборе проб воды из открытых водоемов следует предусмотреть следующие точки: в месте застоя и в месте наиболее быстрого течения (с поверхности и на глубине 50 - 100 см).
При отборе проб сточной жидкости следует предусмотреть точки на этапах ее очистки; воду из колодцев отбирают с поверхности и на глубине 20 - 30 см, воду централизованного водоснабжения - из кранов по разводящей сети. При отборе воды из артезианских скважин предусматривают следующие точки: из крана оголовка скважины, из крана на выходе водоразборных сооружений, из крана после подземного резервуара, перед поступлением в сеть, по разводящей сети.
Отбор проб в бассейнах производят при водообмене, в местах водозабора, на этапах очистки и обеззараживания, перед подачей воды в бассейн, на сливе воды из бассейна, в ванне бассейна - с поверхности и на глубине 20 - 30 см.
Отобранные пробы воды должны сопровождаться документом, содержащим:
1. Наименование пробы воды.
2. Точное наименование места отбора проб воды.
3. Дату и время отбора, а также дату и время доставки пробы воды в лабораторию.
4. Указание температуры отобранной воды.
5. Указание, по чьему заданию и с какой целью производится исследование.
6. Кем произведен отбор пробы воды (фамилия, должность).
Пробы воды доставляют в лабораторию не позднее 5 часов с момента взятия пробы.
1. Прямой посев исследуемой воды на диагностические среды для определения шигелл.
1.1. Питьевая вода.
Воду предварительно фильтруют через мембранные фильтры № 3 в объеме не менее 500 мл. Фильтры помещают на поверхность питательных сред: агара с эозин-метиленовым синим (ЭМС) и бактоагара Плоскарева - антибиотиком и без него. Выбор антибиотика зависит от того, к каким антибиотикам устойчивы штаммы шигелл, выделяемые в данном районе. Посевы подращивают 18 - 24 часа при 37 °C.
1.2. Вода открытых водоемов.
Воду предварительно фильтруют через мембранные фильтры № 3 в объеме не менее 500 мл. Дальнейшее исследование проводят так же, как и при анализе питьевой воды.
1.3. Сточная вода.
Исследуемую воду в количестве 0,1 мл помещают на чашки с дифференциально-диагностической средой (не менее 5 чашек) и растирают шпателем. Посевы инкубируют в термостате при 37 °C 18 - 24 часа.
Дальнейшая идентификация бактерий проводится по общепринятой методике.
2. Посев воды в накопительные среды.
Используют не менее двух сред накопления. Для сальмонелл: магниевую среду, среду Кауфмана, селенитовый бульон, среду с охмеленным суслом. Для шигелл: селенитовый бульон, среду с охмеленным суслом, а также 1 % мясопептонный бульон и 10 % желчный бульон (метод Ростовского-на-Дону НИИЭМГ).
2.1. Посев питьевой воды.
Исследуемую воду фильтруют через мембранный фильтр № 3 (количество фильтров зависит от скорости фильтрации). Фильтры укладывают на поверхность питательной среды Эндо, разлитой в чашки Петри (поверхность фильтра с задержавшимися бактериями остается верхней). Посев подращивают при 37 °C 18 - 24 часа.
После учета выросших на мембранных фильтрах колоний кишечных палочек для определения коли-титра производят следующее: мембранные фильтры, на которых имелся рост мелких единичных бесцветных колоний, помещают в среды накопления - селенитовый бульон или магниевую среду обычной концентрации, разлитые в пробирки по 10 мл, в среду с охмеленным суслом, предварительно разбавленную стерильной водопроводной водой 1:4 и разлитую в пробирки по 10 мл. Посев помещают в термостат на 18 - 24 часа при 37 °C.
При отсутствии мембранных фильтров исследуемую воду распределяют по 500 мл во флаконы и вносят в среды накопления согласно прописям сред. Посевы помещают в термостат на 18 - 24 часа при 37 °C.
2.2. Посев воды открытых водоемов.
Исследуемую воду в количестве 1 л делят на две порции по 500 мл. В каждую порцию вносят накопительные среды по прописям, после чего воду с накопительной средой разливают поровну в 5 флаконов и помещают в термостат на 18 - 24 часа при 37 °C.
2.3. Посев сточной воды.
Сточную воду в количестве 100 мл вносят в накопительные среды по прописям и разливают во флаконы на 10 равных порций. Посевы воды помещают в термостат на 18 - 24 часа при 37 °C.
2.4. Посев воды по методу Ростовского-на-Дону НИИЭМГ (по Р.С. Хомик и А.А. Рындич). Применяется только для шигелл.
В 0,5 - 1 л исследуемой воды добавляют 5 - 10 мл 1 % мясопептонного бульона и помещают в термостат при 37 °C на 18 - 24 часа. Затем произвести посев на среду Эндо, ЭСМ-агар и бактоагар Плоскирева петлей. В этот же день провести посев подращенный в мясопептонном бульоне воды в среды накопления: 10 % желчный бульон или селенитовый бульон, произведя разведение до 10 -8 (берут 0,5 мл воды на 4,5 мл среды накопления). Из разведений делают высев на среды Эндо и ЭМС-агар (по 0,1 мл на каждую чашку) и бактоагар Плоскирева. Чашки с посевами и разведения, откуда делали высев, помещают в термостат при 37 °C на 18 - 24 часа. На следующий день просматривают чашки, а из разведений делают еще один высев на те же плотные среды. Дальнейшее исследование - по общепринятой методике определения шигелл.
3. Высев на дифференциально-диагностические среды.
3.1. Для определения сальмонелл.
Используют висмут-сульфитный агар. Высев из сред накопления производят бактериологической петлей на 2 - 3 чашки. Посевы инкубируют при 37 °C 18 - 24 часа. Просматривают рост на чашках и дальнейшее исследование проводят по общепринятой методике.
3.2. Для определения шигелл.
Используют агар с эозин-метиленовым синим с антибиотиками и без них, бактоагар Плоскирева. Высев из сред накопления производят бактериологической петлей на не менее 5 чашек. Посевы инкубируют в термостате при 37 °C 18 - 24 часа. Просматривают рост на чашках и дальнейшее исследование проводят по общепринятой методике.
4. Ускоренные методы определения сальмонелл и шигелл в воде.
Ускоренные методы определения патогенных энтеробактерий в воде рекомендуется использовать при повторном контроле воды централизованного и нецентрализованного водоснабжения, из которой ранее были выделены сальмонеллы или шигеллы.
4.1. Ускоренный сигнальный метод индикации патогенных энтеробактерий в питьевой воде.
Питьевую воду отбирают в количестве 1 - 2 л. Для посева воды используют параллельно не менее двух сред накопления: среду с охмеленным суслом, магниевую или селенитовую среды. 500 мл исследуемой воды засевают в равное количество магниевой или селенитовой сред двойной концентрации или среды с охмеленным суслом по прописи. Навеску сухой среды с охмеленным суслом в количестве 10 г вносят в 500 мл воды, взбалтывают до растворения в воде. Посевы инкубируют при 37 °C 18 - 24 часа.
Через 6 часов инкубации (ранний высев) из сред накопления три объема по 10 мл фильтруют через мембранные фильтры № 3. На первый фильтр наносят агглютинирующую специфическую сыворотку в количестве 0,5 мл. С помощью бактериологической петли смывают осадок с фильтра, переносят на предметное стекло и проводят реакцию агглютинации. Два фильтра укладывают на поверхность висмутсульфитного агара для подращивания сальмонелл и на ЭМС-агар - для шигелл. Посевы на чашках инкубируют при 37 °C 18 - 24 часа.
Положительная реакция агглютинации может служить сигнальным ответом на наличие соответствующих патогенных энтеробактерий.
Для подтверждения сигнального ответа:
1. На следующий день просматривают рост на фильтрах и, если есть четкие колонии, с каждой проводят пробную реакцию агглютинации на стекле с соответствующей специфической агглютинирующей сывороткой, готовят мазок и окрашивают по Граму. При обнаружении грамотрицательных палочек, дающих реакцию со специфической сывороткой, может быть дан предварительный положительный ответ. Все колонии, которые дали положительную реакцию агглютинации, пересевают на чашки с дифференциально-диагностическими средами и дальнейшее выделение и идентификацию бактерий проводят по общепринятой методике.
2. Наряду с этим, через 18 - 24 часа из сред накопления производят высев петлей на плотные питательные среды: висмут-сульфитный агар и ЭМС-агар с антибиотиком и без него, в зависимости от того, какие штаммы выделяются в данном районе -антибиотикоустойчивые или чувствительные. Посевы инкубируют при 37 °C 18 - 24 часа. Дальнейшее исследование и идентификация выделенных бактерий проводятся по общепринятой методике выделения сальмонелл и шигелл.
4.2. Ускоренное обнаружение сальмонелл в воде централизованного и нецентрализованного водоснабжения с использованием метода люминесцирующих антител.
С помощью красителя бисмарк браун приготавливают нелюминесцирующие мембранные фильтры по способу (Л.Е. Корш и Т.З. Артемовой (1972)). Пробы воды, подозрительные на наличие сальмонелл, фильтруют по 100 мл через 5 мембранных фильтров. Поверхность фильтров обрабатывают кроличьей агглютинирующей специфической сальмонеллезной сывороткой или смесью сывороток. Через 10 - 15 мин препарат помещают на 20 мин во влажную камеру, после чего подсушивают на воздухе. Затем фильтры обрабатывают люминесцирующей сывороткой против глобулинов кролика, время окраски - от 15 до 30 мин во влажной камере при комнатной температуре. Фильтры высушивают на воздухе, помещают на предметное стекло между слоями нелюминесцирующего иммерсионного масла (парафинового или вазелинового), накрывают покровным стеклом, на которое помещают еще каплю иммерсионного масла, и препарат микроскопируют.
Для люминесцентных микроскопов МЛ-2 используют светофильтры БС 8-2, СС 15-2, ФС 1-2, запирающий фильтр Т-2-Н, окуляторы компенсационные К 5Х или К 7Х . Препарат просматривают в падающем свете под ахроматическим иммерсионным объектом 90×1,25 Л.
При специфическом свечении наблюдается люминесценция по периферии микробной клетки, четко контрастирующая с телом клетки. Окрашенные и высушенные препараты могут храниться в темном месте в течение нескольких недель.
При использовании микроскопа МЛ-2Б возможно ориентировочное количественное определение сальмонелл в воде, для чего в один из измерительных окуляров К 7Х вставляется окулярная сетка Гаженко. Определение ведут по формуле:
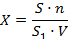
где X - количество сальмонелл в 1 мл воды,
S - площадь фильтрующей поверхности в мкм,
S1 - площадь 1 квадрата сетки Гаженко в мкм,
n - количество клеток сальмонелл в 1 квадрате (среднее арифметическое из 20 квадратов),
V - объем профильтрованной воды в мл.
Для повышения специфичности результатов анализа воды бактерии, задержавшиеся на нелюминесцирующих фильтрах, подращивают на висмут-сульфитном агаре в течение 3 - 4 часов при 37 °C. Образовавшиеся микроколонии обрабатывают и микроскопируют так же, как и отдельные бактерии. Для получения достоверных результатов необходим контроль специфичности.
Затраты времени на анализ: без подращивания - 1 - 1,5 час., с подращиванием - до 5 часов.
1. Магниевая среда.
Навески ингредиентов на исследуемые объемы жидкости

Питьевая вода
В таблице 1 представлены микробиологические показатели действующего норматива СанПиН 2.1.4.1074-01 для питьевой воды:
Таблица 1. Микробиологические нормативы для питьевой воды
| Показатель | Норматив СанПиН 2.1.4.1074-01 |
|---|---|
| Общая микробная численность | Не более 50 КОЕ в 1 мл |
| Общие колиформные бактерии | Отсутствие в 100 мл |
| Термотолерантные колиформные бактерии | Отсутствие в 100 мл |
| Колифаги | Отсутствие в 100 мл |
| Споры сульфитредуцирующих бактерий | Отсутствие в 20 мл |
Стандартный микробиологический анализ питьевой воды в МГУ включает определение трех показателей: общего микробного числа, количества общих колиформных и термотолерантных колиформных бактерий.
Расширенный микробиологический анализ воды включает анализ пяти показателей: общего микробного числа, количества общих колиформных бактерий, количества термотолерантных колиформных бактерий, титр колифагов и содержание спор сульфитредуцирующих бактерий.
Микробиологический анализ поверхностных водоёмов (пруды, реки, бассейны)
Часто на наших участках или поблизости имеются водоемы, где мы и наши дети с удовольствием любим провести время. Конечно, вода в данных водоемах не является питьевой, но ее безопасность для человека также, как и питьевая, регламентируется. В таблице 2 представлены микробиологические показатели действующего норматива по гигиеническим требованиям к охране поверхностных вод (СанПиН 2.1.5.980-00)
Таблица 2. Микробиологические нормативы для рекреационного водопользования, а также в черте населенных мест
| Показатель | Норматив СанПиН 2.1.5.980-00 |
|---|---|
| Общие колиформные бактерии | Не более 500 КОЕ в 100 мл |
| Термотолерантные колиформные бактерии | Не более 100 КОЕ в 100 мл |
| Колифаги | Не более 100 БОЕ в 100 мл |
| Возбудители кишечных инфекций (анализ бактерий из сем. Enterobacteriaceae рода Salmonella) | Вода не должна содержать возбудителей кишечных инфекций (полное отсутствие в 1000 мл) |
Микробиологический анализ воды, предназначенной не для питья, включает определение количества двух показателей: общих колиформных и колиформных термотолерантных бактерий.
Помимо двух основных показателей мы предлагаем провести дополнительный анализ на содержание: колифагов, условно-патогенных дрожжей и микромицетов (частых спутников опортунистических заболеваний) и индекса самоочищения водоёма.
Определение бактерий рода Salmonella и рода Enterococcus
При значительном превышении нормативов СанПиН 2.1.5.980-00, а также возможном фекальном загрязнении водоёма, мы предлагаем провести анализ на наличие возбудителей кишечных инфекций (род Salmonella и Enterococcus).
Глоссарий
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 часов, видимые с увеличением в 2 раза. Данный индикатор выявляет потенциальных бактерий, способных причинить вред здоровью человека.
Общие колиформные бактерии (ОКБ) – грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37+1) °С в течение (24-48) часов. Многие представители данной группы являются микроорганизмами нормальной микрофлоры желудка, поэтому превышение данной группы микроорганизмов может говорить о возможно антропогенном (в том числе и фекальном) загрязнении воды.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44±0,5) °С в течение 24 часов. Также, как и ОКБ являются индикаторной группой, однако более устойчивые в окружающей среде: вот почему обнаружение данной группы микроорганизмов в воде может говорить об однозначном загрязнении ее продуктами жизнедеятельности человека.
Колифаги, определяемые стандартным методом (МУК 4.2.1018-01), являются вирусами кишечной палочки (Escherichia coli) и рассматриваются эпидемиологами как дополнительный, а порой и более чувствительный, метод в определении загрязнения воды микроорганизмами группы кишечной палочки. Вирусные частицы, и в частности колифаги, более устойчивы к окружающей среде, чем их бактерии-хозяева. В связи с этим, наличие колифагов может служить достоверной меткой о более давнем фекальном загрязнении источника воды. Показана прямая корреляция между содержанием колифагов в воде и опасных для человека энтеровирусов, поэтому наличие колифагов в воде может говорить о вирусном заражении источника. Действующий нормативный документ (СанПиН 2.1.4.1074-01) подразумевает отсутствие колифагов в 100 мл воды.
Сульфитредуцирующие клостридии – спорообразующие анаэробные палочковидные микроорганизмы, являющиеся дополнительным микробиологическим показателем фекального загрязнения водоема. В отличие от относительно неустойчивых колиформных и термотолерантных колиформных бактерий, споры клостридий могут сохраняться в водоемах долгое время. Клостридии встречаются в кишечнике человека и домашних животных, однако, при попадании с водой в большом количестве могут вызвать пищевые отравления. К сульфитредуцирующим клостридиям относятся в том числе и опасные для человека клостридии (Clostridiumbotulinum, Clostridium perfringens, Clostridium tetani), вызывающие тяжелейшие заболевания. Согласно действующему нормативу (СанПиН 2.1.4.1074-01) споры клостридий должны отсутствовать в 20 мл воды.
К условно-патогенным дрожжам и микромицетам (плесени) относят большую неоднородную группу грибных организмов, способных сапротрофно расти при 37 °С. В нее входят такие представители, как Candida albicans и Cryptococcus neoformans, которые являются частым фактором оппортунистических заболеваний человека, вызывая кандидозы (грибковые заболевания кожи), молочницы и проч. Другие организмы микромицеты (Cladosporium cladosporioides, Aspergillusniger) могут являться активными сенсебилизаторами аллергических реакций, а иногда и самими аллергенами. В РФ не нормируется вода по плесеням и дрожжевым организмам в воде.
Общее число микроорганизмов не нормируется в воде водоемов в зонах рекреаций, поскольку уровень этой группы микроорганизмов в большей мере зависит от природных особенностей каждого объекта, времени года и т.п.
Однако при выборе нового источника водоснабжения или места рекреации в воде водоёмов дополнительно следует определять общую микробную численность, вырастающую:
- при температуре 37 °С в течение 24 часов;
- при температуре 22 °С в течение 72 часов.
- ОМЧ при 37 °С представлена большей частью алохтонной микрофлорой (внесенную в водоем в результате антропогенного загрязнения, в том числе фекального);
- ОМЧ при 20-22 °С представлена, помимо алохтонной, аборигенной микрофлорой (естественной, свойственной для данного водоёма).
Соотношение численности этих групп микроорганизмов позволяет судить об интенсивности процесса самоочищения. При завершении процесса самоочищения коэффициент ОМЧ 22 °С/ ОМЧ 37 °С. В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки.
Показатель позволяет получить дополнительную информацию о санитарном состоянии водоемов, источниках загрязнения, процессах самоочищения.
Исследование на носительство возбудителей кишечных инфекций

17 декабря. 2019
Обычно анализ на кишечные инфекции проводят при необходимости установить наличие патогенных бактерий в кишечнике или желудке. Именно серологическое исследование и микробиологическое лежат в основе точного определения заболеваний бактериального характера. Благодаря обследованию можно обнаружить микробов, а также определить, какое лекарство будет эффективно. Тест позволяет расшифровать причину возникновения инфекций. Наш кишечник населен хорошими бактериями и условно-патогенной флорой. Если в организм попадают патогенные микробы, либо вирусы, формируется заболевание.
Если произошло снижение иммунитета, то условно-патогенная флора начинает активно размножаться в организме. Среди причин заболеваний также можно отметить:
- зараженная вода;
- недостаточно промытая зелень;
- отсутствие хорошей термической обработки определенных продуктов;
- немытые руки;
- общение с больным человеком;
- заболевшее животное.
Анализ на кишечные инфекции
Определенные тесты назначают, когда сложно поставить диагноз. Многие болезни имеют схожие признаки. Чтобы быть уверенными в точности результата, приходите в наш медицинский центр. Мы проведем диагностику и в кратчайшие сроки выдадим результат. Вы можете прийти в удобное время, при необходимости наши опытные специалисты расшифруют все показатели и назначат грамотное лечение.
Вам не придется столкнуться с большими очередями и мучительным ожиданием. Вы можете связаться с менеджером и уточнить все детали, включая время, в которое можно прийти и провести диагностику. В нашей частной поликлинике пациентам четко разъясняют все показатели теста. И при желании вы можете на месте получить в тот же день консультацию врача.
Для обследования обычно берут:
Обычно анализ назначается при определенной симптоматике, чтобы подтвердить, либо опровергнуть подозрения и назначить лечение, если болезнь выявлена. Тестирование назначается в случаях, когда:
- появилась рвота и диарея;
- при поступлении в больницу;
- произошел контакт с больным;
- чтобы понять, эффективно ли лечение;
- проводятся периодические медосмотры.
Забор биоматериала осуществляется на дому или в больнице. Непременно исследование проходить должны:
- сотрудники медучреждений;
- лица, которые работают на предприятиях, связанных с приготовлением еды;
- воспитатели и другие работники детского сада.
Все вышеперечисленные категории должны обследоваться 1 раз в год. Крайне важны такие мероприятия для исключения вспышек инфекции, наиболее легко распространяющейся в детском саду. При скученности коллектива заболевания передаются очень быстро.
Нельзя не подчеркнуть, что тест на выявление опасной флоры осуществляется серологическим способом, а также микробиологическим или бактериологическим. Для начала проводится микроскопия. Возбудитель в конкретном препарате оценивается под микроскопом. Но подобный метод целесообразен только через пару дней от момента начала болезни.
Уже после того, как лаборанты получают данные микроскопии, они решают, какую выбрать среду, чтобы в нее посеять материал. В особых чашках подготовлены условия для размножение микробов. Через некоторое время определяются морфологические свойства. Многих пациентов интересует вопрос, нужно ли заранее готовиться к диагностике. Необходимо исключить:
- слабительные препараты;
- энтеросорбенты;
- препараты железа;
- антибиотики.
Врачи рекомендуют воздержаться от использования лекарств в течение недели до сдачи анализа. Для сбора каловых масс подойдет только одноразовая емкость. Для удобства были продуманы контейнеры с небольшой ложечкой, которой удобно набирать материал. Подойдет и простая баночка, она должна предварительно кипятиться.
Лучше всего массы собирать с утра и сразу доставить их в лабораторию. Перед забором кала запрещено прибегать к клизмам, иначе результат окажется ложным. Врачи разрешают хранить тару в холодильнике, но не в морозильной камере.
Помните, что своевременное выявление недуга позволяет упростить лечение. Именно поэтому стоит проходить обследование профилактически, даже если жалобы отсутствуют. Целью исследования является выявление болезней у детей и взрослых, страдающих от поноса, либо лиц, которые находятся в очагах заболеваемости. Повторный тест проводится через 14 дней после завершения антибактериальной терапии.
Готовится анализ не менее 5 суток. В нем могут обнаружиться шигеллы или сальмонеллы, стафилококк, клебсиелы и протей. Когда определяется резистентность, то возле каждого из видов указывают антибиотик, а также чувствительность к нему в плюсах. Большое число плюсов указывает, что препарат хорошо действует.
Ученые разработали особую методику выявления кишечных инфекций, которая получила название ПЦР. Она применяется весьма успешно. Метод позволяет быстро поставить диагноз. Даже в небольшом количестве биоматериала легко обнаруживается ДНК возбудителя. Собирается совершенно любая из жидкостей.
Для уточнения всех данных и определения присутствия инфекции проводится общий анализ крови и серологический. Кровь очень быстро реагирует на все происходящие в организме неполадки. При наличии любой инфекции повышается уровень лейкоцитов и СОЭ.
Серология — это достаточно информативный метод, который демонстрирует количество антител. На любой процесс, который является патологическим, организм реагирует выработкой антител. Проверяется зачастую уровень двух иммуноглобулинов — G и М. Самым первым будет реагировать иммуноглобулин, относящийся к классу М. Он указывает на острое течение болезни. Его уровень резко снижается через неделю от начала заболевания. Но в этот период растет титр G. Он указывает на то, что инфекция была перенесена .
Во избежание заражения всевозможными инфекциями, поражающими кишечник, важно тщательно мыть руки, хорошо промывать овощи, фрукты и зелень, избегать контакта с большим числом людей. Не стоит забывать, что способен передаваться возбудитель даже через чихание.
Опасная флора хорошо размножается в теплой и влажной среде. Но главными источниками опасности служат больные люди и животные. Часто происходит заражение в странах третьего мира, где антисанитария. Опасно пить родниковую воду, покупать лопнувшие фрукты, пить сырое молоко, заглатывать воду в водоемах. Если заболел ребенок или пожилой человек, к врачу надо обращаться незамедлительно при первых признаках, так как для этих категорий лиц острые инфекции опасны быстрым обезвоживанием и нередко приводят к гибели.
При малейших подозрениях на недуг обращайтесь в наш центр. Мы проведем полную диагностику, а затем грамотный специалист назначит терапию. Дети до 3 лет всегда подлежат госпитализации при тяжелой инфекции. Не занимайтесь самолечением. Помните, что вовремя поставленный диагноз помогает избежать тяжелых осложнений и во многих случая спасает жизнь. При необходимости у нас можно пройти обследование для санитарной книжки или профосмотр. Наша клиника всегда к вашим услугам и готова предоставить квалифицированную помощь и грамотный подход.
Методические указания
по обнаружению возбудителей кишечных инфекций
бактериальной природы в воде
(утв. Министерством здравоохранения СССР 28 мая 1980 г.)
I. Отбор воды, хранение и транспортировка проб
Питьевую воду отбирают в количестве 3 л.
Воду открытых водоемов - в количестве 1 л.
Сточную воду - 100 мл.
Пробы воды для бактериологического анализа отбирают с соблюдением правил стерильности: в стерильные бутылки или стерильными приборами - батометрами.
Для отбора воды из открытых водоемов, сточных вод, воды из бассейнов, колодцев удобен так называемый бутылочный батометр.
При отборе проб сточной жидкости используют металлические черпаки на деревянных или другого металла ручках либо бутыли, укрепленные винтовым зажимом на деревянном или металлическом стержне.
Пробы воды из кранов отбирают после их стерилизации путем фламбирования пламенем горящего тампона, смоченного спиртом, и последующего спуска воды в течение 10 - 15 минут при полном открытом кране. В случае, если кран оголовка скважины находится в заглубленной части шахты, то воду из него сливать не следует (избегая затопления шахты), а использовать только обжиг крана. Если отбираемая вода содержит следы остаточного хлора, то для нейтрализации хлора необходимо перед отбором во флаконы добавить 1,5 % стерильный раствор тиосульфата (гипосульфита натрия) из расчета 4 мл на 1 л воды.
При отборе проб воды из открытых водоемов следует предусмотреть следующие точки: в месте застоя и в месте наиболее быстрого течения (с поверхности и на глубине 50 - 100 см).
При отборе проб сточной жидкости следует предусмотреть точки на этапах ее очистки; воду из колодцев отбирают с поверхности и на глубине 20 - 30 см, воду централизованного водоснабжения - из кранов по разводящей сети. При отборе воды из артезианских скважин предусматривают следующие точки: из крана оголовка скважины, из крана на выходе водоразборных сооружений, из крана после подземного резервуара, перед поступлением в сеть, по разводящей сети.
Отбор проб в бассейнах производят при водообмене, в местах водозабора, на этапах очистки и обеззараживания, перед подачей воды в бассейн, на сливе воды из бассейна, в ванне бассейна - с поверхности и на глубине 20 - 30 см.
Отобранные пробы воды должны сопровождаться документом, содержащим:
1. Наименование пробы воды.
2. Точное наименование места отбора проб воды.
3. Дату и время отбора, а также дату и время доставки пробы воды в лабораторию.
4. Указание температуры отобранной воды.
5. Указание, по чьему заданию и с какой целью производится исследование.
6. Кем произведен отбор пробы воды (фамилия, должность).
Пробы воды доставляют в лабораторию не позднее 5 часов с момента взятия пробы.
II. Методы исследования воды
1. Прямой посев исследуемой воды на диагностические среды для определения шигелл.
1.1. Питьевая вода.
Воду предварительно фильтруют через мембранные фильтры № 3 в объеме не менее 500 мл. Фильтры помещают на поверхность питательных сред: агара с эозин-метиленовым синим (ЭМС) и бактоагара Плоскарева - антибиотиком и без него. Выбор антибиотика зависит от того, к каким антибиотикам устойчивы штаммы шигелл, выделяемые в данном районе. Посевы подращивают 18 - 24 часа при 37 °C.
1.2. Вода открытых водоемов.
Воду предварительно фильтруют через мембранные фильтры № 3 в объеме не менее 500 мл. Дальнейшее исследование проводят так же, как и при анализе питьевой воды.
1.3. Сточная вода.
Исследуемую воду в количестве 0,1 мл помещают на чашки с дифференциально-диагностической средой (не менее 5 чашек) и растирают шпателем. Посевы инкубируют в термостате при 37 °C 18 - 24 часа.
Дальнейшая идентификация бактерий проводится по общепринятой методике.
2. Посев воды в накопительные среды.
Используют не менее двух сред накопления. Для сальмонелл: магниевую среду, среду Кауфмана, селенитовый бульон, среду с охмеленным суслом. Для шигелл: селенитовый бульон, среду с охмеленным суслом, а также 1 % мясопептонный бульон и 10 % желчный бульон (метод Ростовского-на-Дону НИИЭМГ).
2.1. Посев питьевой воды.
Исследуемую воду фильтруют через мембранный фильтр № 3 (количество фильтров зависит от скорости фильтрации). Фильтры укладывают на поверхность питательной среды Эндо, разлитой в чашки Петри (поверхность фильтра с задержавшимися бактериями остается верхней). Посев подращивают при 37 °C 18 - 24 часа.
После учета выросших на мембранных фильтрах колоний кишечных палочек для определения коли-титра производят следующее: мембранные фильтры, на которых имелся рост мелких единичных бесцветных колоний, помещают в среды накопления - селенитовый бульон или магниевую среду обычной концентрации, разлитые в пробирки по 10 мл, в среду с охмеленным суслом, предварительно разбавленную стерильной водопроводной водой 1:4 и разлитую в пробирки по 10 мл. Посев помещают в термостат на 18 - 24 часа при 37 °C.
При отсутствии мембранных фильтров исследуемую воду распределяют по 500 мл во флаконы и вносят в среды накопления согласно прописям сред. Посевы помещают в термостат на 18 - 24 часа при 37 °C.
2.2. Посев воды открытых водоемов.
Исследуемую воду в количестве 1 л делят на две порции по 500 мл. В каждую порцию вносят накопительные среды по прописям, после чего воду с накопительной средой разливают поровну в 5 флаконов и помещают в термостат на 18 - 24 часа при 37 °C.
2.3. Посев сточной воды.
Сточную воду в количестве 100 мл вносят в накопительные среды по прописям и разливают во флаконы на 10 равных порций. Посевы воды помещают в термостат на 18 - 24 часа при 37 °C.
2.4. Посев воды по методу Ростовского-на-Дону НИИЭМГ (по Р.С. Хомик и А.А. Рындич). Применяется только для шигелл.
В 0,5 - 1 л исследуемой воды добавляют 5 - 10 мл 1 % мясопептонного бульона и помещают в термостат при 37 °C на 18 - 24 часа. Затем произвести посев на среду Эндо, ЭСМ-агар и бактоагар Плоскирева петлей. В этот же день провести посев подращенный в мясопептонном бульоне воды в среды накопления: 10 % желчный бульон или селенитовый бульон, произведя разведение до 10 -8 (берут 0,5 мл воды на 4,5 мл среды накопления). Из разведений делают высев на среды Эндо и ЭМС-агар (по 0,1 мл на каждую чашку) и бактоагар Плоскирева. Чашки с посевами и разведения, откуда делали высев, помещают в термостат при 37 °C на 18 - 24 часа. На следующий день просматривают чашки, а из разведений делают еще один высев на те же плотные среды. Дальнейшее исследование - по общепринятой методике определения шигелл.
3. Высев на дифференциально-диагностические среды.
3.1. Для определения сальмонелл.
Используют висмут-сульфитный агар. Высев из сред накопления производят бактериологической петлей на 2 - 3 чашки. Посевы инкубируют при 37 °C 18 - 24 часа. Просматривают рост на чашках и дальнейшее исследование проводят по общепринятой методике.
3.2. Для определения шигелл.
Используют агар с эозин-метиленовым синим с антибиотиками и без них, бактоагар Плоскирева. Высев из сред накопления производят бактериологической петлей на не менее 5 чашек. Посевы инкубируют в термостате при 37 °C 18 - 24 часа. Просматривают рост на чашках и дальнейшее исследование проводят по общепринятой методике.
4. Ускоренные методы определения сальмонелл и шигелл в воде.
Ускоренные методы определения патогенных энтеробактерий в воде рекомендуется использовать при повторном контроле воды централизованного и нецентрализованного водоснабжения, из которой ранее были выделены сальмонеллы или шигеллы.
4.1. Ускоренный сигнальный метод индикации патогенных энтеробактерий в питьевой воде.
Питьевую воду отбирают в количестве 1 - 2 л. Для посева воды используют параллельно не менее двух сред накопления: среду с охмеленным суслом, магниевую или селенитовую среды. 500 мл исследуемой воды засевают в равное количество магниевой или селенитовой сред двойной концентрации или среды с охмеленным суслом по прописи. Навеску сухой среды с охмеленным суслом в количестве 10 г вносят в 500 мл воды, взбалтывают до растворения в воде. Посевы инкубируют при 37 °C 18 - 24 часа.
Через 6 часов инкубации (ранний высев) из сред накопления три объема по 10 мл фильтруют через мембранные фильтры № 3. На первый фильтр наносят агглютинирующую специфическую сыворотку в количестве 0,5 мл. С помощью бактериологической петли смывают осадок с фильтра, переносят на предметное стекло и проводят реакцию агглютинации. Два фильтра укладывают на поверхность висмутсульфитного агара для подращивания сальмонелл и на ЭМС-агар - для шигелл. Посевы на чашках инкубируют при 37 °C 18 - 24 часа.
Положительная реакция агглютинации может служить сигнальным ответом на наличие соответствующих патогенных энтеробактерий.
Для подтверждения сигнального ответа:
1. На следующий день просматривают рост на фильтрах и, если есть четкие колонии, с каждой проводят пробную реакцию агглютинации на стекле с соответствующей специфической агглютинирующей сывороткой, готовят мазок и окрашивают по Граму. При обнаружении грамотрицательных палочек, дающих реакцию со специфической сывороткой, может быть дан предварительный положительный ответ. Все колонии, которые дали положительную реакцию агглютинации, пересевают на чашки с дифференциально-диагностическими средами и дальнейшее выделение и идентификацию бактерий проводят по общепринятой методике.
2. Наряду с этим, через 18 - 24 часа из сред накопления производят высев петлей на плотные питательные среды: висмут-сульфитный агар и ЭМС-агар с антибиотиком и без него, в зависимости от того, какие штаммы выделяются в данном районе -антибиотикоустойчивые или чувствительные. Посевы инкубируют при 37 °C 18 - 24 часа. Дальнейшее исследование и идентификация выделенных бактерий проводятся по общепринятой методике выделения сальмонелл и шигелл.
4.2. Ускоренное обнаружение сальмонелл в воде централизованного и нецентрализованного водоснабжения с использованием метода люминесцирующих антител.
С помощью красителя бисмарк браун приготавливают нелюминесцирующие мембранные фильтры по способу (Л.Е. Корш и Т.З. Артемовой (1972)). Пробы воды, подозрительные на наличие сальмонелл, фильтруют по 100 мл через 5 мембранных фильтров. Поверхность фильтров обрабатывают кроличьей агглютинирующей специфической сальмонеллезной сывороткой или смесью сывороток. Через 10 - 15 мин препарат помещают на 20 мин во влажную камеру, после чего подсушивают на воздухе. Затем фильтры обрабатывают люминесцирующей сывороткой против глобулинов кролика, время окраски - от 15 до 30 мин во влажной камере при комнатной температуре. Фильтры высушивают на воздухе, помещают на предметное стекло между слоями нелюминесцирующего иммерсионного масла (парафинового или вазелинового), накрывают покровным стеклом, на которое помещают еще каплю иммерсионного масла, и препарат микроскопируют.
Для люминесцентных микроскопов МЛ-2 используют светофильтры БС 8-2, СС 15-2, ФС 1-2, запирающий фильтр Т-2-Н, окуляторы компенсационные К 5Х или К 7Х . Препарат просматривают в падающем свете под ахроматическим иммерсионным объектом 90×1,25 Л.
При специфическом свечении наблюдается люминесценция по периферии микробной клетки, четко контрастирующая с телом клетки. Окрашенные и высушенные препараты могут храниться в темном месте в течение нескольких недель.
При использовании микроскопа МЛ-2Б возможно ориентировочное количественное определение сальмонелл в воде, для чего в один из измерительных окуляров К 7Х вставляется окулярная сетка Гаженко. Определение ведут по формуле:

где X - количество сальмонелл в 1 мл воды,
S - площадь фильтрующей поверхности в мкм,
S1 - площадь 1 квадрата сетки Гаженко в мкм,
n - количество клеток сальмонелл в 1 квадрате (среднее арифметическое из 20 квадратов),
V - объем профильтрованной воды в мл.
Для повышения специфичности результатов анализа воды бактерии, задержавшиеся на нелюминесцирующих фильтрах, подращивают на висмут-сульфитном агаре в течение 3 - 4 часов при 37 °C. Образовавшиеся микроколонии обрабатывают и микроскопируют так же, как и отдельные бактерии. Для получения достоверных результатов необходим контроль специфичности.
Затраты времени на анализ: без подращивания - 1 - 1,5 час., с подращиванием - до 5 часов.
III. Среды определения сальмонелл и шигелл в воде
1. Магниевая среда.
Навески ингредиентов на исследуемые объемы жидкости
Читайте также:


