Антикератиновые антитела при ревматоидном артрите
Антикератиновые антитела (АКА) – аутоантитела, направленные организмом против собственного белка филаггрина, которые являются специфичными маркерами ревматоидного артрита и исследуются для диагностики, оценки активности и прогноза этого заболевания.
Антифилаггриновые антитела (АФА)
Синонимы английские
Anti-keratin antibodies (AKA), Anti-filaggrin antibodies (AFA).
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Ревматоидный артрит – это хроническое системное аутоиммунное заболевание, для которого характерно симметричное поражение суставов кистей и стоп, а также разнообразные внесуставные проявления. Он относится к группе ревматических болезней, объединяющей на основании сходства клинической картины несколько заболеваний, в том числе реактивный и псориатический артрит, болезнь Бехчета, синдром Шегрена, полимиозит и др. Дифференциальная диагностика этих заболеваний во многом опирается на лабораторные методы. Одним из самых специфичных в отношении ревматоидного артрита диагностических методов является исследование антикератиновых антител.
Антикератиновые антитела (АКА) – это аутоантитела, направленные против белка филаггрина, который обнаруживается в составе многослойного ороговевающего эпителия. Остается до конца не ясным, являются ли аутоантитела непосредственной причиной ревматоидного артрита или образуются вторично. Установлено, что они связываются с аминокислотой цитруллином, входящей в состав филаггрина, поэтому в настоящее время их чаще относят в группу так называемых антицитруллиновых антител.
АКА обнаруживаются в крови пациентов с ревматоидным артритом в 40-65 % случаев. Однако следует отметить, что чувствительность анализа на АКА в отношении ревматоидного артрита сопоставима с чувствительностью исследования ревматоидного фактора – одного из основных диагностических критериев этого заболевания. Главное же преимущество теста на АКА заключается в его высокой специфичности, составляющей 92-99 %. Для сравнения: специфичность ревматоидного фактора в отношении ревматоидного артрита составляет 66 %, этот лабораторный маркер также выявляется при анкилозирующем спондилоартрите, системной красной волчанке, синдроме Шегрена, а также многих других неревматических заболеваниях. Таким образом, в то время как отрицательный результат теста на АКА не позволяет полностью исключить ревматоидный артрит, положительный результат этого исследования практически подтверждает диагноз. Однако в редких случаях АКА обнаруживаются в сыворотке больных другими ревматическими заболеваниями (системной красной волчанкой, системной склеродермией, анкилозирующим спондилоартритом). Поэтому рекомендуется интерпретировать результат исследования с учетом других лабораторных, клинических и инструментальных данных.
Еще одним важным отличием АКА от ревматоидного фактора является их раннее появление, что оказывается особенно полезным при обследовании пациента с вновь возникшими симптомами ревматоидного артрита. В то время как ревматоидный фактор не всегда присутствует в начале болезни, обнаружение АКА зачастую даже предшествует развитию симптоматики заболевания.
Течение ревматоидного артрита варьируется от стойкой ремиссии до быстро прогрессирующей деструкции суставов и инвалидизации. При оценке прогноза заболевания учитывают многие факторы, в том числе и выраженность иммунологических нарушений. Вероятность развития эрозивного артрита у АКА-позитивных пациентов выше, чем у АКА-негативных. Обнаружение АКА ассоциировано с повышенной концентрацией провоспалительных факторов, таких как С-реактивный белок и сывороточный амилоид А, и увеличением скорости оседания эритроцитов (СОЭ). Результат исследования АКА может меняться у одного и того же пациента в течение болезни, что отражает изменение активности ревматоидного артрита. Поэтому периодическое измерение АКА наряду с другими лабораторными маркерами может быть использовано для контроля лечения болезни.
Для чего используется исследование?
- Для дифференциальной диагностики ревматических заболеваний;
- для диагностики, оценки активности и прогноза ревматоидного артрита.
Когда назначается исследование?
- При суставном синдроме: боли и деформации в области суставов (симметричное поражение преимущественно мелких суставов кистей и стоп, но возможно вовлечение коленных, бедренных и других крупных суставов), ограничении подвижности (утренняя скованность длительностью более 1 часа), отеке и гиперемии кожи над суставами;
- каждые 6 месяцев или чаще при наблюдении пациента с ревматоидным артритом.
Что означают результаты?
Титр Повышенный результат:
- ревматоидный артрит;
- системная красная волчанка;
- системная склеродермия;
- анкилозирующий спондилоартрит.
- отсутствие ревматоидного артрита;
- контроль заболевания на фоне лечения.
Что может влиять на результат?
- При достижении ремиссии заболевания результат анализа становится отрицательным.
- Отсутствие АКА не исключает диагноз "ревматоидный артрит".
- Результат анализа следует оценивать вместе с данными дополнительных лабораторных и инструментальных исследований.
Кто назначает исследование?
Ревматолог, хирург, врач общей практики.
Литература
- Paimela L, Gripenberg M, Kurki P, Leirisalo-Repo M. Antikeratin antibodies: diagnostic and prognostic markers for early rheumatoid arthritis. Ann Rheum Dis. 1992 Jun;51(6):743-6.
- Sebbag M, Simon M, Vincent C, Masson-Bessière C, Girbal E, Durieux JJ, Serre G. The antiperinuclear factor and the so-called antikeratin antibodies are the same rheumatoidarthritis-specific autoantibodies. J Clin Invest. 1995 Jun;95(6):2672-9.
- Aletaha D. et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/EuropeanLeague Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010 Sep;69(9):1580-8.
- Steiner G, Smolen J. Autoantibodies in rheumatoid arthritis and their clinical significance. Arthritis Res. 2002;4 Suppl 2:S1-5.
- Fauci et al. Harrison's Principles of Internal Medicine/A. Fauci, D. Kasper, D. Longo, E. Braunwald, S. Hauser, J. L. Jameson, J. Loscalzo; 17 ed. - The McGraw-Hill Companies, 2008.
Уважаемые пациенты! Каталог анализов в настоящее время находится в стадии наполнения информацией и содержит в себе далеко не все выполняемые нашим центром исследования. Филиалами Центра эндокринологии проводится более 700 видов лабораторных анализов. С их полным списком Вы можете ознакомиться здесь.
Пожалуйста, уточняйте информацию о стоимости услуг и подготовке к анализам по телефонам (812) 344-0-344, +7 953 360 96 11. При сдаче анализов крови, пожалуйста, учитывайте стоимость забора биоматериала.
Готово к оформлению: 0 анализов
Антикератиновые антитела (или АКА) представляют собой аутоантитела, вырабатываемые иммунной системой организма и ориентированные против собственного протеина - филаггрина. Эти антитела служат в качестве специфичных маркеров ревматоидного артрита, исследуются с целью диагностики, оценки активности, а также прогнозирования этого заболевания.
Ревматоидный артрит (РА) представляет собой хроническое системное заболевание аутоиммунной природы. Достаточно характерным для него является симметричное вовлечение в патологический процесс суставов кистей и стоп, и, кроме того, разнообразные внесуставные проявления. РА входит в группу ревматических заболеваний, в которую по причине сходства клинической картины входит еще ряд патологий, в числе которых, например, реактивный и псориатический артрит, синдром Шегрена, болезнь Бехчета, полимиозит и некоторые другие. Диагностическое разграничение этих болезней во многом основано на лабораторных методах исследования. Одним из наиболее специфичных в плане ревматоидного артрита методов диагностики является изучение антикератиновых антител.
Филаггрин, против которого направлены антикератиновые антитела, обнаруживается в многослойном ороговевающем эпителии. На сегодняшний день не до конца понятно, являются ли эти аутоантитела непосредственной причиной, вызывающей развитие ревматоидного артрита, или же они образуются вторично. Было показано, что они образуют связи с аминокислотой цитруллином, которая является составной частью белка филаггрина, ввиду чего их в настоящее время чаще относят к группе антицитруллиновых антител.
Антикератиновые антитела выявляются в крови лиц с ревматоидным артритом примерно в 40-65% всех случаев. Тем не менее, следует упомянуть о том, что чувствительность исследования на АКА в плане ревматоидного артрита может быть сопоставима с чувствительностью изучения ревматоидного фактора, представляющего собой один из главных диагностических критериев данного заболевания. Основное преимущество исследования на антикератиновые антитела - его высокая специфичность, которая может достигать 92-99%, тогда как специфичность ревматоидного фактора применительно к ревматоидному артрита составляет порядка 66%; ревматоидный фактор может, помимо ревматоидного артрита, также обнаруживаться при анкилозирующем спондилоартрите, синдроме Шегрена, системной красной волчанке, а также при ряде других заболеваний неревматической природы. Таким образом, можно заключить, что отрицательный результат исследования на АКА не дает возможности полностью исключить наличие ревматоидного артрита, а положительный результат исследования практически подтверждает данный диагноз. Тем не менее, в редких случаях антикератиновые антитела обнаруживаются в сыворотке лиц, страдающих другими ревматическими заболеваниями (например системной красной волчанкой, анкилозирующим спондилоартритом, системной склеродермией). По этой причине рекомендуется трактовать результаты исследования, принимая во внимание также и данные иных лабораторных, клинических, инструментальных методов исследования.
Еще одно значимое отличие антикератиновых антител от ревматоидного фактора - их раннее появление; это особенно полезно в случаях обследования лица с вновь появившимися признаками ревматоидного артрита. Ревматоидный фактор может не всегда обнаруживаться в начале заболевания, а выявление АКА часто может даже предшествовать развитию проявлений заболевания.
Течение РА колеблется от стойкой ремиссии с одной стороны до достаточно быстро прогрессирующего поражения суставов, инвалидизации - с другой. При оценке прогноза патологии принимаются во внимание многие факторы, в числе которых и выраженность нарушений функционирования иммунной системы. Вероятность возникновения эрозивного артрита у лиц с обнаруженными АКА выше, нежели у лиц без них. Обнаружение антикератиновых антител сочетается с повышенным содержанием провоспалительных факторов - как, например, С-реактивный белок, сывороточный амилоид А, а также с увеличением СОЭ (скорости оседания эритроцитов). Результат исследования на антикератиновые антитела может меняться на протяжении заболевания, что может свидетельствовать об изменении его активности. По этой причине периодическое исследование АКА вместе с иными лабораторными маркерами может использоваться с целью контроля лечения заболевания.
За 30 минут до взятия крови прекращается курение.
Приведены лишь некоторые процессы, состояния и заболевания, при которых целесообразно назначение данного анализа.
Исследование на антикератиновые антитела может проводиться для диагностического разграничения ревматических заболеваний; с целью диагностики ревматоидного артрита, а также для оценки его активности и прогноза.
Интерпретация результатов
Ниже приведены лишь некоторые возможные процессы, состояния и заболевания, при которых обнаруживаются антикератиновые антитела. Следует помнить, что результат исследования может не всегда являться достаточно специфичным и достаточным критерием для формирования заключения. Представленная информация никоим образом не служит целям самодиагностики и самолечения. Окончательный диагноз устанавливается только врачом при сочетании полученных данных с результатами других методов исследования.
Возможные причины отрицательного результата: ревматоидного артрита нет; контроль течения болезни на фоне лечения; некорректное взятие биологического материала на исследование.
Возможные причины положительного результата: ревматоидный артрит; анкилозирующий спондилоартрит; системная склеродермия; системная красная волчанка.
Факторы, которые могут оказывать влияние на результат исследования
При достижении стадии ремиссии результат исследования становится отрицательным.
Важные замечания
Отсутствие антикератиновых антител не исключает наличия ревматоидного артрита.
Результат исследования необходимо интерпретировать совместно с данными, полученными при дополнительных лабораторных, инструментальных исследованиях.
Истории пациентов
Видеоотзывы: опыт обращения в Северо-Западный центр эндокринологии

Многие годы пытаетесь вылечить СУСТАВЫ?
Глава Института лечения суставов: «Вы будете поражены, насколько просто можно вылечить суставы принимая каждый день средство за 147 рублей.
Ревматоидный артрит — аутоиммунное заболевание хронического течения. Как правило, такой артрит поражает:
- лодыжки,
- суставы кистей рук,
- колени.
Ревматоидный артрит формируется незаметно для человека и выражен многими размытыми симптомами. Поэтому очень часто даже врачи с большим опытом не могут определить данное заболевание.
Ревматоидный артрит, обычно, появляется у женщин после 30 лет. Мужчины также им болеют, но у женщин он такой вид артрита встречается в 5 раз чаще.
Для лечения суставов наши читатели успешно используют Артрейд. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
К сожалению, ревматоидный артрит достаточно опасное заболевание, которым страдают люди трудоспособного возраста.
В настоящее время этиология заболевания неизвестна. Современная медицина не может точно причины, какие приводят здорового человека к воспалению сустава. Но известно, что заболевание провоцирует сбой в иммунной системе.
Воспалительный процесс начинается из-за:
- постоянных сильных стрессов,
- инфекций,
- травм.

Помимо этого, статистика свидетельствует, что 80% больных ревматоидным артритом имеют антитела к вирусу Эпштейна-Барра.
Медицина постоянно и непрерывно развивается, но сейчас все еще нельзя полностью вылечить или предупредить формирование ревматоидного артрита. Заболевание развивается не быстро, но постоянно прогрессирует.
Человек может хорошо себя чувствовать, но в его организме продуцируются антитела, атакующие не инородный вирус или аллерген, а собственный организм.
Ревматоидный артрит, по сути своей, воспалительный процесс, который протекает в суставах и оболочках суставов.
Пораженные органы медленно деформируются и не могут полноценно работать.
У большинства пациентов наблюдаются следующие симптомы:
- Артрит суставов кисти,
- Утренняя скованность суставов, которая не проходит длительное время,
- Симметричность очагов воспаления,
- Ревматоидные узелки – специфические подкожные уплотнения в районе локтей.
Обратите внимание на то, что присутствие хотя бы одного из указанных выше симптомов может сигнализировать о начале заболевания. В тяжелых формах ревматоидного артрита деформации подлежат не только суставы, но и такие органы, как:
- легкие,
- кровеносная система,
- соединительная ткань.
В перечне общих симптомов находится видимое повышение температуры (до субфебрильной 38 С), а также нарушения сна и понижение аппетита.

Самостоятельно ревматоидный артрит не проходит. Если заболевание не лечить, то оно серьезно ухудшает общее качество жизни, а главное, приводит к существенным нарушениям работы организма, в некоторых случаях может наступить летальный исход.
При появлении первых симптомов нужно немедленно проконсультироваться с ревматологом. Категорически запрещается заниматься самодиагностикой и лечением в домашних условиях.
Только квалифицированный врач сможет отличить ревматоидный артрит пальцев рук, к примеру, от других похожих заболеваний и временных нарушений.
Ревматолог внимательно выслушает жалобы, осуществит визуальный осмотр, и обязательно направит на соответствующие анализы. Исследование ревматоидного артрита включает в себя:
- общий клинический анализ крови,
- биохимический и иммунологический анализ крови,
- артроскопия,
- МРТ суставов,
- рентгеноскопия.
В некоторых случаях врач принимает решение о назначении пункции суставной жидкости.
Если заболевание уже находится на поздних стадиях развития, то привлекаются врачи других специализаций. В зависимости от вида поражения внутренних органов можно проконсультироваться с:
- гастроэнтерологом,
- кардиологом,
- пульмонологом и другими врачами.
При ревматоидном артрите общий анализ крови показывает:
- пониженный уровень гемоглобина, то есть умеренную анемию,
- повышенный уровень криоглобулинов,
- лейкоцитоз, прямо пропорциональный интенсивности развития артрита,
- небольшое повышение СОЭ.
Степень анемии при подтвержденном ревматоидном артрите напрямую связана с силой воспалительного процесса.
При формирующемся синдроме Фелти начинается острая нейтропения – пониженная концентрация нейтрофилов, то есть, одного из видов лейкоцитов. Помимо этого, синдром Фелти выражается спленомегалией и полиартритом.
Однако, некоторое время назад, ученые выявили, что Р-фактор может находиться в крови здоровых людей, таковых примерно 5-6%. При этом, Р-фактор часто не обнаруживают у больных артритом.
Таким образом, можно сделать вывод, что выявление Р-фактора не является наиболее веской причиной для решения о наличие артрита. Но на основании биохимического анализа крови можно определить вид ревматоидного артрита: серонегативный или серопозитивный. Р-фактор можно определять с 6-8 недели после начала заболевания.
Помимо прочего, с помощью биохимического анализа крови обнаруживают те показатели, какие характерны и для других коллагенозов:
- увеличенный уровень фибриногена и гаптоглобина,
- высокий уровень пептидов и сиаловых кислот.
При ревматоидном артрите иммунологический анализ крови предоставляет возможность определить одну из нетипичных причин воспаления, а именно, С-реактивный белок.
Если в крови есть серомукоид, то это говорит о патологических воспалительных процессах в организме. Но его присутствие не является окончательным доказательством ревматоидного артрита. На артрит указывают также следующие признаки:
- усиление перекисного окисления липидов,
- снижение антиоксидантной активности,
- уменьшение содержания глюкозаминогликанов.
Помимо анализа крови, человеку у которого подозревают артрит, также назначают анализ мочи. Если заболевание присутствует, то врачи увидят серьезные сбои в работе мочевыделительной системы.
Во многих случаях у больного артритом наблюдается амилоидоз либо нефротическое поражение почек. Амилоидоз формируется через несколько лет после начала развития артрита и выступает осложнением основного заболевания.

Ревматоидный артрит во многих случаях сопровождает характерная дисфункция – почечная недостаточность.
Достаточно часто врачи считают необходимым провести диагностику синовиальной жидкости. У людей с ревматоидным артритом, данная жидкость становится мутной и имеет как целые, так и разрушенные лейкоциты (нейтрофилов там около 80%). Признаки воспалительного процесса показывает также биопсия синовиальной жидкости.
Самым достоверным показателем, позволяющим легко определить наличие ревматоидного артрита, выступает исследование на антитела к цитруллинированному пептиду (АЦЦП). Благодаря этому методу заболевание можно определить не менее, чем у 80% людей.
Нужно отметить еще один положительный момент данного исследования, речь идет о возможности выявить заболевание у людей, имеющих нормальные показатели ревматоидного фактора. Этот анализ получил широкое распространение благодаря точному диагностированию ревматоидного артрита.
СОЭ это скорость оседания эритроцитов. У здорового человека она в пределах 5-12 мм/час.
При ревматоидном артрите СОЭ становится выше и составляет 20 мм/час. Маркер на СОЭ говорит о тяжелом течении либо резком обострении ревматоидного артрита.
Анализы на ревматоидный артрит определяют:
- антинуклеарные антитела, которые возникают при прогрессирующих нарушениях соединительной ткани,
- антиген комплекса гистосовместимости DR4 — при прогрессировании дегенерации суставов,
- LE-клетки – клетки, которые бывают у людей, болеющих красной волчанкой,
- антикератиновые тела.
Важно помнить, что своевременная диагностика является гарантией успешного лечения ревматоидного артрита.
Вход на сайт
где сдать анализ крови на тест анализы спб СПб инвитро Петербург Питер на целиакию аутоиммунные заболевания аутоантитела онкогенетика онкогены онкоген аутоиммунная диагностика Лапин autoimmun антиядерные лабораторная антинуклеарный фактор антинуклеарные антитела HEp-2 тип волчанка свечения амилоидоз склеродермия иммуноблот ревматоидный цитруллиновый расшифровка экстрагируемые скрининг заболевания смешанное системная СКВ артрит дсДНК CCP ССР АЦЦП саркоидоз антинейтрофильные криоглобулины гранулематозные АНФ АНЦА ANCA ENA иммунофиксация васкулиты Крона целиакия аутоиммунный печени язвенный колит глиадину трансглутаминазе стероидпродуцируюшим Вегенера яичника эндокринопатии пузырные пузырчатка пемфигоид рассеянный склероз миастения миелина белок олигоклональный изоэлектрофокусирования IgG IgA IgM легкие цепи полиневрит ганглиозидам полимиозит парапротеин миелома неоптерин островковые GAD антимитохондриальные гладкие скелетные мышцы ASCA колит антигену фосфолипидный синдром кардиолипину фосфолипидам гликопротеину нуклеосомам SSA SSB RNP Sm CENT Scl Jo-1 АМА антикератиновые антиперинуклеарный MCV LKM-1 рецептору иммунофлюоресценция ИФА иммунологическая лаборатория университет санкт-петербург павлова Чардж-Стросса полиангиит микрокристаллические первичный билиарный цирроз трансглутаминаза трансглютаминаза критерии ревматоидного артрита 2010 года СПб Питер Петербург нейрогенетика BRCA NRAS KRAS BRAF HER2 MSI PCA3 тест мутации
Что ищут на нашем сайте:
Ig G 4, Антитела к рецептору фосфолипазы, ревматоид, синовиальн, анализ кала на кальпротектин, полимиозит, Ядерный гранулярный, васкулит, Жильбера, исследование иммунного статуса им, Антитела к тканевой трансглутамин, тест 01 02 15 160 Подробнее, Гломунифрит, Упф, антитела к островковым клеткам под, Анализ на криоглобулинемию, тест активации эозинофилов, анализ на криоглобулины, текальным, Антитела к двухцепочечной ДНК, иммунология.
Ревматоидный артрит и артропатии
Ревматоидный артрит - это воспалительное заболевание, характеризуемое деградацией хряща и эрозиями субхондральной кости (Goldring S.R., 2003). В основе процесса заболевания лежит хроническое системное аутоиммунное воспаление с преимущественным поражением суставов кистей и стоп. Прогрессирующая деструкция и деформация суставов сопровождается также поражением кожи, сердца, лимфатических узлов, селезенки и легких. Распространённость заболевания оценивается от 0.5% до 1%, что в пересчете составляет около 30 случаев на 100 000 жителей, делая это заболевание наиболее частой формой хронических аутоиммунных заболеваний. Пик инвалидности вследствие РА приходился на самый трудоспособный возраст в 40-50 лет. Среди женщин заболевание встречается в три-четыре раза чаще, чем у мужчин.
Эффективные методы терапии РА появились относительно недавно, и несмотря на свою эффективность, имеют значительное количество побочных эффектов. К таким методам относят базисную терапию т.е. лекарства, которые нужно принимать постоянно, болезнь-модифицирующие антиревматические препараты (DMARD – англ.) или генно-инженерные биологические препараты (ГИБП) (Quinn M.A. et al., 2005). Ранний и точный диагноз становится важнейшим условием успеха терапии, поскольку чем раньше начата базисная терапия, тем лучше эффект проводимого лечения (Combe B. et al., 2007). Высокая эффективность ранней терапии РА подтверждена в ходе более 20 рандомизированных клинических исследований (Anderson J.J., 2000). Пока нет окончательных сведений относительно ширины терапевтического окна во времени от начала заболевания. Метаанализ опубликованных данных обнаружил, что задержка терапии на 9 месяцев после начала заболевания (которая соответствует средним срокам окончательной диагностики РА в развитых странах (Chan K.W., 1994)), значительно ухудшает долговременный исход (Finckh A., 2006).
В настоящее время достигнут существенный прогресс в визуальной диагностике РА с внедрением ультразвуковых методов и магнито-резонансной томографии (МРТ). Но в научной и практической работе, по-прежнему, ренгенологический метод остается основным методом инструментальной диагностики и динамического наблюдения. Это связано с тем, что ежегодно удается обнаружить примерно равномерное нарастание рентгенологических изменений за исключением ускоренной динамики между вторым и третьим годами наблюдения (Jayakumar K., 2007). Однако измерение толщины хряща при малых интервалах времени недостаточно точно, и существующие комплексные системы оценки активности, в том числе DAS28, не удовлетворяют ревматологов. Немедленное назначение терапии ГИБП позволяет предупредить прогрессирование заболевания и деструкцию суставов у лиц с ранним РА (один год от начала болезни), а также уменьшить число тяжелых форм РА с внесуставными проявлениями (Turesson С., 2007). Но эти препараты ГИБП, в том числе ингибиторы фактора некроза опухолей (анти-ФНО), дороги и небезопасны. Поэтому они должны назначаться, прежде всего, лицам с высокой активностью и неблагоприятным прогнозом из-за опасности быстрого разрушения суставов. Однако клинический ответ больных РА на терапию нейтрализующими антителами к анти-ФНО отличается большой индивидуальностью. Для выхода из данной проблемы приходится прибегать к сложным лабораторным исследованиям. Так фармакогеномный анализ показаний терапии анти-ФНО ГИБП показал, возможность исследований тканевой экспрессии генов для отбора пациентов для индивидуализации терапии. Для оценки экспрессии была использована Illumina 300K chip technology (Matsubara T., 2007). В биоптатах синовиальной оболочки, полученной при артроскопии, у 18 больных РА с активным течением РА и с DAS28≥3.2 перед началом лечения инфликсимабом было проведен анализ экспрессии генов (Large-scale gene expression profiling). Всего 12 больных ответило на терапию, а у 6 больных положительного результата получено не было. Лечение привело у части больных к уменьшению индекса DAS28 ≥1.2, а у не-отвечающих он остался 40 IU/мл).
Являются первыми изученными антицитруллиновыми антителами. Встречаемость при РА составляет 30-50%. Данные антитела несколько более специфичны по сравнению с антителами к циклическому цитруллин-содержащему пептиду. Серопозитивность по АКА указывает на высокий риск развития деструкций при РА
Обладает чувствительностью 65% и специфичностью 95% для диагностики раннего РА. У бессимптомных доноров встречаемость 0,5%, серонегативных артропатиях 5%, СКВ 2%. Встречаются до развития заболевания на Друзья:
- 4960
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




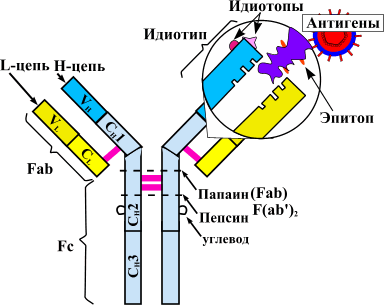
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
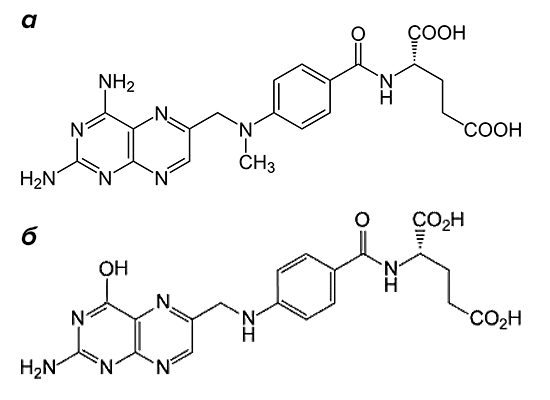
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
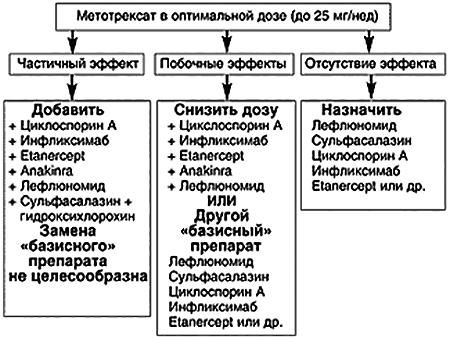
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
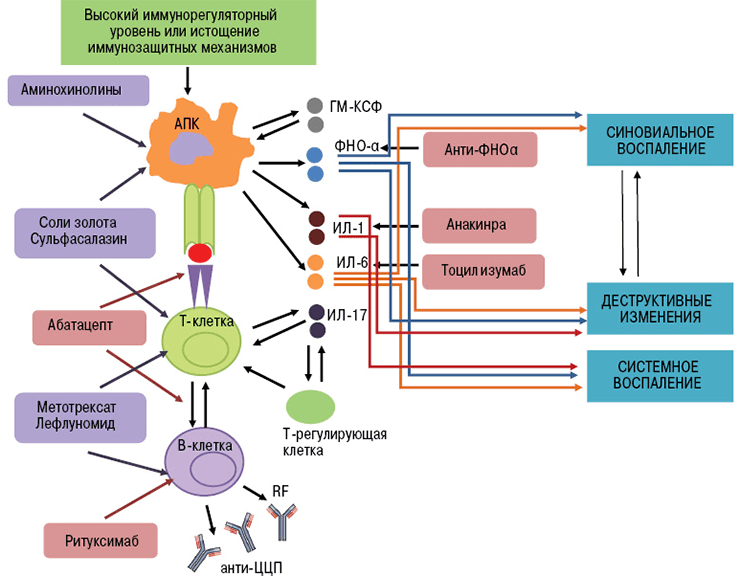
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
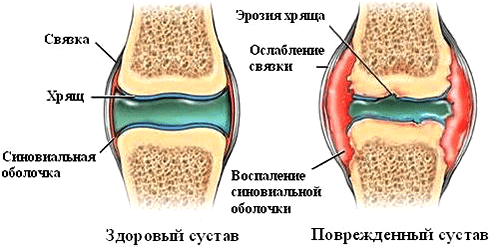
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
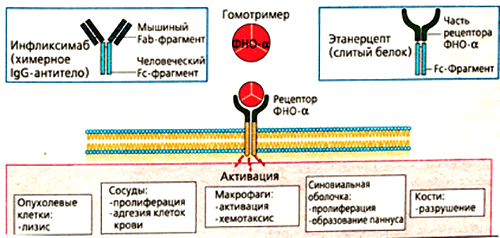
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
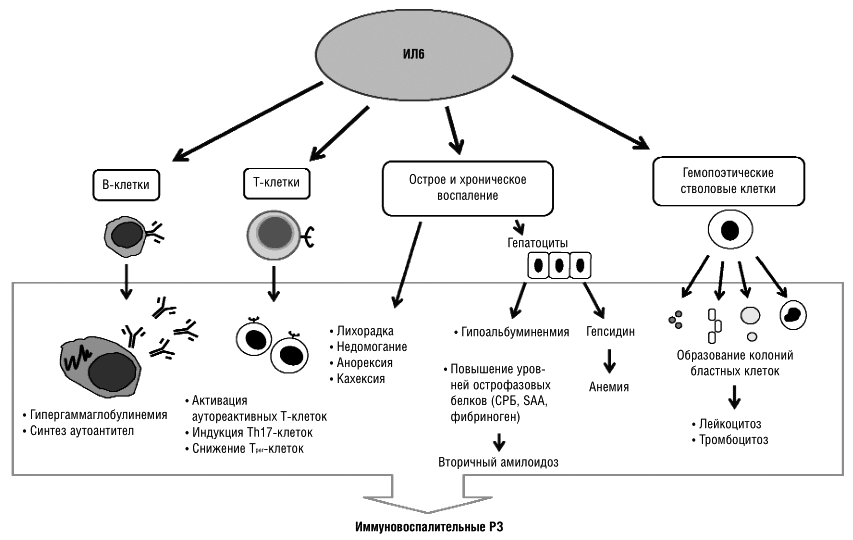
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
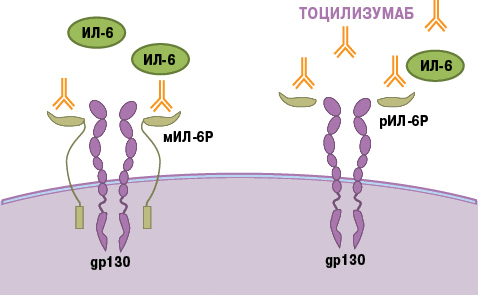
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
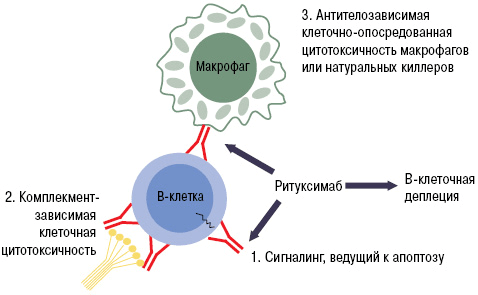
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
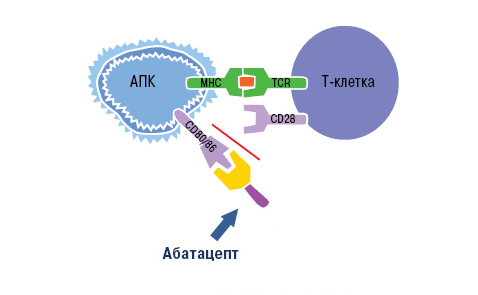
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





