Аутотрансплантат из большеберцовой кости
Пересадка некровоснабжаемых аутотрансплантатов
Данный метод получил широкое распространение в связи со своей простотой, а также зоне, ограниченный объем костно-пластического материала, его чувствительность к инфекции, а также относительно медленное вживление трансплантата в воспринимающее ложе из-за весьма ограниченного участия его клеток в восстановительных процессах.
С учетом вышеизложенного, некровоснабжаемые аутотрансплантаты применяют главным образом при хорошем кровоснабжении тканей воспринимающего ложа, отсутствии инфекции, когда необходим ограниченный объем пластического материала.
Показания к этому виду пластики могут быть значительно расширены в молодом и особенно детском возрасте.
В связи с тем, что после пересадки механическая прочность аутотрансплантата быстро снижается, он не должен подвергаться значительной механической нагрузке.
Источники аутотрансплантатов и особенности их применения. В качестве аутотрансплантатов наиболее часто используют части костей, взятие которых не приводит к существенным функциональным и косметическим дефектам: ребер, диафиза малоберцовой кости, метафизов лучевой и большеберцовой костей, подвздошной кости, суставов пальцев стопы и др.
Специальные исследования показали, что остеоциты способны переносить острую ишемию до 25 ч, но они погибают, если соприкасаются с внешней атмосферой дольше 30 мин или хранятся в изотоническом растворе натрия хлорида (в том числе с антибиотиками).
В связи с этим отметим важное правило: костный трансплантат следует хранить в среде, содержащей кровь, и максимально быстро перемещать в реципиентное ложе.
В связи с тем, что винты могут расщеплять конец трансплантата, возможна его фиксация проволочными швами. В некоторых случаях целесообразна комбинация аутопластики с внутренним остеосинтезом гвоздем или пластинкой, что обеспечивает фиксацию костных отломков и снижает нагрузку на трансплантат.
Исходы операций определяются многими факторами.
Лечение длительное в связи с тем, что органотипическое восстановление кости (полная перестройка трансплантата в соответствии с механическими условиями) происходит лишь через 2—2,5 года, а сроки иммобилизации составляют 8—12 мес.
Функциональные исходы при значительных дефектах костей неопределенны. Это связано с тем, что частота несращения аутотрансплантатов с воспринимающим костным ложем остается высокой (до 30% и более). Значительное снижение механической прочности некровоснабжаемых трансплантатов проявляется их частыми патологическими переломами (до 58% и более после пересадки длинных трансплантатов).
Высокая чувствительность лишенной питания кости к инфекции приводит к развитию гнойных осложнений. Все это в сочетании с развитием других методов замещения дефектов костей определило весьма скромное место некровоснабжаемых костных трансплантатов в современной пластической и реконструктивной хирургии опорно-двигательной системы.
Пересадка кровоснабжаемых аутотрансплантатов
Впервые операцию этого типа выполнили J.Taylor и соавт. в 1974 г., пересадив малоберцовую кость на малоберцовом сосудистом пучке в дефект соседней большеберцовой кости. В настоящее время этот метод костной пластики получает все большее распространение. В качестве кровоснабжаемых костных трансплантатов могут быть использованы различные кости (табл. 13.4.1). Их более детальная характеристика дана во II части руководства.
Все эти трансплантаты могут быть использованы как в качестве монолоскутов, так и в виде поликомплексов тканей, дополнительно включающих участки мышцы, кожи и других тканей.
Как показывает опыт, при сохранении кровообращения и надежной фиксации пересаженных участков кости их клетки активно участвуют в репаративных процессах и быстро перестраиваются в соответствии с условиями механической нагрузки. При этом прочность кровоснабжаемых костных трансплантатов не только не снижается, но при механической нагрузке увеличивается. Они устойчивы к развитию инфекции и не подвергаются рассасыванию.
При замещении значительных по величине дефектов костей сращение трансплантатов с воспринимающим костным ложем достигается при хорошей фиксации в относительно короткие сроки, близкие к срокам сращения переломов. Все это делает данный метод очень важным в реконструктивной хирурги конечностей.
В то же время исключительная техническая сложность операции ограничивает применение этого метода теми наиболее тяжелыми случаями, при которых другие методы костной пластики малоперспективны.
Успех вмешательства определяется, с одной стороны, уровнем восстановленного кровоснабжения пересаженных тканей, с другой — качеством выполнения остеосинтеза, все варианты которого должен иметь возможность выполнить хирург.
Несвободная пересадка кости на питающей ножке
Несвободная пересадка участков кости на питающей ножке — один из наиболее ранних методов костно-пластической хирургии, однако лишь с развитием микрохирургической анатомии он получил более широкое распространение. Те же источники тканей, которые применяются для свободной пересадки с наложением микрососудистых анастомозов, могут быть использованы и для несвободной пластики в соответствии с дугой ротации питающей ножки (табл. 13.5.1).
Репаративные возможности костных лоскутов на питающей ножке и их судьба соответствуют таковым кровоснабжаемых костных трансплантатов. В то же время при несвободной пересадке нет необходимости в наложении микрососудистых анастомозов, что значительно упрощает операцию. Во многих случаях костные лоскуты на ножке могут быть использованы вместе с участками мягких тканей.
Следует отметить и такой особый вариант пересадки, как использование костных фрагментов на лоскуте глубокой фасции, что может обеспечить сегментарное кровоснабжение даже при соотношении длины и ширины лоскута 3:1 и даже 4:1. Такие лоскуты могут быть сформированы в метафизарной зоне многих костей.
Изобретение относится к медицине, а именно к ортопедии и травматологии, и может быть применимо для взятия аутотрансплантата для костной аутопластики. Выделяют сегмент кости из двух небольших разрезов мягких тканей в проекции концов аутотрансплантата. Производят через эти разрезы остеотомию и отслаивание надкостницы на верхнем и нижнем концах трансплантата. Осуществляют ручную фиксацию мышечных футляров конечности в зоне трансплантата. Постепенно отделяют трансплантат от прилежащих мягких тканей ротационными движениями и тягой в дистальном направлении. Извлекают трансплантат через имеющийся разрез. Помещают трансплантат в зону повреждения кости. Способ позволяет снизить травматичность манипуляции, обеспечить минимальный косметический дефект. 4 ил.
Предлагаемое изобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано при лечении повреждений длинных трубчатых костей и замещении дефектов костей с использованием аутотрансплантатов, например взятых из малоберцовой кости.
Известен способ взятия аутотрансплантата для костной пластики, например, из гребня подвздошной кости. При этом делают разрез по проекции гребня до кости. Распатором отделяют мышцы с наружной и внутренней поверхностей последней на протяжении, соответствующем величине трансплантата. Затем долотом сбивают тонкую костную пластинку с верхней поверхности гребня и отворачивают ее в сторону, после чего долотом осуществляют взятие трансплантата [1].
Наиболее близким к предлагаемому способу взятия аутотрансплантата является взятие трансплантата из большеберцовой кости. Выполняют прямой разрез кожи по передней поверхности верхнего метафиза большеберцовой кости в зависимости от длины предполагаемого трансплантата. Для взятия регидного кортикального трансплантата длиной до 30 см делают разрез по передней поверхности голени. Распатором сдвигают надкостницу и обнажают гребень большеберцовой кости. Затем с помощью циркулярной пилы или долота делают два параллельных сечения кости (до костно-мозгового канала) на расстоянии один от другого в соответствии с шириной трансплантата. Затем долотом или остеотомом поперечно рассекают вверху и внизу концы трансплантата. После извлечения трансплантата осуществляют его имплантацию [2].
Однако, известные способы обладают существенными недостатками: 1. Известные технологии взятия аутотрансплантата предполагают разрез мягких тканей длиной, равной длине трансплантата, что повышает травматизм хирургического вмешательства.
2. Наличие косметического дефекта в зоне забора аутотрансплантата.
Для устранения вышеуказанных недостатков была поставлена задача: снизить травматизм хирургической манипуляции и исключить косметические дефекты в зоне забора трансплантата.
Поставленная задача достигается тем, что взятие аутотрансплантата для костной пластики осуществляют путем выделения сегмента кости с последующей его остеотомией и помещением в зону повреждения. Новым в решении поставленной задачи является то, что выделение сегмента кости выполняют из двух небольших разрезов мягких тканей в проекции концов аутотрансплантата. Производят через эти разрезы остеотомию и отслаивание надкостницы на верхнем и нижнем концах трансплантата. Затем осуществляют ручную фиксацию мышечных футляров конечности в зоне трансплантата и постепенно отделяют костный аутотрансплантат от прилежащих мягких тканей ротационными движениями и тягой в дистальном направлении, извлекая аутотрансплантат через имеющийся разрез.
Выделение сегмента кости, например малоберцовой, из двух небольших разрезов мягких тканей в проекции концов аутотрансплантата, выполнение остеотомии и отслаивание надкостницы на верхнем и нижнем концах трансплантата обеспечивают снижение травматизма хирургического вмешательства (исключается повреждение кожных покровов, фасции, мышц, сосудов и нервов) и минимальный косметический дефект в послеоперационном периоде.
Отделение аутотрансплантата от материнского ложа приемом ручной фиксации мышечных футляров в зоне забора трансплантата, а также постепенными ротационными движениями и тягой в дистальном направлении позволяет атравматично выполнить отслойку надкостницы от трансплантата и извлечь его через имеющийся разрез.
Проведенные патентные исследования по подклассу A 61 В 17/56 и 17/322 и анализ научно-медицинской информации, отражающей существующий уровень технологий взятия аутотрансплантата для костной пластики, не выявили способов, идентичных предлагаемому. Таким образом, предлагаемый способ заготовки костного аутотрансплантата является новым.
Взаимосвязь и взаимодействие существенных приемов предлагаемого способа взятия костного аутотрансплантата для костной пластики обеспечивает достижение нового медицинского результата в решении поставленной задачи, а именно снижение травматизма манипуляции и исключение косметического дефекта в зоне забора трансплантата. Таким образом, предлагаемое техническое решение имеет изобретательский уровень.
Предлагаемый способ взятия аутотрансплантата для костной пластики может быть применен в практическом здравоохранении и не требует исключительных средств для использования.
Сущность предлагаемого способа заключается в следующем.
Из двух небольших разрезов в проекции концов предполагаемого аутотрансплатата выполняют остеотомию, например малоберцовой кости, и отслаивают надкостницу на верхнем и нижнем концах аутотрансплантата. Затем осуществляют ручную фиксацию мышечных футляров конечности в зоне забора трансплантата и постепенно отделяют трансплантат от прилежащих мягких тканей ротационными поворотами, например малоберцовой кости, а продольной тягой в дистальном направлении извлекают аутотрансплантат через имеющееся отверстие. После чего трансплантат помещают интрамедуллярно в область повреждения длинной трубчатой кости.
Предлагаемый способ поясняется клиническим примером.
Больной Т., 12 лет, поступил в клинику 09.03.1999 г.
Диагноз: Фиброзная дисплазия левой нижней конечности, многоплоскостная деформация левой голени (фиг. 3).
Болен с 6 лет. С целью исправления деформации левой голени выполнена операция - клиновидная резекция на вершине деформации левой большеберцовой кости, интрамедуллярная костная пластика свободным аутотрансплантатом, взятым из правой малоберцовой кости, левой большеберцовой кости, чрескостный компрессионный остеосинтез.
Для взятия аутотрансплантата из правой малоберцовой кости выполнены два продольных разреза длиной 2 см по наружной поверхности голени в проекции малоберцовой кости на границе верхней и средней трети, нижней трети, отступив от ростковой зоны. Поднадкостнично выделена поверхность малоберцовой кости на протяжении и выполнена остеотомия на двух уровнях. Затем желобоватым долотом освобождены поднадкостнично от окружающих мягких тканей верхний и нижний концы аутотрансплантата. Осуществлены ручная фиксация мышечных футляров конечности в зоне трансплантата и постепенное его отделение от окружающих тканей ротационными поворотами малоберцовой кости и тягой в дистальном направлении. После чего фрагмент малоберцовой кости, отделенный от надкостницы, извлечен через имеющийся разрез (фиг. 1 и 2). Гемостаз, в футляр из надкостницы помещен трубчатый дренаж и швы на рану. После чего произведен линейный доступ длиной 6 см к левой большеберцовой кости по передней поверхности левой голени в средней трети. Выполнена клиновидная остеотомия на вершине деформации размером 2 x 1 см. Кость порозная, костно-мозговые каналы не прослеживаются. Внутрикостными сверлами сформированы костномозговые каналы и в него помещен взятый трансплантат. Концы отломков диафиксированы спицами. Послойные швы, асептическая повязка. Выполнен чрескостный компрессионный остеосинтез (фиг. 4).
На 7-е сутки после операции пациент начал ходить с помощью костылей с нагрузкой на обе конечности.
Таким образом, предлагаемый "Способ взятия аутотрансплантата для костной пластики" по сравнению с другими известными технологиями позволяет уменьшить травматизм хирургического вмешательства и исключить косметические дефекты в послеоперационном периоде.
Источники информации 1. Мовшович И. А. Оперативная ортопедия (Руководство для врачей)//М.: Медицина, 1974. - С.31.
2. Там же. С. 30-31.
Способ взятия аутотрансплантата для костной аутопластики, включающий выделение сегмента кости с последующей его остеотомией и помещением в зону повреждения кости, отличающийся тем, что выделение сегмента кости выполняют из двух небольших разрезов мягких тканей в проекции концов аутотрансплантата, производят через эти разрезы остеотомию и отслаивание надкостницы на верхнем и нижнем концах трансплантата, затем осуществляют ручную фиксацию мышечных футляров конечности в зоне трансплантата и постепенно отделяют трансплантат от прилежащих мягких тканей ротационными движениями и тягой в дистальном направлении, извлекая аутотрансплантат через имеющийся разрез.
Для каждого метода существуют определенные показания, хотя в одном и том же клиническом случае можно пойти разными путями.
На данный момент на рынке присутствует огромное количество различных костных заменителей, которые используются при аугментациях. Большинство прошли успешные клинические испытания и используются в случаях дефицита костной ткани.
Аутотрансплантаты обеспечивают самый высокий клинический успех, прошли самые долгие клинические исследования, исторически имеют самый большой опыт использования.
Основное отличие при использовании аутотрансплантатов от ксенотрансплантатов — необходимость инвазии.
Именно повышенная инвазивность при заборе аутокости является отрицательным фактором по сравнению с использованием различных костных заменителей.
В данной статье на примере клинического случая хотелось бы показать относительную легкость использования аутотрансплантатов с достаточно невысокой степенью инвазии. Преимущества использования проксимальной части большеберцовой кости (БК) в качестве донорского участка для получения губчатого костного трансплантата были изучены в ряде исследований. Послеоперационный дискомфорт при использовании большеберцовой кости намного меньше, чем при использовании гребня подвздошной кости (ГПК).
Кроме того, при операциях на ГПК в большинстве случаев требуется общая анестезия. Максимально возможный объем губчатого трансплантата из большеберцовой кости больше, чем из передней или задней части ГПК. Кроме того, риск осложнений при использовании ГПК намного выше в связи с возможностью повреждения латеральной ветви подвздошно-подчревного нерва и травмой большой и малой ягодичной мыщцы.
Большая часть БК располагается подкожно, а ее проксимальную часть и мыщелки можно пропальпировать ниже колена.
Бугристость БК находится на переднем крае кости между мыщелками и пальпируется как овальное возвышение. Пальпаторное определение бугристости БК чрезвычайно важно для предупреждения повреждения суставных поверхностей коленного сустава.
В непосредственной близости от медиальной поверхности части БК проходят мелкие ветви медиальных поверхностей нижних коленных артерий, которые проходят под связкой коленной чашечки.
Разберем методику на примере клинического случая.
В клинику обратился пациент с жалобой на отсутствие зубов в области 14, 15. После обследования пациенту назначили план лечения, включающий открытый синус-лифтинг и одновременную имплантацию в области 14, 15 зубов. Забор аутокости будет проводиться из БК по методике Ф. Альфаро.
Обработка операционного поля йодом.
Отступив на 20 мм вниз и на 20 мм медиально от наиболее выступающей точки большеберцовой бугристости, проводят горизонтальную линию длиной 10 мм (рис. 1).
В эту область подкожно вводят 2%-ный раствор артикаина с адреналином (1: 100 000).
По отмеченной линии скальпелем № 10 проводят разрез до кости (рис. 2, 3).
После этого острым распатором отслаивают надкостницу, чтобы открыть доступ для трепана (рис. 4).
В кортикальном веществе с помощью ручного трепана диаметром 8 мм делают отверстие такого же размера. Толщина кортикального слоя — около 5 мм (рис. 5, 6, 7).
Костный трансплантат получают из проксимальной части БК с помощью прямых и изогнутых костных кюрет различного размера (рис. 8, 9).

Рис. 8.
Не следует извлекать кость кюретами, их используют только в качестве скребков для отделения губчатого вещества от кортикального. Костный трансплантат извлекают с помощью ловушки, подключенной к отсосу. Кюреты и костную ловушку используют последовательно столько раз, сколько нужно для получения необходимого объема костного трансплантата.
Рану ушивают в три ряда: надкостницу, подкожную клетчатку, кожу. Для первого и второго рядов используют резорбируемую нить толщиной 4-0, а кожу сшивают непрерывным швом нейлоном толщиной 4-0 (рис. 10—12).
В настоящее время существует большое количество разновидностей костных аугментаций. Могут использоваться материалы различного происхождения, позволяющие достичь высокой клинической успешности. Однако в ряде случаев приходится выбирать методику, по которой будет проводиться данная операция.
Для каждого метода существуют определенные показания, хотя в одном и том же клиническом случае можно пойти разными путями.
На данный момент на рынке присутствует огромное количество различных костных заменителей, которые используются при аугментациях. Большинство прошли успешные клинические испытания и используются в случаях дефицита костной ткани.
Аутотрансплантаты обеспечивают самый высокий клинический успех, прошли самые долгие клинические исследования, исторически имеют самый большой опыт использования.
Основное отличие при использовании аутотрансплантатов от ксенотрансплантатов — необходимость инвазии.
Именно повышенная инвазивность при заборе аутокости является отрицательным фактором по сравнению с использованием различных костных заменителей.
В данной статье на примере клинического случая хотелось бы показать относительную легкость использования аутотрансплантатов с достаточно невысокой степенью инвазии. Преимущества использования проксимальной части большеберцовой кости (БК) в качестве донорского участка для получения губчатого костного трансплантата были изучены в ряде исследований. Послеоперационный дискомфорт при использовании большеберцовой кости намного меньше, чем при использовании гребня подвздошной кости (ГПК).
Кроме того, при операциях на ГПК в большинстве случаев требуется общая анестезия. Максимально возможный объем губчатого трансплантата из большеберцовой кости больше, чем из передней или задней части ГПК. Кроме того, риск осложнений при использовании ГПК намного выше в связи с возможностью повреждения латеральной ветви подвздошно-подчревного нерва и травмой большой и малой ягодичной мыщцы.
Большая часть БК располагается подкожно, а ее проксимальную часть и мыщелки можно пропальпировать ниже колена.
Бугристость БК находится на переднем крае кости между мыщелками и пальпируется как овальное возвышение. Пальпаторное определение бугристости БК чрезвычайно важно для предупреждения повреждения суставных поверхностей коленного сустава.
В непосредственной близости от медиальной поверхности части БК проходят мелкие ветви медиальных поверхностей нижних коленных артерий, которые проходят под связкой коленной чашечки.
Разберем методику на примере клинического случая.
В клинику обратился пациент с жалобой на отсутствие зубов в области 14, 15. После обследования пациенту назначили план лечения, включающий открытый синус-лифтинг и одновременную имплантацию в области 14, 15 зубов. Забор аутокости будет проводиться из БК по методике Ф. Альфаро.
Обработка операционного поля йодом.
Отступив на 20 мм вниз и на 20 мм медиально от наиболее выступающей точки большеберцовой бугристости, проводят горизонтальную линию длиной 10 мм.

В эту область подкожно вводят 2%-ный раствор артикаина с адреналином (1: 100 000).
По отмеченной линии скальпелем № 10 проводят разрез до кости .


После этого острым распатором отслаивают надкостницу, чтобы открыть доступ для трепана.

В кортикальном веществе с помощью ручного трепана диаметром 8 мм делают отверстие такого же размера. Толщина кортикального слоя — около 5 мм.
Костная трансплантация – это особый вид хирургического ортопедического лечения позвоночника и других костей, при котором пациенту в место перелома или же костной патологии вводят различные трансплантаты.

Безболезненная, уникальная методика доктора Бобыря
Дешевле, чем мануальная терапия
Мягко, приятно, нас не боятся дети
Только с 20 по 30 июня! Записывайтесь сейчас!

Такая операция может понадобиться при заполнении полостей в костях после предыдущих хирургических вмешательств, для наружной или внутренней фиксации костей, спондилодеза, стимулирования процесса костеобразования и другого лечения заболеваний опорно-двигательного аппарата.
Помимо этого трансплантаты во время лечения болезней позвоночника могут выполнять и структурную функцию. Например, если при удалении значительной части позвонка или межпозвонкового диска хирург помещает в полость трансплантат необходимого размера, который удерживает позвоночник в нужном положении, пока происходит формирование новой кости. Со временем трансплантат перестраивается и вливается в структуру новообразованной кости.
В настоящее время для ортопедических операций используют 4 вида трансплантатов:
- Аутотрансплантаты – костные материалы, взятые у самого пациента.
- Аллотрансплантаты – костные материалы, взятые у донора-человека.
- Ксенотрансплантаты – костные материалы, взятые у донора-животного.
- Аллопластики – синтетические заменители костных тканей.
В то же время большинство специалистов предпочитают по возможности пользоваться другими типами трансплантатов, так как забор кости из донорской области и постепенное ее восстановление – это вторая хирургическая операция, которая значительно увеличивает реабилитационную нагрузку на организм пациента. Еще одно ограничение на применение аутоматериалов – невозможность получить значительное их количество за относительно малый период времени.
Костные ткани, которые пересаживаются от одного человека другому, называются аллотрансплантаты. Как правило, это кости умерших доноров, которые после извлечения проходят медицинские проверки и стерилизацию. После трансплантации этих материалов организм постепенно превращает донорские костные ткани в свои собственные.
Преимуществом этого типа костных трансплантатов является то, что пациенту нет необходимости в дополнительных хирургических процедурах по извлечению собственных костей, а процент их отторжения очень низок.
К недостатку этих материалов можно отнести небольшую вероятность передачи инфекционного заболевания от донора к реципиенту, например, перенос гепатита и ВИЧ.
Это костные ткани животных, как правило, взятые у крупного рогатого скота, обработанные специальным образом, чтобы сделать их стерильными и совместимыми с костными тканями человека. Со временем ксенонаполнитель заменяется собственными костными тканями пациента.
В качестве животного донора используется также и природный коралл, который после обработки становится биосовместимым и близким по структуре к костной ткани человека.
Преимуществом этого вида трансплантатов считается невозможность передачи инфекционного заболевания от животного к реципиенту.
Разнообразные синтетические заменители костных тканей, полученные химическим путем, которые имитируют естественную кость. Для их производства используют биосовместимые микропористые полимеры, биокерамику, биостекло. Чаще всего применяются аллопласты из фосфата кальция и гидроксиапатита.
Трикальций фосфат – это пористая форма биологического наполнителя, который со временем частично рассасывается и замещается костью. Гидроксиапатит – это минеральный компонент кости, создаваемый синтетически в нескольких вариациях: пористый биодеградируемый, пористый бионедеградируемый и плотный бионедеградируемый.
По направленности действия аллопластики могут быть как биодеградируемыми, так и нет. То есть в первом случае происходит процесс резорбции аллопластического трансплантата и организм замещает его собственной новой костью, а во втором – он используется как решетка или подпорка, облегчающая правильное формирование кости.

По данным литературы, доля заболеваний коленного сустава среди всех случаев дегенеративно-дистрофических заболеваний суставов конечностей составляет от 21,9 до 29%, причем в 86% случаев страдают лица трудоспособного возраста, у которых прогрессирование заболевания в течение 10-15 лет приводит к инвалидности в 6,2-14,6% случаев [1]. Зачастую методом выбора при лечении пациентов с дегенеративно-дистрофическими заболеваниями суставов становится тотальное эндопротезирование. Одной из проблем, которую нужно решить в процессе тотального эндопротезирования сустава, это замещение костных дефектов в ложе эндопротеза. Их доля при заболеваниях коленного сустава составляет от 25 до 31% [2].
Причинами формирования дефектов и, как следствие, грубых деформаций являются:
- асептический некроз мыщелков, который, по данным различных авторов, составляет от 8 до 22% всех дегенеративно-дистрофических заболеваний коленного сустава,
- кистовидная перестройка эпифизов бедренной и большеберцовой костей,
- посттравматическая импрессия суставной поверхности 3.
Существует достаточное количество классификаций костных дефектов при первичном и ревизионном эндопротезировании коленного сустава [7]. Мы используем наиболее удобную, нашедшую широкое клиническое и научное применение классификацию AORI, разработанную G.A. Engh в Anderson Ortopaedic Research Institute (AORI США, 1997) [8]. Классификация основана на дооперационной рентгенологической оценке состояния костей, с помощью предварительно заданных критериев. В соответствии с этой классификацией выделяют четыре типа состояния бедренной или большеберцовой костей:
1 тип – интактная кость;
2А тип – повреждённая губчатая кость, кость противоположного мыщелка остается неизменной;
2В тип – симметричная потеря костной массы с вовлечением обоих мыщелков или плато;
3 тип – повреждение губчатой и кортикальной кости.
Классификация AORI достаточно четко показывает корреляцию наличия и размеров костных дефектов с ростом потребности использовать металлические блоки, клинья и/или структурированные трансплантаты. У данной методики существует лишь один минус. По современным данным, в группах I и IIA дефекты кости до 5 мм в 46% случаев посредством дооперационных рентгенограмм диагностированы не были [9].
При выполнении тотального эндопротезирования коленного сустава (ТЭКС) преследуется основная цель – создание долговременной надежной опоры для компонента эндопротеза. В случае имеющегося костного дефекта она может достигаться такими способами, как:
- резекция по дну дефекта,
- цементная пластика с армированием или без армирования,
- замещение металлическим блоком,
- костная аллопластика 12.
При детальном рассмотрении у каждого метода отмечаются свои преимущества и недостатки. Преимуществом замещения костного дефекта путем выполнения резекции по дну дефекта является простота и быстрота выполнения. Недостатком становится снижение количества ткани большеберцовой кости в дистальном направлении. Не исключена ситуация, что на максимальном вкладыше стабильность сустава не будет достигнута. Кроме того, при возникновении необходимости выполнения реэндопротезирования у этой группы пациентов хирург может столкнуться с такой проблемой, как обширный дефект большеберцовой кости. Таким образом, этот вариант замещения костного дефекта не является методом выбора. Его применение допустимо при неглубоких дефектах [12]. По нашим данным, резекция по дну дефекта выполнена у 5% пациентов с имеющимся костным дефектом.
Замещение костного дефекта путем цементной пластики с армированием или без армирования винтами также отличается простотой и дешевизной. Недостатки метода заключаются в том, что непросто добиться адекватной прессуризации цемента при нарушении целостности кортикальной кости. Изменение объема цемента во время полимеризации может достигать 2%. Неравномерное распределение нагрузки на подлежащую кость при эксцентрически действующих силах может приводить к нарушению прочности фиксации. Этот метод используется для замещения достаточно глубоких дефектов, при условии соблюдения правил прессуризации цемента и планирования вектора нагрузки [12]. По нашим данным, такое замещение выполнено у 82% пациентов с имеющимся костным дефектом.
Преимущество метода замещения костного дефекта путем костной аутопластики заключается в максимальном сохранении костной ткани метаэпифиза. К недостаткам метода относятся: существенные ограничения в выборе размера трансплантата, риск коллапса, если структура трансплантата повреждена патологическим процессом, и риск несращения. Метод применяется при наличии трансплантата с соответствующими характеристиками (размер, плотность). По нашим данным, такое замещение выполнено у 7% пациентов с имеющимся костным дефектом.
Достоинством замещения костного дефекта металлическим блоком или клином следует считать быстрое создание надежной опоры для имплантата, даже в условиях обширных дефектов. К недостаткам метода относятся ограничения по размеру и форме трансплантата, необходимость специальных инструментов и компонентов эндопротеза. Увеличивается общая стоимость имплантата. При наличии специального инструментария и соблюдении правил имплантации метод применим для замещения любых дефектов [12; 13]. По нашим данным, замещение костного дефекта этим методом выполнено у 6% пациентов.
Цель исследования: улучшить результаты первичного эндопротезирования коленного сустава у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI.
Материал и методы. В Новосибирском НИИТО за 2012-2015 годы выполнено 7096 операций первичного эндопротезирования коленных суставов. В 2157 (30,4%) случаях был диагностирован требующий замещения костный дефект как бедренной, так и большеберцовой кости [14].
С целью восстановления биомеханики коленного сустава и создания долговременной надежной опоры для компонентов эндопротеза у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI, нами разработан и внедрен в клиническую практику способ аутопластики большеберцовой кости при первичном эндопротезировании коленного сустава.
Данная методика выполняется соответственно стандартным этапам эндопротезирования, но имеет некоторые особенности: после выполнения резекции суставной поверхности большеберцовой кости определяется остаточный костный дефицит мыщелка большеберцовой кости. По классификации AORI для аутопластики допускается дефицит не больше T2А. При формирования межмыщелкового бокса бедренной кости производится одновременный забор аутокости. Производится обработка костного аутотрансплантата до придания ему правильной геометрической формы (рис. 1).
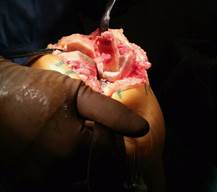
Рис. 1. Забор аутотрансплантата, придание ему правильной геометрической формы
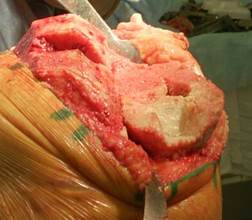
Рис. 2. Обработанный дефект большеберцовой кости со
сформированной опорной площадкой
В последующем аутотрансплантат устанавливается в сформированное ложе и производится импакция до фиксации (рис. 3).
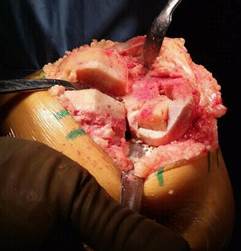
Рис. 3. Импакция аутотрансплантата в сформированном ложе
Дальнейший ход операции соответствует стандартным этапам при первичном эндопротезировании коленного сустава. Восстановительный период не имеет каких-либо особенностей по сравнению со стандартным течением [15].
Клинический пример. Пациент С., 65 лет. Диагноз: левосторонний посттравматический гонартроз 3 степени. Дефект медиального мыщелка левой большеберцовой кости. Варусная деформация левой нижней конечности. Комбинированная контрактура левого коленного сустава. Синдром левосторонней гоналгии (рис. 4).
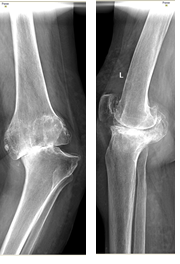
Рис. 4. Рентгенограмма коленного сустава в прямой и боковой проекциях
Пациенту проведено оперативное лечение: эндопротезирование левого коленного сустава с аутопластикой медиального мыщелка большеберцовой кости. Послеоперационный период протекал без особенностей, пациенту была проведена стандартная реабилитация.
На контрольных осмотрах через 6 месяцев, 1 и 2 года после проведенного хирургического лечения пациент отметил хороший результат проведенного лечения, выражающийся в увеличении объема движений в коленном суставе, повышении его стабильности и восстановлении нормальной оси конечности. На контрольной рентгенограмме коленного сустава через 2 года после операции аутотрансплантат состоятелен (рис. 5).
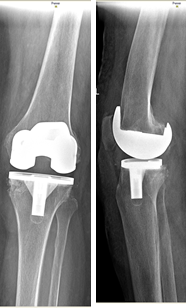
Рис. 5. Контрольная рентгенограмма коленного сустава в прямой и
боковой проекциях через 2 года после операции
Таким образом, у пациентов, имеющих костный дефект большеберцовой кости 2А по AORI, при первичном эндопротезировании коленного сустава выполнение аутопластики по разработанной методике приводит к хорошим результатам, выражающимся в создании долговременной надежной опоры для компонентов эндопротеза, что увеличивает срок его службы за счет нормализации распределения нагрузок в прооперированном коленном суставе.
1. При первичном эндопротезировании коленного сустава максимальное сохранение костной ткани облегчает хирургическую тактику при последующих хирургических вмешательствах, что очень важно у молодых пациентов.
3. Аутопластика должна выполняться при отсутствии противопоказаний.
Читайте также:


