Бактериологическая диагностика раневой инфекции
Еще с детства мы узнаем о том, что такое рана. Маленькие детки сбивают коленки до крови, взрослые могут легко пораниться острыми предметами, люди военных профессий могут получить пулевое ранение. У одних заживает все легко и просто, а у других может начать развиваться инфекция раневая. Что это за инфекция, каковы причины и ее симптомы, как проводится диагностика и в чем состоит особенность лечения, рассмотрим далее.
Описание раневой инфекции
Прежде всего, несколько слов о том, что такое рана. Это нарушение целостности кожного покрова тела в результате внешнего насилия. Раны могут быть:
- Поверхностными.
- Глубокими.
- Проникающими.
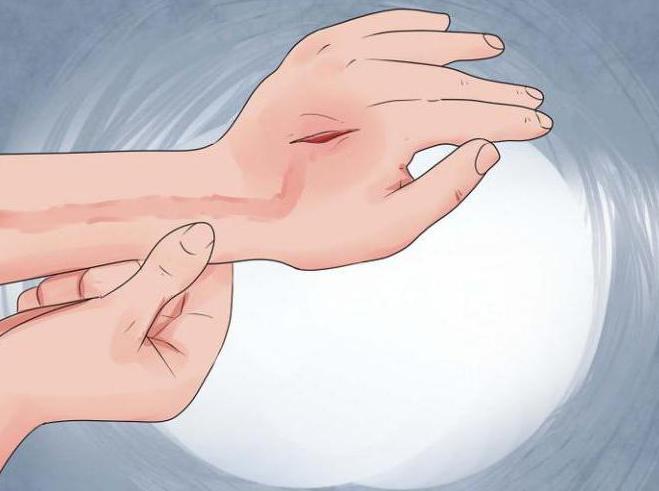
Если случайно появилась на теле рана любого происхождения, кроме тех, что получены в результате хирургического вмешательства, она уже первично загрязнена микробами. Операционные раны считаются асептичными потому, что наносятся на тело стерильными инструментами, в стерильных условиях. Если не соблюдаются правила асептики и антисептики, или на рану не была наложена своевременно стерильная повязка, возможно занесение вторичной инфекции.
На то, насколько случайная рана заражена микробами, влияет несколько факторов:
- Условия, в которых рана получена.
- Характер орудия, которым она нанесена.
Инфекция раневая - это результат развития патогенной микрофлоры в полости раны, то есть происходит осложнение раневого процесса. При случайных ранах инфицирование происходит в результате первичного загрязнения, этому способствует несвоевременное наложение стерильной повязки или неправильная обработка раны. Что касается хирургических ран, инфицирование здесь, как правило, вторичное, из–за ослабленного состояния организма больного, или внутрибольничное инфицирование.
Возбудители раневой инфекции
Самый распространенный возбудитель инфекции раневой - стафилококк.
Гораздо реже встречаются:
Виды раневой инфекции
В зависимости от того, какие микробы попадают в рану и как развивается процесс, раневая инфекция бывает следующих видов:
- Гнойная раневая инфекция. Возбудителями ее являются стафилококки, кишечная палочка, стрептококки и многие другие. Микробы такого вида находятся в воздухе, в гное, на предметах. При попадании в организм и при условии наличия там благоприятной среды может развиться острое гнойное заболевание. Заражение раневой поверхности такими бактериями приведет не только к нагноению, но и будет способствовать распространению инфекции дальше.
- Анаэробная раневая инфекция. Возбудителями являются микробы столбняка, гангрены, злокачественного отека, бациллы. Место нахождения таких возбудителей - это, прежде всего, земля, особенно удобренная навозом. Поэтому частички почвы в ране являются самыми опасными, так как возможно развитие анаэробной инфекции.
- Специфическая инфекция. Возбудителями становятся палочка Леффера и гемолитический стрептококк. Такая инфекция может быть занесена со слизью, слюной, из воздуха, из тканей, соприкасающихся с раной, при разговоре, воздушно-капельным путем.
- Эндогенная инфекция. Микробы, находящиеся в самом организме пациента, могут попасть в рану при оперативном вмешательстве или после него. Распространяется инфекция по кровеносным сосудам. Хирургические раневые инфекции можно предотвратить. Необходимо правильно обработать кожные покровы антисептическими растворами, а также руки и инструмент перед оперативным вмешательством.
Классификация раневой инфекции
Помимо того, какой возбудитель спровоцировал раневую инфекцию, выделяют еще и несколько ее форм. Инфекция раневая может быть общей формы и местной. Первая является наиболее тяжелой. Развивается сепсис, он может быть как с метастазами, так и без. Опасность летального исхода очень велика. А к местным формам относят:
- Инфицирование раны. Имеется четкая граница между живой и поврежденной тканью. Причина - низкая сопротивляемость инфекциям.
- Абсцесс околораневый. Имеет капсулу, которая соединена с раной и отделяется от здоровых тканей.
- Флегмона. Инфекция выходит за пределы раны и имеет свойства распространяться.
- Гнойный затек. Развивается как следствие плохого дренажа. Гной собирается и распространяется в тканях.
- Свищи. Поверхность раны уже затянута, а внутри остался инфекционный очаг.
- Тромбофлебит. Инфекция распространяется на тромб, как осложнение далее переходит на вены.
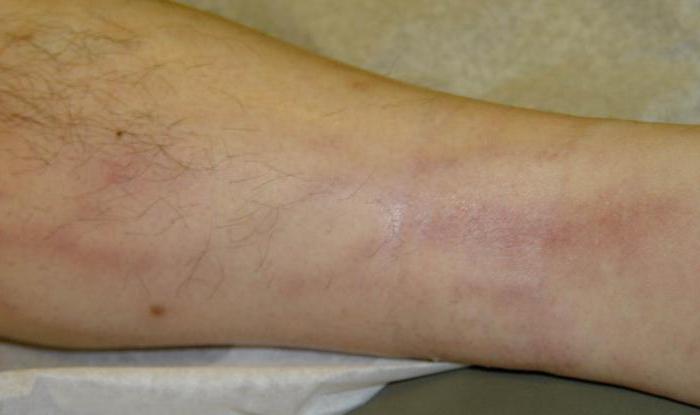
Стоит знать: чтобы инфекция появилась и смогла развиваться, необходима благоприятная среда и много других факторов. Об этом поговорим далее.
Причины раневой инфекции
Существует несколько факторов, которые могут поспособствовать развитию инфекционного процесса в ране:
- Нарушение и несоблюдение норм асептической обработки раны.
- Нестерильный перевязочный материал.
- Отсутствие оттока из раны.
- Особенность хирургического вмешательства на полых органах, например толстом кишечнике.
- Наличие хронических инфекций в организме (тонзиллит, пиелонефрит, больные зубы).
- Степень загрязнения раны.
- Количество поврежденных тканей.
- Иммунный статус организма.
- Наличие инородных тел в ране, сгустков крови, некротических тканей.
- Большая глубина повреждения.
- Плохое кровоснабжение поврежденных тканей.
- Наличие таких заболеваний, как сахарный диабет, цирроз, лейкемия, ожирение, злокачественные образования.
Инфекция раневая начинает активизироваться в том случае, если количество микробов в ране начинает превышать критический уровень - это 100 тысяч микроорганизмов на 1 мм ткани. Это показатель для здорового человека, если же человек болен, то уровень критический может быть гораздо ниже.
Каковы симптомы раневой инфекции?
Как распознать, что инфекция раневая имеет место? Вот несколько симптомов ее проявления:
- Повышение температуры тела.
- Покраснение участка кожи вокруг раны.
- При пальпации вокруг раны возникает ощущение боли.
- Отек.

Наличие таких признаков и симптомов всегда говорит о том, что анаэробная раневая инфекция имеется. Развиться она может на 3-7 день после получения раны. Для того чтобы назначить эффективное лечение, необходимо провести диагностику.
Диагностика раневой инфекции
Конечно же, даже визуально видно по внешнему виду, выделениям, запаху, что инфекция раневая прогрессирует. Но для того чтобы назначить эффективное лечение, необходимо установить, какие бактерии вызвали инфекционный процесс. Для этого необходимо взять мазок из раны. При этом надо придерживаться нескольких правил:
- Материал необходимо брать из глубоких участков раны в достаточном количестве.
- Его берут до того, как начинают применять антибиотики.
- В лабораторию материал необходимо доставить в течение 2 часов.
После проведения исследований и выявления бактерий назначают лечение. Об этом далее.
Как лечат раневую инфекцию
Очень важно не оставлять без терапии раневые инфекции. Лечение таких патологий состоит в хирургическом вмешательстве и в назначении эффективных противомикробных препаратов. Возможно также назначение обезболивающих лекарственных средств.
Хирургическое вмешательство - это:
- Широкое вскрытие инфицированной раны.
- Тщательное промывание и санация раневой полости.
- Иссечение мертвых тканей.
- Дренаж гнойных участков.
Далее требуется регулярная обработка раны антисептиками.
Антибиотики назначает врач с учетом специфики заболеваний, чувствительности к установленным бактериям, взаимодействия их с другими препаратами, а также влияния лекарства на организм пациента.
Применять антисептики для промывания ран также необходимо с особой осторожностью, так как раствор всасывается и при непереносимости может вызвать осложнения. Они не должны вызывать болевых ощущений. Необходимо следить за реакцией организма на длительное использование антисептиков. В некоторых случаях замедляется процесс заживления.
Будьте внимательны: самолечение может усугубить состояние вашего здоровья!
Для лучшего заживания раны рекомендуется укреплять и стимулировать иммунитет и защищать пораженный участок от случайных повреждений.
Профилактические мероприятия
Профилактика раневой инфекции заключается в следующем:
- Повышение активности иммунитета, защитных функций организма.
- Соблюдение осторожности с целью исключения получения травм.
- Незамедлительная обработка раны антисептиком и наложение стерильной повязки.

Столбняк - осложнение раневого процесса
Возбудителем столбняка является анаэробная спороносная палочка. Она легко проникает через любые кожные повреждения и поврежденную слизистую. Опасность состоит в том, что поражает она нервную систему.
В нашей стране положено делать профилактические прививки против столбняка. Если даже пациент перенес это заболевание, иммунитет к нему не вырабатывается - периодически необходима вакцинация.
Для профилактики столбняка пациентам с большими повреждениями тканей вводят противостолбнячный иммуноглобулин или сыворотку.
Профилактическая прививка от столбняка дает гарантию того, что при повреждении кожных покровов человек не заболеет столбняком.
Берегите себя, укрепляйте иммунитет и не получайте раны. И раневая инфекция никогда вас не потревожит.
Все УПМ могут вести к развитию раневой инфекции, особенно на фоне иммунокомп-ромиссного организма. В настоящее время ведущая роль в этиологии раневой инфекции принадлежит стафилококкам, энтеробактери-ям и неферментирующим грамотрицательным палочкам (псевдомонады и др.), увеличивается значение неспорообразующих анаэробных бактерий, грибов.
Раневое отделяемое берут стерильными ватными тампонами из глубины раны до обработки ее антисептическими растворами. Тампоны срочно направляют в бактериологическую лабораторию. При наличии в ране дренажа отделяемое берут стерильным шприцем, из которого оно переносится с соблюдением правил асептики в стерильную пробирку или анаэробный транспортный флакон. Удаляемые при обработке раны кусочки тканей отправляют в лабораторию в стерильных чашках Петри.
Посев раневого отделяемого с тампона производят на питательные среды в следующем порядке: кровяной агар; сахарный бульон; среда для анаэробов.
Жидкие пробы засевают на плотную среду петлей. Предпочтительнее производить посев по 0,1 мл разведенной до 10"' и неразведенной пробы, растирая материал по поверхности питательной среды шпателем. В жидкие питательные среды посев производят пастеровской пипеткой. При посеве на анаэробы пипетку с исследуемым материалом опускают на дно пробирки, не допуская попадания пузырьков воздуха в среду.
Кусочки тканей режут стерильными ножницами, взвешивают в стерильной чашке Петри и измельчают в стерильной ступке с бульоном из расчета 1 мл бульона на 1 г ткани. Затем готовят десятикратные разведения взвеси до 10 3 . По 0,1 мл каждого разведения засевают на кровяной агар.
Подсчет КОЕ/г ткани производят с учетом числа выросших колоний и сделанных разведений.
Посевы инкубируют аэробно и анаэробно при температуре 37 "С и ежедневно просматривают. При появлении роста на плотной среде изучают культуральные свойства. Делается количественная оценка роста. В случае выявления колоний различного вида подсчитывают число колоний каждого вида. При этом выявляют ведущий вид в ассоциации. По 2—3 колонии каждого типа отсевают на соответствующие питательные среды для дальнейшей идентификации.
При проявлении роста в жидких питательных средах готовят мазки для окраски по Граму; с сахарного бульона производят высев на кровяной агар, среду Эндо, молочно-со-левой агар. Отрицательный результат исследования выдают через 7 суток при отсутствии роста на всех питательных средах.
Для приготовления мазков отделяемого ран используют тампоны, которыми забирают и переносят материал на стекло. Мазки окрашивают по Граму. При микроскопии мазков отмечают морфологию и количество микробов. Выделяемые при это особенности могут внести коррекцию в ход исследования — использование дополнительных питательных сред.
Экссудат берут, соблюдая правила асептики, пункцией полостей и отсасывают содержимое с помощью шприца. Из шприца материал переносят у пламени газовой горелки в стерильный анаэробный транспортный флакон и отправляют в лабораторию.
В лаборатории прозрачную жидкость центрифугируют 15—20 мин при 3000 об/мин и осадок используют для посева и приготовления мазков. При гнойном характере экссудата готовят тонкие мазки для микроскопии без предварительного центрифугирования. Посев проб производят на кровяной агар, сахарный бульон, среду для анаэробов. Кроме того, используют специальные питательные среды в зависимости от особенностей источника выпота. Плевральный выпот чаще всего наблюдается у больных с туберкулезом легких, поэтому после центрифугирования
осадок дополнительно засевают на среды для культивирования туберкулезной палочки или заражают патологическим материалом морскую свинку. При эмпиемах частым возбудителем может быть пневмококк, стрептококк группы А, стафилококк, анаэробы, а следовательно, необходимо сделать посев на соответствующие элективные питательные среды. При исследовании синовиальной жидкости следует использовать питательные среды для выделения гонококков.
Интерпретация полученных данных обычно не представляет трудности, так как при условии соблюдения правил асептики во время взятия материала из закрытых полостей и из глубины гнойных ран выделенные микробы являются возбудителями данного гнойно-воспалительного процесса.
При выделении ассоциаций микробов из раневого отделяемого ведущее значение в течении раневого процесса следует отдавать видам, количественно преобладающим в данном микробиоценозе. Уровень обсеменен-ности тканей в ране, равный 10 5 КОЕ/г, является критическим. Превышение этого уровня указывает на большую вероятность развития гнойной инфекции и возможность генерализации процесса. При обсмененности менее 10 5 КОЕ/г ткани раны заживают без явлений нагноения.
Дата добавления: 2016-02-04 ; просмотров: 960 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Раневую анаэробную инфекцию у человека вызывают как спорообразующие анаэробные бактерии (Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum), так и неспорообразующие анаэробные микроорганизмы родов Bacteroides, Peptococcus, Peptostreptococcus, Veilonella и др.
Методы микробиологических исследований при анаэробной инфекции представлены в схеме 3.
Бактериоскопический метод. Проводится микроскопия окрашенных по Граму, Цилю-Нильсену и Гинсу-Бурри мазков, приготовленных из раневого отделяемого, отечной жидкости, некротизированной ткани. Обнаружение в препаратах крупных прямых грамположительных палочек, образующих капсулы и центрально или субтерминально расположенные споры (рис. 3), дает основание поставить предварительный диагноз газовой гангрены. Для экспресс-диагностики применяют прямой метод иммунофлюоресценции.
Бактериологический метод.Производят посев исследуемого материалана среды Цейсслера (анаэробный кровяной МПА), Китт-Тароцци, железо-сульфитный агар (ЖСА) и молоко. В молоке через 3-4 часа образуется губкообразный сгусток, погруженный в прозрачную жидкость. На среде Китт-Тароцци через сутки регистрируется помутнение и образование газа, на ЖCA - черные колонии в глубине агарового столбика, на среде Цейсслера – шероховатые (реже – гладкие), крупные, плоские сероватые колонии с зоной гемолиза. В глубине плотных питательных сред образуются колонии в виде чечевичек, дисков, комочков ваты и т.д. В мазках из колоний обнаруживают крупные грамположительные палочки (рис. 5). Для выделения чистой культуры возбудителей газовой гангрены типичные колонии пересевают на среду Китт-Тароцци и идентифицируют до вида в соответствии с таблицами 4 и 5.
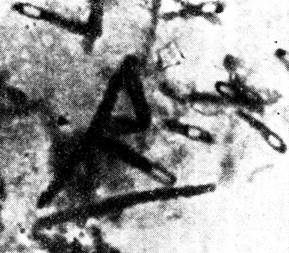 | 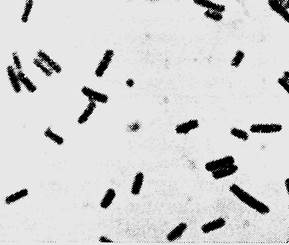 |
| Рис. 4. Возбудитель газовой гангрены (Clostridium perfringens) в материале от больного. Окраскапо Граму. х 900 | Рис. 5. Возбудитель газовой гангрены. Чистая суточная культура Clostridium perfringens. Окраскапо Граму. х 900 |
Таблица 4. Биологические свойства неспорообразующих и спорообразующих анаэробов
| Свойства | Бактерии | ||||||||
| Peptococcus | Peptostreptococcus | Veilonella | Bacteroides | C.perfringens | C.novy | C.septicum | C.sordelli | C.histolyticum | |
| Морфология | кокки | кокки | кокки | палочки | палочки | палочки | палочки | палочки | палочки |
| Подвижность | - | - | - | ± | - | + | + | + | + |
| Споры | - | - | - | - | + | + | + | + | + |
| Окраска по Граму | + | + | - | - | + | + | + | + | + |
| Ферментация углеводов | + | + | - | + | + | + | + | + | - |
| Свертывание молока | - | - | + | + | + | v | - | + | + |
| Продукция H2S | + | - | + | ± | - | - | - | v | v |
| Продукция индола | - | - | - | ± | - | - | - | - | - |
| Разжижение желатины | - | - | - | ± | + | + | + | + | + |
| Редукция нитратов | ± | - | + | ± | ± | ± | ± | - | - |
| Гемолиз эритроцитов | - | - | ± | + | + | + | + | + | |
| Образование токсина | - | - | - | - | + | + | + | + | + |
Обозначения:(+) - постоянный признак, (±) - непостоянный признак, (-) – отсутствие признака, V- вариабельный признак
Таблица 5.Биологические свойства основных возбудителей газовой гангрены и столбняка
| Виды клостридий | Капсула | Подвижность | Лецитиназа | Индол | Ферментация | ||
| лактозы | сахарозы | маннита | |||||
| Clostridium perfringens | + | - | + | - | + | + | + |
| Clostridium Novy | - | + | + | - | - | - | - |
| Clostridium septicum | - | + | _ | - | + | - | - |
| Clostridium Tetani | - | + | _ | + | - | - | - |
Обозначения:(+) - постоянный признак, (-) – отсутствие признака,
Определение лецитиназной активности. Положительная реакция на лецитиназу проявляется в виде помутнения взвеси лецитина. При отрицательной реакции, которая наблюдается при нейтрализации фермента соответствующей антисывороткой, жидкость остается прозрачной.
Окончательную идентификацию выделенных клостридий газовой гангрены проводят с помощью биопробы (см. ниже) путем постановки реакции нейтрализации с поливалентными и моновалентными сыворотками для выявления и типирования экзотоксинов клостридий.
Биопроба. Смесь исследуемого материала с моновалентными антитоксическими сыворотками против различных видов клостридий вводят подкожно морским свинкам. Контролем служит морская свинка, которой вводят исследуемый материал без сывороток. При наличии токсина контрольная морская свинка погибает через 30 минут – 4 часа после инъекции материала. В опытах нейтрализации токсина антитоксическими сыворотками выживает одна морская свинка, при этом вид сыворотки соответствует виду токсина.
Не нашли то, что искали? Воспользуйтесь поиском:
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из очага, кровь — при сепсисе.
МЕТОДЫДИАГНОСТИКИ:
Бактериоскопическое исследование(см. схему 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах бактерий позволяет поставить ориентировочный диагноз и наметить план дальнейшего исследования.
Бактериологическое исследование.Посевы производят на элективные обогатительные среды для анаэробов (среда Китта—Та-роцци, тиогликолевый бульон или полужидкий тиогликолевый агар), содержащие специальные добавки (гемин, витамин К и др.), и инкубируют при 37 °С втечение 24—48 ч. После просмотра выросшей культуры делают мазки, окрашивают их по методу Грама и микроскопируют. Бактериоскопия дает возможность установить однородность или неоднородность куль-
туры, а по морфологии клеток и тинкториальным свойствам ориентировочно отнести ее к определенному роду. Для получения чистой культуры делают пересевы на плотные среды в чашки Петри и инкубируют в анаэробных условиях 3—4 сут до формирования изолированных колоний. После изучения колоний их пересевают на элективные среды. Идентификацию выделенной чистой культуры производят на основании присущих ей дифференциальных признаков, которые определяют также в строго анаэробных условиях (табл. 12.2.1).
Таблица 12.2.1. Дифференциальные признаки неспорообразующих и спорообразующих анаэробных бактерий
| Признак | Бактерии | |||||||
| Рер- | Рер- | Veil- | Вас- | C.per- | C.no- | C.se- | C.so- | C.hi- |
| to- | tost- | lone l- | teroi- | frin- | vy | pti- | rdel- | stoty- |
| сос- CUS | repto-сос-cus | la | des | gens | cum | li | ticum |

Условные обозначения: (+) — наличие признака; (—) — отсутствие признака; х — непостоянный признак; (+) — отсутствие признака у большинства штаммов; (±) — наличие признака у большинства штаммов; с — слабая ферментация.
 |
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Биохимические имолекулярно-биологические исследования. Анаэробные бактерии вырабатывают специфические метаболиты, включая летучие жирные кислоты с короткой цепью, спирты и нелетучие органические кислоты. Для их обнаружения в материале от больного используют ГЖХ (см. главу 11).
• Микробиологическая диагностика раневой анаэробной кло-стридиалъной инфекции — газовая гангрена (схема 12.2.1).
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: раневое отделяемое, отечная жидкость, кусочки мышечной ткани, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. Кровь — при сепсисе.
Бактериоскопическое исследование.Проводят путем микроскопии мазков, приготовленных из отечной жидкости или некротизированной ткани. Наличие в препаратах крупных (1—1,5x3—10 мкм) грамположительных палочек, некоторые из которых (C.perfringens) образуют макрокапсулу (рис. 12.2.1; на вклейке), позволяет поставить предварительный диагноз.
Бактериологическое исследование.Исследуемый материал вносят в несколько пробирок со средой Китта—Тароцци, железо-сульфитным агаром (среда Вильсона—Блера) и молоком. Часть пробирок прогревают при 80 "С в течение 30 мин для уничтожения неспорообразующих бактерий. Посевы инкубируют в обычном термостате при 37 "С. C.perfringens растет в глубине среды. В молоке уже через 3—4 ч посева образуется губкооб-разный сгусток, содержащий пузырьки газа и отделившуюся прозрачную жидкость. Через сутки на среде Китта—Тароцци отмечается помутнение и газообразование, а на железосуль-фитном агаре несколько позднее появляются черные колонии в глубине агарового столбика. Для получения культур других видов клостридий требуются более строгие анаэробные условия. Из всех посевов делают мазки, окрашивают их по методу Грама и микроскопируют. При положительном результате обнаруживаются крупные грамположительные палочки.
Для получения чистой культуры делают пересевы на сахарный кровяной агар в чашки Петри и инкубируют в строго анаэробных условиях при 37 °С в течение 3—4 дней. Выросшие колонии пересевают в пробирки со средой Китта—Тароцци. Идентификацию чистой культуры производят на основании признаков, перечисленных в табл. 12.2.1. Идентификация по биохимическим признакам осуществляется традиционными методами или с помощью тест-систем для определения специфических бактериальных ферментов или метаболитов.



Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Иммунохимические исследования. Лецитиназная проба: для быстрого обнаружения и серологической идентификации а-токсина клостридий в раневом отделяемом определяют его лецитиназ-ную активность в реакции нейтрализации (РН) с моновалентными антисыворотками против токсинов клостридий разных видов (табл. 12.2.2). С этой целью исследуемый материал (раневое отделяемое) помещают в пробирки с раствором лецитина и добавляют антисыворотки. Присутствие лецитиназы в раневом отделяемом выявляется помутнением жидкости в пробирке. При нейтрализации лецитиназной активности токсина соответствующей антисывороткой жидкость остается прозрачной.
Таблица 12.2.2. Постановка лецитиназной пробы для определения и идентификации токсиновклостридий в РН (форма протокола)
| Реагент | Количество реагента, мл | ||
| пробирка | пробирка | пробирка | пробирка |
| Исследуемый материал 0,3 | 0,3 0,3 0,3 | ||
| Лецитин 0,1 | 0,1 0,1 - | ||
| Раствор хлорида натрия 0,1 | 0,2 | ||
| Сыворотка анти- C.perfringens — | 0,1 | ||
| Сыворотка анти- С.novy — | 0,1 | ||
| Инкубация при 37 "С в течение 46—60 мин | |||
| Учет результатов (наличие | |||
| помутнения) |
Примечание. При учете результатов используют обозначения: (+) — наличие помутнения; (—) — отсутствие помутнения.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
ГЖХ используют для обнаружения в материале от больного специфических метаболитов клостридий, включая летучие жирные кислоты с короткой цепью, спирты и нелетучие органические кислоты (см. главу 11).
Биопроба.Для серологической идентификации токсинов также можно использовать биопробу. Проводят РН токсина на лабораторных животных. С этой целью смесь исследуемого токсина с моновалентными антитоксическими сыворотками (к токсинам C.perfringens или других видов клостридий) вводят подкожно морской свинке. В случае нейтрализации токсина животное выживает; при отрицательной реакции морская свинка погибает через 30 мин — 4ч после инъекции.
• Микробиологическая диагностика столбняка (см. схему 12.2.1)
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кусочки ткани вокруг предполагаемых входных ворот инфекции, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. При подозрении на столбняк у женщин после родов или аборта — выделения из матки, у новорожденных — выделения из пупочной раны.
Бактериологическое исследование. Материал засевают в среду Китта—Тароцци и инкубируют в анаэробных условиях при 37 °С в течение 3—4 сут, наблюдая придонный рост бактерий. Затем делают посевы на сахарный агар в чашки Петри, в столбик сахарного питательного агара впробирке. Посевы также инкубируют в анаэробных условиях. На поверхности кровяного агара C.tetani образует нежные прозрачные колонии, окруженные малозаметной зоной гемолиза. Для получения чистой культуры подозрительные колонии пересевают в пробирки со средой Китта—Тароцци исохраняют их под слоем вазелинового масла или в эксикаторе, заполненном смесью инертных газов. Для определения способности выделенной чистой культуры к образованию столбнячного токсина (токси-генности) используют серологические реакции (преципитации в геле и др.) с антителами к тетаноспазмину. Бактериологический метод используют в качестве дополнительного метода для подтверждения диагноза, поскольку он не дает своевременного результата.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Иммунохимические исследования. Токсин в материале может быть обнаружен с помощью серологических реакций in vitro (ИФА и др.). Метод позволяет получить ответ в течение нескольких часов и обеспечивает своевременную диагностику заболевания.
Биопроба.Проводят для обнаружения столбнячного токсина в исследуемом материале. С этой целью материал растирают встерильной ступке с песком, заливают изотоническим раствором хлорида натрия для экстрагирования токсина и фильтруют через бумажный фильтр. Фильтрат вводят внутримышечно белым мышам. Животным контрольной группы вводят смесь фильтрата с антитоксической сывороткой. Через 1—2 сут у мышей появляется ригидность мышц хвоста и задних конечностей. В результате резкого сокращения хвостовых мышц хвост поднимается в виде дуги. Затем подопытные животные погибают. У животных в контрольной группе признаки инток-

сикации отсутствуют вследствие нейтрализации токсина антисывороткой. В настоящее время биопроба практически не применяется.
• Диагностические, профилактические и лечебные препараты
Антитоксические противогангренозные сыворотки— моновалентные(антиперфрингенс, антиэдематиенс — антинови, анти-септикум и др.) и поливалентная.Сыворотки получают путем иммунизации лошадей соответствующими анатоксинами, с последующей очисткой и концентрацией методом ферментативного гидролиза (диаферм-3). Препараты выпускаются в жидком и сухом виде. Применяют для экстренной пассивной профилактики и специфической иммунотерапии газовой гангрены.
Адсорбированный столбнячный анатоксин.Получен путем обезвреживания формалином столбнячного токсина с последующей его очисткой, концентрацией и адсорбцией на гидрате оксида алюминия. Входит в состав ассоциированной коклюш-но-дифтерийно-столбнячной вакцины и других препаратов. Применяют для активной иммунизации против столбняка.
Противостолбнячная сыворотка.Получена из крови лошадей, гипериммунизированных столбнячным анатоксином. Очищена и концентрирована методом диаферм-3. Активность измеряется в международных единицах. Применяют для экстренной пассивной профилактики и лечения столбняка.
Иммуноглобулинчеловеческий противостолбнячный.Получен из гамма-глобулиновой фракции крови доноров, ревакциниро-ванных очищенным адсорбированным столбнячным анатоксином. Применяют для экстренной пассивной профилактики и лечения столбняка.
Антибиотики.Грамположительные бактерии — р-лактамные антибиотики, ванкомицин, тетрациклины, макро-лиды, линкомицины, метронидазол.
Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, тетрациклины, сульфаниламиды, метронидазол.
Аминогликозиды и фторхинолоны, как правило, не активны по отношению к анаэробным микробам.
Читайте также:


