Биологическая терапия ревматических заболеваний
Председатели:
- главный терапевт Комитета по здравоохранению Правительства Санкт-Петербурга член-корр. РАМН, проф. В.И. Мазуров.
- главный ревматолог Комитета по здравоохранению Правительства Санкт-Петербурга проф. А.М. Лила.
В настоящие время согласно статистическим данным патология суставов, сухожильно-связочного аппарата и позвоночника по частоте находится на 3 месте после заболеваний органов кровообращения и дыхания. В структуре первичной инвалидности она занимает 2 место, а по временной нетрудоспособности находятся на 1 месте среди болезней внутренних органов. Наиболее распространенным в структуре воспалительных ревматических заболеваний является ревматоидный артрит, частота которого по данным ВОЗ колеблется от 0,4 до 1%. Известно, что в северных районах он встречается чаще, чем в других регионах страны, в том числе в Санкт-Петербурге, что связано с демографическими факторами. Согласно имеющимся данным более 50% пациентов, страдающих данной патологией, становятся инвалидами в течение первых 5 лет болезни. К менее распространенным ревматическим заболеваниям относятся псориатический артрит и болезнь Бехтерева (анкилозирующий спондилоартрит), однако, в последние годы отмечается тенденция к увеличению заболеваемости и более агрессивному их течению.
По данным большинства авторов, псориатический артрит развивается у 10-25% больных псориазом. Распространенность анкилозирующего спондилоартрита в разных странах составляет 0,5-2%. Этим заболеванием страдают преимущественно мужчины в возрасте 15-30 лет.
Нередко в практической работе терапевта и гастроэнтеролога встречаются язвенный колит и болезнь Крона. К сожалению, следует отметить, что системная красная волчанка и системные васкулиты за последние годы все чаще стали приобретать агрессивное течение, нередко уже на начальных этапах ведут к инвалидизации больных.
В практике ревматолога появились инновационные технологии ранней диагностики ревматической патологии, в том числе иммунологические методы (определение волчаночных клеток, ревматоидных факторов и других специфических маркеров ряда ревматических заболеваний), рентгенологические (магнитно-резонансная томография и компьютерная томография), ультразвуковое исследование суставов. Сложнее дела обстоят с системными васкулитами и системной красной волчанкой, при которых, помимо иммунологических методов диагностики, требуется достаточно часто проведение биопсии почки или кожи и мышцы с иммуногистохимических анализом.
Больные ревматическими заболеваниями требуют длительной терапии болезнь-модифицирующими (базисным) средствами, назначение которых позволяет снизить клиническую активность, затормозить развитие деструктивных изменений в суставах и, тем самым, улучшить прогноз течения данного заболевания. В лечении также применяются гормональные и обезболивающие нестероидные противовоспалительные препараты, экстракорпоральные методы лечения и др. Методы интенсификации с использованием вариантов высокодозной пульс-терапии и применение базисных препаратов дают хороший эффект, но у 30% больных, к сожалению, являются малоэффективными и в дальнейшем следует ожидать увеличения активности заболевания.
Позитивные изменения в лечении ревматических заболеваний в нашей стране произошли в 2001 году, с внедрением в клиническую практику биологических генно-инженерных препаратов, в частности, инфликсимаба. В последующие годы нашли свое применение и другие биологические препараты: адалимумаб и ритуксимаб. Указанные препараты влияют на различные звенья воспалительного процесса, блокируя фактор некроза опухоли-альфа или взаимодействуя с клеточными рецепторами В-лимфоцитов, вызывая подавление иммуновоспалительного процесса и, следовательно, снижая активность заболевания.
Применение биологических генно-инженерных препаратов возможно только под контролем врача в специализированных учреждениях. Для осуществления контроля за лечением, оценки безопасности терапии, осуществления взаимодействия и решения вопросов об обеспечении льготных категорий граждан 20 апреля 2006 года решением Комитета по здравоохранению администрации Санкт-Петербурга на базе Санкт-Петербургской медицинской академии последипломного образования создан Центр терапии генно-инженерными биологическим препаратами (Центр терапии ГИБП). За 5 лет существования более 1000 ревматических больных консультированы специалистами центра, а более 200 больных после уже получают лечение этими препаратами в условиях центра.
Все больные Центра терапии ГИБП состоят в Регистре центра и получают препарат бесплатно по согласованию с Комитетом по здравоохранению администрации Санкт-Петербурга. Центр является связующим звеном в подготовке специалистов для работы в других центрах терапии ГИБП России и Северо-Западного Федерального округа согласно программе, утвержденной президиумом Ассоциации ревматологов России.
Большое значение для специалистов, занимающихся самыми передовыми методами терапии имеет опыт международного сотрудничества. За 5 лет работы Центра терапии ГИБП, ревматологи участвовали в образовательных программах зарубежных центров, которые имеют опыт ведения тысяч больных с иммуновоспалительными заболеваниями. Впервые в России, 1 июля 2011 г., в Центре терапии ГИБП Санкт-Петербурга проводится Clinical Observation Program - образовательная программа для зарубежных врачей, которым интересен опыт российских ревматологов по лечению ревматологических больных с применением современных методов лечения - генно-инженерных биологических препаратов.
Clinical Observation Program - клиническая образовательная программа. Это образовательная инициатива, в ходе которой в течение 1-2 дней обсуждаются наиболее актуальные проблемы современной ревматологии, приводятся примеры наиболее успешных или уникальных диагностических или терапевтических методик той базы, на которой проходит мероприятие. Неотъемлемой частью клинической образовательной программы является практическая часть, во время которой обсуждаются конкретные клинические случаи, сложные диагностические ситуации, вопросы тактики на клинических примерах.
Это стало возможным благодаря успешной 5-летней работе Санкт-Петербургских ревматологов под руководством члена-корреспондента РАМН, профессора В.И. Мазурова, проректора по клинической работе СПб МАПО и главного терапевта Комитета по здравоохранению правительства Санкт-Петербурга.
В Центре терапии ГИБП накоплен весомый научный и клинический опыт, включающий мониторинг эффективности и безопасности самых современных препаратов, применяемых в ревматологии, определены четкие критерии отбора пациентов на такую терапию, а также используются современные подходы для ранней диагностики ревматических заболеваний.
Впервые в России, Центр терапии ГИБП будет демонстрировать свой клинический и научный опыт ревматологам из 13 стран: восточной Европы, ближнего востока и стран СНГ. Специально подготовлена научная образовательная программа, в которой примут участие проректор по учебной работе СПб МАПО Лила А.М., профессор кафедры СПб МАПО Беляева И.Б. и заведующий ревматологическим отделением ФГУ "Центр крови сердца и эндокринологии им. Алмазова " Маслянский А.Л. , руководитель Центра терапии ГИБП СПб МАПО - Долгих С.В.
Начальник отдела по связям с общественностью СПбМАПО
Пустарнакова О.Ю.
За последние десятилетия в ревматологии произошли существенные изменения, которые связанны с активным внедрением в клиническую практику генно–инженерных биологических препаратов (ГИБП). Их действие направлено на специфические компоненты механизма развития ревматических заболеваний. Ревматологи Юсуповской больницы применяют ГИБП препараты, зарегистрированные в РФ.
Лечение назначают после комплексного обследования пациентов с помощью новейшей аппаратуры ведущих мировых производителей и точных методов лабораторной диагностики. Тяжёлые случаи заболеваний обсуждают на заседании Экспертного Совета. Доктора и кандидаты медицинских наук, врачи высшей категории коллегиально вырабатывают тактику ведения каждого пациента.
Для лечения аутоиммунных заболеваний, особенно ревматоидного артрита ревматологи применяют генно-инженерные биологические препараты (ГИБП). Они представляют собой моноклональные антитела и рекомбинантные белковые молекулы, которые подавляют активность важнейших факторов, которые принимают участие в развитии аутоиммунного воспалительного процесса. В настоящее время список ГИБП пополнил новый точечный ингибитор киназы (ингибитор JAK-киназы). Врачи Юсуповской больницы применяют генно-инженерные биологические препараты в ревматологии. Цена препаратов высокая, но они обладают высокой эффективностью.

Классификация
Генно-инженерные биологические препараты представлены следующими лекарственными средствами:
- Ингибиторами фактора некроза опухоли-альфа (ФНО-альфа);
- Моноклональные антитела к рецепторам интерлейкин;
- Анти В-клеточные моноклональные антитела;
- Блокатор КО-стимуляции Т-лимфоцитов;
- Ингибитор протеинкиназы.
К ингибиторам ФНО-альфа относится инфликсимаб (ремикейд). Препарат оказывает селективное иммуномодулирующее действие. Лекарственное средство применяют при следующих ревматических заболеваниях:
- Ревматоидном артрите;
- Анкилозирующем спондилоартрите;
- Ювенильном ревматоидном артрите.
- Псориатическом артрите.
Адалимумаб (хумира) – селективный иммунодепрессант, рекомбинантное человеческое моноклональное антитело. По пептидной последовательности идентичен иммуноглобулинам Ig. Лекарственное средство применяют при среднетяжёлом и тяжёлом ревматоидном артрите в виде монотерапии или в сочетании с метотрексатом, ГИБП. Хумира применяется для лечения псориатического артрита, активного анкилозирующего спондилита.
Этанерцепт (Энбрел) тормозит биологические эффекты ФНО-α. Препарат представляет собой гибридную молекулу, которая состоит из ФНО-рецептора, соединённую с Fс-фрагментом IgG человека. Состоит из 934 аминокислот. Димерная структура ФНОР в молекуле этанерцепта обеспечивает более высокое взаимодействие препарата к ФНО-α, чем с мономерный рФНОР.
Препарат эффективен в лечении ревматоидного артрита, хорошо переносится пациентами даже при длительном применении. Комбинированная терапия этанерцептом и метотрексатом значительно превосходит монотерапию энбрелом у пациентов как с ранним, так и развёрнутым ревматоидным артритом. Потенциальными преимуществами этанерцепта перед другими ингибиторами ФНО-α является сохранение эффекта терапии в процессе длительного лечения и меньший риск активации туберкулёза.
Цертолизумаб пэгол – моноклональное антитело, ингибитор ФНО-α. Препарат нейтрализует мембранные и растворимые рецепторы фактора некроза опухоли альфа. Ревматологи назначают цертолизумаб пациентам, страдающим ревматоидным артритом средней и высокой активности у взрослых. Препарат применяют для монотерапии или в комбинации с другими базисными средствами.
Препарат назначают для лечения ревматоидного артрита в комбинации с метотрексатом при неэффективности других базисных средств, а также для терапии пациентов с тяжёлым прогрессирующим течением ревматоидного артрита, которые ранее не получали метотрексат. Показанием к применению препарата является псориатический артрит, тяжелый, прогрессирующий анкилозирующий спондилит без ответа на стандартную терапию.
Моноклональное антитело к рецепторам интерлейкин – устекинумаб (стелара). Это человеческие моноклональные антитела (класса Ig-G/к). Применяется для лечения псориаза, псориатического артрита. Ревматологи назначают устекинумаб в виде монотерапии и в сочетании с метотрексатом.
Анакинра (Кинерет) – рекомбинантный антагонист рецептора ИЛ-1, медиатора воспаления, который присутствует в синовиальной жидкости и плазме пациентов, страдающих ревматоидным артритом. Применяют для терапии пациентов, страдающих среднетяжелыми и тяжёлыми формами ревматоидного артрита, резистентных к метотрексату и действию других базисных средств. Препарат эффективен при острой и подострой формах подагры. Значительно облегчает боль, особенно у тех пациентов, кто не переносит стандартные противовоспалительные средства.
Тоцилизумаб – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 из подкласса иммуноглобулина Ig-G. Избирательно связывается и подавляет растворимые и мембранные рецепторы интерлейкина 6. Применяется для лечения ревматоидного артрита со средней или высокой степенью активности в виде монотерапии и в комбинации с другими базисными средствами. Особенно эффективно тормозит рентгенологически доказанную деструкцию суставов. Препарат используют в терапии активного полиартикулярного ювенильного идиопатического артрита и активного системного ювенильного идиопатического артрита.
Анти В-клеточные моноклональные антитела представлены препаратом ритуксимаб-РТМ (мабтера). Это синтетическое (генно-инженерное) химерное моноклональное антитело мыши или человека. Оно по структуре относится к иммуноглобулинам класса G1 (IgG1 каппа).
Ритуксимаб обладает высокой эффективностью при лечении пациентов, страдающих системной красной волчанкой с активными внепочечными проявлениями (серозитом, полиартритом, поражением кожи, стоматитом, лихорадкой, анемией), прогрессирующим волчаночным нефритом. Он является быть препаратом выбора для терапии системной красной волчанки, протекающей критически.
Ритуксимаб ревматологи применяют при мультиорганном тромбозе, связанном с катастрофическим антифосфолипидным синдромом. Препарат успешно применяют для лечения следующих заболеваний:
- Синдрома Шегрена;
- Полимиозита;
- Дерматомиозита;
- Гранулематоза Вегенера.
Ритуксимаб успешно применяют при пузырчатке – потенциально смертельном аутоиммунном заболевании, в основе которого лежит выработка аутоантител, реагирующих с десмоглеином 1 и 3 и молекулами адгезии эпидермиса. Ритуксимаб является родоначальником нового направления в лечении аутоиммунных заболеваний человека. Он модулирует В-клеточное звено иммунитета.
Блокатор КО-стимуляции Т-лимфоцитов абатацепт (оренсия) продуцируется путём технологии рекомбинантной ДНК на клетках яичников китайского хомячка. Препарат назначают пациентам с ревматоидным артритом при непереносимости и неэффективности других средств базисной терапии совместно с метотрексатом. Не сочетают с другими базисными препаратами, в том числе ингибиторами ФНО-α, анакинрой, ритуксимабом.
Тофацитиниб (Яквинус) – мощный избирательный ингибитор янус-киназы. Обладает высокой избирательностью в отношении янус-киназы 1, 2, 3. Препарат применяют при умеренном или тяжёлом активном ревматоидном артрите у взрослых с неадекватным ответом на один или несколько базисных средств.
Осложнения
Невзирая на высокую эффективность, ГИБП оказывают побочные действия. Тяжёлым осложнением терапии генно-инженерными биологическими препаратами ревматологи считают инфекции, ассоциированные с ГИБП. Ситуация осложняется тем, что лечение ревматических заболеваний требует применения иных антиревматических препаратов, которые обладают иммуносупрессивным действием.
При лечении ГИБП могут развиться следующие инфекционные осложнения:
- Септический артрит;
- Остеомиелит;
- Инфекции;
- Кожи и мягких тканей;
- Пневмония.
Основными прогностическими критериями развития инфекций при ревматических заболеваниях являются лейкопения, хронические заболевания лёгких, внесуставные проявления болезни, увеличение СОЭ, наличие ревматоидного фактора, лечение глюкокортикоидами. Применение метотрексата у больных ревматоидным артритом приводит к достоверному повышению общего числа вторичных инфекций.
Чтобы свести к минимуму риск развития инфекционных осложнений, связанных с терапией генно-инженерными биологическими препаратами, ревматологи Юсуповской больницы проводят тщательный отбор больных в строгом соответствии с показаниями, не назначают ГИБП пациентам, страдающим клинически значимой инфекцией в активной форме. Врачи проводят тщательное обследование пациентов с целью выявления латентной инфекции, соответствующее лечение в случае её обнаружения, откладывают начало терапии ГИБП. Крайнюю осторожность проявляют при решении вопроса о лечении ГИБП у пациентов с повышенной восприимчивостью к инфекциям, с наличием в анамнезе рецидивирующих инфекций или страдающим хроническим инфекционным заболеванием.
Во время и после лечения информируют пациентов о том, что ГИБП могут повышать способность к развитию инфекций. Ревматологи проводят инструктаж больных о необходимости немедленного обращения к врачу при появлении во время или после лечения ГИБП симптомов инфекции (повышения tº тела, общей слабости, кашля или гриппоподобных симптомов) или признаков, которые позволяют заподозрить туберкулёз (субфебрилитета, длительно сохраняющегося кашля, снижения массы тела).
Врачи Юсуповской больницы проводят тщательное наблюдение как минимум в течение шести месяцев после окончания лечения ГИБП. При развитии тяжёлой инфекции терапию генно-инженерными биологическими препаратами прекращают, проводят в связи с этим соответствующее обследование и лечение

Терапия остеопороза при ревматоидном артрите
Ревматоидный артрит является центральной проблемой современной ревматологии. Это хроническое прогрессирующее заболевание с постепенно нарастающей деструкцией мягких тканей, хряща и костей. Наиболее часто встречающееся и тяжелое проявление ревматоидного артрита – остеопороз. Он может быть обусловлен активностью самого заболевания и побочным действием проводимой терапии.
Деструкцию костной ткани вызывают медиаторы воспалительного и иммунного процессов — провоспалительные цитокины, которые вырабатываются субпопуляцией Т-лимфоцитов. К ним относят:
- Фактор некроза опухоли а (ФНО-а);
- Интерлейкины 1, 2, 12, 17;
- Интерферон;
- Простагландины;
- Протеолитические ферменты.
Генно-инженерные биологические препараты (ГИБП), которые применяют для лечения ревматоидного артрита, уменьшают воспалительные изменения суставов, сдерживают развитие деструкции и развитие остеопороза. При применении ГИБП наблюдается стабилизация или повышение минеральной плоскости кости. У пациентов повышается образование костной ткани и снижается рассасывание кости. Препараты способствуют замедлению деструкции суставов при ревматоидном артрите. Для того чтобы пройти комбинированную терапию ревматических заболеваний, в том числе генно-инженерными биологическими препаратами, по доступной цене, звоните в контакт центр Юсуповской больницы.
Цель рекомендаций: сформулировать основные положения, касающиеся диагностики и тактики ведения пациентов с ревматическими заболеваниями, имеющими риск заболеваемости COVID-19
Клинические проявления:
Диагноз и дифференциальный диагноз (таблица 1)
Таблица 1. Критерии подозрения COVID-19 при скрининге
Лихорадка или симптомы инфекции нижних дыхательных путей (кашель, затруднение дыхания и др.)
Любой человек (включая медицинского работника), который имел тесный контакт с пациентом, у которого имеет место подтвержденная инфекция COVID-19 за 14 дней до появления первых симптомов заболевания
Лихорадка или симптомы инфекции нижних дыхательных путей (кашель, затруднение дыхания и др.), по тяжести, требующие госпитализации
Пребывание в странах, в которым имеет место эпидемия COVID-19, в предшествующие 14 дней до появления первых симптомов заболевания, в анамнезе
Лихорадка в сочетании с тяжелым поражением легких (пневмония, ОРДС), требующими госпитализации не зависимо от потенциальных причин этих состояний (например, грипп)
Не зависимо от эпидемиологического анамнеза
Примечание: тесный контакт: нахождение от человека, инфицированного COVID-19 на расстоянии менее 2-х метров в течении длительного времени
Таблица 2. Клинические варианты COVID -19
Отсутствие пневмонии или легкая/умеренно тяжелая пневмония*
Одышка, частота дыхательных движений ≥ 30 в минуту, сатурацию кислорода крови ≤ 93%, парциальное давление кислорода в артериальной крови к фракции кислорода на вдохе 50% в течении 24-48 часов
Дыхательная недостаточность, септический шок, и/или множественная органная дисфункция или недостаточность
*Примечание: 1. Легкая пневмония: Частота дыхания менее 25 в минуту, частота пульса менее 90 в минуту. Поражены 1-2 сегмента или доля, интоксикация не выражена, температура тела до 38С. 2. Средней степени: Частота дыхания более 25 в минуту, частота пульса около 100 в минуту. Температура тела до 39С, умеренно выражена интоксикация, нет осложнений. Поражение в пределах доли.
Рекомендации для ревматологов и пациентом с ревматическими заболеваниями
Рекомендации планируется регулярно обновлять при появлении новых данных, касающихся эпидемиологии, клиническо-лабораторных проявлений и осложнений COVID-19 при ревматических заболеваниях и возможностях их профилактики и лечения.
Таблица 3. Стратификация риска инфицирования и тяжелого течения COVID-19 у пациентов с иммуновоспалительными ревматическими заболеваниями
Прием глюкокортикоидов в дозе > 20 мг (0.5 мг/кг) в день в течении более 4 недель
Прием глюкокортикоидов в дозе > 5 мг преднизолона, но меньше
Прием циклофосфамида в любой дозе перорально или внутривенно в течении предшествующих 6 месяцев
Прием метотрексата в дозе
Прием одного сБПВП (лефлуномид, азатиоприн, микофенолата мофетил, циклоспорин А, такролимус), ГИБП или тБПВП
Прием двух и более сБПВП, ГИБП или тБПВП
Прием одного сБПВП, ГИБП или тБПВП в комбинации с глюкокортикоидами в дозе
Гидроксихлорохин или сульфасалазин
Любой, перечисленный фактор риска (коморбидная патология): возраст> 70 лет, сахарный диабет, заболевание легких, почечная недостаточность, ишемическая болезнь сердца, артериальная гипертензия.
Высокая активность патологического процесса
Счет 3 и более – очень высокий риск
Счет 2 – высокий
Счет 1- умеренный
Примечание: ГИБП – генно-инженерные биологические препараты
Таблица 4. Клинические критерии гемафагоцитарного лимфогистиоцитоза и синдрома «цитокинового шторма, при тяжелом течении COVID -19
Критерии гемафагоцитарного лимфогистиоцитоза
Увеличение уровня растворимых CD25
Таблица 5. Базисные противовоспалительные препараты, применяемые для лечения иммуновоспалительных (аутоиммунных) ревматических заболеваний
Молекулярная мишень
Нежелательные лекарственные реакции
Стандартные базисные противовоспалительные препараты
Дегилрофолат редуктаза и другие фолат-зависимые ферменты
10-30 мг в неделю
Тошнота, рвота, стоматит, повышение печеночных ферментов, супрессия кроветворения, пневмонит (очень редко)
Сульфасалазин (синтетическая молекула)
Кожные реакции гиперчувствительности, тошнота, рвота, диарея, агранулоцитоз, азоспермия, лекарственная волчанка
Лефлуномид (синтетическая молекула)
Диарея, артериальная гипертензия, реакции гиперчувствительности, увеличение печеночных ферментов, лейкоцитопения
Гидроксихлоро-хин (синтетическая молекула)
Тошноты рвоты, диарея, миопатии, нарушении ритма и проводимости сердца, кардиомиопатии и ретинопатия (редко)
Таргетные базисные противовоспалительные препараты
Тофацитиниб (синтетическая молекула)
5 мг 2 раза в день
Инфекции, реактивация туберкулеза, герпес, цитопения (включая анемию), гиперлипидемия, увеличение КФК, увеличение риска венозных тромбозов?
Барицитиниб (синтетическая молекула)
Апремиласт (синтетическая молекула)
30 мг внутрь 2 раза в день, утром и вечером, с интервалом 12 ч.
Диарея, тошнота; рвота, диспепсия, частый стул, боль в верхних отделах живота (часто); желудочно-кишечное кровотечение (редко), крапивница, снижение массы тела
Генно-инженерные биологические препараты
Ингибиторы фактора некроза опухоли (ФНО)α
(рекомбинант-ный рецептор ФНО- IgGFc)
(Fab фрагмент гуманизиро-ванных мАТ)
5 мг/кг 0, 2 и 6 недели, затем каждые 6-8 недель
40 мг каждые 2 недели, п/к)
50-100 мг 1 раз в 4 недели, п/к
400 мг 0, 2, 4 неделя, затем 200 мг каждые 2 недели
Инфекции, реактивация туберкулеза, псориазиформные поражение кожи, аутоиммунные волчаночно-подобные реакции, инъекционные и инфузионные реакции, демиелинизирующие заболеваний ЦНС
Ингибиторы ИЛ-6 рецепторов
4-8 мг/кг каждые 4 недели, в/в или 162 мг/неделя, п/к
150 - 200 мг каждые 2 недели, п/к
Инфекции, реактивация туберкулеза, перфорация кишечника, реакции гиперчувствительности, нейтропения, инъекционные и инфузионные реакции, гиперлипидемия, нейтропения
1000 мг 2 раза с промежутком 14 дней, повторные курсы через 6 месяцев, в/в
600 мг 2 раза с промежутком 14 дней, повторные курсы через 6 месяцев, в/в
Инфекции, реакции гиперчувствительности, лейкоцитопения, реактивация инфекции вирусом гепатита В
Блокатор ко-стимуляции Т клеток
500-1000 мг, каждые 4 недели, в/в, 125 мг/неделя, п/к
Инфекции, реактивация туберкулеза, лейкопения, инъекционные и инфузионные реакции
45 мг 9 и 4 недели, затем каждые 12 недели (90 мг при массе тела более 90 кг)
Головокружение, головная боль (часто), депрессия (редко). диарея, рвота, тошнота (часто)
(человеческое м АТ)
150 (или 300) мг 0, 1, 2, 3, 4 недели, затем каждые 4 недели или 150 мг в месяц
Инъекционные реакции, нейтропения, конъюнктивит, ОРВ (часто), диарея, грибковые инфекции, болезнь Крона, активация латентной туберкулезной инфекции (редко)
160 мг (две инъекции по 80 мг, через 4 недели 1 раз каждые 4 недели в дозе 80 мг, п/к
Инъекционные реакции, ОРВ, тошнота, грибковые инфекции, конъюнктивит, болезнь Крона (редко), активация латентной туберкулезной инфекции (редко)
150 мг каждые 2 мес, п/к
Инъекционные реакции, инфекции (назофарингит, синусит, вирусные инфекции верхних дыхательных путей, бронхит, пневмония, фарингит, грипп, инфекции мочевыводящих путей, инфекции уха, гастроэнтерит) (часто).
Таблица 6. Иммуновоспалительные (аутоиммунные) ревматические заболевания с высоким риском инфицирования и тяжелого течения COVID -19
Все аутоимунные ревматические заболевания
Системная красная волчанка
Тяжелое поражение легких, легочная артериальная гипертензия, поражение пищевода (затруднение при интубации); часто лечение высокими дозами циклофосфамида и ритуксимабом
Идиопатические воспалительные миопатии (дерматомиозит, полимиозит, аутоиммунный миозит, некротизируюший воспалительный миозит, миозит с включениями
Лечение высокими дозами глюкокортикоидов; поражение диафрагмы (нарушение функции легких, риск легочной инфекции)
Высокий/очень высокий (при развитии тяжелых системных проявлений)
Лечение высокими дозами глюкокортикоидов, циклофосфамида и ритуксимаба
Смешанное заболевание соединительной ткани
Риск зависит от преобладающих клинических проявлений
Системные васкулиты, ассоциированные с анти-нейтрофильными цитоплазматическими антителами (грануламатоз с полиангиитом, эозинофильный гранулематоз с полиангиитом, микроскопический полиангиит, узелковый полиартериит)
Высокая частота поражения почек и легких; часто лечение высокими дозами глюкокортикоидов, а также циклофосфамидом и ритуксимабом
Пожилой возраст, длительное лечение глюкокортикоидами
Лечение глюкокортикоидами и ингибиторами ФНОα
Другие формы системных васкулитов (IgA васкулит, криоглобулинемический васкулит, гипокомплементемический уртикарный васкулит, сидром Когана, болезнь Гудпасчера
Возможность поражения почек, легких и необходимость лечения глюкокортикоидами, циклофосфамидом.
IgG4- связанное заболевание
Необходимость лечения глюкокортикоидов и ритуксимаба
Необходимость приема глюкокортикоидов, сБПВП, ГИБП, тБПВП, высокая частота коморбидных заболеваний (антериальная гипертензия, ишемическая болезнь сердца, сахарный диабет)
Лечение ГИБП (ингибиторы ФНОα и ИЛ-17)
Высокая частота коморбидных заболеваний
Лечение ГИБП (ингибиторы ФНОα и ИЛ-17, ИЛ-12/23)
Высокая частота коморбидных заболеваний; лечение ингибиторами ИЛ-1β
Лечение ингибиторами ИЛ-1β
Ювенильный идиопатический артрит (ЮИА)
- 4962
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




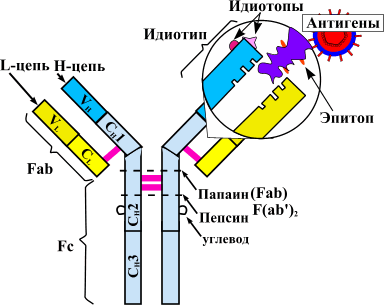
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
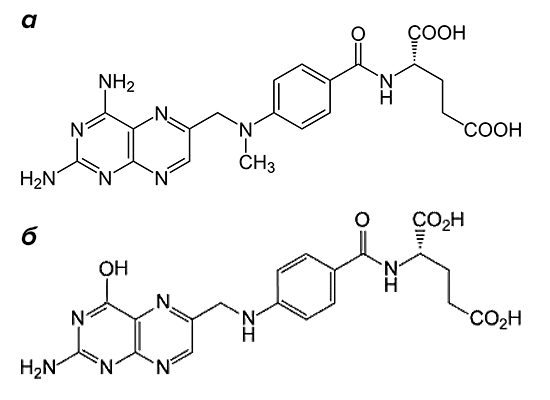
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
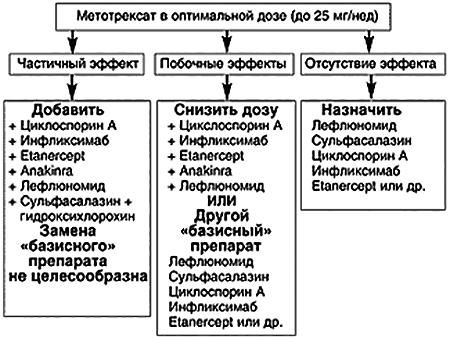
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
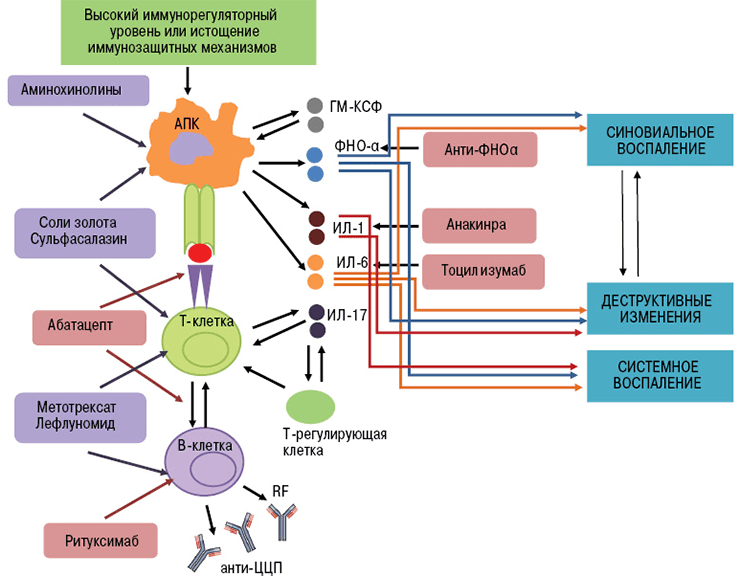
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
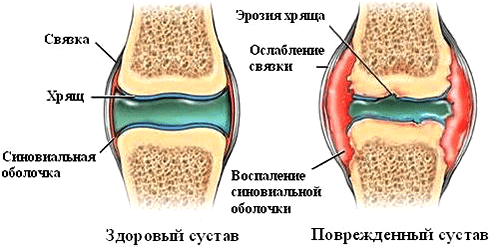
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
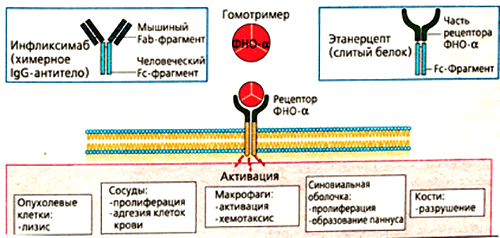
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
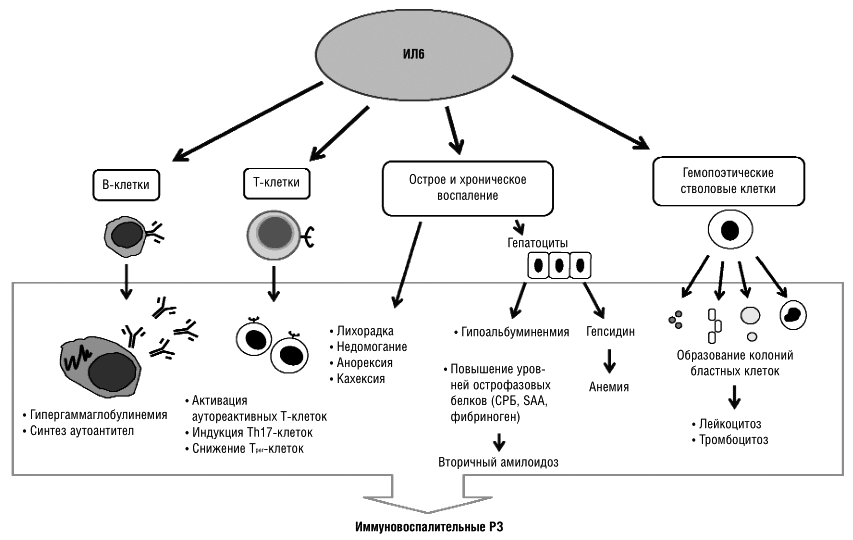
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
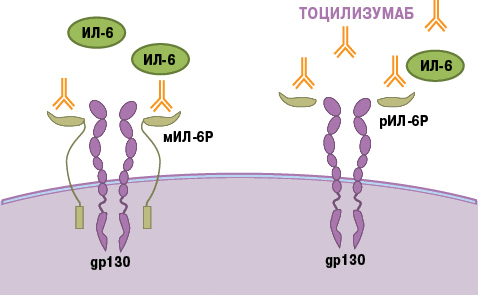
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
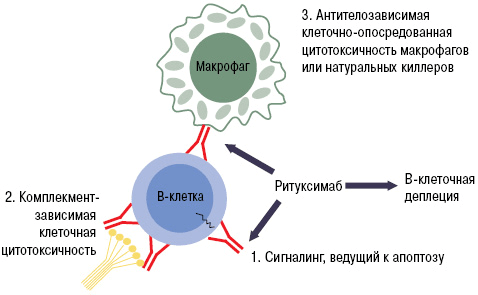
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
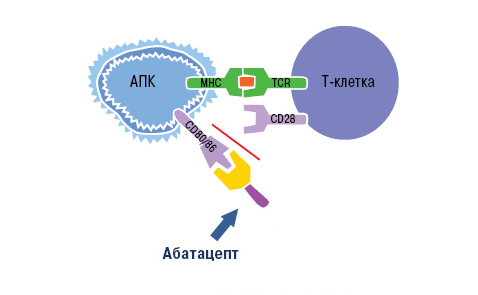
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





