Что такое anca ассоциированные васкулиты
Среди всех разновидностей васкулитов самыми опасными считаются АНЦА-ассоциированные васкулиты (ААВ). Такие системные патологии характеризуются наличием в крови пациента антинейтрофильных цитоплазматических антител (АНЦА).
В ходе развития патологий страдают в основном мелкие кровеносные сосуды. Но это не значит, что болезнь можно не воспринимать серьезно. Коварен ассоциированный васкулит АНЦА своим мгновенным стремительным течением.
То есть пострадавшие органы критически недополучают питания, а в результате развиваются необратимые некротические процессы. Код патологии по МКБ — М 31.3 и М 31.8. Как проявляется АНЦА васкулит и как его лечат, разбираем ниже.
Подвиды АНЦА васкулитов
К васкулитам АНЦА в медицине относят несколько разновидностей васкулитов. Каждый из них поражает определенные органы и крайне опасен для организма человека. Выделяют такие разновидности ААВ:
- Гранулематоз Вегенера. В этом случае страдают респираторные пути: слизистые органов слуха, зрения и дыхания. В некоторых случаях поражаются даже легкие. Болезнь развивается крайне стремительно. Если не принять меры, летальный исход наступает уже в течение первых 6–12 месяцев от начала патологии. Гранулематоз Вегенера бывает генерализованным и локальным. В некоторых случаях медики считают эти виды стадиями болезни. В ходе гранулематоза Вегенера на слизистых пациента образуются своеобразные наросты по типу полипов. С течением болезни они распадаются, образуя кровоточащие раны. Именно поэтому у пациента иногда выявляют легочное или иное кровотечение.
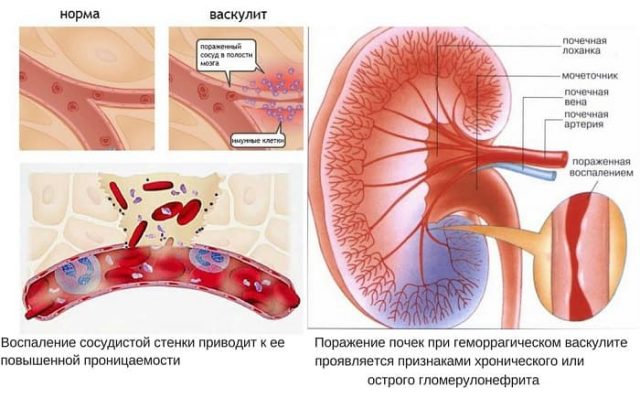
Важно: В некоторых случаях у пациентов страдают почки. Поражение мочевыделительных органов приводит к развитию быстропрогрессирующего гломерулонефрита. Почки некротизируются максимально быстро.
- Микроскопический полиангиит (МПА). Страдают мелкие и реже средние кровеносные сосуды внутренних органов. В основном поражаются почки, легкие, желудочно-кишечный тракт. В ходе прогрессирования болезни возникают внутренние кровотечения в легких, почках, органах ЖКТ. Иногда отмечаются неврологические симптомы заболевания в виде мононеврита. Сердце при МПА страдает реже.
- Эозинофильный гранулематозный полиартериит (ЭГПА). Болезнь еще называют синдромом Черджа–Стросс. В ходе такой разновидности АНЦА-васкулита страдают респираторные органы. Гранулемы на слизистой имеют выраженную эозинофильную инфильтрацию. То есть на слизистой образуются уплотнения и наросты из подвида лейкоцитов — эозинофилов.
Все виды ААВ являются серьезной проблемой для современной медицины, поскольку на начальных этапах заболевание практически никак не проявляется. Позднее, при явных признаках и симптомах, болезнь схожа со многими патологиями, что затрудняет проведение дифференциальной диагностики. Пока теряется драгоценное время на постановку диагноза, пациент как минимум превращается в инвалида. В худшем случае наступает летальный исход.
Механизм развития патологии
Все ААВ происходят на фоне аутоиммунных процессов в организме. По невыявленным причинам организм пациента начинает вырабатывать аутоантитела к клеткам кровеносных сосудов. В результате развивается воспаление стенок сосудистого русла. Просвет сосудов сильно сужается, что препятствует нормальному питанию органов-мишеней. От этого возникает ишемия тканей, питаемых данными сосудами. На фоне ишемии у пациента начинается некроз тканей и как следствие полный отказ органа.
Ученые выделяют несколько форм развития ААВ:
- Ограниченная. Характеризуется поражением исключительно верхних дыхательных путей.
- Генерализованная ранняя. Поражаются лишь сосуды без признаков нарушения работы внутренних органов.
- Генерализованная активная. Явно проявляются сбои в работе внутренних органов.
- Тяжелая. Налицо тяжелая декомпенсированная недостаточность внутренних органов на фоне васкулита АНЦА.
- Рефрактерная. Считается окончательной, поскольку добиться ремиссии при ней уже не удается даже на фоне грамотного и своевременного лечения.
Симптомы болезни
В зависимости от классификации ААВ клиническая картина при разных его видах гетерогенна, то есть разнообразна. Выглядит симптоматика так:
- ГВ (гранулематоз Вегенера). Начало патологии характеризуется проявлением общей слабости и потерей аппетита. Позднее присоединяются повышенная температура тела, миалгия и слабость суставов (артралгия). Далее симптоматика зависит от пострадавшего органа-мишени. Если это глаза, то страдают радужка и белочная оболочка. Если это дыхательные пути, то сначала проявляется устойчивый насморк с гнойными выделениями. Не исключена перфорация носовой перегородки. Могут появиться кровохарканье, язвенный стоматит, гнойные выделения из ушей по типу отита. При поражении легких у пациента отмечаются одышка, плеврит и пр. Если же мишенью ГВ стали почки, то у пациента в моче явно видна кровь, отмечена высокая концентрация белка и при этом анализ на гемоглобин отрицательный. То есть его уровень критически снижен.
- Микроскопический полиангиит (МПА). В большинстве случаев у пациента проявляются поражения почек в виде стремительно прогрессирующего гломерулонефрита. Симптомы — кровь в моче, повышенный белок, болезненность в области поясницы. При поражении органов ЖКТ не исключен стул с примесью крови или рвотные массы с кровью.
- ЭГПА. В этом случае ко всем приведенным выше симптомам примешивается эозинофильный мио- или эндокардит, перикардит, гипертензия артериальная. На коже проявляются подкожные узелки, папулы. Со временем из папул образуются язвы. Отмечаются боли в животе при поражении органов ЖКТ.
Важно: причинами летальных исходов при ААВ становятся острая почечная или сердечная недостаточность, остановка кровообращения, сильное внутреннее кровотечение, дыхательная недостаточность.
Диагностика заболевания
Для постановки точного диагноза следует сделать анализ крови на антинейтрофильные цитоплазматические антитела. В 50 % случаев у больного выявляют миелопероксидазу АНЦА, в 40 % случаев — протеиназу-3 АНЦА. И лишь в 10 % случаев результат является отрицательным.
Далее для подтверждения или опровержения диагноза нужно выполнить:
- общие анализы крови и мочи;
- КТ или МРТ пораженного органа;
- рентгеноконтрастное ангиологическое исследование;
- биопсию легких или почек (в зависимости от подозрений на орган-мишень).
Крайне важна дифференциальная диагностика, в ходе которой различают ГВ и синдром Черджа-Стросса (в первом случае астма отсутствует, во втором — присутствует). Также нужно исключить и другие патологии, при которых отмечается почечно-легочный синдром. В частности, это синдром Гудпасчера, васкулит системный, периартериит узелковый, васкулит геморрагический, красная волчанка системная, ангиоцентрическая злокачественная лимфома, образования злокачественные, сифилис и проказа, микоз, туберкулез, бериллиоз и др.
Важно: При ГВ в крови пациента выявляют антитела к протеиназе-3, в то время как при ЭГПА и при МПА у больного в крови повышена концентрация антител к миелопероксидазе.
Лечение патологии
Главной целью лечения системного васкулита АНЦА является достижение стойкой ремиссии. Поэтому терапию делят на три этапа:
- Индукция ремиссии. Здесь используют в основном глюкокортикоиды типа преднизолон и метилпреднизолон. Препараты вводят внутривенно методом капельниц и внутрь в виде таблеток. Как правило, улучшение наступает в течение первых трех недель лечения. Но расслабляться не стоит. Поддерживающая терапия показана каждые четыре недели.
- Поддержание ремиссии. На этом этапе продолжают введение циклофосфамида для поддержания стойкого результата. Также используют препараты метотрексат или азатиоприн. На сегодняшний день ученые изучают эффективность лефлуномида и микофенолата мофетила.
- Терапия эскалационная. Направлена на восстановление функций пострадавшего органа. Лечение подбирают в зависимости от сложности состояния пациента и внутреннего органа-мишени.
Общие прогнозы для пациентов с васкулитами АНЦА
В целом прогноз для пациентов с васкулитом АНЦА сложно назвать благоприятным. Но с усовершенствованием современной медицины показатели улучшаются. Жизненный прогноз для больных с ААВ зависит от формы развития болезни, своевременности поставленного диагноза и адекватности назначенного лечения. Кроме того во внимание стоит брать общее состояние организма пациента, его возраст и наличие дополнительных хронических заболеваний. Если говорить сухими цифрами, то прогноз для пациентов с ААВ выглядит так:
- Выживаемость при гранулематозе Вегенера в первый год от постановки диагноза составляет почти 85 %.
- В первые пять лет при ГВ выживаемость составляет около 65 %, при синдроме Черджа-Стросса около 65–70 %, при МПА — 46–54 %.
Важно: патология очень коварна и провоцирует летальность в первые 1–5 лет от момента выявления болезни.

Напомню, что к группе так называемых АНЦА-ассоциированных васкулитов относят гранулематоз с полиангиитом (Вегенера), эозинофильный гранулематоз с полиангиитом (Чардж-Стросса) и микросокпический полиангиит.
Классификационные критерии АНЦА-ассоциированных васкулитов.
с полиангиитом
Особенности клинического течения гранулематоза с полиангиитом (Вегенера)
Гранулематозу с полиангиитом свойственна триада поражения органов с вовлечением верхних дыхательных путей, легких и почек.

У подавляющего большинства пациентов, развивается некротизирующее гранулематозное воспаление верних дыхательных путей: язвенно-некротический ринит, синусит, поражение органа слуха, вовлечение трахеи и гортани с формированием подскладочной гранулемы. Патология верхних дыхательных путей может осложняться перфорацией носовой перегородки с формированием седловидной деформации носа, развитием тяжелого деструктивного пансинусита с распространением гранулематозной ткани в орбиту, потерей слуха, стенозом гортани.

Поражение легких (50- 70%) характеризуется некротизирующим гранулематозным воспалением, которое при рентгенографическом исследовании определяется в виде узлов или инфильтратов, склонных к распаду и формированию полостей. В каждом пятом случае поражение легких протекает бессимптомно, с отсутствием жалоб на кашель и скудной аускультативной картиной даже при тяжелом поражении.
Поражение почек отмечается у 80% пациентов.
Для поражения органа зрения (50%) свойственно формирование псевдоопухоли орбиты вследствие образования периорбитальной гранулемы, что у каждого пятого больного приводит к слепоте.

Поражение кожи (25- 35%) в первую очередь характеризуется геморрагическими или язвенно- геморрагическими высыпаниями преимущественно на коже конечностей.
Для поражения периферической нервной системы свойственно развитие асимметричного сенсорно- моторного множественного мононеврита (20- 30%), значительно реже наблюдается дистальная симметричная полинейропатия. У каждого четвертого больного с поражением органа слуха развивается вторичный (одонтогенный) неврит V, VII пары черепно- мозговых нервов.
Поражение сердца при не превышает 20%. При этом гранулематозе возрастает риск сердечно-сосудистых заболеваний (ИБС, инсульта, периферической артериальной окклюзии), при этом отмечено повышение риска острого инфаркта миокарда, но не стенокардии.
Поражение желудочно- кишечного тракта (ЖКТ) встречается редко (5%).
Особенности клинического течения микроскопического полиангиита.

У 50% больных микроскопический полиангиит проявляется в виде тяжёлого лёгочно-почечного синдрома. Как правило, при микроскопическом полиангиите наблюдают острое начало и более агрессивное течение, чем при других АНЦА-ассоциированных васкулитах.
Микроскопический полиангиит имеет много общих черт с гранулематозом Вегенера (см. выше), отличаясь отсутствием гранулематозного воспаления.
Патология легких (35- 70%) при микроскопическом полиангиите представлена некротизирующим альвеолитом. При рентгенологическом обследовании выявляют инфильтраты без распада, часто с реакцией плевры. Поражение легких протекает тяжело (особенно при наличии антител к протеиназе-3), у половины больных осложняется легочным кровотечением, что в каждом втором случае становится фатальным.
Поражение почек отмечается у 90% пациентов и нередко характеризуется быстропрогрессирующим течением (40- 55%).
Поражение кожи (70%) характеризуется геморрагическими или язвенно-геморрагическими высыпаниями преимущественно на коже конечностей, реже некрозами кожи и подлежащих мягких тканей.
Для поражения органа зрения (30%) свойственно развитие склерита и эписклерита.
Поражение периферической нервной системы (30%) проявляется асимметричным сенсорно- моторным множественным мононевритом.
Поражение ЖКТ (10%) характеризуется болями в животе, диареей, иногда кровотечением вследствие развития язв желудка и кишечника.
Особенности клинического течения эозинофильного гранулематоза с полиангиитом (болезнь Чарджа-Стросса).

Клиническое развитие этой болезни подразделяют на 3 стадии, которые, как правило, последовательно разворачиваются на протяжении нескольких лет. Для первого этапа свойственно постепенное развитие симптомов бронхиальной астмы, аллергического ринита, синусита, проявлений лекарственной непереносимости, при этом повышение количества эозинофилов в крови не всегда выражено. На второй стадии присоединяются эпизоды эозинофильной инфильтрации тканей в виде эозинофильной пневмонии или гастроэнтерита, что часто сочетается с периферической эозинофилией более 10%. Третья стадия болезни характеризуется развитием системного некротизирующего васкулита.
Поражение легких (70%) характеризуется мигрирующими инфильтратами (эозинофильная пневмония) или узлами без полостей распада. Возможно вовлечение плевры (эозинофильный плеврит), умеренное увеличение внутригрудных лимфатических узлов.
Поражение почек отмечается у 20- 45% пациентов.
Поражение сердца (30- 50%) проявляется разнообразной патологией (перикардит, эндомиокардит, коронарит, сердечная недостаточность, нарушения ритма и проводимости) и становится причиной летального исхода у 50% пациентов.
Поражение кожи (64%) характеризуется геморрагическими или язвенно- геморрагическими высыпаниями преимущественно на коже конечностей, реже уртикарными высыпаниями.
Поражение периферической нервной системы (64%) развивается чаще, чем при других формах АНЦА-васкулитов и характеризуется асимметричным сенсорно- моторным множественным мононевритом. Поражение центральной нервной системы (10%) может проявляться невритом черепно-мозговых нервов, острыми нарушениями мозгового кровообращения, очаговыми изменениями мозга, эпилептическим синдромом.
Для поражения органа зрения (30%) свойственны склерит и эписклерит.
Поражение ЖКТ (10%) связано как с эозинофильным гастроэнтеритом, так и с васкулитом стенки кишечника, способным вызвать образование ишемических язв, перфорацию.

Лабораторная диагностика АНЦА- ассоциированных васкулитов.

Основное значение имеет определение в сыворотке крови этих самых АНЦА — антинейтрофильных цитоплазматических антител — методом непрямой иммунофлуоресценции (с использованием нейтрофилов здоровых доноров, фиксированных этанолом) или с помощью иммуноферментного анализа с определением специфичности к протеиназе-3 (ПР-3) или миелопероксидазе (МПО). Также характерно увеличение СОЭ, концентрации СРБ, нормохромная нормоцитарная анемия, умеренный тромбоцитоз.
АНЦА с цитоплазматическим типом иммунофлуоресцентного свечения (цАНЦА) или антитела к ПР-3 высокочувствительны и специфичны для гранулематоза Вегенера (более 90%). АНЦА с перинуклеарным типом свечения (пАНЦА) обнаруживают у 70 % больных гранулематозом Чардж-Стросса, но не всегда со специфичностью к МПО.
Когда необходимо определять АНЦА?
+ гломерулонефрит, особенно быстро прогрессирующий,
+ кровохарканье/легочное кровотечение, особенно в сочетании с гломерулонефритом,
+ кожный васкулит, сопровождающийся системными проявлениями,
+ множественные очаги поражения легких при рентгенологическом исследовании,
+ хроническое деструктивное поражение верхних дыхательных путей,
+ затяжное течение синусита или отита,
+ подскладочный стеноз гортани/трахеи,
+ множественный мононеврит или другая периферическая нейропатия,
АНЦА – это лабораторный показатель, который подтверждает диагноз аутоиммунных заболеваний. АНЦА (антинейтрофильные цитоплазматические тела) встречаются при АНЦА-ассоциированных васкулитах, других АНЦА-ассоциированных заболеваниях. АНЦА анализ проводится на сыворотке крови. Антинейтрофильные цитоплазматические антитела – это группа неоднородных антител, образующиеся к ферментам и белкам цитоплазмы клеток крови моноцитов и нейтрофилов. АНЦА вызывает выброс свободных радикалов кислорода и различных ферментов из клеток – в результате травмируются стенки кровеносных сосудов.
В лаборатории Юсуповской больницы проводятся различные исследования и анализы, в том числе анализ АНЦА. Юсуповская больница – это современный разнопрофильный медицинский комплекс. В состав комплекса входит несколько разнопрофильных клиник, лаборатория, диагностический центр, стационар, реабилитационный центр. Стационар больницы – это комфортные палаты, квалифицированная помощь медицинского персонала, высокоэффективная помощь разнопрофильных врачей. В Юсуповской больнице пациенты смогут пройти реабилитацию в Центре восстановительной медицины.

АНЦА анализ крови: что это?
Тест АНЦА проводится методом непрямой иммунофлюоресценции с использованием препаратов человеческих нейтрофилов. В результате теста обнаруживают антитела в виде диффузного цитоплазматического или перинуклеарного окрашивания (cANCA или pANCA). Мишенью для cANCA служит лизосомная протеиназа, для pANCA мишенью служит миелопероксидаза. Антитела к цитоплазме нейтрофилов различают по типу свечения – так интерферируют pANCA c антителами ANA. Анализ на антитела к цитоплазме нейтрофилов (АНЦА) имеет показания:
- Диагностика неспецифического язвенного колита, болезни Крона.
- Диагностика васкулитов (микроскопический полиангиит, узелковый периартрит, синдром Чарга-Стросса, гранулематоз Вегенера, васкулит при ревматоидном артрите и системной красной волчанке, другие виды васкулитов).
АНЦА ассоциированный васкулит
АНЦА васкулит ассоциированный – это группа заболеваний, к которой относится МПА (микроскопический полиангиит), ГПА - гранулематоз с полиангиитом (гранулематоз Вегенера), ЭГПА – эозинофильный гранулематоз с полиангиитом (синдром Чарга-Стросса). Ассоциированный васкулит некротизирующий МПА (микроскопический полиангиит) характеризуется преимущественным поражением мелких кровеносных сосудов, могут быть поражены мелкие и средние артерии. МПА нередко сопутствуют геморрагический альвеолит и некротизирующий гломерулонефрит. АНЦА ассоциированный васкулит (ГПА) – это некротизирующий гранулематозный воспалительный процесс, поражающий нижние и верхние дыхательных пути, преимущественно средние и мелкие кровеносные сосуды. Нередко заболеванию сопутствует гломерулонефрит некротизирующий.
ANCA ассоциированный васкулит ГПА у большинства больных сопровождается развитием некротизирующего гранулематозного воспалительного процесса, который проявляется в виде:
- Поражения органа слуха.
- Язвенно-некротического ринита.
- Синусита.
- В воспалительный процесс вовлекаются гортань и трахея.
Гранулематозное некротизирующее воспаление нередко осложняется полной потерей слуха, деформацией носа из-за перфорации носовой перегородки, развитием тяжелой формы деструктивного пансинусита, очень часто заболевание сопровождается поражением легких, которое может протекать бессимптомно даже при тяжелом течении. У 80% больных развивается поражение почек, у 50% пациентов происходит потеря зрения, у 35% больных отмечаются поражения кожного покрова, у 20% больных диагностируется поражение сердца, около 30% пациентов страдают на сенсорно-моторный множественный мононеврит. АНЦА ассоциированные системные васкулиты увеличивают риск развития различных заболеваний сердца, в 5% случаев отмечается поражение желудочно-кишечного тракта.
Микроскопический полиангиит протекает остро, не сопровождается гранулематозным воспалительным процессом, но нередко осложняется поражением легких и легочным кровотечением. Также может развиться фиброзирующий альвеолит. Около 90 % случаев осложнений при МПА – это поражение почек, которое в половине случаев характеризуется быстропрогрессирующим течением. МПА характеризуется поражением органов зрения, периферической нервной системы, желудочно-кишечного тракта.

Где можно пройти исследование в Москве
Исследование АНЦА можно пройти в различных медицинских клиниках и медицинских центрах в Москве, а также в Юсуповской больнице. Существуют определенные требования для сдачи теста:
- Тест сдается утром, натощак. За 8-12 часов до сдачи анализа не следует принимать пищу.
- Перед сдачей теста нельзя есть жирную пищу.
В лаборатории Юсуповской больницы проводят исследования крови, мочи, кала, ликвора. В лаборатории можно пройти исследования для диагностики различных заболеваний, в том числе аутоиммунных. Перед проведением исследования пациент должен получить консультацию врача. Записаться на прием можно по телефону больницы или онлайн.
Аннотация научной статьи по клинической медицине, автор научной работы — Казачкина Е.О., Люгай А.В., Хоммятов М.Р., Вознюк К.О.
Системные васкулиты представляют собой большую группу заболеваний, характеризующихся развитием воспаления в сосудистой стенке вследствие иммунных нарушений различного характера. Одним из вариантов таких нарушений является формирование антинейтро-фильных цитоплазматических антител (АНЦА), обусловливающих развитие так называемых АНЦА-ассоциирован-ных васкулитов: микроскопического полиангиита (МПА), гранулематоза с полиангиитом (ГПА, ранее известный как гранулематоз Вегенера) и эозинофильного гранулематоза с полиангиитом (ЭГПА, ранее известный как синдром Чарга-Стросса). Данную подгруппу васкулитов отличает злокачественное течение, что особенно сильно проявляется при поражении почек. Указанные особенности определяют исключительную важность понимания их патогенеза, клинической картины и лечения, что и будет рассмотрено в данной статье.
Похожие темы научных работ по клинической медицине , автор научной работы — Казачкина Е.О., Люгай А.В., Хоммятов М.Р., Вознюк К.О.
ANCA-ASSOCIATED VASCULITIS
Systemic vasculitides are a large group of diseases characterized by the development of an inflammatory process in the blood vessel wall due to different immune disorders. One of the variants of such disorders is the formation of antineutrophil cytoplasmic antibodies (ANCA), which lead to the development of so-called ANCA-associated vasculitides: microscopic polyangiitis (MPA), granulomatosis with polyangiitis (GPA, Wegener's granulomatosis) and eosinophilic granulomatosis with polyangiitis (EGPA, Charge-Strauss syndrome). This subgroup of vas-culitides is distinguished by rapid and malignant course, which is especially pronounced in case of kidney damage. These features determine the exceptional importance of understanding its pathogenesis and treatment that will be discussed in this article.
The journal of scientific articles
АНЦА-АССОЦИИРОВАННЫЕ ВАСКУЛИТЫ Казачкина Е.О., Люгай А.В., Хоммятов М.Р., Вознюк К.О. ФГАОУВО Первый московский государственный медицинский университет имени И.М. Сеченова (Сеченовский университет), г. Москва, Российская Федерация Аннотация. Системные васкулиты представляют собой большую группу заболеваний, характеризующихся развитием воспаления в сосудистой стенке вследствие иммунных нарушений различного характера. Одним из вариантов таких нарушений является формирование антинейтро-фильных цитоплазматических антител (АНЦА), обусловливающих развитие так называемых АНЦА-ассоциирован-ных васкулитов: микроскопического полиангиита (МПА), гранулематоза с полиангиитом (ГПА, ранее известный как гранулематоз Вегенера) и эозинофильного гранулематоза с полиангиитом (ЭГПА, ранее известный как синдром Чарга-Стросса). Данную подгруппу васкулитов отличает злокачественное течение, что особенно сильно проявляется при поражении почек. Указанные особенности определяют исключительную важность понимания их патогенеза, клинической картины и лечения, что и будет рассмотрено в данной статье. Ключевые слова: АНЦА-ассоциированные васкулиты, ан-тинейтрофильные цитоплазматические антитела, микроскопический полиангиит, гранулематоз с полиангиитом, эозинофильный гранулематоз с полиангиитом. ANCA-ASSOCIATED VASCULITIS Kazachkina E.O., Liugai A. V., Khommyatov M.R., Voznyuk K.O. First Moscow state medical university named after I.M. Sechenov, Moscow, Russian Federation Annotation. Systemic vasculitides are a large group of diseases characterized by the development of an inflammatory process in the blood vessel wall due to different immune disorders. One of the variants of such disorders is the formation of antineutrophil cytoplasmic antibodies (ANCA), which lead to the development of so-called ANCA-associated vasculitides: microscopic polyan-giitis (MPA), granulomatosis with polyangiitis (GPA, Wegener's granulomatosis) and eosinophilic granulomatosis with polyan-giitis (EGPA, Charge-Strauss syndrome). This subgroup of vas-culitides is distinguished by rapid and malignant course, which is especially pronounced in case of kidney damage. These features determine the exceptional importance of understanding its pathogenesis and treatment that will be discussed in this article. Key words: ANCA-associated vasculitis, antineutrophil cyto-plasmic antibodies, microscopic polyangiitis, granulomatosis with polyangiitis, eosinophilic granulomatosis with polyangiitis.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК [1] M. Yates, R. Watts ANCA-associated vasculitis. Clinical Medicine 2017 Vol 17, No 1: 60-4 [2] C.G.M. Kallenberg Pathogenesis and treatment of ANCA-associated vasculitides Clin Exp Rheumatol 2015; 33 (Suppl. 92): p. 11-S14. [3] Gene V. Ball, Barri J. Fessler, S. Louis Bridges Oxford Textbook of Vasculitis (third edition). Autoantibodies in vasculitis; Pathogenesis of vasculitis. Oxford University Press, 2014, pp 61-93 [4] Jennette JC, Falk RJ, Bacon PA et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65: 1 - 11. [5] Carol A. Langford, Anthony S. Fauci Harrison's Rheumatology (fourth edition). The Vasculitis syndromes. McGraw-Hill Education, 2017, pp 156-177. [6] Stone JH, Merkel PA, Spiera R et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. New England Journal of Medicine, 2010; 363: 221 - 32. REFERENCES [1] M. Yates, R. Watts ANCA-associated vasculitis. Clinical Medicine 2017 Vol 17, No 1: 60-4 [2] C.G.M. Kallenberg Pathogenesis and treatment of ANCA-associated vasculitides Clin Exp Rheumatol 2015; 33 (Suppl. 92): p11-p14. [3] Gene V. Ball, Barri J. Fessler, S. Louis Bridges Oxford Textbook of Vasculitis (third edition). Autoantibodies in vasculitis; Pathogenesis of Vasculitis. Oxford University Press, 2014, pp 61-93. [4] Jennette JC, Falk RJ, Bacon PA et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65: 1 - 11. [5] Carol A. Langford, Anthony S. Fauci Harrison's Rheumatology (fourth edition). The Vasculitis syndromes. McGraw-Hill Education, 2017, pp 156-177. [6] Stone JH, Merkel PA, Spiera R et al. Rituximab versus cy-clophosphamide for ANCA-associated vasculitis. N Engl J Med 2010; 363: 221 - 32.
' Jones R.B., Tervaert J.W., Hauser T. et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. New England Journal of Medicine,2010; 363: 211 -20.
[7] Jones RB, Tervaert JW, Hauser T et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med 2010; 363: 211 - 20.
Введение. АНЦА (антинейтрофильные цитоплаз-матические антитела) - ассоциированные васкулиты (ААВ) - это группа сравнительно редких аутоиммунных заболеваний неизвестной этиологии, которые характеризуются иммунным воспалением и некрозом сосудистой стенки. Связь между АНЦА и васкулитом впервые была описана в 1812 году в коротком докладе, посвященном клиническому течению сегментарного некротизирующего гломерулонефрита у восьми пациентов. В 1980-е годы с помощью метода непрямой им-мунофлуоресценции были обнаружены перинуклеар-ные и цитоплазматические паттерны антител СЛАНЦА и Ц-АНЦА), а также выявлена специфичность
миелопероксидазы (МПО) и протеиназы-3 (Пр3). ААВ включают гранулематоз с полиангиитом (ГЛА, ранее известный как гранулематоз Вегенера), микроскопический полиангиит (МЛА) и эозинофильный гранулема-тоз с полиангиитом (ЭГЛА, ранее известный как синдром Чарга-Стросса).
Классификация и эпидемиология. В 1990 году Американская коллегия ревматологов разработала классификационные критерии ГЛА и ЭГЛА. На Международной консенсусной конференции в Чапел-Хилле в 1994 году впервые были даны (пересмотрены в 2012 году) определения ААВ (Таблица 1).
Определения ААВ, принятые на конференции в Чапел-Хилл
АНЦА-ассоцииро-ванный васкулит (ААВ) Некротизирующий васкулит с небольшим количеством иммунных отложений или без них, преимущественно поражающий небольшие сосуды (например, капилляры, венулы, арте-риолы и небольшие артерии) и связанный с мПО-АНЦА или Пр3-АНЦА. Не у всех пациентов выявляются АНЦА.
Гранулематоз с полиангиитом (Вегенера) Некротизирующее гранулематозное воспаление, обычно поражающее верхние и нижние дыхательные пути, в сочетании с некротизирующим васкулитом, поражающим преимущественно мелкие и средние сосуды (например, капилляры, венулы, артериолы, артерии и вены). Как правило, сопровождается некротизирующим гломерулонефритом.
Эозинофильный гранулематоз с полиангиитом (Чарга - Стросса) Эозинофильное и некротизирующее гранулематозное воспаление, часто поражающее дыхательные пути, в сочетании с некротизирующим васкулитом, преимущественно затрагивающим сосуды малого и среднего калибра и связанным с астмой и эозинофилией. АНЦА чаще встречается при наличии гломерулонефрита.
Микроскопический полиангиит Некротизирующий васкулит с небольшим количеством иммунных отложений или без них, преимущественно поражающий небольшие сосуды (т.е. капилляры, венулы или артериолы). Может присутствовать некротизирующий артериит с вовлечением артерий малого и среднего калибра. Некротический гломерулонефрит, как и легочный капиллярит, встречается часто.
Уровень заболеваемости ГЛА, МЛА, ЭГЛА в Европе составляет 2,1 - 14,4; 2,4 - 10,1; и 0,5 - 3,7 на миллион человек соответственно, а распространенность ААВ оценивается как 46 - 184 на миллион человек. Данная патология чаще выявляется у лиц старше 60 лет, мужчины страдают ААВ относительно чаще женщин. Лятилетняя выживаемость для ГЛА, МЛА и ЭГЛА составляет 74-91%, 45 - 76%, 60-97% соответственно.
Латогенез. Как уже упоминалось, АНЦА присутствует почти у всех пациентов с ААВ (таблица 1). Кроме того, уровень АНЦА возрастает на фоне предшествующего рецидива ААВ, хотя сила данной
ассоциации варьирует в разных исследованиях. Вероятно, изменения в специфичности эпитопа или эпигенетических модификациях АНЦА могут, помимо уровней антител, влиять на их патогенность. Таким образом, клинические наблюдения показывают, что АНЦА вовлечены в патогенез, но данные выводы не являются окончательными. Широкомасштабные исследования генома показали выраженную генетическую ассоциацию с аутоантителами: МРО-АНЦА ассоциируется с НЬА-БО, НЬА-ЭР, ЛрЗ-АНЦА, с самой Лр3 и ее анти-протеиназой (а1-антитрипсин). Это также говорит о том, что аутоантитела играют ключевую роль в развитии ААВ.
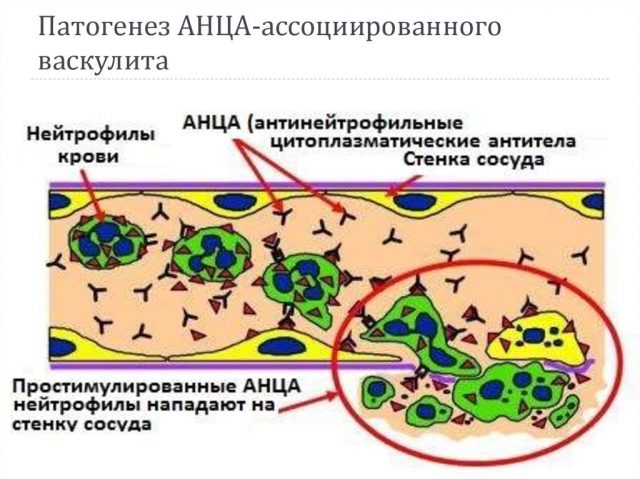
Исследования in vitro показали, что АНЦА способны дополнительно активировать нейтрофилы для получения активных форм кислорода и высвобождения литических ферментов. В контексте эндотелиаль-ных клеток это приводит к устойчивой адгезии нейтро-филов к эндотелию с последующим отделением и лизисом эндотелиальных клеток. Альтернативный путь системы комплемента также задействован в данном процессе. Выделение фактора B, пропердина, C3, активных форм кислорода активированными нейтрофи-лами приводит к активации системы комплемента с образованием C5a, который является очень сильным хе-моаттрактантом для других нейтрофилов. АНЦА-ин-дуцированная активация нейтрофилов также стимулирует адаптивный иммунный ответ сначала путем индуцирования синтеза внеклеточных ловушек нейтрофилов, экспрессирующих Пр3 и МПО на своей поверхности, что способствует аутоиммунному ответу, а затем высвобождением активирующего B-клетки фактора. Таким образом, АНЦА-индуцированная активация нейтрофилов играет первостепенную роль в патогенезе болезни.
Экспериментальные исследования in vivo подтверждают роль АНЦА в развитии данной группы васкули-тов. Когда спленоциты от МПО-дефицитных мышей, иммунизированных мышиным МПО, переносятся на обычных реципиентных мышей, у последних развивается пауци-иммунный некротизирующий и полулунный гломерулонефрит (НПГН) и геморрагический легочный капиллярит. Перенос только IgG приводит к появлению пауци-иммунного НПГН у реципиентов. Альтернативный путь комплемента также участвует в данном процессе, поскольку у мышей-реципиентов с дефицитом фактора B и C5 не наблюдается развития заболевания, а блокада С5а-рецептора пероральным препаратом защищает от развития МПО-АНЦА НСГН. Разработка модели животных для ГПА, связанного с ПрЗ-АНЦА, была менее успешной. Инъекция человеческого ПрЗ-АНЦА вместе с липополисахаридом гуманизированным мышам приводила к НСГН и легочному капилляриту у меньшего количества мышей, при этом гранулематозное воспаление, характерное для человеческого GPA, не развивалось. Таким образом, экспериментально in vivo подтверждается выраженная патогенетическая МПО-АНЦА, и в куда меньшей степени - роль Пр3-АНЦА.
Гранулематозное воспаление предполагает участие клеточного иммунитета. Действительно, количество эффекторных CD4-положительных Т-клеток памяти возрастает в периферической крови пациентов с ГПА, и они могут быть выявлены в моче при прогрессирова-нии почечной недостаточности. Кроме того, синтез ин-терлейкина (ИЛ) - 17 и ИЛ-23 увеличивается при активном ГПА в сочетании с ПР3 -специфичными T-
хэлперами-17. Более того, растет синтез ИЛ-15 и CD4-позитивных Т-клеток, экспрессирующих NKG2D, тогда как рецептор этих Т-клеток на эндотелии, то есть М1С-А, также проявляет повышенную экспрессию. Лри ГЛА растет количество и ГЬ-21 с фолликулярными хелперными Т-клетками, способствующими гуморальному иммунному ответу. Существует предположение, что при ГЛА происходит образование дефектных регу-ляторных Т-клеток и, возможно, регуляторных В-кле-ток.
Клиническая картина. Спектр клинических проявлений ААВ очень широк: от кожной сыпи до фульми-нантного мультисистемного заболевания.
Характерным признаками гранулематозного поли-ангиита (ГЛА) является патология верхних дыхательных путей, возникающая у 95% пациентов. Часто возникают боль в носовых пазухах, гнойные или кровянистые выделения из носа, иногда с изъязвлениями. Такие симптомы часто осложняются перфорацией перегородки, ведущей к седловидной деформации. Также при данном заболевании поражаются сосуды почек, что можно заподозрить при наличии признаков активного воспаления мочевыводящих путей по данным микроскопии осадка мочи.
Микроскопическим полиангиитом (МЛА) чаще страдают пациенты старшего возраста. Начало болезни может быть постепенным и сопровождаться лихорадкой, потерей веса и мышечно-скелетными болями в качестве симптомов, однако чаще болезнь манифестирует остро. Гломерулонефрит развивается примерно у 79% и быстро приводит к почечной недостаточности. Кровохарканье может явиться первым симптомом легочного кровотечения. Лолиневропатии и проявления кожного васкулита также могут присутствовать.
Эозинофильный гранулематозный полиангиит (ЭГЛА, синдром Чарга-Стросса) также характеризуется лихорадкой, недомоганием, анорексией и потерей веса, а также мультисистемностью поражения. В клинической картине доминируют легочные проявления, в виде астматических приступов и наличия легочных инфильтратов. Лолиневропатия - второе наиболее частое клиническое проявление, имеющееся более чем у 72% пациентов. Аллергические риниты и синуситы развиваются примерно у 61% пациентов и относятся к ранним признакам ЭГЛА. Лоражение сердца регистрируется у 14% и часто является причиной летального исхода. Кожные проявления включают пурпуру, а также кожные и подкожные узелки. Лоражение почек при ЭГЛА встречается реже, по сравнению с ГЛА и МЛА, и характеризуются более легким течением.
Диагностика. Относительная редкость возникновения и неспецифичность проявлений ААВ часто затрудняют постановку верного диагноза. Необходим
Журнал включен в Перечень рецензируемых научных изданий ВАК
тщательный и систематизированный подход. Требуются подробное изучение анамнеза, физикальный осмотр, анализ лабораторных данных крови (маркеры воспаления), оценка показателей функции почек (кре-атинин, мочевина, электролиты, объем диуреза, наличие белка и эритроцитов), серологическое тестирование, включающее АНЦА, антиядерные антитела и антитела базальным мембранам клубочков почек (дифференциальный диагноз с системной красной волчанкой и синдромом Гудпасчера). Должны быть исключены инфекция и бактериальный эндокардит. Необходимо провести рентгенографию грудной клетки. Для более детального анализа грудной клетки, головного мозга, глазницы и уха, носа и горла могут потребоваться данные КТ или МРТ.
Морфологическое исследование - золотой стандарт диагностики любого заболевания, однако лечение не должно откладываться до получения результатов биопсии. Ориентиром может служить показатель активности в соответствии с Бирмингемским индексом клинической активности васкулита BVAS (Birmingham Vasculitis Activity Score).
Роль последовательного измерения АНЦА для определения тактики лечения в период ремиссии остается спорной. Некоторые данные свидетельствуют о том, что пациенты, у которых АНЦА остаются или повышаются более чем в четыре раза, имеют больший риск рецидива. Принято считать, что любое изменение тактики лечения должно базироваться на данных клинического обследования, а не только на измерении АНЦА.
Лечение. До открытия эффективной терапии для АНЦА-васкулитов было характерно быстрое развитие летального исхода, в течение нескольких месяцев с момента постановки диагноза. Изолированное применение глюкокортикоидов приводило к симптоматическому улучшению, но мало влияло на течение заболевания. Применение циклофосфамида кардинально изменило течение заболевания, приведя к заметному улучшению у 90% пациентов, полной ремиссии у 75% и увеличению пятилетней выживаемости до показателя 80%.
Достижение ремиссии. Достижение ремиссии с использованием циклофосфамида (или ритуксимаба) должно рассматриваться у всех пациентов, имеющих впервые выявленный васкулит. Использование схем
лечения, включающих метотрексат или микофенолята мофетил, допустимо только у пациентов, не имеющих риска развития жизнеугрожающих состояний.
Циклофосфамид. Исследование CYCAZAREM показало, что лечение циклофосфамидом (2 мг/кг/сут) совместно с ГКС в течение 3-6 месяцев приводило к ремиссии более чем в 90% случаев. Также было выявлено, что внутривенная пульс-терапия циклофосфамидом (10-15 мг/кг) по эффективности не уступает перо-ральному приему препарата и характеризуется более низкой кумулятивной дозой вещества, что снижает количество побочных эффектов. Долгосрочное наблюдение за участниками исследования не выявило существенных различий в функции почек или выживаемости.
Ритуксимаб. Ритуксимаб при ААВ был протестирован в двух рандомизированных контролируемых испытаниях: RAVE и RITUXVAS. В обоих исследованиях участники получали ритуксимаб в дозировке 375 мг/м2 один раз в неделю и изначально высокие дозировки ГКС с последующим их уменьшением. В обоих исследованиях дозировка ритуксимаба была идентична таковой в исследованиях с циклофосфамидом, при этом данное лечение оказалось более эффективным в достижении рецидивов ААВ по данным RAVE. Необходимо отметить, что наибольший эффект был обнаружен у PRS-положительных пациентов.
Поддержание ремиссии. После успешного достижения ремиссии рекомендуется замена исходного им-мунодепрессанта на поддерживающие дозы азатио-прина или метотрексата. На сегодняшний день недостаточно данных, позволяющих рассчитать точную продолжительность курса поддерживающей терапии. Известно, что раннее прекращение терапии (
Читайте также:


