Что такое фаговая инфекция
1. продуктивная (взаимодействие фага с микробной клеткой) инфекцию, завершающуюся образованием жизнеспособного потомства, определяют как недефектные. Для всех недефектных фагов свойственно два состояния: состояние внеклеточного, или свободного, фага (иногда его называют также зрелым фагом) и состояние вегетативного фага. Для некоторых так называемых умеренных фагов возможно еще и состояние профага.
Иногда инфекция чувствительных клеток недефектным фагом не завершается образованием жизнеспособного потомства. Это может быть в двух случаях: при абортивной инфекции или вследствие лизогенного состояния клетки при инфекции умеренным фагом.
3. абортивная Причиной абортивного характера инфекции может быть активное вмешательство тех или иных систем клетки в ход инфекции, например разрушение введенного в бактерию генома фага, или отсутствие в клетке какого-то продукта, необходимого для развития фага, и т.д.
36. Какая разница между вирулентным и умеренным бактериофагом?
Вирулентные фаги, проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и весьма схож с процессом взаимодействия вирусов человека и животных с клеткой хозяина, вот они:
1) адсорбция — с помощью нитей хвостового отростка;
2) проникновение в клетку;
3) репродукция белка и нуклеиновой кислоты внутри клетки;
4) сборка и формирование зрелых фагов;
5) лизис клетки, выход фага из нее.
После биосинтеза фаговых компонентов и их самосборки в бактериальной клетке накапливается до 200 новых фаговых частиц. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Один литический цикл (от момента адсорбции фагов до их выхода из клетки) продолжается 30—40 мин. Процесс бактериофагии проходит несколько циклов, пока не будут лизированы все чувствительные к данному фагу бактерии.
Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий.
Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков.
Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т. е. вести себя как вирулентный фаг, лизирующий бактерии.
Доказано индуцирующее действие магнитных полей на лизогенные системы. При отщеплении профаг переходит в вегетативную (размножающуюся) форму и лизирует клетку. Выделившиеся фаговые частицы не способны к репродукции в лизогенных по тому же фагу бактериях, но могут вызывать лизис нелизогенных или лизогенных по другим фагам родственных клеток.
Изредка лизогенные бактерии утрачивают фаг без перехода его в вегетативную форму. Так, в результате лизогенизации у некоторых бактерий изменяются форма и цвет колоний, нетоксигенные штаммы коринебактерий дифтерии превращаются в токсигенные, а у сальмонелл появляются новые антигенные детерминанты. Изменчивость, формирующаяся под влиянием профага, получила название фаговой конверсии.
При индукции лизогенных бактерий в профаг нередко включаются гены бактерий, но чаще они замещают некоторую часть того его участка ДНК, которая остается в геноме бактериальной клетки.
Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства. Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов.
37.Что такое лизогения? Лизогенная конверсия?
Лизогения – это способность различные штаммов бактерий. Содержащих бактериофаги, лизировать другие штаммы бактерий, не разрушаясь при этом. Геном бактерии и умеренного фага сосуществуют в виде единой хромосомы, в которой ДНК фага включена в ДНК хромосомы бактерий. Передается по наследству дочерним клеткам, фаговый геном освобождается с последующим лизисом бактерии.
Лизогенная конверсия – это ассоциация фаговой ДНК с геном бактерии. Вызывает изменение морфологии и антигенных свойств бактерии.
Как протекает фаговая инфекция
Начинается все с того, что вирусная частица случайно сталкивается с клеткой бактерии. Фаг способен заразить вовсе не любую бактерию. Например, фаг, заражающий кишечную палочку, не замечает – сколько бы он с ними ни сталкивался – клетки стафилококка, и наоборот. Больше того, у той же кишечной палочки известно много разновидностей (их называют штаммами), и фаги, как правило, способны очень хорошо их различать. Они охотно заражают одни штаммы и совершенно игнорируют другие. Почему так происходит? Дело в том, что на поверхности бактериальной клетки есть структуры, к которым базальная пластинка фага по форме подходит, как ключ к замку. Такие структуры называются рецепторами. Есть рецептор для данного фага – фаг способен заражать эту бактерию, а эта бактерия способна стать его хозяином. Не подходит ключик? – Ну, стало быть, эта бактерия не для него.
Возникает вопрос, почему бактериальная клетка вынуждена жить под постоянной угрозой фаговой интервенции, не проще ли незаметно потерять где–то эти рецепторы и стать неприступной для фага? Но фаг тоже не прост, он использует в качестве причала структуры, предназначенные не для него, а совсем для других целей и жизненно важные для клетки, у которой, стало быть, есть веские причины не лишаться их.
Если фаг и бактерия узнали друг друга, фаг прочно связывается с ее поверхностью. Дальнейшая задача вируса состоит в том, чтобы ввести свой генетический материал внутрь бактериальной клетки, не нанеся ей – до поры до времени – вреда. Вот как это делает, например, фаг Т4, заражающий кишечную палочку – обычного обитателя нашего кишечника.
Бактериофаг Т4 является одним из наиболее сложно устроенных вирусов. Несколько вытянутая головка служит контейнером для хранения нуклеиновой кислоты. Сокращение чехла обеспечивает прободение бактериальной стенки. По внутреннему каналу стержневого отростка фаговая ДНК перемещается внутрь бактериальной клетки. К шестиугольной базальной пластинке крепятся длинные нити – фибриллы, которые обеспечивают начальный контакт фага с поверхностью бактерии. Чехол с одной стороны жестко закреплен на фаговой головке, а с другой прикреплен к базальной пластинке, находящейся на конце отростка. Чехол заметно короче отростка, поэтому, подобно пружине, пребывает в растянутом состоянии. После стыковки фага с бактерией форма базальной пластинки меняется, она больше не может удерживать чехол в растянутом состоянии, тот сжимается, и жесткий стержень как бы выстреливает из чехла, проминая клеточную стенку бактерии.

Бактериофаг Т4: 1 – головка; 2 – отросток, покрытый чехлом;3 – базальная пластинка; 4 – длинные фибриллы
Одного механического усилия недостаточно. Прогибаясь, клеточная стенка успешно сопротивляется попытке фагового отростка проткнуть ее, но оказывается бессильной противостоять секретному оружию фага – ферменту лизоциму, который находится вблизи острия отростка и, войдя в плотный контакт с клеточной стенкой, моментально прогрызает в ней дыру. Наконец–то стержень отростка пронзает клеточную стенку насквозь. Тут же по внутреннему каналу отростка, как сквозь игольное ушко, в бактерию впрыскивается нуклеиновая кислота, до того момента покоившаяся в фаговой головке.
На первый взгляд, задача может показаться не слишком сложной, но надо учесть, что молекула ДНК – очень длинная и чрезвычайно плотно упакована. Если уж сравнивать внутренний диаметр канала с игольным ушком, то в этом масштабе длина нити ДНК будет около метра, а скорость ее разматывания напоминает разматывание лески с катушки спиннинга при забрасывании блесны. И протащить нить надо так, чтобы не порвать ее. Порванная даже в одном месте, она уже неинфекционна и, стало быть, совершенно безвредна для бактерии и абсолютно бесполезна для фага.
Большинство фагов не имеют сократимого чехла, не говоря уже о том, что у многих и отростка–то никакого нет, ни большого, ни маленького. А преграда на пути серьезная – клеточная стенка бактерии. Она состоит из нескольких слоев и, подобно неповрежденной коже человека или кутикуле на поверхности листа, совершенно непроницаема для вируса. Как–то ее надо продырявить, и, так или иначе, все фаги умеют это делать.
Например, многие фаги связываются только с половыми пилями – нитевидными выростами на мужских клетках кишечной палочки. Да, как ни удивительно, у бактерий есть пол, мужской и женский, а у мужских клеток есть вырост, с помощью которого они конъюгируют с женской клеткой. Облепив вырост, фаги внедряют свою нуклеиновую кислоту в клетку бактерии. В общем, тем или иным способом, но фаги вводят свой генетический материал внутрь бактериальной клетки, оставляя на поверхности пустую, никому уже не нужную белковую оболочку.

Фаговая ДНК проникла внутрь бактерии. 1 – фаговая ДНК; 2 – стенка бактериальной клетки; 3 – сократившийся чехол; 4 – длинные фибриллы
С этого момента все меняется для бактериальной клетки. Вирус на время как бы исчезает. В клетке, куда проникла фаговая нуклеиновая кислота, не удается обнаружить никаких вирусных частиц. Более того, зараженная клетка выглядит совершенно нормальной. Но на самом деле жить ей осталось всего несколько минут. Под покровом клеточной стенки фаг начинает свое черное дело. Он заставляет все клеточные структуры работать на себя. Все ресурсы клетки отныне тратятся только на размножение фаговой ДНК, самой клетке уже ничего не достается. Белки образуются только фаговые, синтез клеточных компонентов совершенно подавлен или осуществляется лишь в той мере, в которой это нужно фагу. Многочисленные копии вновь образованной фаговой ДНК упаковываются в форме многогранника. Сверху они покрываются фаговым белком, и возникает зрелая фаговая головка с упакованной внутри нее ДНК. В другом месте клетки, в другом ее помещении налажено производство и сборка других фаговых белков, из которых образуется хвостовой отросток. Наконец, отростки и головки соединяются в полноценную фаговую частицу. Проникла в бактерию нуклеиновая кислота одной–единственной фаговой частицы, а теперь, через полчаса, их уже больше сотни. Им тесно, им пора покидать эту бактерию, с которой уже нечего взять. Вот только как это сделать? Бактерия мертва, но ее клеточная стенка все еще надежно удерживает взаперти многочисленное фаговое потомство.

Продольный разрез фага с пустой головкой: 1 – фибриллы, прикрепленные к головке;2 – "воротничок"; 3 – отросток;4 – канал, проходящий внутри отростка
И вновь приходит на помощь фаговый лизоцим. Он подгрызает клеточную стенку обреченной бактерии изнутри до тех пор, пока она достаточно не истончится и в конце концов не разорвется. Фаговое потомство выходит наружу и немедленно набрасывается на соседние бактерии, которые ожидает та же участь.
Такая инфекция называется продуктивной, а фаги, вызывающие продуктивную инфекцию – вирулентными.
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
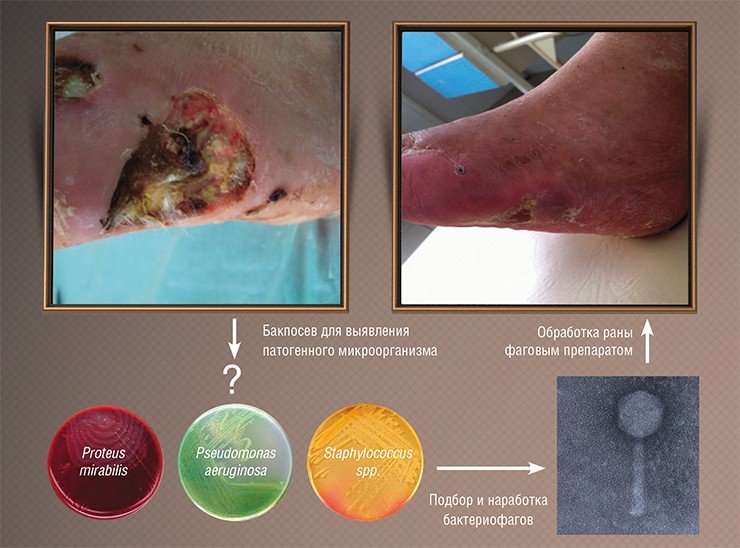
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
- 1066
- 0,9
- 0
- 0
Схематичное изображение фага на поверхности клетки
То, что слизь, вырабатываемая практически всеми организмами в самых разных местах и ситуациях, способствует защите от бактериальных инфекций, было известно давно, однако недавние работы ученых из Университета Калифорнии в Сан-Диего позволяют по-новому посмотреть на то, как именно она это делает. В самых разных слизях содержатся белки, гидролизующие клеточные стенки бактерий (например, лизоцим). Также в составе слизей есть иммуноглобулины. Однако сейчас выдвигается гипотеза о том, что решающим действующим компонентом ответа на инфекции могут быть отнюдь не белки, а бактериофаги, которых в слизях оказывается чрезвычайно много.
Бактериофаги (бактериальные вирусы) — это наиболее распространенные организмы на нашей планете. В прибрежных тропических водах концентрация фаговых частиц может достигать 10 7 на миллилитр жидкости, что на порядок больше количества бактерий, которых они заражают, в этих же биотопах. Всего же число фаговых частиц в биосфере может достигать 10 30 штук [1], [2]. Такое огромное количество индивидуальных организмов не может не быть мощнейшим фактором в экологии сообществ и эволюции биосферы в целом. Так, например, несмотря на то, что гены бактерий при заражении фагами попадают в новые фаговые частицы лишь один раз на каждые 10 8 инфекций, генетическая трансдукция (горизонтальный перенос бактериальных генов фагами) происходит в океане с частотой примерно 20 миллионов миллиардов раз в секунду [3].
Разумеется, и наши организмы, населенные большим количеством бактерий, не могут при этом не нести в себе существенного числа бактериофагов. В наших телах они обитают в основном на поверхности кожи и слизистых оболочек, в легких, а также во рту и в остальных частях желудочно-кишечного тракта.
В организме человека бактериальных клеток чуть ли не в 10 раз больше, чем наших собственных [4]. Примерно 2–4 килограмма нашего веса приходится на долю микробиома — микробного сообщества, для которого мы являемся средой обитания. Его состав и общее состояние является важным фактором нашего здоровья — какие-то бактерии нам помогают (например, переваривать пищу), а какие-то вызывают заболевания. Нам важно контролировать свой микробиом, поддерживая полезных микроорганизмов и репрессируя вредных. И мы, разумеется, не одиноки в этой своей потребности, — эволюция механизмов взаимодействия многоклеточных организмов с микробами началась с появлением многоклеточных. И слизь — одно из первых эволюционных изобретений в этой области. Практически все животные так или иначе используют слизь в качестве барьера между окружающей средой и тканями. В составе слизи можно секретировать антитела, гидролитические белки и прочие факторы, ограничивающие рост опасных бактерий. А недавние исследования показывают, что слизь может стать отличной средой для налаживания уникального симбиоза между многоклеточными животными и бактериофагами.
Форест Роуэр из Университета Калифорнии в Сан-Диего занимается изучением состава и свойств слизей разных животных (преимущественно морских) на протяжении нескольких лет. Его группе удалось обнаружить, что количество бактериофагов в этих субстанциях превышает их количество в окружающей среде приблизительно в четыре раза. А в своей последней работе коллективу удалось продемонстрировать, как фаги взаимодействуют с компонентами слизи и почему это взаимодействие может быть основой взаимовыгодного симбиоза. Выяснилось, что отдельные поверхностные белки фаговых капсидов, своей структурой напоминающие иммуноглобулины, в состояние присоединяться к гликанам, входящим в состав основного компонента слизи — муциновых комплексов. Муцин — это гликопротеид, содержащий помимо белковой основы большое количество разветвленных олигосахаридов, которые чрезвычайно разнообразны по своему составу и длине, что дает им возможность взаимодействовать с широким диапазоном разных бактериофагов [5].
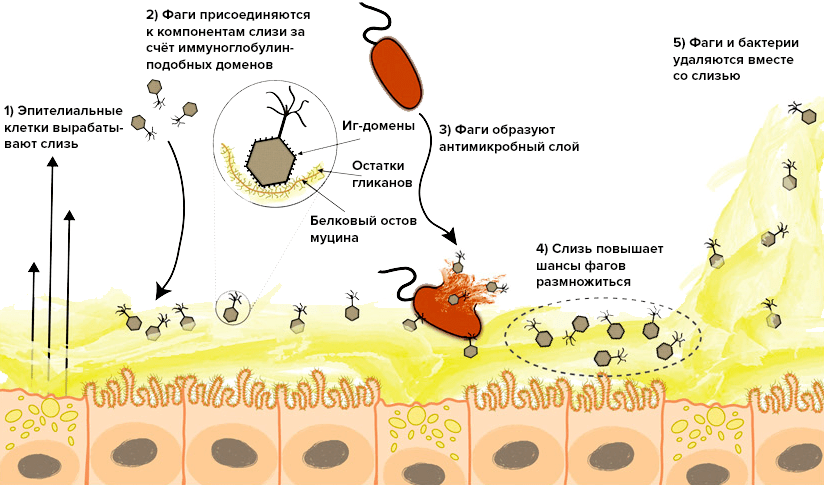
Рисунок 1. Поведение бактериофагов на поверхности слизистых оболочек
Публикация Барра и Роуэра нашла живой отклик в сообществе микробиологов и вирусологов. Ротем Сорек, микробиолог из Института Вейсмана в Реховоте, называет пример такого симбиоза уникальным, а его коллега из Университета Пеннсильвании в Филадельфии Фредерик Бушмен находит идею о том, что фаги могут быть компонентом врожденного иммунитета, оригинальной и вдохновляющей. Сам Джереми Барр считает, что фаги стали населять слизистые оболочки самых разных организмов с момента возникновения слизи в результате эволюции.
Бактериофаги— вирусы бактерий. Бактериофагия — процесс взаимодействия фагов с бактериями, заканчивающийся очень часто их разрушением.
Различают фаги инфекционные, т. е. способные вызвать разные формы фаговой инфекции, и неинфекционные (вегетативные), или незрелые, фаги, находящиеся еще в стадии размножения. В свою очередь инфекционные фаги разделяют на покоящиеся (находящиеся вне клетки), вирулентные — способные вызвать продуктивную форму инфекции, и умеренные фаги — способные вызывать не только продуктивную, но и редуктивную фаговую инфекцию.
Механизм взаимодействия вирулентного фага с микробной клеткой.
1)Адсорбция фагов на клеточной поверхности бактерий при помощи специфических рецепторов (белков-лоцманов), которые располагаются на кончике нити, шипа или хвостика. В свою очередь, на клеточной стенке бактерии располагаются ее фагоспецифические рецепторы, распознаваемые фагом.
2)Проникновение фагового генома через клеточную стенку и цитоплазматиче- скую мембрану внутрь клетки и освобождение его от оболочки (раздевание фага).
3)Установление фагового генома с помощью белка-лоцмана для реализации содержащейся в геноме информации:
4)Репликация фаговой геномной ДНК или РНК.
5)Сборка вновь синтезированных вирионов — заключение геномной НК в белковую оболочку, морфогенез фагов.
6) Выход вновь синтезированных фагов из клетки:
а) путем отпочковывания;
б) путем лизиса клетки изнутри. Он осуществляется свободным лизоцимом и вызывает гибель клетки.
Особенности морфогенеза фагов.
Морфогенез мелких фагов протекает по типу самосборки. У крупных фагов этот процесс носит более сложный характер. Например, морфогенез фага Т4 требует активности более чем 40 генов и протекает при участии трех самостоятельных линий. На одной из них происходит сборка хвостика (участвует около 20 генов), на другой — головки фага (не менее 16 генов) и на третьей — сборка ворсинок (5 генов). Соединение хвостика с головкой не требует участия генов, однако оно не может произойти до тех пор, пока и хвостик, и головка не будут смонтированы полностью. Точно так же ворсинки могут присоединяться к хвостику только после того, как он соединится с полностью готовой головкой. Благодаря строгому генетическому контролю со стороны фага обеспечивается последовательность и согласованность всех процессов его внутриклеточного размножения.
Выход сформировавшихся фагов в большинстве случаев происходит благодаря лизису изнутри свободным лизоцимом. Он синтезируется на самом последнем этапе размножения фага. Иногда бывает лизис бактерий извне как следствие адсорбции многих фагов на одной клетке, но при этом размножения фагов не происходит.
Обычно же после внедрения фагового генома в клетку у нее возникает состояние иммунитета к суперинфекции данным фагом, т. е. проникновение других фаговых геномов становится невозможным. Иммунитет обеспечивается особым цитоплазматическим репрессором.
6. Методы культивирования вирусов. Заражение животных, куриных эмбрионов. Получение культур клеток. Среды, применяемые для культур клеток. Цитопатический эффект и его проявления. Реакция гемадсорбции.
Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах.
Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые.
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови.
Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование in vitro, и сохраняются на протяжении нескольких десятков пассажей.
Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьяны и др.
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток.
Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности.
Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз.
Более точным количественным методом учета отдельных вирусных частиц является метод бляшек.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям.
Для получения чистых культур риккетсий, хламидий. и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках.
О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами.
К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов.
Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки).
Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
7. Особенности размножения вирусов, геном которых представлен однонитчатой ДНК. Репликативная и промежуточная репликативные формы. Особенности размножения вирусов, геном которых представлен однонитчатой РНК.
У вирусов, геном которых представлен однонитевой РНК, ее репликация происходит по следующей схеме: вначале на вирионной РНК (вРНК) синтезируются комплементарные ей РНК (кРНК). Этот процесс катализируется специфической РНК-репликазой I. Затем на кРНК синтезируется комплементарная ей, но идентичная исходной вирионная РНК (вРНК), этот процесс также катализируется специфической репликазой И. Таким образом, репликация идет по схеме:
вРНК > кРНК > вРНК.
Общие закономерности размножения вирусов.
Во-первых, все РНК-содержащие вирусы, кроме вирусов гриппа и ретровирусов, размножаются в цитоплазме. Для своего размножения вирусы гриппа А и В и ретровирусы проникают в ядро, что связано с особенностями поведения их генома. Во-вторых, размножение всех ДНК-содержащих вирусов, кроме вирусов оспы, протекает в ядре, где происходит транскрипция и репликация их геномных нуклеиновых кислот, и в цитоплазме, где происходит трансляция вирусных белков, их процессинг и морфогенез вирионов. Лишь размножение вирусов группы оспы происходит в цитоплазме клетки, поскольку они обладают собственными системами транскрипции.
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


