Что такое глюкокортикоидный остеопороз
Остеопороз вследствие длительного приема глюкокортикоидов — наиболее типичная и частая форма лекарственного остеопороза. Остеопороз, возникающий вследствие синдрома Иценко-Кушинга , встречается гораздо реже.
Остеопороз, вызванный глюкокортикоидами - патогенез (основные положения):
Глюкокортикоидные гормоны используются для лечения воспалительных и аутоиммунных заболеваний, неоплазий, назначаются после трансплантаций органов. Главным действующим моментом при развитии остеопороза является угнетение процессов образования костной ткани вследствие нарушения дифференциации остеобластов и их функций. С самого начала курса приема кортикостероидов отмечается усиление процессов костной резорбции, что объясняет ранние потери массы костной ткани, характерные для стероидного остеопороза . Глюкокортикоиды угнетают формирование костной ткани и воздействуют на ее метаболизм посредством различных механизмов, что увеличивает вероятность переломов.
Непосредственные эффекты действия глюкокортикоидов на костную ткань многочисленны:
- подавление пролиферации, дифференциации и функциональных возможностей остеобластов;
- усиление апоптоза остеобластов;
- стимуляция активности остеокластов;
- снижение абсорбции кальция в кишечнике;
- усиление экскреции кальция с мочой;
- увеличение секреции паратгормона;
- уменьшение секреции кальцитонина;
- уменьшение количества участков обновления костной ткани;
- образование участков асептического некроза костной ткани;
- увеличение синтеза коллагеназ;
- уменьшение синтеза кортикотропина и гонадотропина;
Опосредованные (вследствие взаимодействия с другими факторами) эффекты влияния глюкокортикоидов на костную ткань:
- увеличение чувствительности остеобластов к паратиреоидному гормону (ПТГ, паратгормон) и к активной форме витамина D;
- снижение синтеза простагландина E;
- снижение локального синтеза инсулин-подобного фактора роста (IGF)-I;
- влияние на протеины, связывающиеся с IGF;
Иногда причины потерь костной ткани объясняют следствием заболевания, по поводу которого назначаются глюкокортикоиды (болезнь Крона, ревматизм, коллагенозы, трансплантация органов, бронхиальная астма, злокачественные лимфомы, миеломная болезнь и др.); то есть, кортикостероидная терапия не является в таких случаях первопричиной, но действует в качестве добавочного фактора, вызывающего остеопороз. Этому способствуют и хроническое воспаление, нарушенное питание, пониженная физическая активность.
Некоторые особенности кортикостероидного остеопороза:
Самыми уязвимыми категориями для этой разновидности остеопороза являются женщины в постменопаузе, дети и молодые мужчины.
Для остеопороза, вызванного глюкокортикоидами, характерен низкий уровень обновления костной ткани и переломы, которые имеют место у 30–50% больных. Страдают прежде всего губчатые кости, что выражается в высоком риске возникновения переломов позвоночного столба (тела позвонков), для которых характерно отсутствие жалоб и возникновение в первые же месяцы от начала кортикостероидной терапии. Другие типичные локализации переломов — шейка бедренной кости, ребра.
Наивысший процент возникновения патологических переломов наблюдается у женщин в постменопаузе и пожилых мужчин . У лиц, получающих высокие дозы кортикостероидов циклами, риск возникновения переломов так же высок. Степень риска понижается после отмены кортикостероидов, но время, которое для этого требуется, бывает весьма разным.
Риск возникновения остеопороза при ингаляциях глюкокортикоидов и при местном использовании при болезни Крона, язвенном колите невысок, потому что количество попадающего в организм препарата ограничено. Риск возникновения переломов у лиц, использующих ингаляторы с гормонами, может несколько повышаться, но этот эффект относят обычно на счет основного заболевания, а не кортикостероидной терапии. Относительная безопасность препаратов, используемых в ингаляторах (по мере повышения степени риска):
- будесонид (Budesonide);
- беклометазон дипропионат (Beclomethasone);
- триамцинолон (Triamcinolone);
Лечение остеопороза, возникшего вследствие употребления глкокортикоидов:
Учитывая способность кортикостероидных препаратов вызывать остеопороз и конкретные степени риска для данного больного, общие рекомендации при назначении лечения могут выглядеть так:
- выбор возможно менее продолжительной схемы лечения кортикостероидами;
- использование препаратов с наиболее коротким периодом полувыведения;
- использование местных форм, где возможно (кремы, спреи, и т. д. );
- стимуляция физической активности и тренировки мышечной системы больного;
- назначение витамина D (
1000 IU в день); контроль количества кальция, употребляемого с продуктами и добавками (
1000–1500 мГ в день);
Приемлемая продолжительность лечения больных, получавших кортикостероидную терапию в суточных дозировках не менее 5 мГ, составляет примерно 3–6 мес. Практически всегда рекомендуется назначение витамина D и препаратов кальция. Весьма полезно помнить о том, что бисфосфонаты могут предотвратить раннюю потерю костной ткани. Алендронат, ризедронат и золедроновая кислота предотвращают потери и восполняют минеральную плотность костей при терапии глюкокортикоидами примерно в 2 раза эффективнее, чем витамин D и кальций.
Еще более действенным методом лечением остеопороза, вызванного приемом кортикостероидных препаратов, представляется терапия анаболическими средствами или такими лекарствами, как терипаратид (Teriparatide — рекомбинантный человеческий паратиреоидный гормон), который эффективнее, чем алендронат увеличивает показатели минеральной плотности костной ткани и снижает степень риска возникновения переломов тел позвонков.
- необходимость физической активности и тренировки костно-мышечной системы;
- обеспечение поступления в организм необходимых количеств кальция и витамина D;
- выявление и лечение сахарного диабета, возникшего на почве приема глюкокортикоидов;
- выявление и лечение гипогонадизма. Назначение тестостерона мужчинам, уровень тестостерона сыворотки которых понижен вследствие приема кортикостероидов, может увеличить минеральную плотность костей позвоночника в поясничном отделе на 5% за год.
- раннее назначение современных азотсодержащих бисфосфонатов (алендронат 70 мГ 1 раз в неделю или ризедронат 35 мГ 1 раз в неделю).
Больным, у которых есть проблемы со всасываемостью препаратов в кишечнике (болезнь Крона, состояние после операции трансплантации, и т. д. ), надо назначать азотсодержащие бисфосфонаты парентерально (золендроновая кислота, внутривенно 5 мГ ежегодно).
Перед началом лечения рекомендуется определение значений минеральной плотности костной ткани для определения самой общей стратегии:
- если значение Т-критерия больше -1.0 (нормальная плотность костной ткани) и нет дополнительных факторов риска, то назначается диета, богатая кальцием, витамин D, физические нагрузки. Двойная энергетическая рентгеновская абсорбциометрия (ДЭРА) — 1 раз в 6 мес.;
- если значение Т-критерия меньше -1.0 (остеопения или остеопороз), то к перечисленному выше добавляется прием бисфосфонатов.
(создана: 2011-03-18 19:47:22, дополнена: 2013-11-27 23:13:28)
Остеопороз и остеонекроз, связанные с приемом глюкокортикоидов-обзор: клиника, факторы риска, патогенез, лечение, рекомендации специалиста.
Глюкокортикоидный остеопороз – одна из наиболее распространенных форм вторичного остеопороза. Глюкокортикоидные препараты применяются для лечения заболеваний бронхо-легочной, эндокринной систем, ревматических, кожных, онкологических и других болезней. Дли

Безболезненная, уникальная методика доктора Бобыря
Дешевле, чем мануальная терапия
Мягко, приятно, нас не боятся дети
Только с 20 по 30 июня! Записывайтесь сейчас!

Наиболее высокий показатель потери костной массы отмечается в первый год терапии глюкокортикоидными средствами. При этом в процесс вымывания кальция вовлекаются как трабекулярные костные ткани, так и кортикальные, а переломы чаще всего локализируются в костях предплечий, ребер, трубчатых структурах, тазобедренном сочленении и позвонках. Единичные переломы тел позвонков проходят практически бессимптомно, и обращение пациентов в центр лечение остеопороза происходит уже на достаточно запущенных стадиях болезни.
Негативное влияние на кости оказывают даже минимальные дозы глюкокортикостероидов, поэтому они должны назначаться в комплексе с препаратами кальция, витамином D, бисфосфонатами и пр.
Глюкокортикоиды – стероидные гормоны человеческого организма, которые продуцируются корой надпочечников. Как лекарственные препараты они стали применяться во второй половине прошлого века после удачного выделения и производства их синтетических аналогов.
Используются эти стероиды не только в терапии больных с недостаточностью надпочечников. Благодаря широкому спектру действия они обладают противовоспалительными, противоаллергическими, противошоковыми, антидепрессивными свойствами, подстегивают иммунитет, улучшают обменные процессы (глюкозы и аминокислот в печени). Широко применяются для лечения системных ревматических болезней (ревматоидный артрит, красная волчанка, спондилоартрит), что позволяет существенно улучшать качество жизни пациентов и значительно повышает ее продолжительность.
Глюкокортикоиды напрямую воздействуют на клетки костных структур, усиливая костную резорбцию (разрушение) и подавляя костеобразование, а также ослабляют синтез коллагена, который образует матрикс кости. По этой причине перед проведением глюкокортикоидной терапии лечащий врач обязательно назначает пациенту консультацию остеопата, проводит профилактику остеопороза и диагностирует вероятность появления костных переломов.
Еще одной причиной стремительного развития глюкокортикоидного остеопороза является угнетение описываемыми веществами секреции половых гормонов, имеющих немаловажное значение в процессах костеобразования. У пациентов мужского пола происходит снижение показателей содержания тестостерона (у женщин – эстрогена) в сыворотке крови, пропорционально зависимое от назначаемой дозировки глюкокортикоидов.
Достаточно неблагоприятное воздействие оказывают препараты и на клеточные структуры мышечных тканей, а также проводимость нервных импульсов через мышечные волокна. В результате повышается вероятность развития патологической мышечной слабости, последующего лечения заболеваний опорно-двигательного аппарата, нарушения координации движений, что может привести к нежелательным переломам. При этом статистика отмечает, что, при одинаковых показателях минеральной плотности костных тканей, риск переломов у пациентов, страдающих глюкокортикоидным остеопорозом, намного выше, чем например, при постменопаузальном у женщин.
Список основных глюкокортикоидов: дексаметазон, гидрокортизон, кеналог, метипред, преднизолон, фторокорт, беконазе.
Для всех пациентов, принимающих глюкокортикоидные препараты, должны быть оценены факторы риска развития остеопороза, возможность падений и получения неожиданных переломов.
Показаниями к назначению препаратов для профилактики остеопороза являются:
- возраст пациента (старше 70 лет, женщины в постменопаузальный период и старше);
- планируемый срок проведения терапии глюкокортикоидами более трех месяцев;
- дозировки препарата от 2,5 до 7,5 мг.
Всем категориям группы риска рекомендуется сделать денситометрию (исследование, определяющее коэффициент минеральной плотности кости).
При отсутствии возможности осуществления денситометрической диагностики расчет вероятности переломов проводится с помощью компьютерного метода FRAX (с учетом поправочных коэффициентов и доз принимаемых глюкокортикоидных препаратов в перерасчете на преднизолон).
Программные модели разрабатываются отдельно для каждой страны на основе эпидемиологической десятилетней статистики переломов и средней продолжительности жизни в данной стране. Коэффициент величины абсолютного риска переломов рассчитывается с учетом возраста пациента, пола, индекса массы тела, генетических наследственных факторов, вредных привычек (количества потребляемого алкоголя в сутки), наличия ревматоидного артрита и других хронических болезней.
Лечащему врачу пациента рекомендуется:
- постепенно снижать суточную дозу препаратов вплоть до минимума и последующей полной отмены;
- при необходимости назначить лекарственные препараты кальция и витамина D.
Общие рекомендации пациентам, принимающим пероральные глюкокортикоиды:
- рациональное сбалансированное питание с достаточным потреблением белка, повышенным потреблением кисломолочных продуктов и продуктов, содержащих большое количество кальция и витамина D;
- отказ от истощающих диет и поддержание нормального индекса массы тела;
- адекватные регулярные физические нагрузки, занятия спортом, соразмерные с общим состоянием организма;
- отказ от табакокурения и ограничение потребления алкогольных напитков;
- предпринять все меры для снижения риска падения и получения переломов.
Последний пункт особенно важен, хотя пациенты и не всегда уделяют ему должное внимание. Сюда входит:
- переоценка и изменение домашней обстановки;
- коррекция зрения при необходимости;
- лечение нарушений осанки и выработка правильного стереотипа движений;
- ношение удобной обуви;
- использование поддерживающих средств, например, трости;
- лечение сопутствующих и хронических болезней;
- выполнение физических упражнений на тренировку координации движений и поддержания равновесия и пр.
Профилактика глюкокортикоидного остеопороза в большинстве пунктов перекликается с общими рекомендациями по приему стероидных препаратов. При этом возраст и пол пациента не играют особой роли, а длительная терапия (более трех месяцев) системными глюкокортикоидными веществами автоматически переносит их в повышенную зону риска остеопоротических переломов.
Лечение остеопороза вторичной этиологии заключается в терапии бисфосфонатами, природным кальцитонином, паратиреоидными гормонами, активными метаболитами витамина D (альфакальцидол, кальцитриол). Однако проведенные клинические исследования не доказали эффективность перечисленных средств, так как в качестве первичной цели бралось не снижение риска переломов, а повышение уровня коэффициента минеральной плотности костных тканей.
Статистика подтверждает резкое увеличение риска остеопоротических переломов в первые месяцы лечения глюкокортикоидами и такое же резкое снижение сразу после прекращения приема препаратов. Таким образом, потеря костной массы и нарушение архитектоники в данном случае – процессы вполне обратимые. Риск перелома значительно возрастает и при коротких, но частых курсах употребления системных стероидных веществ. Более безопасными считаются ингаляционные формы лекарств.
При этом клинические исследования установили, что нет минимальных безопасных доз глюкокортикоидных препаратов, а ежедневное употребление 10 мг преднизолона (или его эквивалента) увеличивает риск переломов шейки бедра в семь раз, а тел позвонков в 17 раз.
Лечение глюкокортикоидного остеопороза должно проводиться с обязательной периодической денситометрией костей, цена на которую достаточно велика, либо с ежегодными рентгенографическими исследованиями позвоночного столба в двух проекциях для исключения компрессионных переломов тел позвонков.
Информация для специалистов
- Pharmacare -
- Публикации -
- Эндокринология -
- Глюкокортикоид-индуцированный остеопороз: особенности диагностики и лечения на современном этапе
Информация предназначена для специалистов здравоохранения и не может быть использована иными лицами, в том числе для замены консультации с врачом и для принятия решения о применении данных препаратов!
Впервые связь между снижением минеральной плотности кости и избытком глюкокортикостероидов (ГКС) была отмечена в 1932 году Кушингом, который при аутопсийном исследовании обнаружил остеопению в позвоночнике у 6 из 8 больных, погибших от “неясного полигландулярного синдрома” (в дальнейшем назван его именем).
В этиологической структуре ГК выделяют:
-- центральный ГК (болезнь Иценко-Кушинга),
-- периферический ГК (синдром Иценко-Кушинга),
-- медикаментозный ГК [2,3,4,10,20].
На сегодняшний день ГК является одной из основных причин в развитии тяжелой формы вторичного остеопороза. Среди причин ГК ведущее место занимает медикаментозный ГК, который составляет практически 99% [2,7,16,21]. По данным исследований, проведенных в Великобритании, 1,4% пациентов с различными заболеваниями принимали таблетированные ГКС в средних дозах 8 мг/сут, в течение 3 месяцев в году [24]. Основными причинами назначения ГКС являлись: ревматоидный артрит в 23 % случаев, ревматическая полимиалгия – в 22%, и в 18% - бронхиальная астма и хронические обструктивные заболевания легких [24,25].
Несмотря на высокую эффективность ГКС при неинфекционном воспалении, лечение препаратами данной группы ассоциируется с широким спектром побочных эффектов (таблица 1) [1,2,24]:
Таблица 1 - Частота встречаемости основных симптомов, характерных для гиперкортицизма (Lavin N.,1999)
Нарушение толерантности к глюкозе
Лунообразное лицо, багровый румянец
Абдоминальные стрии, красно-фиолетового цвета
При этом медикаментозный ГК по спектру клинических проявлений имеет ряд отличий от эндогенного. В частности, для экзогенного ГК более характерно доброкачественное повышение внутричерепного давления, глаукома, задняя субкапсулярная катаракта, панкреатит и аваскулярный некроз, которые развиваются на фоне длительного приема больших доз ГКС [5,6,26,27]. В то же время артериальная гипертензия, образование угрей, нарушение менструального цикла, гирсутизм и вирилизация, импотенция у мужчин, стрии и пурпура чаще наблюдаются при центральном ГК [5,6]. Одинаково часто встречаются увеличение массы тела, психические нарушения, отеки и ухудшение заживления ран [5,6]. Различия связывают, прежде всего, с тем, что при медикаментозном ГК отмечается подавление синтеза АКТГ, тогда как, при эндогенном ГК происходит увеличение синтеза кортикотропина и его предшественников, что приводит к гиперсекреции андрогенов и минералокортикоидов [23,28].
Одним из тяжелых последствий длительной терапии ГКС является ГКОП, занимающий не только первое место в этиологической структуре вторичного остеопороза, но и обуславливающий более половины всех случаев остеопороза в молодом возрасте [10,12,25].
Наиболее интенсивная потеря костной массы отмечается в первые 6-12 месяцев от начала терапии ГКС, достигая 15% в год, затем замедляется и выходит на плато на уровне 3,5% в год [2,10,16]. Негативное влияние ГК на МПК по мере увеличения длительности терапии носит нелинейный характер. На фоне приема высоких доз ГКС (более 20 мг/сут) потеря костной массы развивается преимущественно в поясничном отделе позвоночника (20 - 30%) в первые 6 - 12 месяцев терапии.
Отмечается зависимость ГК-индуцированной потери костной массы по мере увеличения дозы ГКС, однако до настоящего времени ведутся дискуссии по поводу наличия относительно безопасной доза ГКС. В недавних исследованиях было показано, что эндогенная продукция кортизола составляет 6 мг/м2, что примерно соответствует дозе экзогенно вводимого гидрокортизона 20 мг/сут у мужчин и 15 мг/сут у женщин. Если принять во внимание, что относительная активность гидрокортизона по отношению к преднизолону составляет 1:4, то физиологическая доза преднизолона не должна превышать 3,75 мг/сут у женщин и 5 мг/сут у мужчин [16,25].
Снижение костной массы при ГКОП происходит неравномерно в различных участках скелета. По мнению ряда авторов, снижение МПК может быть выражено как в проксимальных отделах бедренной кости, так и в области позвоночнике [26,27]. В то же время, данные эпидемиологических исследований, свидетельствуют о том, что частота переломов шейки бедра у больных с ГКОП ниже, чем частота переломов позвоночника [25,28].
У пациентов с медикаментозным ГК без применения препаратов для лечения остеопороза отмечено развитие повторных переломов в 12% случаев, при этом в период менопаузы у женщин риск развития переломов увеличивался в 2-3 раза [2]. Данные о частоте переломов при медикаментозном ГК представлены в таблице 2:
Таблица 2 - Частота переломов у больных, получающих терапию ГКС
Adinoft et al., 1983
Vеrstraeten et al.
Dykman et al., 1986
Вadley et al., 1960
Luengo et al., 1991
СКВ – системная красная волчанка
ЮРА – ювенильный ревматоидный артрит
В случае эндогенного ГК продукция ГКС увеличивается в 4-10 раз и при хроническом воздействии приводит к снижению прочности преимущественно трабекулярной кости, что обуславливает развитие переломов тел позвонков, ребер, костей таза в 50-80% случаев [9,10,12].
Экзогенное введение синтетических аналогов ГКС приводит к развитию ГКОП у 30-50% пациентов, причем его частота и выраженность зависят от длительности приема препаратов, их суммарной дозы, возраста и массы тела, в меньшей степени - от способа введения [1,2,16,24].
Важное значение в прогнозировании развития остеопороза при медикаментозном ГК имеет оценка факторов риска , среди которых выделяют определенные (высокая кумулятивная доза ГКС, возраст 50 лет, постменопаузальный период) и вероятные (длительный прием ГКС, высокая ежедневная доза ГКС, молодой возраст (лет), низкая масса тела, женский пол (до менопаузы), снижение физической активности, воспалительные заболевания, другие общие факторы риска остеопороза) [5].
Патогенез ГКОП представляет собой сложный процесс, зависящий от различных эффектов ГКС на костный метаболизм и фосфорно-кальциевый обмен [29]:
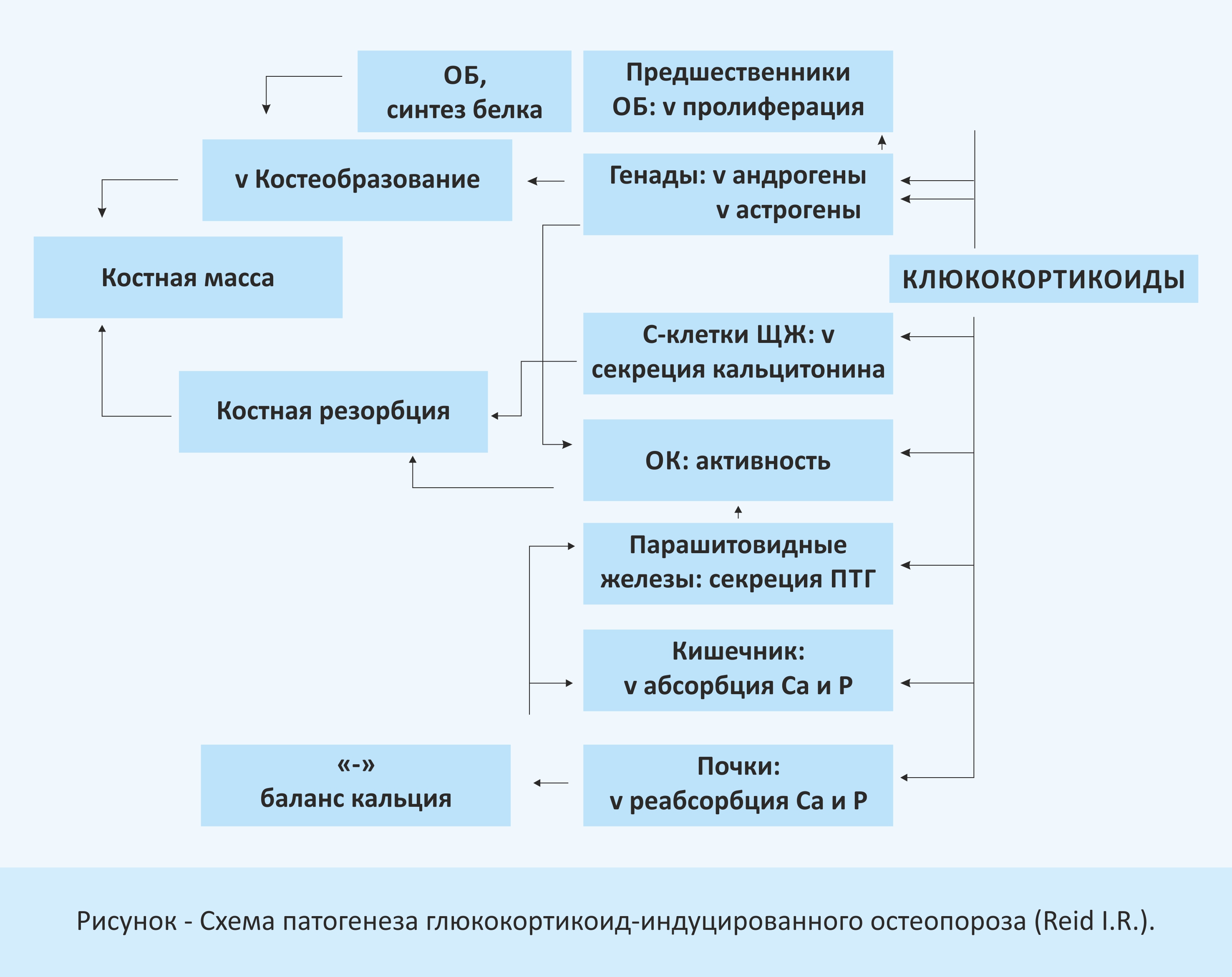
Основные эффекты ГКС на костеобразование заключаются в снижении репликации клеток остеобластического ряда, уменьшении образования новых остеобластов, а также в усилении апоптоза и некроза. Результатом данных изменений является истощение клеточной популяции, способной к образованию кости [1,2,12].
Помимо прямого действия, ГКС оказывают непрямые эффекты , опосредуемые локальными факторами: снижение синтеза коллагена 1 типа и усиление экспрессии коллагеназы 111 типа, что приводит к уменьшению костного матрикса, а увеличение синтеза связывающих белков в свою очередь способствует снижению костеобразования [10,23].
Значительный прогресс в понимании механизмов развития ГКОП был достигнут благодаря открытию новых членов семейства лигандов ФНО-a и их рецепторов (RANKL, RANK, остеопротегерина), которые играют ключевую роль в формировании, дифференцировке и активности остеокластов, кроме того являются молекулярными посредниками других медиаторов ремоделирования костной ткани. В опытах in vitro было показано, что ГКС подавляют образование остеопротегерина (ингибитор костной резорбции) и конкурентно стимулируют экспрессию RANKL (стимулятор костной резорбции) на остеокластах и стромальных костномозговых клетках. Высказано предположение о том, что быстрая потеря костной массы в начале ГКС-терапии связана со способностью ГКС увеличивать продолжительность жизни зрелых остеокластов, опосредуемое гиперэкспрессией RANKL [23] (таблица 3):
Таблица 3 - Характеристика RANKL, RANK и OPG.
Лиганд рецептора активатора NF- kB (Receptor Activator of NF-kB)
ODF (osteoclast inducing factor) TRANCE (TNF related activation- induced cytokine OPGL– osteoprotegerin ligand)
Активированные Т-лимфоциты и синовиальные фибробласты и др.
Образование, дифференцировка и активация остеокластов
Рецептор активатора NF-kB (Receptor Activator NF-kB)
Предшественники остеокластов, остеобласты, дендритные клетки, хондроциты
OCIF (osteoclast inhibitory factor)
Блокирует дифференцировку остеокластов, индуцированную RANKL
Экспериментальные данные последних лет по оценке влияния ГКС на костную резорбцию, выполненные на культуре остеокластов человека свидетельствуют о стимулирующем влиянии ГКС на остеокласты[12,16]. Кроме того, повышенное содержание ГКС в организме приводит к увеличению скорости резорбции костной ткани, обусловленное рядом патологических влияний. ГКС снижают абсорбцию кальция в кишечнике, воздействуя на рецепторы кальцитриола. В то же время, ГКС способствуют снижению тубулярной реабсорбции кальция и усиленному выделению его с мочой. Отрицательный баланс кальция в организме приводит к гиперсекреции паратиреоидного гормона, что в свою очередь усиливает процессы резорбции костной ткани [10,12,24]. Необходимо иметь в виду, что ГКС ингибируют только активную кишечную абсорбцию кальция, в то время как пассивная диффузия через стенку кишечника несколько возрастает и становится основным механизмом поступления кальция в организм больных, получающих терапию ГКС. Следовательно, нарушение абсорбции кальция на фоне ГКС терапии может иметь особенно важное значение в развитии остеопороза при ограничении поступления кальция с пищей.
Одним из значимых факторов в развитии снижения плотности кости при ГК является снижение уровня половых стероидов и подавление секреции соматотропного гормона ГКС [12,14,21]. Ингибирующее действие ГКС на ряд факторов роста, а также формирование гипогонадизма при ГК вносят свой вклад в снижение костеобразования и быстрое развитие системного ОП. Большой интерес в этом отношении вызывает роль дефицита дегидроэпиандростерона (ДЭАС) [23], который синтезируется в надпочечниках и является основным циркулирующим андрогеном у женщин. Адренокортикотропный гормон индуцирует синтез ГКС и ДЭАС, причем последний, как полагают, в определенной степени компенсирует катаболические эффекты ГКС, в том числе и на костную ткань. На фоне длительного лечения ГКС наблюдается подавление синтеза АКТГ, что приводит к снижению ДЭАС. Данные о корреляции между снижением МПК в различных участках скелета и сниженным уровнем сывороточного ДЭАС-сульфата потенциально свидетельствуют о роли дефицита ДЭАС в развитии ОП [21,23].
Особенности диагностики ГКОП. Приведенные выше данные о выраженных изменениях как количественных, так и к качественных характеристик костной ткани при наличии ГК, могут пояснить результаты эпидемиологических исследований свидетельствующие о том, что переломы позвонков при ГКОП развиваются при более высокой минеральной плотности кости, чем при инволюционном и постменопаузальном остеопорозе [3,25,29]. Согласно рекомендациям Британского национального общества остеопороза [16], Российской Ассоциации Остеопороза [3] по диагностике и лечению ГКОП пороговым значением для диагностики ОП у пациентов с ГК является значение Т-критерия менее - 1,5.
С целью ранней диагностики ГКОП в клинической практике используются следующие методы [2,12,16,17]:
- костная денситометрия (двойная рентгеновская абсорбциометрия - ДРА) позвоночника, проксимальных отделов бедренной кости;
- рентгеноморфометрия позвоночника;
- определение маркеров костной резорбции (С-телопептиды, N-теллопептиды с пиридинолиновой сшивкой - NTX) и костеобразования (костный изофермент щелочной фосфатазы, остеокальцин).
Наличие любой формы эндогенного ГК является показанием к проведению ДРА осевого скелета. Кроме того, данное обследование необходимо выполнять всем пациентам, которым планируется длительное применение ГКС [5,11,13,]. Использование ДРА не исключает рентгеноморфометрическое исследование позвоночника, которое выполняется с целью выявления деформаций и переломов тел позвонков. Исследование маркеров костного метаболизма способствует индивидуализации терапии и адекватному мониторингу лечения [18].
Периодичность мониторинга МПК для оценки эффективности лечения должна составлять 1 раз в 6 месяцев, маркеров костной резорбции - 1 раз в 3-6 месяца [12,18].
Принципы лечения и профилактики ГКОП. Несмотря на то, что сведения о связи развития ГКОП на фоне длительной терапии системными ГКС известны с начала ХХ века, данные современных эпидемиологических исследований, к сожалению, свидетельствуют о том, что даже в странах Западной Европы профилактическое лечение ГКОП получают лишь 8-14% пациентов [25].
Согласно клиническим рекомендациям Российского Ассоциации Остеопороза при назначении ГКС на длительный срок (более 6 месяцев) в дозах более 5 мг в сутки одновременно целесообразно проведение профилактических мероприятий по развитию ОП, поскольку наиболее быстрые и выраженные изменения в костной ткани происходят в первые 6-12 месяцев от начала лечения ГКС [2,12,16].
Результаты исследований, включавших оценку эффективности лечебно-профилактических мероприятий ГКОП, представлены в таблице 4:
Таблица 4 - Эффективность методов профилактики и лечения ГКОП
Глюкокортикоидный остеопороз: диагностика и лечение
Глюкокортикоиды (ГК) являются самыми мощными из существующих в настоящее время противовоспалительных препаратов, благодаря чему они широко используются во многих областях медицины, в том числе при лечении больных бронхо–легочными, ревматическими, эндокринными, кожными заболеваниями и др. Например, в Великобритании около 1% взрослого населения принимает ГК, это число возрастает до 2,4% среди лиц в возрасте 70–79 лет [22]. В России подобные данные отсутствуют.
Однако применение глюкокортикоидов имеет и свои ограничения, что в первую очередь связано с развивающимися на фоне их использования побочными эффектами. Среди них особое место занимает ГК–индуцированный остеопороз, который рассматривается как одно из наиболее характерных и потенциально тяжелых последствий этого вида терапии [4,17]. При длительном применении ГК данное тяжелое осложнение развивается у 30–50% пациентов [1]. Известно, что для мужчин и женщин, их получающих, относительный риск переломов в 2 раза больше, чем в общей популяции.
Патогенетические пути развития ГК–остеопороза связаны с основными механизмами, лежащими в основе их биологического действия, и опосредуются ГК–рецепторами, которые экспрессируются на остеобластах и остеокластах [4,18].
Использование данных препаратов обусловливает целый каскад патогенетических механизмов. В первую очередь снижается кишечная абсорбция кальция, что выявляется уже на первых неделях терапии ГК и имеет дозозависимый эффект. Одновременно с этим уменьшается почечная канальцевая реабсорбция и усиливается потеря кальция с мочой. Все это приводит к формированию отрицательного баланса кальция в организме, что компенсаторно стимулирует костную резорбцию. Ускорение резорбции обусловлено также и развитием вторичного гиперпаратиреоза у многих больных [3]. Кроме того, прямое воздействие на остеобласты приводит к снижению их функциональной активности и дифференцировки.
Еще одним потенциальным механизмом действия ГК является их влияние на синтез половых гормонов, что связано как с подавлением выделения гонадотропинов, так и прямым негативным влиянием на половые железы у мужчин и женщин [3]. В свою очередь дефицит этих гормонов, обладающих анаболической активностью, создает предпосылки для развития остеопороза [4].
Однако при рассмотрении патогенеза развития остеопороза при назначении ГК нельзя не учитывать их выраженного противовоспалительного действия, которое приводит к подавлению продукции провоспалительных цитокинов, что, в свою очередь, способствует уменьшению потерь и приросту костной ткани. У больных ревматическими заболеваниями это вызывает также регрессию суставного синдрома, что сопровождается увеличением двигательной активности пациентов. Таким образом, ГК одновременно оказывают и протективное действие на костную ткань за счет подавления воспалительного процесса. По мнению ряда авторов [1], остеопенический синдром при ревматических заболеваниях, таких как ревматоидный артрит, системная красная волчанка, алкилозирующий спондилоартрит, является скорее системным проявлением данных заболеваний, чем только осложнением терапии ГК. Хотя негативное влияние ГК на костную ткань нельзя недооценивать.
Известно, что прием глюкокортикостероидов приводит к быстрой потере минеральной плотности кости (МПК), скорость которой максимальна в первый год лечения и может достигать 30% в первые 6 месяцев приема препарата. Прием системных ГК продолжительностью более 3 месяцев является фактором риска снижения МПК и переломов костей, особенно у женщин в постменопаузе и мужчин старше 50 лет [5].
Более высокие по сравнению с нормой скорости снижения МПК могут отмечаться в течение всего периода лечения [11,16]. Однако после прекращения приема ГК этот процесс нормализуется, то есть потери костной ткани являются обратимыми [14,20,24].
Следует отметить, что снижение костной массы происходит во всех типах костей, как в трабекулярной, так и в кортикальной кости [13,25]. В связи с этим при ГК–остеопорозе встечаются самые различные локализации переломов костей: позвонки, проксимальный отдел бедра, кости таза, предплечья, ребра, трубчатые кости. Установлено, что ГК–индуцированные переломы возникают при значениях МПК более высоких, чем переломы у пациентов с постменопаузальным или сенильным остеопорозом [15].
Есть данные, что при снижении МПК позвоночника на каждое 1 SD относительный риск переломов увеличивается на 85% [23]. В настоящее время не существует единого мнения в отношении порогового значения МПК, при котором необходимо проведение лечебных мероприятий. Так, в Великобритании рекомендуется начинать лечение при снижении величины Т–критерия до –1,5 SD по результатам остеоденситометрии [10], тогда как Американская коллегия ревматологов рекомендует назначение терапии при величине Т–критерия –1,0 SD [6], то есть еще на уровне остеопении.
Что касается назначения коротких курсов ГК или использования периодического их приема, вероятность развития остеопороза при этом менее изучена, данные исследований противоречивы.
В последние десятилетия широкое распространение для лечения заболеваний бронхо–легочной системы получили ингаляционные ГК (ИГК). Проведенные исследования, изучавшие их влияние на костную ткань, доказали, что они значительно более безопасны в отношение снижения МПК по сравнению с системным приемом ГК. Выявленное в ряде исследований негативное влияние ИГК на костную ткань не подтверждалось, если проводился учет тяжести самого заболевания [21]. Таким образом, необходимость проведения профилактики и лечения остеопороза у больных, принимающих ИГК, на сегодняшний день не доказана.
Таким образом, при лечении целого ряда заболеваний для достижения клинического улучшения требуется назначение глюкокортикостероидов. Однако, учитывая их отрицательное влияние на костную ткань, одновременно с началом данной терапии необходимо планировать профилактические и лечебные мероприятия.
В первую очередь при назначении больному ГК необходимо оценить у него факторы риска развития остеопороза, особенности и характер течения основного заболевания, а также дозу и планируемую длительность лечения. Профилактика данного вида остеопороза направлена в первую очередь на рациональное лечение основного заболевания, предотвращение потерь МПК у пациентов с нормальной МПК или остеопенией.
Важное значение имеет выбор момента начала терапии остеопороза. При назначении ГК клиницисту необходимо обращать особое внимание и на другие факторы риска развития остеопороза, которые могут быть выявлены у данного пациента. Особое внимание уделяется пожилому возрасту больного, наличию предшествующих переломов у самого пациента или его ближайших родственников, а также выявление низкой МПК, по данным остеоденситометрии, что является основанием для включения пациента в группу с высоким риском развития переломов и решения вопроса о раннем назначении терапии. При этом низкая МПК и наличие переломов должны рассматриваться как основные факторы риска развития ГК–остеопороза. Кроме того, является доказанным тот факт, что у женщин в постменопаузе, принимающих ГК, риск развития переломов значительно выше, чем у более молодых пациенток [23].
Исходя из этого, лицам с высоким риском развития остеопороза (пациентам старше 65 лет или имеющим переломы в анамнезе) должно быть рекомендовано профилактическое лечение одновременно с назначением ГК (уровень доказательств А).
Пациентам, которым предполагается или уже проводится лечение преднизолоном в дозе >7,5 мг/сут. в течение трех месяцев и более, показано измерение МПК для решения вопроса о присоединении антиостеопоротической терапии. При этом следует помнить, что антиостеопоротические препараты в данной ситуации следует назначать уже при значениях МПК в пределах остеопении менее –1,5 SD.
В случае если пациент получал ГК–терапию в дозе от 2,5 до 7,5 мг/сут. более трех месяцев, требуется тщательная оценка риска развития остеопороза и переломов (уровень доказательности В) [2].
Для предупреждения потерь МПК у лиц, получающих лечение указанными препаратами, необходимо своевременное снижение и использование минимальных доз ГК, при возможности – отмена препарата. Рекомендуется использование альтернативных форм введения ГК, которые оказывают меньшее влияние на костную ткань (ингаляционные формы ГК, внутрисуставное или периартикулярное введение, ГК для наружного применения и др.). Кроме того, следует оценить необходимость своевременного назначения иммуносупрессивных препаратов в адекватной дозе (уровень доказательности А) [2].
Общие профилактические мероприятия у лиц, принимающих системные ГК, не отличаются от таковых при других видах остеопороза. Больным рекомендуется сбалансированная диета с достаточным потреблением кальция (не менее 1500 мг в сутки). Важно соблюдать адекватную физическую нагрузку, так как у пациентов с поражением суставов часто отмечается гиподинамия, что ускоряет костные потери. Пациентам советуют исключить курение и употребление алкоголя.
Кроме того, необходима оценка риска возможных падений, который обычно повышен в связи с поражением опорно–двигательного аппарата, наличием сопутствующих сердечно–сосудистых, церебральных заболеваний, снижения зрения и т.д. При повышении вероятности падений пациентам проводится коррекция имеющихся нарушений (подбор гипотензивной, сосудистой терапии, очков, ходьба с использованием дополнительных средств опоры), что снижает риск возникновения переломов.
К препаратам, используемым для профилактики остеопороза, относятся медикаменты, содержащие соли кальция и витамин D. По данным мета–анализов, комбинация этих препаратов должна назначаться всем больным, начавшим системный прием ГК в первую очередь, так как они повышают всасывание кальция в кишечнике, на которую негативно влияют глюкокортикоидные препараты [2,9,12]. Сочетанный прием кальция и витамина D является эффективным средством первичной профилактики ГК–индуцированного остеопороза (уровень доказательств А). Доза витамина D составляет 800 МЕ/сут., а элементарного кальция – от 1000 до 1500 мг/сут. (в зависимости от возраста). Предпочтение отдается карбонату кальция, но можно использовать также лактат и цитрат.
Монотерапию препаратами кальция нельзя рекомендовать для первичной и вторичной профилактики, а также лечения данного вида остеопороза, так как это не предотвращает потерь МПК и соответственно не снижает риск переломов [2].
Что касается активных метаболитов витамина D, по данным исследований, альфакальцидол снижает потерю МПК в позвоночнике у больных, принимающих системные ГК. Кроме того, согласно результатам последних исследований [8,19], активные метаболиты витамина D снижают риск переломов позвонков более эффективно, чем нативные препараты витамина D в сочетании с кальцием или без него. Альфакальцидол применяется в дозе 0,5–1,0 мг/сут., при его использовании необходимо тщательное мониторирование уровня кальция крови и мочи. При появлении гиперкальциемии и гиперкальциурии доза препарата должна быть снижена.
Для лечения ГК–остеопороза используются традиционные антиостеопоротические препараты. Доказана эффективность различных средств, однако уровень доказательности в отношении большинства из них ниже, чем при постменопаузальном остеопорозе. К препаратам с доказанной эффективностью относятся бисфосфонаты и кальцитонин лосося (уровень доказательности А) [2].
В отношение кальцитонина лосося (Миакальцика) получены данные, что он эффективен для первичной и вторичной профилактики, а также лечении ГК–индуцированного остеопороза, при этом используется как инъекционная форма препарата, так и назальный спрей.
Кальцитонин лосося влияет преимущественно на трабекулярную кость [9]. Получены данные, свидетельствующие о том, что в течение 1–го года терапии Миакальцик предупреждал снижение МПК в позвоночнике по сравнению с плацебо (разница 3%) [7]. При этом терапевтический эффект более выражен у пациентов, принимавших ГК более 3 месяцев, по сравнению с больными, которым препарат был назначен профилактически (у них различие в величине МПК в сравнении с плацебо составило только 1%). В проведенных исследованиях, однако, не было получено достоверных доказательств о влиянии кальцитонина лосося на МПК шейки бедра и снижение риска возникновения переломов позвоночника [2].
Кроме того, одним из важных свойств Миакальцика является выраженный обезболивающий эффект, что позволяет назначать его в острых ситуациях, связанных с переломами. Это было продемонстрировано в исследованиях парентеральной и интраназальной форм кальцитонина. Снижение индекса боли по сравнению с плацебо зарегистрировано на 3–й день приема, на 7–10–й день пациенты отмечали значительное улучшение.
Таким образом, Миакальцик является одним из эффективных препаратов для лечения ГК–индуцированного остеопороза. К преимуществам данного препарата, наряду с увеличением МПК в позвоночнике, относится выраженный анальгетический эффект, что позволяет применять его у пациентов с выраженным болевым синдромом.
5. Adachi JD, Olszynski WP, Hanley DA, Hodsman AB et al.. Management of corticosteroid–induced osteoporosis. Semin Arthritis Rheum. 2000 Feb;29(4):228–51.
6. American College of Rheumatology Taskforce on Osteoporosis Guidelines. Recommendations for the prevention and treatment of glucocorticoid–induced osteoporosis. Arthritis Rheum 1996;39:1791–801.
7. Cranney A, Welch V, Adachi JD, Homik J, Shea B, Suarez–Almazor M, Tugwell P, Wells G. Calcitonin for preventing and treating corticosteroid–induced osteoporosis. (Cochrane Review), In; The Cochrane Library, Issue I, 2004.
8. de Nijs R.N., Jacobs J.W., Algra A. et al. Prevention and treatment of glucocorticoid–induced osteoporosis with active vitamin D3 analogues: a review with meta–analysis of randomized controlled trials including organ transplantation studies. Osteoporos Int. 2004 Aug;15(8):589–602.
9. Devogelaer J.P., Goemaere S., Boonen S. et al. Evidence–based guidelines for the prevention and treatment of glucocorticoid–induced osteoporosis: a consensus document of the Belgian Bone Club. Osteoporos Int. 2006 Jan;17(1):8–19.
10. Eastell R, Reid DM, Compston JE, Cooper C, et al. A UK consensus group on management of glucocorticoidinduced osteoporosis: an update. J Intern Med 1998;244:271–92.
11. Gennari C, Imbimbo B. Effects of prednisone and deflazacort on vertebral bone mass. Calcif Tissue Int 1985;37:592–3.
12. Homik J., Suarez–Almazor ME., Shea B. et.al. Calcium and vitamin D for corticosteroid–induced osteoporosis. Osteoporos.Int. 1999; 9:75–81.
13. Laan RFJM, Buijs WCAM, van Erning LJTO, Lemmens JAM et al. Differential effects of glucocorticoids on cortical appendicular and cortical vertebral bone mineral content. Calcif Tissue Int 1993;52:5–9.
14. Laan RFJM, van Riel PLCM, van de Putte LBA, van Erning LJTO et al. Low–dose prednisone induces rapid reversible axial bone loss in patients with rheumatoid–arthritis– a randomized, controlled study. Ann Intern Med 1993;119:963–8.
15. Luengo M, Picado C, Delrio L, Guanabens N et al. Vertebral fractures in steroid dependent asthma and involutional osneoporosis – a comparative stady. Thorax 1991; 46:803–6
16. Lukert BP, Johnson BE, Robinson RG. Estrogen and progesterone replacement therapy reduces glucocorticoid–induced bone loss. J Bone Miner Res 1992;7:1063–9.
17. Lukert B.P.,Raisz I.G. Glucocorticoid–induced osteoporosis: pathogenesis and management.Ann Int Med 1990; 112: 352–364
18. Peck W.A. The effects of glucocorticoids on bone cells metabolism and function. Adv Exp Med Biol 1984;171:111–119
19. Richy F., Ethgen O., Bruyere O., Reginster J.Y. Efficacy of alphacalcidol and calcitriol in primary and corticosteroid–induced osteoporosis: a meta–analysis of their effects on bone mineral density and fracture rate. Osteoporos Int. 2004 Apr;15(4):301–10.
20. Rizzato G, Tosi G, Schiraldi G, Montemurro L, Sisti DS. Bone protection with salmon calcitonin (sCT) in the long–term steroid therapy of chronic sarcoidosis. Sarcoidosis 1988;5:99–103.
21. van Staa TP, Bishop N, Leufkens HG, Cooper С Are inhaled corticosteroids associated with an increased risk of fracture in children? Оsteoporos Int. 2004: 21 [Epub ahead of print]
22. van Staa TP, Leufkens HGM, Abenhaim L, Begaud B et al. Use of oral corticosteroids in the United Kingdom. Q J Med 2000;93:105–11
23. van Staa, T P, Laan, R F, Barton, IP, Cohen, S., Reid, D M.,Cooper, С. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis Rheum 2003 Nov;48(11):3224–9
24. van Staa T, Leufkens HGM, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15:993–1000.
25. van Staa T, Leufkens HGM, Cooper C. The epidemiology of corticosteroid–induced osteoporosis. Osteopros Int 2002;13:777–87.
Читайте также:


